Introducción
Un mejor diagnóstico y atención de pacientes ha permitido tratamientos más prolongados, los cuales han sido favorables para una mayor supervivencia del paciente con cáncer. Por esta razón, los pacientes están expuestos con mayor frecuencia, y por períodos más prolongados a la quimioterapia. Esta situación aumenta el riesgo de reacciones de hipersensibilidad (RHS) a la quimioterapia, lo cual constituye un desafío para el tratamiento del cáncer.1,2
Existen múltiples sistemas de clasificación utilizados en las reacciones de hipersensibilidad que resultan verdaderos desafíos cuando se intenta describir la gravedad de estas. Una de estas clasificaciones, quizás la más usada, es la de criterios comunes de toxicidad para eventos adversos del Instituto Nacional de Cáncer, conocida por sus siglas en inglés (CTCAE-NCI), donde utilizan los términos “reacción alérgica” y “anafilaxia” para clasificar la RHS, mientras que la guía de la red nacional de centros integrales de cáncer (NCCN, por sus siglas en inglés) para el cáncer de ovario, enfatiza el tratamiento de las reacciones de RHS en lugar de la clasificación de esas reacciones.3,4 Ambos criterios incluyen reacciones definidas usando síntomas subjetivos en lugar de usar signos clínicos claramente definidos. En un pequeño estudio, donde se evalúa la incidencia de reacciones de hipersensibilidad al carboplatino, 66,7 % de los pacientes se clasificaron como grado 1-2, según lo definido por CTCAE (versión 3.0), y el resto fueron reacciones grado 3-4.5
Las RHS se clasifican según el momento de inicio como inmediato (menos de una hora de administración del medicamento) o retardado (desde una hora a una semana, luego de la administración del medicamento), y al mecanismo involucrado: alérgico o no alérgico. Las RHS de inicio inmediato incluyen reacciones agudas relacionadas con la perfusión, como el síndrome de liberación de citoquinas, y de reacciones mediadas por IgE. Pueden ser clínicamente indistinguibles una de la otra, y se pueden observar reacciones de tipo mixto. Por su parte, las reacciones de tipo retardada, pueden incluir: erupción cutánea, vasculitis, y se han reportado, síndrome de Stevens-Johnson, y necrolisis tóxica epidérmica.6
El momento en que ocurren, y la presentación clínica de las reacciones sugiere fuertemente que el mecanismo de hipersensibilidad de las sales de platino se basa en la sensibilización inducida por IgE, donde el riesgo está relacionado con el número de infusiones acumulado, y/o la dosis acumulativa del fármaco. Típicamente, las reacciones ocurren entre el cuarto y octavo ciclo, o después de la sexta exposición a los platinos. A diferencia de lo anterior, la mayoría de las reacciones a los anticuerpos monoclonales o medicamentos de quimioterapia (sin platino), no fueron por reacciones clásicas mediadas por IgE tipo I, ya que muchas reacciones ocurrieron desde la primera o segunda exposición.7,8
Lee y otros, desde 2002 a 2004, desensibilizaron con éxito a diez pacientes, utilizando un protocolo en el que la quimioterapia se administró en doce pasos, utilizando tres soluciones separadas de concentraciones variables de carboplatino.9 El programa de desensibilización a los medicamentos de quimioterapia se amplió y, en 2008, Castells y otros, publicaron una serie de casos de 98 pacientes que se sometieron a 413 desensibilizaciones, con un protocolo de desensibilización rápida (PDR). De las desensibilizaciones realizadas, 94 % no tuvieron reacciones estrictamente cutáneas muy leves, que respondieron rápidamente a dosis adicionales de antihistamínicos. La lista de fármacos exitosamente desensibilizados se expandió para incluir otros medicamentos como paclitaxel, cisplatino, oxaliplatino y doxorrubicina.10
En el Servicio de Oncología Clínica de nuestro hospital, se introdujo este PDR, en enero de 2016. Por esta razón, se realizó esta investigación, con el objetivo de evaluar el protocolo de desensibilización rápida en escenario ambulatorio en pacientes que presentaron reacciones de hipersensibilidad a fármacos citotóxicos.
Métodos
Se realizó un estudio retrospectivo y observacional en pacientes con diagnóstico confirmado de un tumor maligno sólido, atendidos en el Hospital de Día Onco-Hematológico del Servicio de Oncología Clínica del Hospital Clínico Quirúrgico “Hermanos Ameijeiras”, en el período de enero 2016 hasta diciembre de 2018, que cumplieran los criterios de selección más abajo expuestos.
El universo quedó constituido por todos los pacientes con diagnóstico de tumor maligno sólido, que presentaron una reacción de hipersensibilidad a alguno de los fármacos con fines oncológicos empleados en el Hospital de Día Onco-Hematológico (n= 132).
Los criterios de inclusión fueron: edad mayor de 18 años; capacidad para firmar consentimiento informado; haber tenido una RHS a un fármaco quimioterapéutico que haya ocurrido durante la infusión de la quimioterapia (inmediato), o retardado (en las primeras 48 h de haberla recibido). Esta reacción debe haberse clasificado como grado 3 por la NCI-CTC versión 5.0 o, moderado-estándar o severo, según la clasificación de la OSU (ver en el acápite de clasificaciones). Se excluyeron 51 pacientes con reacciones tardías (> 48 h), 50 pacientes por presentar reacciones agudas de tipo leve o moderado-bajo, y uno por necrolisis epidérmica tóxica. La muestra quedó constituida por 30 pacientes.
Definición y operacionalización de las variables
Las clasificaciones utilizadas para el estudio fueron las siguientes:
Clasificación de RHS de la Universidad Estatal de Ohio2 (OSU, siglas en inglés).
Leve: prurito, enrojecimiento facial, erupción cutánea (localizada, particularmente en palmas de manos y plantas de los pies), fiebre relacionada con fármacos (<38.0°C).
Moderado-bajo: eritema difuso o urticaria, náuseas/vómitos, dolor/hinchazón abdominal, estornudos, congestión nasal, disnea sin hipoxia, garganta apretada sin hipoxia, tos/sibilancias, fiebre relacionada con fármacos (≥ 38.0°C)
Moderado-estándar: hipo/hipertensión transitoria, taquicardia/bradicardia transitorias, dolor torácico transitorio, hipoxia transitoria, trastornos de la visión, zumbidos en los oídos, angioedema sin anafilaxia.
Severo: hipo/hipertensión sostenida, taquicardia/bradicardia sostenida, hipoxia sostenida a pesar del uso de oxígeno, estado mental alterado, alucinaciones, desorientación, pre-síncope, síncope, anafilaxia.
Clasificación de NCI-CTC versión 5.03 - Reacción relacionada con la infusión:
Grado 1: reacción transitoria leve; interrupción de la infusión no indicada; intervención no indicada.
Grado 2: la terapia o la interrupción de la infusión están indicadas, pero responden rápidamente al tratamiento sintomático (Ej. antihistamínicos, AINES, narcóticos, y/o líquidos por vía intravenosa); medicamentos profilácticos indicados por ≤ 24 h.
Grado 3: No responde rápidamente a la medicación sintomática y/o breve interrupción de la infusión; recurrencia de síntomas después de una mejoría inicial; u hospitalización indicada para secuelas clínicas.
Grado 4: consecuencias potencialmente mortales; intervención urgente indicada.
Grado 5: Muerte.
Variables analizadas
Edad: ≤ 60 años y > 60 años.
Sexo: masculino y femenino.
Localización del tumor primario:
Antecedentes de alergia: Sí o No.
Antecedentes de reacción a fármacos: Sí o No.
Fármaco desencadenante:
Escenario de quimioterapia: adyuvante o metastásico.
Número de ciclo en que desarrolló la RHS:
Tipo de reacción: durante la infusión o retardada (menos de 48 h).
Intensidad de la reacción: moderado-estándar o severo.
Síntomas cutáneos (prurito, enrojecimiento, urticaria)
Síntomas respiratorios (tos, disnea, broncoespasmo)
Síntomas gastrointestinales (náuseas, vómitos, dolor abdominal)
Síntomas cardiovasculares (hipertensión, hipotensión, dolor torácico)
Síntomas Neurológico/musculares: dolor de espalda, manifestaciones neurológicas.
Sistémico/idiosincrásico (fiebre, diaforesis, escalofríos)
Número de ciclos realizados con PDR:
Plan de tratamiento
Premedicación
Se administró de 15 a 20 min antes del comienzo del PDR, y consistió en: difenhidramina (20 mg), ranitidina (50 mg) y dexametasona (20 mg), administrados por vía intravenosa (IV).
Protocolo de desensibilización rápida (PDR) de doce pasos10
El PDR consistió en 12 etapas para la administración de la dosis total del fármaco. El protocolo consistió en ir aumentando de forma progresiva la velocidad de infusión y la concentración del fármaco. Se prepararon tres soluciones de las siguientes diluciones: 1 %, 10 %, y 89 % de la dosis total del fármaco, respectivamente, con un volumen total que puede ser variable, teniendo en cuenta la metodología de administración del fármaco en cuestión. La primera solución se utilizó en los cuatro primeros pasos, la segunda en los cuatro siguientes, y la tercera solución en los últimos cuatro pasos. La velocidad de infusión se incrementó cada 15 min, de forma que con cada paso se administraba el doble que en el paso anterior. En el último paso, se mantuvo la velocidad constante hasta acabar de administrar la dosis total (tabla 1). La administración se realizó en hospital de día onco-hematológico bajo estrecha monitorización y supervisión médica.
Tabla 1 Protocolo de desensibilización rápida (Modificado de M. Castell). Ejemplo en paciente que requiere 220 mg de oxaliplatino. En este caso, las bolsas deben contener soluciones glucosadas
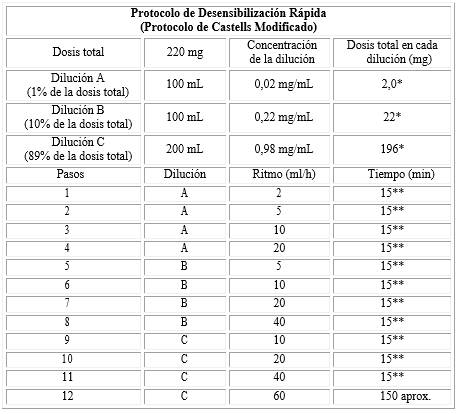
* La suma de las dosis de las disoluciones A, B y C es aproximadamente 220,0 mg.
** Al finalizar el paso de 15 minutos, cambiar la velocidad de infusión cada 15 minutos, tal y como se
indica en la tabla; en el paso de A a B, de B a C. El tiempo total es de aproximadamente 5 horas, 45 minutos a seis horas.
Tratamiento de reacciones durante la desensibilización
Se trataron, primero, deteniendo inmediatamente la infusión del medicamento, la administración de difenhidramina (20 mg), oxígeno por catéter nasal, e incrementar el ritmo de infusión de la solución electrolítica. En caso de reacciones graves, se añadió succinato de metilprednisolona sódica (0,5 mg/kg), ranitidina (50 mg). Todos los fármacos, en caso de ser necesario, fueron administrados por vía intravenosa. La epinefrina, 0.3 mL, (1 mg/mL), estuvo disponible al lado de la cama para su uso, según necesidad. Una vez que la reacción remitió, el protocolo se reinició desde el paso en el que se había detenido. Si los pacientes experimentaron reacciones y requirieron desensibilizaciones repetidas con el mismo fármaco, modificamos el protocolo al prolongar el paso anterior cuando la reacción ocurrió, agregando un paso adicional y/o administrando medicación profiláctica antes del paso en el que el paciente tuvo la reacción.
Recogida y análisis de la información
Los datos primarios se obtuvieron del registro de enfermería de las extravasaciones y reacciones de hipersensibilidad. Se revisaron las historias clínicas y planillas de tratamiento ambulatorio, para completar los datos de pacientes que desarrollaron algún grado de hipersensibilidad. Luego, se obtuvo la información para la confección de la base de datos.
Se confeccionó una base de datos en el programa Excel que se procesó con la ayuda del paquete estadístico SPSS- v.20.0. Se emplearon medidas de resumen para las variables cualitativas, frecuencias absolutas y relativas expresadas en porcentajes, además de la prueba estadística Chi-cuadrado de Pearson (x 2) como método de análisis para evaluar la asociación entre variables. En todas las pruebas se fijó un nivel de significación de 0,05.
Aspectos éticos
El presente estudio contó con la aprobación del Consejo Científico y el Comité de Ética de Investigaciones del Hospital Clínico Quirúrgico "Hermanos Ameijeiras", quienes revisaron la calidad del proyecto y el adecuado cumplimiento de sus procedimientos. La investigación se diseñó y ejecutó según los principios éticos para la investigación médica con sujetos humanos. Para la realización del PDR, se solicitó consentimiento informado específico. Se utilizó información de historias clínicas, y se respetó la confidencialidad.
Resultados
La muestra quedó constituida por 30 pacientes que desarrollaron RHS. Predominaron las pacientes femeninas, menores de 60 años, tumor primario en colon, antecedentes de alergia, y sin antecedentes de reacción a fármacos. El oxaliplatino fue el fármaco más implicado. Acorde a la clasificación de la OSU, el tipo de reacción más frecuentemente observado en cuanto a la intensidad, fue la moderada-estándar, durante la infusión de los fármacos, y éstos administrados en escenario adyuvante (tabla 2).
Tabla 2 Características basales de los pacientes con RHS que se les realizó el PDR (n=30)
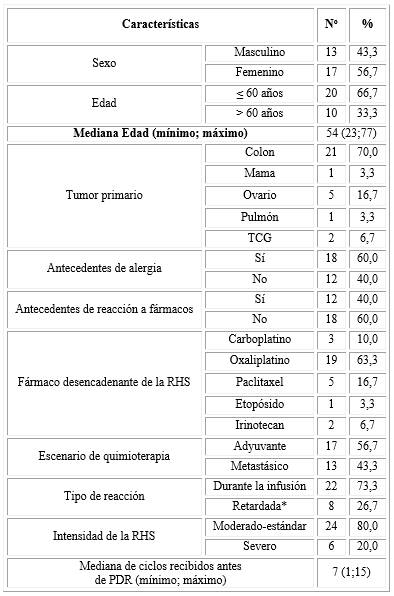
RHS: reacción de hipersensibilidad; PDR
protocolo de desensibilización rápida;
TCG: tumor de células germinales;
*menos de 48 h.
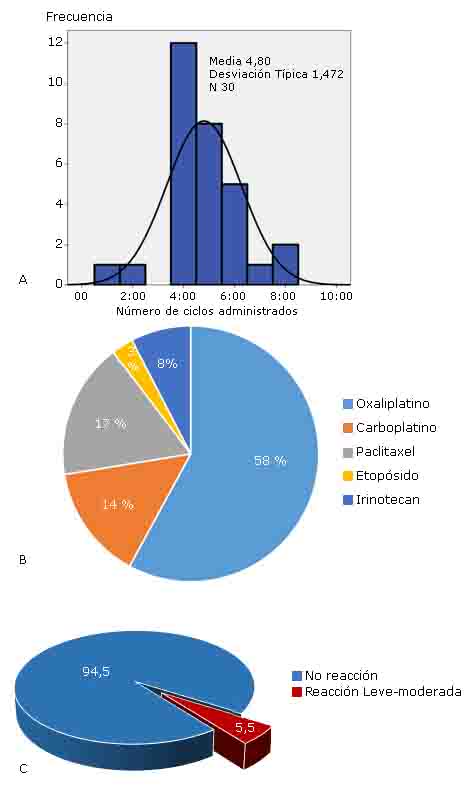
Los síntomas más frecuentemente observados durante la RHS fueron las náuseas y vómitos, enrojecimiento facial, tos, disnea, y dolor torácico. Cuando agrupamos estos síntomas por órganos o sistemas, más del 70% de los pacientes desarrollaron manifestaciones cutáneas, gastrointestinales, y respiratorias (fig. 1).
La tabla 3 presenta las características de los pacientes con RHS, según el fármaco implicado en los que se han eliminado el irinotecan, y el etopósido por tener una frecuencia menor de tres, por lo que los análisis presentados son en base a 27 pacientes. Se pudo observar que existe un desbalance de número de pacientes entre los tres fármacos. No obstante, proporcionalmente, las RHS ocurren más frecuentemente en pacientes más jóvenes, y con antecedentes de alergia cuando se les administra el paclitaxel, y al igual que el carboplatino, ocurrió fundamentalmente durante la infusión, y con una intensidad moderada-estándar. Todos los pacientes que presentaron una RHS al carboplatino, manifestaron reacciones cutáneas, gastrointestinales y cardiovasculares. Las manifestaciones respiratorias fueron más frecuentes en pacientes que recibieron paclitaxel, mientras que los síntomas sistémicos y neuromusculares se observaron discretamente superiores en el grupo de pacientes con oxaliplatino y paclitaxel en relación al de carboplatino. Los pacientes en tratamiento con paclitaxel que desarrollaron una RHS, lo realizaron más tempranamente que aquellos que recibieron sales de platino.
Tabla 3 Características basales de pacientes con RHS que realizaron PDR acorde a fármacos implicados seleccionados (n=27)
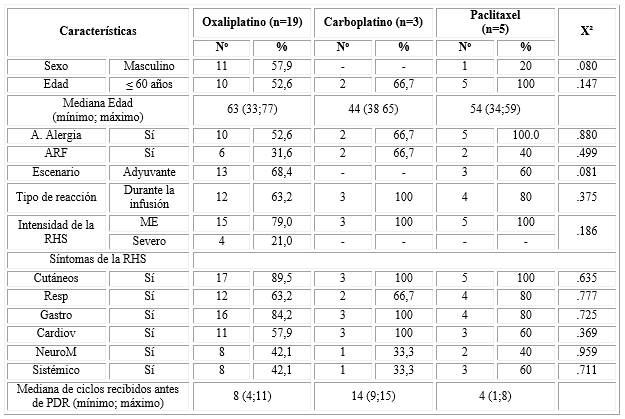
Leyenda: A. Alergia: antecedentes de alergia; ARF: antecedentes de reacción a fármacos; RHS: reacción de hipersensibilidad; Resp: respiratorios; Gastro: gastrointestinales; Cardiov: cardiovasculares; Orof: orofaríngeos; NeuroM: neuromusculares; TCG: tumor de células germinales; ME: moderado estándar; PDR: protocolo de desensibilización rápida.
Con la aplicación del PDR, se pudieron administrar 145 ciclos adicionales a los 30 pacientes incluidos en la presente serie. En la figura 2A, se puede observar que por paciente pudo aplicarse 5 ciclos de fármacos [mediana: 5 (1; 8)] adicionales. El mayor número de desensibilizaciones pudo ser realizada con oxaliplatino (58 %), y paclitaxel (17 %) (fig. 2B), mientras que en solo ocho desensibilizaciones se presentaron reacciones leves a moderadas, de tipo cutáneas, que representaron el 5,5 % del total (fig. 2C).
Discusión
Las RHS son definidas como respuestas impredecibles, que no pueden ser explicadas ni por la acción farmacológica, ni por el perfil de toxicidad del medicamento, producidas por un mecanismo inmunológico, humoral o celular. Casi todos los quimioterápicos tienen potencial para causarlas, pero determinados grupos han sido asociados con un mayor riesgo, como los derivados del platino, los taxanos, las asparaginasas, y los anticuerpos monoclonales. Estas reacciones pueden estar causadas por el principio activo, sus metabolitos, o incluso por el propio disolvente.6,11 El mecanismo asociado con el desarrollo de estas reacciones aún no se conoce totalmente, y varía de un fármaco a otro. La mayoría de las RHS a fármacos antineoplásicos es de tipo I, caracterizadas por la unión de inmunoglobulinas E (IgE) al fármaco, y a basófilos y mastocitos, produciendo su degranulación con liberación masiva al torrente sanguíneo de histamina y otros mediadores químicos de la inflamación. Esto provoca una rápida contracción del músculo liso y dilatación de los capilares.6,11,12
Con el presente trabajo, reportamos nuestra experiencia con 145 desensibilizaciones exitosamente tratadas en 30 pacientes que experimentaron algún grado de RHS de tipo inmediato a platinos, taxanos y otros quimioterapéuticos (excluidos los biológicos). Todos los pacientes incluidos tenían antecedentes de RHS inmediatas a citostáticos, a pesar de la premedicación con antihistamínicos H1, y corticosteroides, y/o enlentecimiento de los ritmos infusionales, como protocolos estandarizados de oncología. Este tipo de premedicación, generalmente revierte reacciones leves y/o moderadas, pero no logran prevenir las reacciones graves mediadas por la IgE.13,14
Las reacciones adversas que observamos son consistentes con lo hallado por otros autores.1,5,10,15,16 Pero, a diferencia de estos trabajos, el mayor número de RHS fueron relacionadas con el uso de oxaliplatino, y está dado fundamentalmente en el alto número de pacientes que son atendidos en el Hospital de Día Onco-Hematológico de nuestra institución por tumores gastrointestinales, y por otra parte, la mayor parte de las reacciones observadas a los taxanos y a otras sales de platino fueron clasificadas como leves, por lo que no fue necesaria la realización de protocolos de desensibilización.
En un trabajo realizado por Parel y otros, tres parámetros clínico-patológicos surgieron como posibles factores de riesgo para la RHS mediado por oxaliplatino: edades más jóvenes; sexo femenino, y exposición previa a las sales de platino. La dosis media de oxaliplatino y la presencia de antecedentes atópicos no se asocian significativamente con la RHS. Sin embargo, en el análisis multivariante, el sexo fue la única covariable significativa restante, lo que confirma que las mujeres tienen un mayor riesgo de RHS a oxaliplatino que los hombres (p<0,05).17 En la presente serie, el sexo femenino fue predominante, pero específicamente en las reacciones producidas por el oxaliplatino, fue el sexo masculino más frecuentemente observado. Resultados muy similares al nuestro, fueron reportados por Okayama y otros.18 El 60 % de los pacientes tuvieron antecedentes de atopia o alergia, siendo éste más frecuente en pacientes con RHS secundarios al uso de carboplatino o paclitaxel. Esta situación ha sido planteada en diferentes trabajos desde hace muchos años.19
Los signos y síntomas varían de paciente a paciente. Las manifestaciones típicas incluyen síntomas mucocutáneos (90 %), respiratorio (40 %), cardiovasculares, y gastrointestinales (30-35 %).20 La alta tasa de síntomas gastrointestinales y respiratorios, junto a cutáneos observado en la serie se justifica, teniendo en cuenta que más del 60 % de los pacientes incluidos con RHS fueron debidos al oxaliplatino. Es por ello que en este acápite, difiere de la mayor parte de los estudios revisados.1,5,10,15,16,21 No obstante, las RHS al carboplatino suele aparecer cuando el paciente ha recibido más de seis ciclos, mientras que los taxanos producen reacciones durante los primeros ciclos de quimioterapia.15,16,22,23 Los resultados presentados en el estudio así lo han corroborado.
Un hecho que llama la atención en el estudio, es la ausencia de la realización de los test cutáneos, los cuales han sido controversiales en la literatura revisada. Ni las características clínicas, ni los resultados de los test de piel, pueden pronosticar la posibilidad de una RHS, de forma certera. Un resultado del test negativo o equívoco, no debería alterar la decisión de desensibilización, si el historial del paciente es sugestivo de hipersensibilidad de tipo inmediato al agente quimioterapéutico en cuestión.24,25
La clasificación de la OSU2 que se ha utilizado en la investigación nos ha proporcionado la posibilidad de establecer un algoritmo de diagnóstico y tratamiento más objetivo en la definición de la RHS, y su manejo más óptimo, por encima de otras, como se ha mencionado en la introducción de este manuscrito. De esta forma, se ha podido cumplimentar las denominadas “4 R, por su sigla inicial en inglés”: evaluar el riesgo, reconocer los síntomas y signos, responder calmada, y rápidamente, y, revisar la situación para prevenir la recurrencia.20
La desensibilización es la técnica que induce una tolerancia temporal de un fármaco al que el paciente es alérgico mediante la administración gradual de pequeñas cantidades del medicamento hasta alcanzar la dosis terapéutica.11 Esta es altamente efectiva en el tratamiento de las reacciones de hipersensibilidad inmediata, independientemente de si la reacción es o no mediado por IgE. Cuando se ejecuta correctamente, es altamente exitoso independientemente del grado inicial de anafilaxia. Al mantener a los pacientes en terapia de primera línea, se obtienen mejores resultados clínicos, y menos complicaciones del tratamiento, lo que reduce la mortalidad, la morbilidad, y el gasto sanitario.1,9,10
Por lo general, no hay disminución en la eficacia del fármaco cuando se administra por desensibilización, independientemente de que los tiempos de infusión se incrementan, y el pico de concentración del fármaco, difiere de la concentración estándar.10,12 Los primeros estudios sobre desensibilización a la quimioterapia fueron publicados a principios del siglo. Otros grupos han descrito otros protocolos de desensibilización que son variaciones en el tema de aumento gradual de la dosis desde un comienzo a muy bajas dosis.26,27,28 Estos protocolos más nuevos parecen mostrar una seguridad similar y eficacia que el protocolo diseñado por Castells, y utilizado por nosotros en la presente investigación.
Sloane y otros publicaron el trabajo que mayor número de desensibilizaciones ha realizado, y muestra que la mayoría de las desensibilizaciones podían realizarse en el ámbito ambulatorio, incluso para reacciones anafilácticas grado 3. De esta forma, se podrían realizar más desensibilizaciones iniciales en el entorno ambulatorio, lo que reduce la demanda global de recursos y costos de atención médica para pacientes que requieren desensibilización. En su análisis, estos pacientes tienen aproximadamente costos generales equivalentes de atención médica que aquellos que no requirieron desensibilización, y por otra parte, no diferencias en los análisis de mortalidad de éstos en comparación a quienes recibieron la misma quimioterapia por infusión regular.29
Un estudio investigó los efectos de un programa estructurado de intervención educativa sobre conocimiento, habilidades y parámetros psicológicos en el manejo de emergencias con episodios de anafilaxia. Como conclusión se enfatiza en la importancia de proporcionar apoyo psicológico, y tener una discusión completa e informativa con al paciente, sobre los beneficios potenciales de continuar con los fármacos que inicialmente se planificaron, y el riesgo de recurrencia.30
Presentamos la primera experiencia cubana de evaluación de un nuevo tratamiento terapéutico práctico en las RHS con quimioterapia, mediante la administración de esta en doce etapas. Confirmamos que la realización rigurosa del proceder, permite que la quimioterapia continúe en el 100 % de los pacientes. Estas decisiones deben tomarse en el seno de un equipo multidisciplinario (oncólogos, enfermeros y farmacéuticos), donde deben sopesarse los riesgos de la desensibilización con sus ventajas, siempre que no haya terapias alternativas eficaces, a pesar de la notable seguridad del PDR. La realización de este en el escenario ambulatorio del Hospital de Día, en vez de un ingreso en una Unidad de Cuidados Intensivos (UCI), hace que los gastos hospitalarios se reduzcan considerablemente. No obstante, para la generalización de este proceder en otros Servicios de Oncología del país, se necesita tener una infraestructura de soporte adecuada en estas instalaciones ambulatorias, una coordinación estrecha del equipo multidisciplinario, y con la UCI, por cualquier complicación durante el procedimiento.
Las limitaciones principales de los resultados presentados están dados por la muestra pequeña de pacientes, y que se restringe solo a la desensibilización de pacientes que hayan tenido una RHS a la quimioterapia (se excluyeron los agentes biológicos que tienen diferente esquema de desensibilización).