Introducción
Los autoanticuerpos anti-insulina (AAI) fueron considerados como marcador de lesión autoinmune de las células beta pancreáticas a partir de que Palmer1 los detectara en pacientes jóvenes recién diagnosticados de diabetes tipo 1 (DT1) sin haber recibido terapia con insulina. La presencia de los AAI está asociada a la de otros marcadores de autoinmunidad pancreática y se correlaciona inversamente con la edad de los pacientes: los AAI se encuentran en el 48 % de los pacientes en edades pediátricas con DT1, mientras solo en el 4 % de los adultos que desarrollan la DT1.2 La producción de AAI precede varios años el inicio clínico de la DT1, por lo que constituye un importante factor de riesgo de desarrollar la DT1, permite el diagnóstico precoz de la diabetes, antes de las manifestaciones clínicas.3
Además del valor predictivo de los AAI para la DT1, el significado clínico de los AAI se extiende al diagnóstico de la diabetes autoinmune latente del adulto (LADA),4 y el síndrome hipoglicémico causado por AAI, conocido como síndrome autoinmune de la insulina (IAS) o enfermedad de Hirata’s.5 El IAS es la condición clínica que se caracteriza por una hipoglicemia hiperinsulinémica y elevados títulos de AAI, la cual ha sido descrita más frecuente en países asiáticos como Japón y Korea.6 La IAS podría pasar inadvertida si los niveles de AAI no son determinados oportunamente en pacientes con hipoglicemia hiperinsulinemia endógena.7
Uno de los métodos actuales para la detección de los AAI es el ensayo inmuno-adsorbente ligado a enzima (ELISA), en el cual los AAI presentes en la muestra del paciente se unen a la insulina humana inmovilizada sobre la superficie de la placa de prueba y esta reacción es detectada con un antisuero específico de inmunoglobulina IgG humana conjugado con una enzima.8 El ELISA se distingue por su simple aplicación, sin necesidad de utilizar material radioactivo. El objetivo de este trabajo fue determinar la sensibilidad y la especificidad de los AAI determinados por ELISA en pacientes cubanos adultos con diagnóstico de DT1.
Métodos
Se trata de un estudio descriptivo transversal para la determinación de autoanticuerpos realizado en el Hospital Clínico Quirúrgico “Hermanos Ameijeiras” (HCQHA) del Ministerio de Salud Pública de Cuba (MINSAP). Este estudio recibió la aprobación ética de la comisión científica del HCQHA. Los métodos se desarrollaron según los procedimientos operativos aprobados. Se obtuvo el consentimiento informado para participar en el estudio de todos los sujetos involucrados. La población de estudio consistió en 33 pacientes adultos con diagnósticos de DT1, ambulatorios y hospitalizados del servicio de Endocrinología del Hospital Clínico Quirúrgico “Hermanos Ameijeiras” desde 2019 hasta 2020. El diagnóstico de la DT1 fue establecido hace ≥5 años. Todos los pacientes con DT1 recibían multidosis diarias de insulina humana recombinante. Del mismo servicio fueron seleccionados 78 pacientes con diagnóstico de enfermedades endocrinas distintas a la DT1, como diabetes tipo 2 (DT2) (n=27), tiroiditis de Hashimoto con o sin hipotiroidismo (n=37) e hiperinsulinemia (n=14), los cuales representaron el grupo control de enfermedades endocrinas (CEE). Como controles de la determinación de autoanticuerpos se utilizaron las muestras séricas de 49 individuos sanos donantes voluntarios (CN). Todos los pacientes y sujetos sanos fueron de nacionalidad cubana y residentes en Cuba. Los datos demográficos, clínicos y de laboratorio se obtuvieron de la historia clínica de los pacientes. Determinación de los autoanticuerpos anti-insulina.
Se obtuvieron muestras de suero a partir de 5 mL de sangre venosa periférica de los pacientes con DT1, CEE y CN y se conservaron a -20 C hasta la fecha de la determinación de los AAI. Las determinaciones de los AAI se realizaron por el método de ELISA dirigido específicamente a la detección de AAI de isotipo IgG (MDSS GmbH, Hannover, Alemania). El método de ELISA para los AAI se utilizó como antígeno la insulina humana inmovilizada sobre la superficie de los micropocillos. Las muestras fueron analizadas por duplicado. Los resultados se expresaron como valor del índice respecto a los valores de densidad óptica del control de referencia de AAI del fabricante. Los controles negativo y positivo mostraron los valores del índice recomendados por el fabricante en todos los ensayos. Los resultados de las determinaciones de los AAI fueron registrados en la historia clínica del paciente de la base de datos correspondiente al software GALEN Clínicas del hospital en estudio.
Se utilizó para el análisis el paquete estadístico Statistical Package Social Science (Spss) versión 20.0. Las pruebas para la normalidad demostraron una distribución asimétrica de la edad y los AAI. La estadística descriptiva se expresó como mediana, amplitud intercuartil (AI) y rango mínimo-máximo para las variables continuas y como frecuencia y porcentaje para las variables categóricas. Los datos cualitativos fueron analizados con la prueba Chi-cuadrado con corrección de Yates. Las variables cuantitativas se analizaron con la prueba U de Mann-Whitney y Kruskal-Wallis. El coeficiente de correlación (r) entre los AAI y la edad se calculó con la correlación no paramétrica de Spearman. Fueron construidas las curvas COR para evaluar la sensibilidad y especificidad diagnóstica de los AAI para los pacientes con DT1. La significación estadística fue definida como p<0,05 calculado bilateralmente (2-tailed).
Resultados
Se analizaron 33 pacientes con DT1, el grupo control de enfermedades endocrinas CEE compuesto de 78 pacientes de los cuales 27 estaban diagnosticados de DT2; 37 de tiroiditis de Hashimoto con o sin hipotiroidismo y 14 de hipersinsulinemia, y el grupo de controles normales (CN) integrado por 49 individuos sanos. No se encontraron diferencias significativas en la edad entre los tres grupos, pero la distribución del sexo fue desigual con predominio de mujeres en los DT1 y CEE y predominio de hombres en CN. (Tabla 1).
Tabla 1 Características demográficas de la población estudiada

Abreviaciones: DT1: diabetes tipo 1; CEE: Controles de enfermedades endocrinas (diabetes tipo 2, Tiroiditis de Hashimoto, hipotiroidismo, hiperinsulinemia); CN: individuos sanos, AI: amplitud intercuartil. Los valores representan la mediana de la edad y la proporción del sexo.a: Prueba de Kruskal-Wallis;b: prueba de X2 cuadrado.
Fue construida la curva COR para obtener los valores de corte más adecuados de AAI para la población cubana, estas curvas son de particular importancia para la interpretación de resultados de nuevos medios (kit) diagnósticos. La curva COR de los AAI de los pacientes con DT1 frente a los controles sanos (CN) está representada en la figura 1 con el área bajo la curva (AUC =0,647) y la p correspondiente (p=0,024). El análisis de la curva COR nos permitió definir como valor de corte de AAI para el diagnóstico de DT1 al índice de 1,05, asociado a la combinación más conveniente de sensibilidad y especificidad, valor que resultó similar al valor de corte recomendado por el fabricante (Tabla 2).
Tabla 2 Sensibilidad (S), especificidad (E), razón de verosimilitud positiva (RV+) y razón de verosimilitud negativa (RV-) de los autoanticuerpos anti-insulina
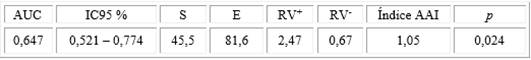
El área bajo la curva (AUC =0,647) y la p correspondiente (p=0,024)
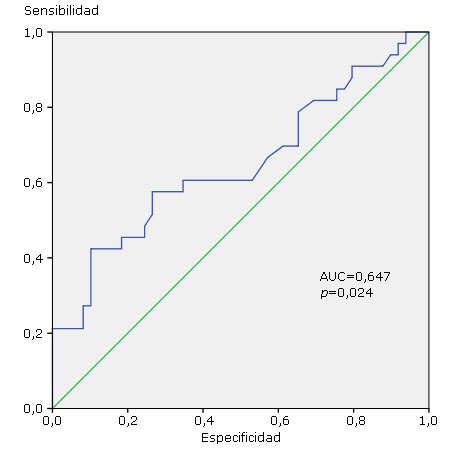
Fig. 1 Curvas COR de los autonticuerpos anti-insulina (AAI). La curva representa la sensibilidad y la especificidad de los AAI para diabetes tipo 1 respecto a los controles sanos. Están indicadas el área bajo curva (AUC) y la p correspondiente.
Los niveles de AAI fueron significativamente más altos en los DT1 (índice de 0,97) que en el grupo de controles sanos (índice de 0,70; p= 0,020) y en el grupo de otras enfermedades endocrinas (índice de 0,63; p= 0.009) (tabla 3 y figura 2). Respecto a los resultados cualitativos, los AAI estuvieron por encima del valor de corte para la positividad (índice de 1,05) en15 de los 33 DT1; mientras que 9 de los 49 controles sanos y 14 de los 78 controles de otras enfermedades endocrinas resultaron positivas para los AAI (p=0,017; p=0,006, respectivas) (Tabla 3). De los 27 pacientes con DT2, 2 resultaron positivos de AAI (7,4 %); de los 37 con tiroiditis de Hashimoto, 8 fueron positivos de AAI (21,6 %) y de los 14 con hiperinsulinemia, 4 fueron positivos de AAI (28,6 %).
Tabla 3 Resultados de los autoanticuerpos anti-insulina (AAI)
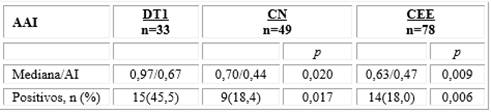
Abreviaciones: AAI: autonticuerpos anti-insulina; DT1: diabéticos tipo 1; CN: individuos sanos; CEE: pacientes con otras enfermedades endocrinas; AI: amplitud intercuartil. Los valores representan la mediana del índice de AAI; y las proporciones de los positivos de AAI. Las diferencias fueron evaluadas por la prueba de Mann-Whitney para las variables continuas o la prueba X2 con corrección de Yates para las proporciones.
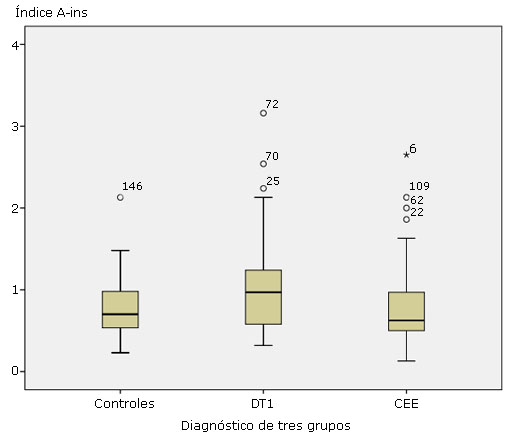
Fig. 2 Las medianas de los niveles de autonticuerpos anti-insulina (AAI) fueron superiores en pacientes con diabetes tipo 1 (DT1) respecto a las de individuos sanos (Controles) (p=0,020), y a las de pacientes con otras enfermedades endocrinas (CEE) (p=0,009).
La correlación entre los niveles de los AAI y la edad de los pacientes diabéticos DT1 y DT2 resultó en un coeficiente de correlación de Spearman (ρ) de -0,252 (p=0,030).
Discusión
Los resultados de este trabajo enseñaron que una proporción alta de los pacientes adultos con diagnóstico establecido de DT1 presentaron AAI. Los AAI estuvieron presentes en un porcentaje considerable de pacientes con otras condiciones endocrinas como la DT2, tiroiditis de Hashimoto y la hipersinsulinemia, así como en individuos sanos, lo que ha colocado la especificidad de la prueba para los AAI en cifras subóptimas. Aun así, la reactividad de los AAI fue superior en los pacientes con DT1 respecto al grupo de individuos sanos (p=0,017) y al grupo de otras enfermedades endocrinas (p=0,006). Además, los pacientes con DT1 se distinguieron por títulos séricos más elevados de los AAI que los de los individuos sanos (p=0,020) y los de las otras enfermedades endocrinas (p=0,009).
Si bien es cierto que los AAI son marcadores serológicos de la DT1, no son exclusivos de los pacientes con DT1. La presencia de AAI ha sido observada en pacientes adultos con diagnóstico de DT2 de otras regiones geográficas. Los AAI se han encontrado hasta en el 30 % en pacientes adultos caucásicos con DT2.9 Al respecto se ha señalado que los pacientes con DT2 exhiben una respuesta autoinmune similar a la de los pacientes con DT1, en ambas se expresan AAI y otros anticuerpos de células pancreáticas, pero en cantidades diferentes.10 La presencia de los AAI en pacientes con DT2 podría tener valor de predicción para el desarrollo de la insulinodependencia.11
Un porcentaje considerable de los pacientes con tiroiditis de Hashimoto fueron positivos de AAI en este estudio. Ha sido argumentada la desregulación generalizada de la respuesta inmune en los pacientes con enfermedad tiroidea autoinmune. En particular, las enfermedades inflamatorias autoinmunes del tiroides se asocian a alteraciones del metabolismo de glucosa e insulina, y con frecuencia concurren con la diabetes, tanto en el plano clínico, como serológico.12,13 Son numerosos los estudios que han demostrado la prevalencia de autoanticuerpos tiroideos en pacientes con DT1, poco se ha explorado el status de la autoinmunidad insular en la enfermedad tiroidea autoinmune.14 Diversas especificidades de autoanticuerpos además de los AAI, asociados a la DT1 han sido encontradas en pacientes con la tiroiditis de Hashimoto y la enfermedad de Graves.14,15,16,17
Algunos estudios recientes han señalado que los pacientes con enfermedades tiroideas autoinmunes presentan un riesgo mayor de desarrollar la DT1.18,19 El riesgo de desarrollar la diabetes en los pacientes con enfermedades tiroideas está asociado a la expresión de autoanticuerpos insulares.19 Se ha sugerido que los pacientes con enfermedades tiroideas autoinmunes necesitan de pruebas de cribado de autoanticuerpos insulares y los positivos requieren seguimiento para evaluar la función insular y los niveles de glucosa en sangre.14 Valdría la pena emprender investigaciones que definan con más precisión el potencial vínculo entre la autoinmunidad tiroidea y la autoinmunidad insular.
Un análisis aparte, merece la relación entre los AAI y su pareja molecular, la insulina. En este trabajo, aproximado de la tercera parte (28,6 %) de los pacientes con hiperinsulinemia fueron positivos de AAI. Al respecto, se ha observado que los niveles séricos de insulina están más elevados en los pacientes con anticuerpos a la insulina que en los negativos de estos20 Los AAI pueden prolongar la vida media de la insulina y modificar la biodisponibilidad de la hormona.21 Un estudio reciente demostró que la sensibilidad a la insulina es inversamente proporcional a los niveles de AAI, y no de otros autoanticuerpos, en pacientes adultos con DT1 de reciente comienzo. Estos hallazgos permiten identificar la resistencia a la insulina en el adulto con la presencia de AAI en títulos altos.22
La presencia de autoanticuerpos frente a un antígeno circulante, como la molécula de insulina, está asociada a un tipo particular de reacción de hipersensibilidad.23 La aparición de los AAI es la piedra angular del IAS o enfermedad de Hirata’s,5 donde los AAI juegan el papel patogénico en el desarrollo de los episodios de hipoglicemia autoinmune. El análisis de los AAI presentes en el IAS ha revelado que estos anticuerpos poseen una alta capacidad de unión, pero baja afinidad, en virtud de lo cual producen la hiperinsulinemia y la hipoglicemia posprandial tardía.24) Debido a la alta capacidad de unión, los AAI unen varias moléculas de insulina, lo que produce formación de inmunocomplejos de gran tamaño, que producen el “efecto de reservorio” de insulina.7 Por otra parte, la baja afinidad para la insulina permite la disociación espontánea del inmunocomplejos, lo que eleva la concentración de insulina libre, produce la hipoglicemia.25
La insulina exógena también puede estimular la producción de anticuerpos, pero estos generalmente no provocan alteración de la regulación glicémica. Los anticuerpos a la insulina exógena son de mayor afinidad y menor capacidad de unión que los AAI, por lo que sus inmunocomplejos son más pequeños y de menos disociación espontánea.26 En ocasiones los anticuerpos frente a la insulina exógena resultan de características similares a los de AAI, dando lugar a marcadas fluctuaciones glicémicas.26,27
La descripción del IAS en pacientes diabéticos tratados con insulina y otros numerosos fármacos ha permitido proponer la reclasificación del síndrome con la distinción de formas espontáneas, descritas originalmente y las formas inducidas por fármacos.28 Se ha indicado que dada la progresiva extensión de la lista de fármacos asociados al desarrollo del síndrome, la forma del IAS inducida por fármacos es la que prevalece en la actualidad.28,29 La consideración del IAS en el diagnóstico diferencial de hipoglicemia hiperinsulínica es una exigencia actual, y su confirmación depende de la disponibilidad de la prueba de AAI en los laboratorios.6
La importancia de la detección de los AAI genera gran expectativa, por lo que urge estandarizar las condiciones para su determinación. Los AAI fueron detectados en este trabajo por el ELISA frente a la insulina humana. Históricamente, los ELISA han mostrado un desempeño inferior para la detección de los AAI que los ensayos de fase líquida como el ensayo de unión de radioligando (RBA, por sus siglas en inglés), reconocido en la actualidad como el método de referencia.30 De todos los autoanticuerpos asociados a la DT1, los AAI ha sido la determinación más difícil de estandarizar con relativamente amplias diferencias entre los laboratorios.30,31 Las discrepancias entre las técnicas han sido atribuidas a las diferencias en la afinidad de unión y cambios conformacionales inducidos por la unión de la insulina a la superficie plástica del ELISA.32
El desarrollo de nuevas plataformas diagnósticas no radioactivas, como la electroquimioluminiscencia para la detección de los AAI, aún no se ha logrado un nivel satisfactorio de sensibilidad y especificidad.33 Los análisis de las características de unión a la insulina han mostrado que los AAI naturales son diferentes de los anticuerpos a la insulina exógena, aunque estos pudieran no distinguirse en los ensayos actuales.34 Al respecto, en este estudio encontramos una prevalencia relativamente alta de AAI en pacientes adultos con DT1 (45,5 %). Se demostró el efecto de la edad sobre los niveles de AAI, los cuales se correlacionaron inversamente con la edad en los pacientes diabéticos. Se ha afirmado que tanto la prevalencia como los niveles de AAI se afectan inversamente por la edad, con menor frecuencia y niveles inferiores en los adultos en relación a los pacientes pediátricos donde pueden alcanzar cifras superiores al 50 %.35
Probablemente la frecuencia de AAI encontrada en los pacientes con DT1 no puede ser atribuida totalmente a la presencia de AAI naturales, se tuvo en cuenta que éstos pudieran ser indistinguibles analíticamente de los anticuerpos a la insulina inducidos. Estudios de seguimiento de larga duración de pacientes con DT1 han demostrado que los autoanticuerpos, aunque declinan sus niveles, pueden persistir por más de 50 años después del comienzo de la enfermedad en hasta el 50 % de los pacientes.36 Pero los AAI no es la especificidad que se ha destacado por su persistencia evolutiva en la DT1, cediendo en duración frente a los anti-glutamato decarboxilasa (GAD) y otros en menor medida.37
Anticuerpos a la insulina exógena pudieran haber contribuido a la frecuencia de AAI observada en los pacientes con DT1. Independientemente de la pureza y naturaleza, las insulinas terapéuticas siguen siendo inmunogénicas. La insulina humana recombinante y biosimilares inmunizan entre el 14 % y 44 % de los pacientes con diabetes.20,38,39 En cualquier caso, la presencia de anticuerpos a la insulina, especialmente en títulos elevados, debe ser considerada la evolución por el médico de asistencia porque puede generar resistencia a la insulina al interferir con su acción.21,22 Pudiera ser útil emprender estudios longitudinales que permitan definir el papel de los anticuerpos en la respuesta terapéutica a la insulina exógena y el control de la glicemia de los pacientes con DT1.
En conclusión, estos resultados evidenciaron una respuesta autoinmune notable a la insulina en los pacientes con DT1. Los AAI estuvieron presentes en mayor frecuencia y niveles más altos en los pacientes con DT1 respecto a otras enfermedades endocrinas. Estos datos señalan la utilidad potencial de los AAI en la evaluación clínica de pacientes con DT1.














