Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Pediatría
versión On-line ISSN 1561-3119
Rev Cubana Pediatr v.71 n.2 Ciudad de la Habana abr.-jun. 1999
Actualización de temas
Hospital Pediátrico Docente "Centro Habana"Fisiopatología de la diarrea aguda*
Dr. Raúl L. Riverón Corteguera1RESUMEN
Es un artículo de revisión de los aspectos importantes de la fisiopatología de la diarrea. Se hace una descripción de la fisiopatología intestinal que incluye la anatomía del intestino y de su superficie de absorción y la estructura funcional de la mucosa intestinal. La fisiopatología normal de los líquidos intestinales. Mecanismo de absorción del agua y los electrólitos. Absorción de sodio por difusión electrogénica, unido al ion cloro, intercambio con el ion hidrógeno y unido a sustancias orgánicas como glucosa, aminoácidos y algunos oligopéptidos; secreción intestinal de agua y electrólitos. Control intracelular de la secreción. Mediadores y moduladores extracelulares del transporte intestinal. Factores que aumentan la absorción y reducen la secreción. Factores que estimulan la secreción y reducen la absorción Mecanismo fisiopatológico de la diarrea. Clasificación de la diarrea infecciosa aguda: acuosa secretoria y osmótica; diarrea con sangre invasiva y no invasiva.Descriptores DeCS: DIARREA/fisiopatología; MUCOSA INTESTINAL/fisiopatología; INTESTINOS/fisiopatología; ABSORCION INTESTINAL.
La fisiopatología de las enfermedades diarreicas constituye un elemento de extraordinaria importancia en su tratamiento efectivo. Para su comprensión es necesario conocer las funciones fisiológicas intestinales relacionadas con la absorción y secreción del agua y los electrólitos, de igual forma que la distribución del agua en el organismo es esencial para comprender las alteraciones funcionales inducidas por las enfermedades diarreicas.1-3
FISIOLOGÍA INTESTINAL
Los mecanismos que rigen los movimientos del agua y los electrólitos en el intestino son los que permiten una absorción casi total de los volúmenes hídricos provenientes de la ingestión de líquidos, del agua contenida en los alimentos y de las secreciones digestivas. Cuando estos mecanismos se alteran por una infección u otro fenómeno, el agua y los electrólitos son mal absorbidos o no se absorben, lo que implica su pérdida considerable mediante las heces que se fugan por las diarreas. La terapia de rehidratación oral tiene como base funcional la fisiología de mucosa intestinal y los trastornos digestivos derivados.4,5ANATOMÍA DEL INTESTINO Y DE LA SUPERFICIE DE ABSORCIÓN
El intestino constituye una gran superficie de absorción de agua, electrólitos y otros nutrientes. Al igual que los demás segmentos del tubo digestivo, la pared del intestino delgado está compuesta, del exterior al interior, por 5 capas: la serosa, que es una extensión del peritoneo; la musculosa, que está formada por 2 capas de fibras musculares lisas, una externa longitudinal y otra interna circular; la submucosa, formada por un tejido conjuntivo denso que contiene células dispersas, así como las glándulas de Brünner en el duodeno; la muscularis mucosae, que está constituida por una capa delgada de fibras musculares; y la mucosa, formada por un epitelio de una sola capa que recubre un tejido conjuntivo denominado lámina propia. Es a nivel de la mucosa donde se ubican los principales mecanismos que controlan la absorción del agua y los electrólitos4 (fig. 1).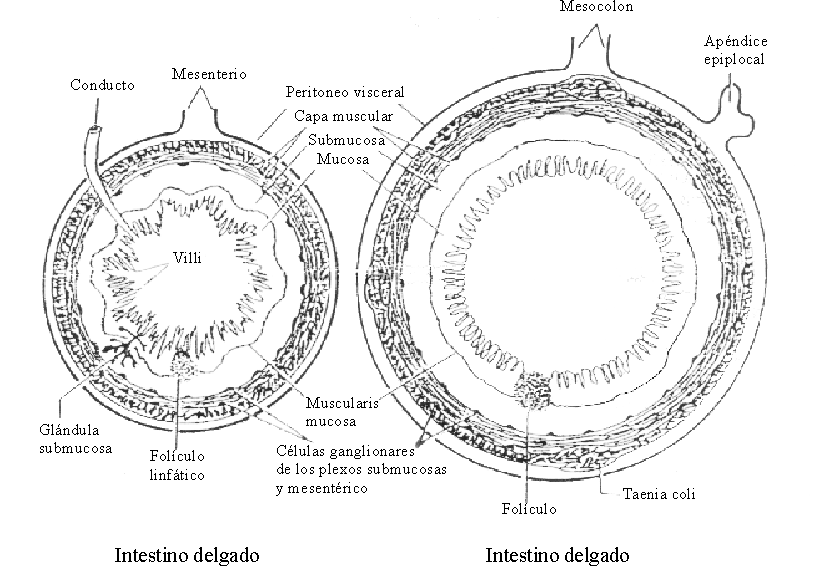
Fuente: OPS. Fisiología de la absorción intestinal de agua, electrólitos y macronutrientes. En: Manual de tratamiento de la diarrea. Serie Paltex No. 13, 1987:4-20.
El intestino delgado tiene la forma de un tubo alargado, que en el adulto mide aproximadamente de 5 a 8 m. Consta de 3 partes: el duodeno, el yeyuno y el íleon. El intestino grueso se compone de ciego y apéndice; el colon ascendente, transverso y descendente; el sigmoides; el recto y el canal anal. Tiene una longitud de 1,5 m, y cada uno de los segmentos tiene estructura y funcionamiento diferentes.5,6
El intestino posee una superficie de absorción que se multiplica por varios sistemas: las válvulas conniventes, las vellosidades y las microvellosidades.
Las válvulas conniventes o pliegues del Kerkring son repliegues transversales de la submucosa recubierta por la muscularis mucosae y la mucosa. Miden hasta 1 cm de diámetro, lo que las hace visibles macroscópicamente, y el intestino delgado tiene alrededor de 1 000 millones en su conjunto. El área de la superficie luminal de la mucosa del intestino delgado se aumenta 600 veces por la presencia de estos pliegues, las vellosidades y las microvellosidades.
Las vellosidades intestinales son proyecciones de la mucosa en forma de dedos de guante u hojas, representan alrededor de 10 millones y son visibles con una lupa binocular. Cada vellosidad tiene un vaso linfático denominado lácteo que se comunica con los vasos linfáticos de la mucosa y que se agranda para formar un seno pequeño cubierto por células endoteliales; entre el epitelio y el seno central se encuentra una red de vasos sanguíneos. Cada vellosidad intestinal está recubierta por una capa de células epiteliales columnares denominadas enterocitos y en la base de las vellosidades están las criptas de Lieberkühn o glándulas intestinales.
Las microvellosidades de los enterocitos forman el "borde en cepillo", que está compuesto por microvellosidades finas de aproximadamente 1 mm de longitud por 0,1 mm de ancho. Se estima que cada enterocito contiene alrededor de 600 microvellosidades y que 1 m2 de superficie absorbente contiene 50 millones de estos elementos. Debido a ellas, el área de la superficie luminal de la mucosa del adulto es de aproximadamente 200 m2. Esta superficie de absorción tan grande muestra la importancia de los intercambios que en ella se llevan a cabo (fig. 2).
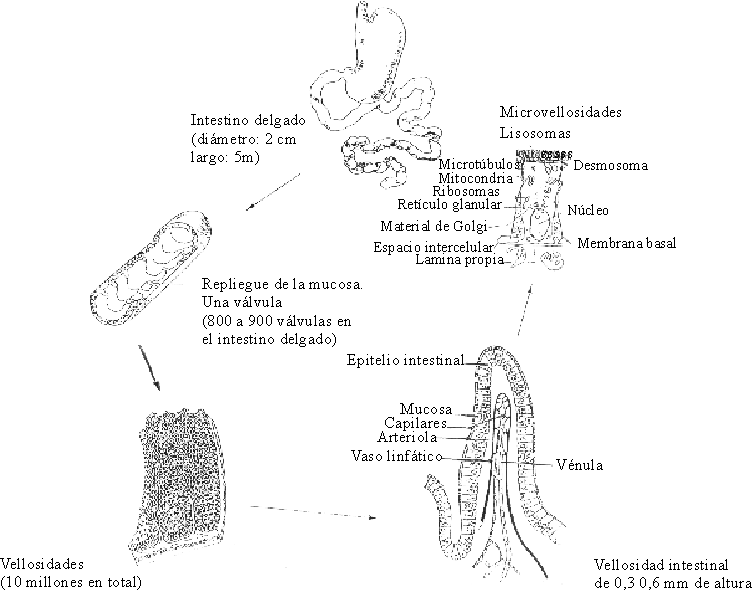
Fuente: Tomado de Fricker J. Halte aux meladies diarrhieques. Revue du Centre International de L´Enfants 1993:204,6-12.
Las microvellosidades producen una capa superficial de glicoproteínas, denominada glicocalix, la cual contiene los transportadores intestinales y las enzimas digestivas (glicoamilasa, sacarasa, maltasa, isomaltasa, lactasa, trealasa, enteroquinasa y oligopeptidasas) que hidrolizan sus respectivos substratos.4-8
Otro elemento de gran importancia en el intestino lo constituyen las criptas, cuya función principal es la de producir continuamente las células epiteliales (enterocitos) que recubren las vellosidades. Los enterocitos que cubren las extremidades y la parte media de las vellosidades son células epiteliales columnares y tienen como función la absorción, mientras que los enterocitos de las criptas de las vellosidades son células epiteliales cuboideas con función secretoria.
Las células inmaduras no diferenciadas de las vellosidades, maduran durante su emigración hasta alcanzar su capacidad de producción de enzimas digestivas especializadas y transportar los nutrientes. De esta forma una misma célula en su proceso migratorio y de maduración tiene las funciones secretorias y absortiva. Las células caducas son expulsadas al lumen intestinal, a través de su extremidad, en un período de 3 días, lo que permite una renovación constante del epitelio intestinal. Diariamente se depositan en el lumen intestinal alrededor de 250 g de células epiteliales. Este sistema de renovación celular es el más rápido del organismo.7-9 Cuando la descamación es acelerada, como ocurre en la diarrea, la vellosidad disminuye su longitud mientras que la producción de células en las criptas aumenta, y de esta forma se fortalece el mantenimiento de la integridad de la pared epitelial.4
ESTRUCTURA FUNCIONAL DE LA MUCOSA INTESTINAL
Los enterocitos tienen una membrana apical hacia el lumen intestinal y una membrana basolateral (MBL) hacia el espacio intercelular enterocitario. Los enterocitos están unidos entre sí por los desmosomas y los espacios intercelulares. El lado correspondiente a la serosa se encuentra cerrado por la membrana basolateral y el que se corresponde con la mucosa, por los espacios intercelulares. En la membrana basolateral se encuentran las enzimas del sistema ATPasa-Na-K, que dirigen la "bomba de sodio"7,10 (fig. 3).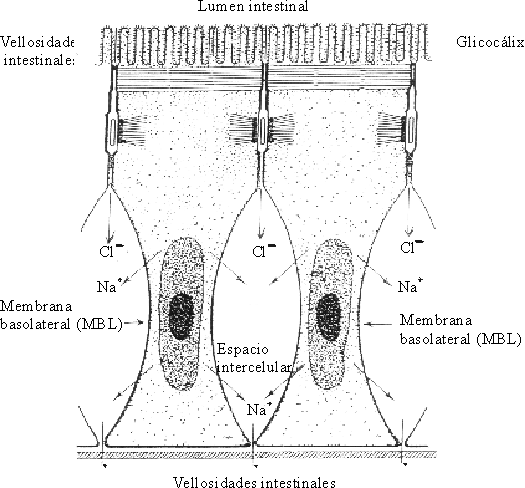
Fuente: OPS. Fisiología de la absorción intestinal de agua, electrólitos y macronutrientes. En: Manual de tratamiento de la diarrea. Serie Paltex No. 13, 1987:4-20.
En la membrana apical del enterocito, que hace relieve en el lumen intestinal, es donde se produce la recepción, entrada y transferencia de solventes y solutos para la porción intracelular del enterocito. Dichas operaciones ocurren por difusión, transporte activo o transporte facilitado a través de la vía transcelular, y dirigen las sustancias a las porciones cercanas de la membrana basolateral, que es la responsable de traspasarlas al espacio intercelular del enterocito. Hay que destacar también la presencia de los espacios intercelulares de los enterocitos, cuyo límite es el estrechamiento formado por los microfilamentos que atan las uniones intercelulares. Ellos establecen la ruta paracelular que constituye la vía principal para el tráfico de agua y solutos.
La mucosa es una membrana completa formada por una capa luminal, el epitelio basal y capilares sanguíneos; sin embargo, se le considera como una membrana con poros pequeños cargados de líquido, a través de los cuales pasan agua, iones y solutos.4,8,11,12
FISIOLOGÍA NORMAL DE LOS LÍQUIDOS INTESTINALES
Normalmente a lo largo del intestino existe absorción y secreción de agua y electrólitos, o sea, que cada día cantidades considerables de éstos transitan a lo largo del intestino delgado (fig. 4).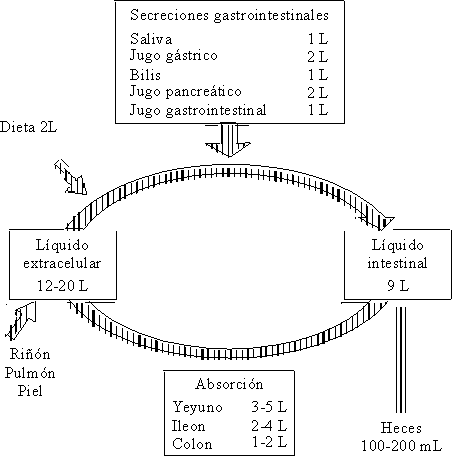
Un adulto en pleno estado de salud, con una dieta normal ingiere alrededor de 2 L de líquido (en forma de alimentos o bebidas) diariamente. A éstos hay que añadirle el agua contenida en la saliva, la secreción gástrica, pancreática y hepática, cuya cantidad es de aproximadamente 7 L, lo que hace un total aproximado de 9 a 10 L que pasan al intestino delgado cada día. La mayor parte de la absorción de estos líquidos tiene lugar a nivel del yeyuno, donde existe una elevada permeabilidad para el agua y el sodio y donde se absorben alrededor de 4 a 5 L.
Otra parte considerable de la absorción se lleva a cabo en el íleon, que resulta menos permeable que el yeyuno, pero donde se efectúa una absorción activa de agua y de sodio. Al colon llegan alrededor de 1,5 L en condiciones normales; aquí la absorción de agua es más lenta y sólo se excretan en las heces de 100 a 200 mL.2,4,5,8,10
De esta forma existe en el intestino un movimiento o flujo bidireccional de agua y de iones a través de la mucosa, por una parte hay una secreción de agua del plasma hacia la luz intestinal y por otra, una absorción de la luz intestinal hacia el plasma. Esto hace que se mantenga el equilibrio entre la absorción y la secreción intestinal, que son las 2 funciones diferentes que presenta la mucosa intestinal. La absorción es normalmente mayor que la secreción, lo que da por resultado un balance positivo en la absorción de líquidos.4,8-10,12
Cualquier cambio que ocurra en el flujo bidireccional de agua y electrólitos en el intestino delgado, bien porque se produzca una inhibición de los procesos de absorción o porque se estimule la secreción, o por ambos mecanismos a la vez, el volumen de agua y electrólitos que llega al colon excede su capacidad de absorción y se produce la diarrea.2,4,8,10,13-15
MECANISMOS DE ABSORCIÓN DEL AGUA Y ELECTRÓLITOS
Tanto el intestino delgado como el grueso tienen la capacidad de absorber y secretar líquidos; al equilibrio existente entre estas 2 funciones se le ha denominado tono del transporte intestinal. La absorción tiene lugar en las vellosidades intestinales y en la superficie epitelial del colon, mientras que la secreción se produce en las criptas del intestino delgado y el colon.11,12La absorción de agua por el intestino delgado es debido a gradientes osmóticos que se crean cuando los solutos (particularmente el sodio) son absorbidos del lumen intestinal por las células epiteliales de las vellosidades (enterocitos).2 El sodio y el cloro son los iones más importantes involucrados en el movimiento del agua, mientras que los azúcares y aminoácidos regulan el transporte intestinal del sodio.8,11,12
La absorción de agua en el intestino está determinada, en gran parte por la absorción de sodio y cloro; en condiciones normales tiene lugar la entrada de agua y electrólitos, hacia el interior del enterocito, a través de su superficie luminal y una salida hacia el plasma por la superficie serosa del enterocito.15-17
Diversos mecanismos se han descrito18-23 para explicar la absorción de sodio en el intestino delgado, ellos son:
- Directamente como ion sodio por difusión electrogénica.
- Unido al ion cloro.
- Mediante el intercambio con el ion hidrógeno.
- Unido a sustancias orgánicas como glucosa o ciertos aminoácidos.
ABSORCIÓN DEL SODIO POR DIFUSIÓN ELECTROGÉNICA
La absorción de sodio se lleva a cabo en 2 fases: en la primera se produce la entrada del ion sodio, por un mecanismo electrogénico, a través del "borde en cepillo" del enterocito. En la segunda fase del proceso, la ATPasa-Na-K, enzima ligada al metabolismo celular, suministra la energía para transportar el sodio a través de la MBL hacia el espacio intercelular. De esta forma, el aumento del flujo de sodio se compensa por un aumento de la actividad de la ATPasa-Na-K en la membrana. Esto hace que la concentración de sodio en el enterocito sea baja (fig. 5).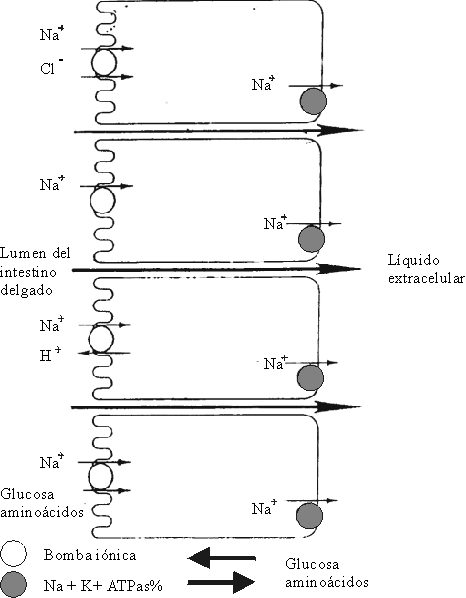
Fuente: Patofisiología de la diarrea. En: Enfermedades diarreicas: diagnóstico y tratamiento. OPS/OMS 1995: 16-20.
Por cada molécula hidrolizada de ATP, se expulsan del enterocito 3 moléculas de sodio, lo que permite el intercambio con el plasma por 2 moléculas de potasio que entran al enterocito. La expulsión activa de sodio tiende a aumentar la osmolaridad en el espacio intercelular, y esto da lugar a una fuerza osmótica de conducción para la absorción activa de agua.24-28
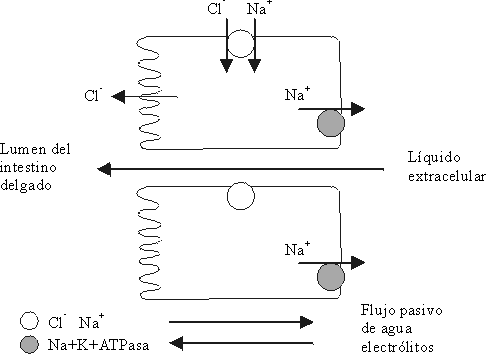
Fuente: Patofisiología de la diarrea. En: Enfermedades diarreicas: diagnóstico y tratamiento. OPS/OMS 1995:16-20.
SODIO UNIDO AL ION CLORO
Después que el ion sodio es sacado de forma activa del enterocito por la "bomba de sodio" (sistema ATPasa-Na-K), en la solución de la serosa, el ion sodio le da una carga eléctrica positiva que establece una diferencia de potencial, que proporciona una fuerza para la difusión del ion cloro de la mucosa a la serosa a través de la ruta paracelular o parcialmente transcelular.25,27INTERCAMBIO CON EL ION HIDRÓGENO
El ion sodio penetra en el enterocito procedente del lumen intestinal y se intercambia con el ion hidrógeno de forma directa.2SODIO UNIDO A SUSTANCIAS ORGÁNICAS COMO GLUCOSA, AMINOÁCIDOS Y ALGUNOS OLIGOPÉPTIDOS
La absorción de estos solutos depende absoluta o parcialmente, de la presencia de sodio en el lumen intestinal; la tasa de absorción de sodio es mucho mayor en presencia de ellos. En ausencia de glucosa, la absorción de sodio es mínima por esta vía. La glucosa se une a un transportador específico de membrana y este sistema es energizado por el sodio, y juntos penetran a través de la membrana al enterocito. El efecto producido es el incremento en la absorción del sodio. La absorción de la glucosa unida al sodio facilita la absorción de gran cantidad de agua. La extensión basocelular de la glucosa se realiza por "difusión facilitada", mediada por un transportador.5,8,11,12La absorción del sodio en el colon se lleva a cabo por un mecanismo de absorción electrogénico, por simple diferencia de potencial electroquímico, y constituye la fuerza principal para la absorción de agua. En el colon existe un proceso neutro de intercambio de aniones, diferente a lo que ocurre en el intestino delgado. Los iones cloro se absorben a cambio de iones bicarbonato (HCO3). La absorción de aniones orgánicos a través de la mucosa colónica establece un estímulo para el transporte de iones y agua.29,30
SECRECIÓN INTESTINAL DE AGUA Y ELECTRÓLITOS
La secreción de agua y electrólitos se produce en las criptas del epitelio del intestino delgado, donde el cloruro de sodio es transportado del espacio extracelular (EEC) al enterocito, a través de la (MBL). Posteriormente el sodio es devuelto al EEC por la acción de la "bomba de sodio" ejercida por la enzima ATPasa-Na-K. Simultáneamente, el estímulo secretor permite que el cloro pase, a través de la membrana luminal de los enterocitos de las criptas, al lumen intestinal. Esto da lugar a la creación de un gradiente osmótico que hace que el agua y otros electrólitos fluyan de manera pasiva del EEC al lumen intestinal a través de los canales intracelulares4,10,15,18En el control intracelular de la secreción se han descrito hasta el momento 3 tipos de mensajeros secundarios. Ellos son:
- Nucleótidos cíclicos enterocitarios (AMPc y GMPc).
- Sistema endógeno de producción de prostaglandinas (PGs).
- Calcio intracelular.
CONTROL INTRACELULAR DE LA SECRECIÓN
La combinación de un secretagogo extracelular con la membrana de las células da lugar a cambios en la permeabilidad de los iones asociados con la secreción mediante la activación de los mediadores intracelulares. Éstos comprenden los nucleótidos cíclicos (AMPc y GMPc), el calcio, la calmodulina, metabolitos de fosfatidil inositol y la proteína G (proteína reguladora dependiente de trifosfato de guanosina).Estos mediadores intracelulares alteran el transporte de membrana, en parte por la activación de las proteinokinasas específicas, que producen la fosforilación, ya sea de los canales de iones o de las proteínas reguladoras asociadas. El calcio y el AMPc no sólo median la secreción de las criptas, sino que inhiben también la absorción de cloruro de sodio y agua a través de las vellosidades e inhiben el intercambio sodio-hidrógeno. El transporte de sodio acoplado no se ve afectado (fig. 7).
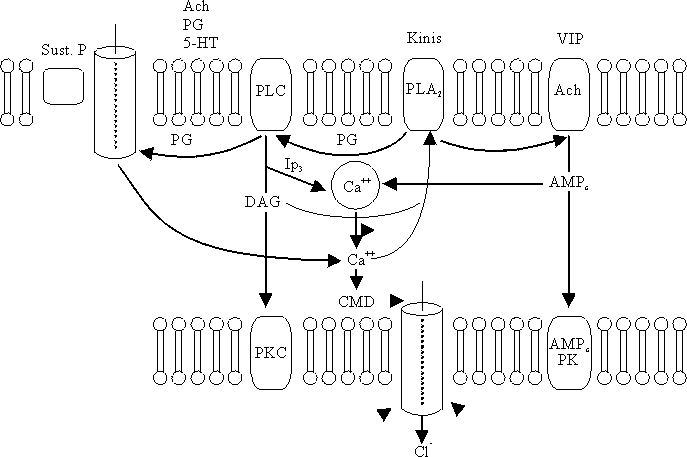
Los diferentes secretagogos no emplean necesariamente los mismos mediadores intracelulares, aunque existe una interacción de importancia entre los diversos mecanismos y mediadores. El péptido intestinal vasoactivo (VIP) se combina con un receptor en la membrana basolateral para liberar la proteína G, que activa el adenilato ciclasa y da lugar a la formación de AMPc.31 El AMPc provoca secreción mediante el enlace con el componente regulador de una proteinokinasa dependiente de dicho AMPc. Esto provoca una separación de la subunidad catalítica que modifica el transporte de membrana. La noradrenalina inhibe la secreción intestinal mediante la combinación con los adrenorreceptores alfa2 y mediante la liberación de la proteína G que suprime el adenilato ciclasa.32
Otros transmisores actúan por incremento de la concentración intracelular del calcio, lo cual puede ocurrir de diversas formas:
- Sustancia P. Al interactuar con un receptor unido a la membrana produce aumento de la permeabilidad de la membrana al calcio.
- Acetilcolina, serotonina y prostaglandina E2. Estos activan la fosfolipasa C en las membranas basolaterales y provocan la formación de diacylglycerol (DAG) y trifosfato de inositol de los componentes de membrana.33
- Trifosfato de inositol. Libera el calcio de las organelas en el citoplasma y aumenta también la permeabilidad de la membrana al calcio.
- El calcio también puede liberarse a través del AMPc. Un aumento del calcio citosólico modifica las proteínas de transporte y las enzimas relacionadas con inclusión de la calmodulina y las proteinokinasas.
- Calmodulina (proteína reguladora calcio-dependiente) desempeñaba un papel clave en la mediación de la secreción activa de cloruros: sin embargo, estudios más recientes indican que sólo tiene una responsabilidad discreta en la producción de la secreción.
- La activación de la proteinokinasa C por el (DAG), causante de que la enzima se una a la membrana, provoca una secreción más prolongada que no depende del aumento de las concentraciones citosólicas de calcio.34
- El DAG y el aumento del calcio citosólico pueden inducir secrecion mediante el estímulo de la fosfolipasa A2 (PLA2) unida a la membrana, liberando ácido araquidónico, el cual se descompone para producir prostaglandinas.
MEDIADORES Y MODULADORES EXTRACELULARES DEL TRANSPORTE INTESTINAL
Existe toda una variedad de sustancias químicas que pueden modificar el transporte intestinal.35,36 Ellas incluyen toxinas bacterianas, mediadores de la inflamación, neurotransmisores, hormonas y elementos normales del contenido intestinal. Sólo algunas actúan directamente sobre los enterocitos. La mayoría actúa sobre los receptores neurales para modular la liberación de neurotransmisores de los nervios secretores motores (tabla 1 y fig. 8).| Agentes que aumentan la absorción intestinal e inhiben la secreción | Agentes que disminuyen la absorción y estimulan la secreción |
| - Nutrientes | - Toxinas bacterianas |
| . Glucosa | . Toxina del Vibrión colérico |
| . Aminoácidos | . Toxinas de Escherichia coli |
| . Péptidos | - Contenidos del lumen intestinal |
| . Ácidos grasos volátiles (colon) | . Ácidos biliares |
| . Acidos grasos de cadena larga (colon) | |
| - Neurotransmisores o neuromodulares | |
| . Neuropéptido Y | - Neurotransmisores o neuromoduladores |
| . Noradrenalina | . Acetilcolina |
| . Dopamina | . Prostaglandinas |
| . Somatostatina | . Leucotrienos |
| . Encefalinas | . Serotonina |
| . Angiotensina | . Histamina |
| . Glucocorticoides | . Péptido intestinal vasoactivo |
| . Neurotensina | |
| . Colecistokinina | |
| . Secretina | |
| . Glucagón | |
| . Bradykinina | |
| . Sustancia P | |
| . Radicales libres de oxígeno | |
| . Factor de activación plaquetaria (FAP) | |
| . Bombesina | |
| . Trifosfato de adenosina (ATP) |

FACTORES QUE AUMENTAN LA ABSORCIÓN Y REDUCEN LA SECRECIÓN
La proporción de sustancias que estimulan la absorción intestinal es mucho más pequeña que las que provocan la secreción. Las de mayor importancia son:- Nutrientes luminales que incluyen:
- Hexosas (intestino delgado).
- Aminoácidos ( " ").
- Oligopéptidos ( " ").
- Ácidos grasos de cadena corta (colon).
- Neuropéptido Y. Se considera el principal agente proabsorción o antisecreción liberado por las terminaciones nerviosas entéricas.
- Noradrenalina
- Encefalinas. Tiene un efecto similar a la noradrenalina en el sistema nervioso entérico.
- Somatostatina. Se libera por las células mucosas paracrínicas e inhibe la secreción por la acción directa sobre los enterocitos, así como por un efecto indirecto sobre los nervios entéricos.
- Angiotensina. Tiene una acción importante en la proabsorción y la antisecreción. Se forma como una respuesta a la liberación de renina por el riñón, promueve la absorción probablemente actuando por la vía de la liberación de las catecolaminas de las glándulas suprarrenales y los nervios simpáticos.
- Aldosterona. Acelera la absorción en el colon e incrementa la conducción del sodio de la membrana mucosa.
- Glucocorticoides. Estimulan la absorción, tanto en el intestino delgado como en el colon, y aumentan la actividad de la ATPasa Na-K en la membrana basolateral. Son también antisecretores; inducen la síntesis de la lipomodulina, una proteína intracelular que inhibe la acción de la fosfolipasa A2, y suprime la liberación del precursor eicosanoide, el ácido araquidónico de la membrana celular.
- Eicosanoides. Son una gran familia de sustancias transmisoras locales que incluyen las prostaglandinas y los leucotrienos, cada uno de los cuales es un potente secretagogo.
FACTORES QUE ESTIMULAN LA SECRECIÓN Y REDUCEN LA ABSORCIÓN
La secreción se considera un mecanismo de defensa del organismo, que produce secreción de líquidos siempre que el epitelio intestinal se encuentre dañado, irritado o invadido por agentes químicos o elementos extraños. Existe una gran variedad de sustancias que pueden estimular al intestino a secretar líquidos. Ellas incluyen: toxinas bacterianas, neurotransmisores y sustancias paracrínicas liberadas de: leucocitos, linfocitos, macrófagos, mastocitos (células cebadas), células enteroendocrinas y enterocitos dañados. Comparativamente, algunas de ellas actúan de forma directa sobre el enterocito, pero la mayor parte opera por la vía del sistema nervioso entérico, de las células inflamatorias o inmunorreactivas.35-40- Enterotoxinas bacterianas. Las enterotoxinas bacterianas constituyen posiblemente la causa más estudiada de secreción intestinal. La toxina del cólera se une a una glucoproteína en la membrana celular e induce la secreción en una pocas horas. La subunidad A de la toxina colérica se separa de la proteína G unida a la membrana, para liberar un fragmento que es capaz de atravesar la célula y activar el sistema adenilciclasa.
- Epitelio intestinal dañado. Otros organismos como virus y Shigella pueden invadir y dañar el epitelio intestinal directa o indirectamente a través de la liberación de agentes citotóxicos.
Muchos de los mediadores de la inflamación son secretagogos intestinales. El daño de la célula epitelial estimula el metabolismo del ácido araquidónico por la vía de la cicloxigenasa y libera prostaglandina E2, la cual puede inducir la secreción intestinal.
Los secretagogos pueden también ser liberados de células inflamatorias y de inmunocitos. Ellos incluyen histamina, serotonina, radicales libres de O2, factor de agregación plaquetaria (FAP) y kininas.35,37-40
Estas sustancias actúan por diversas vías:
- Las kininas estimulan la fosfolipasa A en la membrana celular y liberan ácido araquidónico, que a su vez libera eicosanoides.
- La vía del metabolismo del ácido araquidónico depende del tipo de células: las células epiteliales y de la lámina propia liberan productos de la cicloxigenasa (prostaciclinas, prostaglandinas y tromboxanos), mientras que los leucocitos y mastocitos liberan productos de la lipoxigenasa (leucotrienos).
- Las prostaglandinas pueden provocar secreción por un efecto directo en los enterocitos o por la vía de un reflejo nervioso entérico.21,36,37
- Los leucotrienos también pueden causar secreción, pero probablemente por la vía de la liberación de productos de los mastocitos.
- La actividad de los leucocitos también puede liberar radicales libres de O2 que contribuyen a la secreción y desgranulación de mastocitos por liberación de prostaglandinas de los enterocitos.
- La histamina actúa a través de receptores sobre los nervios entéricos y los fagocitos.
- La observación de que la secreción inducida por varios de estos mediadores puede ser parcialmente inhibida por neurotoxinas o agentes anticolinérgicos indica que muchos pueden ejercer sus efectos por la vía del sistema nervioso entérico.42,43 Como consecuencia de esto, los receptores neuropéptidos se han encontrado en la membrana de las células inflamatorias de manera que el alcance de la interacción entre los sistemas nervioso e inmune sea muy grande.
SENSIBILIZACIÓN INMUNOLÓGICA
La sensibilización del intestino por antígenos específicos puede traer como resultado la hipersecreción intestinal, cuando el intestino es reexpuesto al mismo antígeno.43,44En animales de experimentación esto puede ser provocado por:
- Ingestión de leche en lugar de agua.
- Infestación parasitaria.
- Inyección intraperitoneal.
- Lesión del epitelio por ácidos biliares, detergentes y luz ultravioleta.
Los mastocitos pueden ser estimulados por la sustancia P y la adenosina, así como por una combinación específica del antígeno con anticuerpos IgE. La proliferación de los mastocitos de la submucosa es una característica de la alergia alimentaria, enfermedad celíaca, infestación parasitaria, enfermedad inflamatoria del intestino y posiblemente del síndrome de intestino irritable.
La desgranulación del mastocito libera numerosos secretagogos. Los mastocitos tienden a acumularse alrededor de los nervios entéricos y forman conexiones muy estrechas. Esta proximidad e interdependencia sugiere la posibilidad de que la desgranulación del mastocito o ambas, sea causa y efecto de la actividad nerviosa.
Es posible que la sensibilización pueda ocurrir en humanos a continuación de un episodio de gastroenteritis. Esto ofrecería una explicación para el período posgastroenteritis y para la diarrea relacionada con la alimentación. Estudios recientes sugieren que la respuesta a antígenos alimentarios puede ser condicionada. Así se ha demostrado que si una campana suena cada vez que se administra el alimento que contiene el antígeno, después de un tiempo, el sonido de la campana puede provocar por sí solo, la desgranulación del mastocito.41
MALABSORCIÓN DE NUTRIENTES
La diarrea asociada con una absorción alterada de nutrientes puede tener también un componente secretorio importante que se expresa de diversas formas:- La secreción de base se aumenta por la atrofia de las vellosidades intestinales como ocurre en la enfermedad celíaca.
- Puede ser estimulada por inflamación o por alergia.
- Aumento de la secreción debido a la presencia de ácidos grasos no absorbibles o ácidos biliares en el colon, posiblemente como resultado de la acción de productos derivados de la degradación bacteriana en las células enteroendocrinas.34 La bilis y los ácidos grasos no saturados provocan secreción que puede ser inhibida parcialmente por neurotoxinas que involucran al sistema nervioso entérico.35,36
MECANISMOS FISIOPATOLÓGICOS DE LA DIARREA
La diarrea es una consecuencia de la disfunción en el transporte de agua y electrólitos a nivel del intestino. Como resultado de esta alteración se produce un aumento de la frecuencia, cantidad y volumen de las heces, así como un cambio en su consistencia por el incremento de agua y electrólitos contenidos en ellas. Todo esto condiciona un riesgo, que es la deshidratación y los trastornos del equilibrio hidromineral4,21 (fig. 9).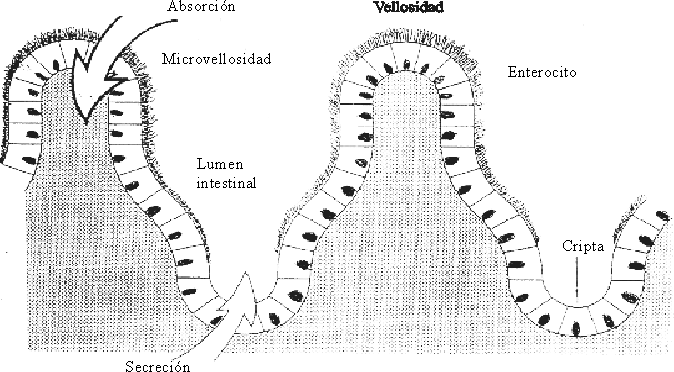
Los mecanismos patogénicos que ocasionan diarrea47-50 están en dependencia de los agentes causales que la producen. En la actualidad se describen varios mecanismos:
- Invasividad. Invasión de la mucosa seguida de multiplicación celular intraepitelial y penetración de la bacteria en la lámina propia. La capacidad de una bacteria para invadir y multiplicarse en una célula, causando su destrucción, está determinada por la composición del lipopolisacárido de la pared celular de dicha bacteria en combinación con la producción y liberación de enzimas específicas. La invasividad está regulada por una combinación de plásmidos específicos y genes cromosomales que varían de un enteropatógeno a otro.
- Producción de citotoxinas. Éstas producen daño celular directo por inhibición de la síntesis de proteína.
- Producción de enterotoxinas. Da lugar a trastornos del balance de agua y sodio y mantienen la morfología celular sin alteraciones.
- Adherencia a la superficie de la mucosa. Esto da por resultado el aplanamiento de la microvellosidad y la destrucción de la función celular normal.
CLASIFICACIÓN DE LA DIARREA INFECCIOSA AGUDA
La diarrea infecciosa aguda es aquella que tiene una duración menor de 14 días. Actualmente se clasifica de manera práctica en diarrea acuosa y diarrea con sangre47,48 (fig. 10).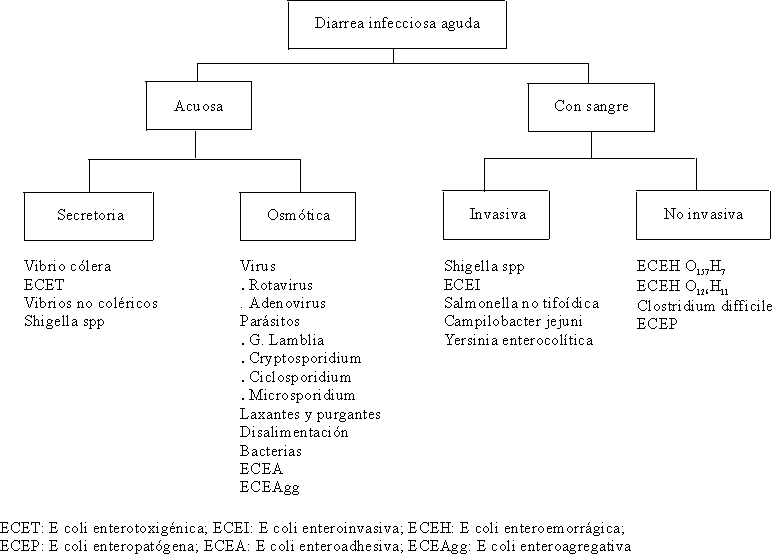
Fuente: Adaptado de: Riverón Corteguera RL, González Fernández NA. Atención de la diarrea con sangre. Rev Cubana Med Gen Integral 1996;12(1):50-8.
DIARREA ACUOSA
La diarrea acuosa puede ser secretora u osmótica y la diarrea con sangre puede ser invasiva o no invasiva.47,48DIARREA SECRETORA
Se define como un cuadro diarreico, aquél que es el resultado del movimiento neto de agua y electrólitos desde la mucosa intestinal hasta el lumen, y cuyo volumen excede los 10 mL/kg/día y cuya osmolaridad es similar al plasma.La diarrea secretora es una diarrea acuosa abundante que produce deshidratación con trastornos del equilibrio hidroelectrolítico y ácido básico y es producida principalmente por el Vibrio cholerae y la Echerichia coli enterotoxigénica (ECET), aunque otras bacterias como la Shigella spp, la Yersinia enterocolítica y las Aeromonas también pueden producirla.
VIBRIO CHOLERAE
El Vibrio cholerae produce una enterotoxina que está formada por una subunidad A y otra subunidad B. El vibrio llega a la superficie del enterocito, se adhiere a ella y produce la toxina colérica. La subunidad A se desprende de la bacteria y se une a un receptor de membrana GM-1, en la superficie del enterocito mientras que la subunidad B se une a la membrana celular. Posteriormente la subunidad A penetra en la membrana celular, se une a un receptor, en la membrana basolateral del enterocito, y se genera el AMPc intracelular, el cual estimula el canal de cloro en las criptas intestinales, lo que incrementa la secreción de agua y electrólitos e inhibe el cotransporte de sodio y cloro en las células de las vellosidades. Como resultado de estas 2 acciones en las criptas y en las vellosidades por la toxina colérica, la secreción de líquidos en el lumen intestinal lleva a una diarrea secretora.48,56La toxina colérica (TC) puede estimular al intestino delgado por activación secundaria de los metabolitos del ácido araquidónico, y aumentar la producción de prostaglandinas, las cuales activan el sistema nervioso entérico. Este proceso parece estar mediado por la 5-hidroxitriptamina (5-HT) liberada por las células cromafines y la neurotoxina liberada por las células neuroendocrinas. Estos neurotransmisores pueden actuar independientemente en las células epiteliales y provocar secreción o secundariamente, como es el caso de la producción de prostaglandina-E2 por la estimulación de la 5-hidroxitriptamina, para provocar secreción de líquidos.57-62
ESCHERICHIA COLI ENTEROTOXIGÉNICA
La (ECET) produce 2 tipos diferentes de enterotoxinas, la termolábil (TL) y la termoestable (TE). Ambas dan lugar a diarrea secretora.60-62Las cepas de ECET poseen los plásmidos necesarios para producir una enterotoxina TL, que es similar a la TC. Ambas toxinas son estructuralmente similares y la homología de sus aminoácidos tiene alrededor del 80 % de similitud. Una de sus diferencias radica en que los genes que regulan la TL se encuentran en los plásmidos, mientras que los genes de la TC están en los cromosomas.47,57
La ECET se adhiere a las células epiteliales de la mucosa intestinal por medio de organelas en forma de pelos, y denominadas fimbrias o pilis, ubicadas en la superficie de las bacterias. Ellas actúan como factor de colonización que permiten contrarrestar los movimientos peristálticos intestinales y además constituyen un mecanismo de defensa del huesped.47
El control genético de producción de las toxinas (TL y TE) de ECET reside en plásmidos transferibles.63,64 Además de la elaboración de las toxinas, las cepas de ECET producen proteínas fimbriales, por medio de las cuales se adhieren a receptores específicos. Se han identificado 6 antígenos diferentes determinantes para las fimbrias de ECET (CS1 a CS6). Estos antígenos forman combinaciones que se agrupan en familias y se denominan factores de colonización antígenos (CFA).61
En la actualidad se han descrito alrededor de 15 tipos diferentes de estos factores adhesivos. Los más importantes son: K88, K99, 987P y F41 producidos por cepas de ECET de origen animal y CFA-1, CFA-II, CFA-III y CFA-IV en cepas aisladas en humanos.65,66 La producción de factores de adherencia, al igual que en las enterotoxinas, está controlada por plásmidos67 y restringida a ciertos serotipos de ECET.68
La TL de ECET estimula la actividad enzimática adenilciclasa en las células epiteliales del intestino delgado y provoca una pérdida considerable de agua y electrólitos. Estructualmente la TL está compuesta por 2 subunidades, la subunidad A que posee la actividad enzimática y está constituida por 2 fracciones, una A1 cuya función es la ribosilación del ADP que provoca un aumento del AMPc intracelular y otra fracción A2 la cual participa en la unión de la subunidad A1 con la subunidad B así como en el proceso de internalización de la subunidad A a la célula intestinal. La subunidad B tiene la propiedad de unir la toxina a un gangliósido GM-1 presente en la superficie de la célula epitelial intestinal, el cual actúa como su receptor para facilitar la internalización de la subunidad A.47,69-72
En la TE de ECET hay que diferenciar 2 tipos de enterotoxinas TE-1 y TE-2. Ambas difieren en la secuencia de aminoácidos y sus características de unión al receptor. La toxina TE-1 se une estrechamente a un receptor intestinal y activa la enzima guanilciclasa en las células de la mucosa intestinal para producir secreción. El mecanismo de acción de la TE-2 es desconocido.73-77 La ECET es uno de los agentes productores de la diarrea del viajero.
SHIGELLA
La Shigella spp produce una citotoxina que tiene 3 funciones diferentes, una de las cuales es actuar como una enterotoxina que desencadena el sistema adenilatociclasa y da lugar a una diarrea secretora en sus inicios.HORMONAS
Hormonas intestinales es la denominación que se ha dado a numerosos péptidos muchos de los cuales alteran la función gastrointestinal en el sistema gastroenteropancreático.62,78El número de péptidos identificados se ha incrementado desde principios de siglo; la gastrina y la secretina fueron los primeros. Muchos de ellos no son hormonas y actúan localmente. La comunicación de una célula con otra, por péptidos, ha sido clasificada en 4 tipos diferentes: endocrina, paracrina, neurocrina y autocrina. De acuerdo con la interacción de una célula con otra, las hormonas actúan uniéndose a receptores. Sobre la base de esto existen 3 clases diferentes de receptores hormonales: proteína G-acoplada, que representa el 80 % de todos los receptores hormonales; las enzimas disparador ligante y el receptor del disparador ligante del canal iónico (tabla 2).
| Localización | Hormonas |
| Estómago | Gastrina |
| Somatostatina | |
| Páncreas | Insulina |
| Glucagón | |
| Polipéptido pancreático | |
| Somatostatina | |
| Duodeno y yeyuno | Secretina |
| Colecistoquinina | |
| Motilina | |
| Polipéptido inhibidor gástrico | |
| Somatostatina | |
| Íleo o colon | Enteroglucagón |
| Polipéptido YY | |
| Neurotensina | |
| Somatostatina |
Las hormonas actúan como secretagogos y, liberadas por varios tumores, actúan a través de estos receptores provocando diarrea secretora.55,65
DIARREA OSMÓTICA
La diarrea osmótica es aquélla que se produce por un incremento de carbohidratos en el lumen intestinal, como consecuencia de lesiones en forma de parches en las vellosidades intestinales y por la invasión de los enterocitos de la vellosidad y la posterior aglutinación de las vellosidades afectadas (fig. 11).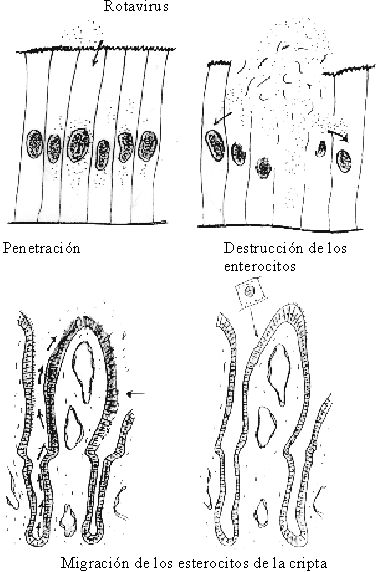
Fuente: Tomado de: Chauliae M. Water requirement: Physiology and pathology. En: Diarrhoeal diseases. International children´s. París: Children in the Tropics 1985;158:11-9.
La necrosis de la porción superior (apex) de las vellosidades da lugar a que en un período de 12 a 40 horas, los enterocitos de las criptas, que son enterocitos secretores, cubran totalmente la vellosidad y den lugar a áreas donde hay secreción de líquidos y la absorción está disminuida o ausente. En la medida que las lesiones se hacen más extensas tendrá lugar una menor absorción y se aumentará la secreción. Este mecanismo de producción de diarrea osmótica es el que provocan los agentes virales, principalmente los rotavirus.79-83
Otro mecanismo de producción de diarrea osmótica es el que ocurre por la adhesión de algunos protozoos al "borde en cepillo" del enterocito que bloquean la entrada de agua, electrólitos y micronutrientes lo que produce un exceso de carbohidratos a nivel del lumen intestinal, que son atacados por las bacterias con producción de ácido láctico, lo cual da lugar a una diarrea ácida que se traduce clínicamente por un marcado eritema perianal. Los parásitos que con mayor frecuencia presentan este tipo de diarrea con acentuada malabsorción a los carbohidratos son la Giardia lamblia, Cryptosporidium parvum, Ciclospora cayetanensis y los Microsporidios, aunque los pacientes inmunosuprimidos presentan un componente de hipersecreción.84-89
También puede producirse una diarrea osmótica cuando se ingiere una sustancia osmóticamente activa de pobre absorción, esto puede suceder cuando se administran purgantes como el sulfato de magnesia. Si la sustancia es ingerida con una solución isotónica, el agua y los solutos pasan por el intestino sin absorberse, y esto da lugar a la diarrea osmótica. Este tipo de diarrea se puede observar en los pacientes con malabsorción a los disacáridos (lactosa) y en lactantes alimentados con el seno materno (exceso de lactosa) o cuando se administran grandes cantidades de leche animal o leches muy concentradas.1,90
DIARREA CON SANGRE
La diarrea con sangre se presenta con una elevada frecuencia en niños menores de 5 años. Constituye un problema de salud en los países subdesarrollados y puede expresarse con manifestaciones clínicas severas que pueden llevar al paciente a la muerte y, en otras ocasiones, su cuadro clínico es más benigno por tener sus agentes causales una vida autolimitada.90 De una manera práctica, la diarrea con sangre puede ser invasiva y no invasiva.Diarrea con sangre invasiva
La diarrea con sangre invasiva tiene como prototipo a la Shigella, aunque también puede ser producida por otros agentes bacterianos enteropatógenos como son: Escherichia coli enteroinvasiva, Salmonella, Campylobacter jejuni, Yersinia enterocolítica y Vibrio parahemolyticus.60,62SHIGELLA
Los mecanismos patogénicos para explicar la infección por Shigella han sido numerosos. Se han empleado modelos experimentales para probar la capacidad de invasión de las células epiteliales, que incluyen: la prueba de Sereny, que detecta la propiedad de un organismo para producir queratoconjuntivitis por invasión de la córnea en conejillos de India; pruebas que emplean monocapas de células de mamíferos (HeLa u otras) que exploran la penetración intracelular, el examen histológico o por microscopia electrónica del intestino de animales de experimentación infectados, en busca del microorganismo en su epitelio; la producción de líquido en ligadura de asa ileal del conejo; la instalación de genes en cepas de E. coli K12 para demostrar sus propiedades de virulencia y la presencia de un lipopolisacárido antígeno O; así como la elaboración de una potente toxina que invade la célula.91-101La diarrea invasiva por Shigella se produce cuando ésta es ingerida y vence las barreras de resistencia inespecíficas del huésped, tales como la motilidad intestinal, la flora normal del intestino y el moco. La enterotoxina induce cambios en la motilidad intestinal lo que favorece la colonización del intestino.98 Existen evidencias de que en la flora normal del colon, las proteasas y glucosidasas pueden modificar el epitelio colónico al mejorar la adherencia de la Shigella.89 El género Shigella produce una potente toxina que posee efectos enterotóxicos, citotóxicos y neurotóxicos. La Shigella dysenteriae 1 (Sd1) produce la mayor cantidad de toxina Shiga, mientras que otras especies elaboran concentraciones más pequeñas de una toxina similar a la toxina Shiga.94
La Shigella penetra en el tubo digestivo y produce una invasión superficial, atraviesa las barreras propias del organismo, penetra en las células epiteliales intestinales (enterocitos) y da lugar a lesiones inflamatorias y en ocasiones ulceraciones en la porción distal del íleon y, de forma más marcada, en el colon. Una vez en el interior del enterocito prolifera allí o en la lámina propia y produce una citotoxina. El organismo, como una respuesta inflamatoria, moviliza hacia la circulación sanguínea una serie de elementos como linfocitos, plasmocitos y leucocitos polimorfonucleares (LPN) con la finalidad de neutralizar al agente agresor.21,101-104
La citotoxina liberada por la Shigella (toxina Shiga) tiene un origen endocelular, con un peso molecular que oscila entre 68 000 y 76 000 daltons y es elaborada por una proenzima que requiere de modificaciones para obtener su actividad máxima.
La toxina Shiga tiene varias acciones, la primera es la de actuar como una enterotoxina y desencadenar el sistema adenilatociclasa, lo que da lugar a una diarrea secretora en sus inicios, con pérdidas elevadas de agua y electrólitos, que pueden producir una deshidratación.104
Otra de las acciones de la toxina Shiga, es aquella dependiente de las subunidades que la componen. Así la subunidad A es la que actúa inactivando los ribosomas 60S, que inhiben la síntesis de proteínas y las subunidades B forman parte de la molécula que ataca a las células de la membrana. Este efecto citolítico de la toxina destruye al enterocito en pocas horas, ocasiona ulceraciones en la mucosa, y da lugar a la producción de heces con moco, pus y sangre con LPN; la otra acción de la toxina es la de comportarse como una neurotoxina y producir edema y hemorragias como consecuencia del daño ocasionado en el endotelio de los pequeños vasos del sistema nervioso central21,94,95,103,104 (fig. 12).
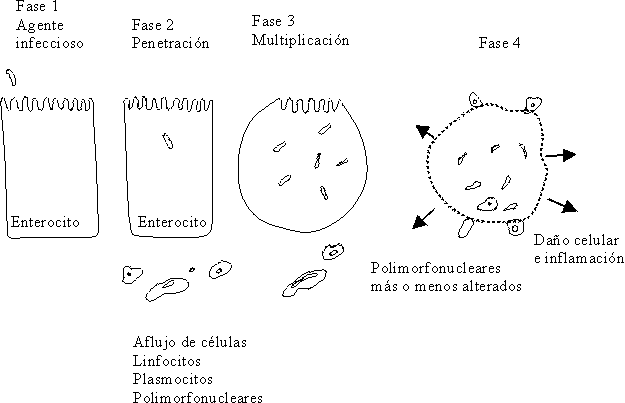
Fuente: Tomado de: Chauliac M. Water requirement: physiology and pathology. En: Diarrhoeal diseases. International Children´s. París: Children in the Tropics 1985;158:11-9.
Los factores determinantes de la virulencia de la Shigella están codificados por genes localizados en el ADN cromosomal y del plásmido. Se ha demostrado que los genes más recientes son portadores de grandes plásmidos de 120-140 mdaltons los cuales se encuentran en el interior de la bacteria. Estos plásmidos determinan la comprensión de la invasibilidad de las células de los mamíferos por estos organismos invasores, pues la pérdida de un plásmido de 140 mdaltons se acompaña de la eliminación del fenotipo invasivo. Este fenotipo puede ser reparado por transferencia conjugada de un plásmido similar de cepas heterólogas invasivas.91,92,105-109
La Shigella produce diarrea por invasión de la mucosa y proliferación bacteriana en el interior del enterocito. Cuando se examinan las heces microscópicamente, el moco de ésta contiene abundantes leucocitos polimorfonucleares.8
ESCHERICHIA COLI ENTEROINVASIVA
Su mecanismo patogénico es muy similar al de la Shigella, tiene la capacidad para colonizar, invadir y destruir los enterocitos del colon, propiedades que se codifican genéticamente por ADN cromosomal y de plásmidos. La ECEI posee un plásmido de 120 mdaltons que guarda cierta homología con el plásmido de virulencia de la Shigella. Elabora una enterotoxina que se presenta con mayor intensidad en presencia de un ambiente bajo en hierro.61,108,109SALMONELLA NO TIFOÍDICA, CAMPYLOBACTER JEJUNI Y YERSINIA ENTEROCOLÍTICA
Estos agentes bacterianos producen diarrea con sangre y por translocación de la mucosa seguida por proliferación bacteriana en la lámina propia y en los ganglios linfáticos mesetéricos.8En biopsias realizadas a pacientes con aislamiento de Campylobacter jejuni se ha podido observar una mucosa inflamada y edematosa con disminución de células epiteliales, irregularmente espaciadas y poca producción de moco. También se observan abscesos en las criptas e infiltración de la lámina propia con leucocitos polimorfonucleares, linfocitos y células plasmáticas. En ocasiones, las lesiones son muy similares a una colitis ulcerativa aguda.110
Algunas cepas de Salmonella y Campylobacter jejuni elaboran toxinas termolábiles muy similares a la TL de ECET y de Vibrio cólera,111 y otras cepas de Yersinia enterocolítica y de Salmonella producen enterotoxinas estables al calor semejantes a la TE de ECET.112
DIARREA CON SANGRE NO INVASIVA
ESCHERICHIA COLI ENTEROHEMORRÁGICA
La diarrea con sangre no invasiva tiene como prototipo a la Escherichia coli enterohemorrágica (ECEH). Los primeros estudios de este tipo de Escherichia coli se realizaron en 1983,113 cuando se asociaron cepas de Escherichia coli del serotipo O157H7 raramente encontradas con anterioridad, con un brote de una nueva enfermedad, la colitis hemorrágica, caracterizada por diarrea con abundante sangre y sin fiebre. Estudios realizados posteriormente pusieron de manifiesto que dichas cepas pueden producir también un síndrome hemolítico urémico y llevar a una insuficiencia renal aguda.114En los últimos años se han producido numerosos brotes de esta enfermedad en EE.UU. y Canadá vinculados principalmente con la ingestión de leche no pasteurizada y hamburguesas no bien cocinadas, elaboradas con carne de vacunos.113,114 Existen estudios que indican que el ganado vacuno es el principal reservorio de ECEH,115,116 por lo que la colitis hemorrágica por ECEH O157H7 es considerada como una zoonosis.
Las cepas de serotipo O157H7 elaboran 2 potentes citotoxinas que destruyen las células Vero, por lo que reciben el nombre de verotoxinas (VT-1 y VT-2).117,118 Estas toxinas están relacionadas, biológica y estructuralmente, con la toxina Shiga sintetizada por la Shigella dysenteriae tipo l (Sdl) por lo que se propuso la denominación de toxinas similares a la toxina Shiga (SLT-1 y SLT-2).119,120
El aspecto clínico más relevante de la ECEH es su habilidad para causar el síndrome hemolítico urémico, caracterizado por anemia microangiopática, trombocitopenia e insuficiencia renal.121-125 La ECEH presenta 3 mecanismos patogénicos característicos:
- Adherencia mediada por un plásmido que codifica sus fimbrias.
- Lesiones de unión y destrucción esfacelada idénticas a las que produce la ECEP y mediadas por un gene cromosomal similar a la ECEP eae.
- Producción de 1 ó 2 toxinas similares a la toxina elaborada por la Shigella dysenteriae tipo 1 y denominadas toxinas parecidas a la toxina Shiga I y II (SLT-1 y SLT-2).
La Escherichia coli O157 H7 se considera una enfermedad emergente y en 1993 provocó, en la parte occidental de los EE.UU., el mayor brote epidémico con más de 500 casos confirmados por cultivos con 56 pacientes que desarrollaron síndrome hemolítico urémico como complicación y 4 defunciones en niños.128,129
ESCHERICHIA COLI ENTEROAGREGATIVA
Los estudios realizados sobre la capacidad adherente de la E.coli a células heteroaploides (HEp-2) muestran que, además de la adherencia localizada, existen otros 2 mecanismos: uno llamado difuso, que se produce cuando las bacterias se unen al citoplasma celular, y otro agregativo, que se forma cuando las bacterias se acumulan en forma de empalizada tanto en la superficie celular como en el vidrio de la preparación.130-132Estudios recientes han definido algunas características de estas cepas, como es el fenómeno de la autoagregación, que está determinado por un plásmido de 55 a 65 mdaltons, que codifica para una fimbria de adherencia, un lipopolisacárido uniforme y una nueva enterotoxina termoestable (TE) denominada toxina enteroagregativa estable (TEAE).133 Se han detectado algunas cepas que elaboran una segunda toxina termolábil antigénicamente relacionada con la hemolisina de E. coli, la cual puede causar necrosis de las microvellosidades, acortamiento de las vellosidades intestinales e infiltración mononuclear de la submucosa.134
La capacidad de las cepas de E.coli enteroagregativa (ECEAgg) para sobrevivir largo tiempo en el intestino humano y la producción de una o más de las toxinas descritas, pudiera explicar la persistencia de las diarreas por ellas producidas. Se han aislado cepas de ECEAgg en niños con diarrea con sangre,135,136 aunque en la actualidad se desconoce si existen diferentes cepas agregativas relacionadas con diarreas persistentes u otras en relación con diarrea con sangre.
Estudios recientes muestran la existencia de una toxina que es capaz de producir lesiones hemorrágicas severas cuando se inoculan ratas con la toxina purificada. Esto pudiera apoyar la capacidad de cepas de ECEAgg para causar diarrea con sangre en humanos.137 Estudios realizados en México identifican el 51 % de pacientes con diarrea persistente como portadores de ECEAgg y sólo el 5 % en niños asintomáticos.138,139
CLOSTRIDIUM DIFFICILE
La colitis por Clostridium difficile es una enfermedad mediada por toxinas de acción local y en raras ocasiones puede invadir el torrente circulatorio. Produce 2 tipos diferentes de toxinas: la toxina A es una enterotoxina y el factor patogénico de mayor importancia, mientras que la toxina B es una citotoxina con un efecto muy pequeño o nulo en ratones.140,141El primer paso en su patogénesis es el enlace de la toxina A a un receptor específico. La actividad de la toxina A enlazada y su respuesta biológica es muy baja al nacimiento y aumenta durante las primeras 3 semanas de vida para alcanzar los niveles del adulto a los 30 o 40 días de edad.142 La baja actividad de la toxina enlazada puede explicar la falta de respuesta de la enfermedad en niños colonizados por Clostridium difficile.
Después de enlazarse con el receptor existente en el "borde en cepillo" del enterocito, la toxina A es internalizada y después de un período de latencia de 1 a 2 horas ocurren alteraciones en la estructura del citoplasma, con inclusión de la despolimerización de actinas filamentosas, se abren en las células intestinales las uniones herméticas y aumentan la permeabilidad transepitelial. La acción principal de la toxina A en el intestino es su habilidad para producir una respuesta inflamatoria aguda con activación de macrófagos, mastocitos y movilización de neutrófilos. Estos mecanismos que envuelven la respuesta inflamatoria son complejos e involucran la liberación en varias células, de potentes mediadores de la inflamación y citocinas incluyendo prostaglandina E2, leucotrieno B4 y C2, factor de activación plaquetaria, interleucina-1 y 8 (IL-1, IL-8) e histamina.143
La colitis pseudomembranosa (CPM) asociada a Clostridium difficile es muy diferente a las lesiones descritas en animales experimentales. La principal diferencia radica en la focalización de la pseudomembrana colónica en la infección humana. Histológicamente las pseudomembranas están compuestas por restos necróticos, moco y células inflamatorias que fluyen hacia afuera de la superficie mucosal.144 Puede producir diarrea con sangre y no es invasiva.
La patogenia de la diarrea aguda infecciosa ha tenido grandes avances en los últimos 20 años, lo cual ha permitido explicar muchas de las interrogantes que se tenían en décadas pasadas. Sin embargo, es un capítulo abierto que en lo que queda de siglo y en el próximo, se perfeccionará cada vez más, acorde con el desarrollo cientificotécnico alcanzado en esa época futura.
SUMMARY
This a review of some important aspects of the physiopathology of diarrhea. A description is made of the intestinal physiopathology, including the anatomy of the intestine and of its surface of absorption, as well as the functional structure of the intestinal mucosa: the normal physiopathology of the intestinal fluids; the mechanism of absorption of water and electrolites; the absorption of sodium by electrogenic difussion, joined to the chloride ion; the interchange with the hydrogen ion and attached to organic substances, such as glucose, aminoacids and some oligopeptides; the intestinal secretion of water and electrolites; the intracellular control of secretion, the extracellular mediators and modulators of intestinal transport; the factors that increase absorption and reduce secretion; the factors that stimulate secretion and absorption; and the physiopathological mechanism of diarrhea. The classification of acute infectious diarrhea in aqueous secretory and osmotic, and diarrhea with invasive and noninvasive blood is also approached.Subject headings: DIARRHEA/physiopathology; INTESTINAL MUCOSA/physiopathology; INTESTINE/physiopathology; INTESTINAL ABSORPTION.
REFERENCIAS BIBLIOGRÁFICAS
- World Health Organization. Pathophysiology and watery diarrhoea: dehydration and rehydration. En: Readings on diarrhoea: student manual Geneva, 1992:17-27.
- Organización Panamericana de la Salud. Enfermedades diarreicas: prevención y tratamiento. Washington DC; 1995:13-28.
- Procame II. Fisiopatología de la Diarrea Acuosa y la deshidratación En: E. Salazar Ed. lecturas en Diarrea e Infección Respiratoria Aguda en Niños. Lima MSP/UP Cayetano Heredia/USAID 1994:8-13.
- Fricker, J. Intestinal absorption of water and Electrolytes. En: Putting an end to Diarrhoeal Diseases. Children in the tropics 1993:204:6-12.
- World Health Organization. Diarrhoeal disease control program absorption and secretion of water and electrolytes at intestinal epithelium, WHO/CDD/SER/90.13 Geneva, 1990.
- Gardner E. Esophagus, stomach and intestine. En: Gardner E. Editor Anatomy: regional study of human structure, 4 ed. W.B. Philadelphia Saunders, 1975:383-93.
- Brodeck J, Best-Taylor. Secretim, digestion and absorption in the intestine. En: Physiological basis and medical practice. 10 ed. Batimore Williams and Wilkins, 1979:86-101.
- Organización Panamericana de la Salud. Fisiología de la absorción intestinal de agua, electrólitos y macronutrientes En: Manual de tratamiento de la diarrea, Washington DC (Serie Paltex, No. 13)1987:4-20.
- Vega Franco L. Bases fisiológicas de la hidratación oral. En: Mota F, Velasquez Jones L, eds. Hidratación oral en diarreas: Memorias del I Seminario Taller Internacional sobre Hidratación Oral en Diarreas, México, UNICEF/OPS/OMS/SSA, 1985:41-7.
- Martins Campos JV. Bases fisiológicas gastrointestinais: O movimiento de fluidos e ions no compartimento transintestinal. En: Carraza FR Hidrataçao, Centro de Estudios Prof. Pedro de Alcântara", Universidad de Sao Paulo, 1985:9-22.
- Curran PF. Solute-solving interactions and water transport. En: Zolisl G ed. Role of the membrane in secretory processes, Amsterdan: North Hollald Publish, 1972:408-19.
- Desjeaux JF. Effects of sugar and aminoacids on sodium movement across small intestine. Review article. Am J Dis Child 1977;131:331-40.
- Riverón Corteguera RL. Avances recientes en la fisiopatología del agua y los electrólitos en el enterocito. Rev Cubana Pediatr 1986;58(6):773-92.
- Tumberg LA. Disturbances of intestinal ion transport in diarrhea. En: Diarrhoea: new insight, read, N.W. (Ed.) Clin res Review, 1981 1 (Supplement 1):1-9.
- Turnberg L.A. Mechanisms of intestinal absorption and secretion of electrolytes and water. In: Development of Vaccines and Drugs against Diarrhoea. Holmgren, J; Lindberg, A, and Mölby, R (Eds.), Studentlitteratur Lund, 1986;231-239.
- Flores, J. Fisiología del transporte intestinal. GEN, 1980, 36(1):13-16.
- Field, M: Regulation of active ion transport in the small intestine. In: Acute Diarrhea in Childhood, Amsterdam, Elsevier, CIBA Simposium 1986 42:109-124.
- ______. Regulation of small intestinal ion transport by ciclic nucleotides and calcium In: Field, M (Eds): Secretory Diarrhoea, William and Wilkin Baltimore, Am Physiological Society 1980:21-31.
- Fondacaro, JD: Intestinal ion transport and diarrhoeal disease. Am J Physiol 1986;250:G1-G8.
- Welsh M, P Smith, M Fromm, R Frizzell: Crypts are the side of intestinal fluid and electrolyte secretion. Science 1982;218:1219-1221.
- Chauliac, M: Water requirements: physiology and pathology. In: Diarrhoeal Diseases. Children in the Tropics, Centre International des Enfants, París, 1985;158:11-19.
- Valdés Martín, S, RL Riverón Corteguera, A Fernández Hernández, R. Hernández Huerta, O. Rodríguez Castillo. Características de algunos iones. En: Agua y Electrólitos en Pediatría: aspectos fundamentales en los trastornos gastrointestinales. La Habana, Editorial Pueblo y Educación, 1988:23-31.
- Read, NW. Secretory Diarrhoea. Sandoz Pharma S.A. Basel, 1992:5-21.
- Schultz, S.G. Cellular models of sodium and chloride absorption by mammalian small and large intestine. In: Fiel M. (Ed) Secretory Diarrhea, William and Wilkins, Baltimore, Am Physiological Society, 1980:1-9.
- Schultz, S.G, PF Curran: Sodium and chloride absorption transport across isolated rabbit ileum In: Bronner, R. and Klein Zeller A. (Eds) Current Topics in Membranes and Transport, Academic Press Inc, New York 1974:225-281.
- Mahalanabis D, Merson M. Development of a improved formulation of oral rehydration salts (ORS) with antidiarrheal and nutritional properties: a "Super ORS" En: Holmgren J, Lindberg A, Mölby R, eds. Development of vaccines and drugs against diarrhea. Studentlitteratur, Lund, 1986.
- Powell DW, Fan CC. Coupled NaCl transport, cotransport or parallel ion exchange? En: Mechanisms of intestinal electrolyte transport and regulation by calcium. Bethesda: Alan R. Liss Ind, 1984;13-26.
- Schultz SG. Sodium transport and the electrophysiology of rabbit colon. J Membr Biol 1977;33:351.
- Krejs GJ, Fordtran JS. Physiology and pathophysiology of ion and water movement in the human intestine En: Sleisenger MH. Fordtran JS, eds Gastrointestinal disease. 2da ed. 1978.
- Howker PC. Mashiter KE and Turnberg LA. Mechanisms of transport of Na+, Cl- and K+ in the human colon. Gastroenterology 1978;74:1241-1274.
- Christophe J, Svoboda M, Lambert M. Effector mechanisms of peptide of the VIP family. Peptides, 1986;(Suppl 1):101-7.
- Rao MC. Toxins which activate guanylate cyclase: heat stable enterotoxina CIBA Found Symp 1985;112:74-93.
- Berridge MJ. Inositol triphosphate and diacylglycerol as second messenger. Biochem J 1984;220:345-65.
- Nishizuka Y. Studies and perspectives of protein kinase C. Science 1986;233:305-12.
- Field M, Rao MC. Chang EB. Intestinal electrolyte transport and diarrhoeal disease. N Engl J Med 1989;321:800-6.
- Heubi JE. Bile acid-induced diarrhea. En: Lebenthal E, Duffey M, eds Texbook of Secretory Diarrhea. New York: 1990:281-90.
- Gaginella TS. Eicosanoid-mediated intestinal secretion. En: Lebenthal E, Duffey M, eds New York: Raven, 1990;15-30.
- Cooke HJ, HV Carey. Neural regulation of intestinal ion transport En: Lebenthal E, Duffey M, eds. Texbook of secretory diarrhea. New York: 1990:1-15.
- Cooke HJ. Neural and humoral regulation of small intestinal electrolyte transport En: Johnson LR, ed. Physiology of the gastrointestinal tract. 2 ed New York: Raven 1987:1307-50.
- Hormones and neurotransmitters regulating intestinal ion transport. En: Field M, ed Current Topics in gastroenterology: Diarrheal disease. New York: Elsevier 1991;23-48.
- Powell DW. Immunophysiology of intestinal electrolyte transport. En: Field M, Frizzell RA, eds. Handbook of physiology: intestinal absorption and secretion. Bethesda: American Physiology Society, 1991;t4:591.
- Chang EB, Rao MC. Intracellular mediators of intestinal electrolyte transport. En: Field M ed. Current topics in gastroenterology: diarrheal disease, New York: New Elsevier, 1991:49-72.
- Lundgren O. Nervous control of intestinal transport. Bailliere Clin Gastroenterol 1988;2:85-106.
- Bienenstock J. An update on mast cell heterogeneity including comments on mast cell nerve relationships. J Allergy Clin Immunol 1988;81:763-9.
- Young A, Levin BJ. Diarrhoea of famine and malnutrition: investigation using a rat model jejunal hypersecretion induced by starvation. Gut 1990;31(1):43-53.
- Krejs GJ. VIPoma syndrome. Am J Med 1987;82:37-48.
- Organización Panamericana de la Salud. Patogenia de la diarrea infecciosa. En: Manual de tratamiento de la diarrea. Washington DC, 1987:70-93. (Serie Paltex; 13).
- Riverón Corteguera RL, González Fernández MA. Atención de la diarrea con sangre. Rev Cubana Med Gen Integr 1996;12(1):50-8.
- Riverón Corteguera RL. Cólera. En: Cólera, Shigellosis y Rotavirus. La Habana: Editorial Ciencias Médicas, 1993:5-26.
- Gangarosa EJ. Recent developments in diarrheal disease. Postgrad Med 1977;62(2):113-7.
- WHO Scientific Working Group. Cholera and other vibrio-assocuited diarrhoeas. Bulletin Worl Health Organ 58(3):353-74.
- Holmgren J. Actions of cholera toxin and the prevention and treatment of cholera. Nature 1981;292(5822):413-7.
- Brooy JL, Rowley E. Cholera vaccine-recent progress. En: Easmon CSF, Jeljaszewicz, eds. Medical microbiology immunization against bacterial dis. London: Academic 1983;t2:157-76.
- WHO. Scientific Working Group on Bacterial Enteric Infections. Diarrhoeal Disease Control Programm. Geneva WHO/CDD/BEI/84,5, 10-11, 1984.
- Finkelstein RA, Burks MF, Zupan A, Dallas WS, Jacob CO, Ludwing DS. Epitopes of the cholera family of enterotoxins. Rev Infect Dis 1987;93:544-61.
- Nguyen TD, Shaffer N. Cholera. En: Rustgi VK, ed. Gastrointestinal infections in the tropics. Basel: Kanger, 1990:186-205.
- Sprangler BD. Structure and function of cholera toxin and the related Escherichia coli heat-labil enterotoxin. Microbiol Rev 1992;56:622-47.
- Gardner JD. Diarrhoea as a symptom. Clin Gastroenterol 1985;14:599-613.
- Hudges S. Acute secretory diarrhoea. Current concepts in pathogenesis and treatment. Drugs 1983;26:80-90.
- Cohen MB. Etiology and mechanisms of acute infectious diarrhea in infants in the United States. J Pediatr 1991;118 (Suppl):34-9.
- Prado V, O´Ryan ML. Acute gastroenteritis in Latin América. Infec Dis Clin North Am 1994;8(1):77-106.
- Udall JN Jr. Secretory diarrhea in children. Pediat Clin North Am 1996;43(2):333-53.
- Pickett CL, Twiddy EM, C Cocker et al. Cloning nucleotide sequence and hybridization studies of the type IIa heat-labile enterotoxin gene of Escherichia coli. J Bacteriol 1989;171:4945-52.
- Moseley SL, JW Hardy, Huq MI et al. Isolation and nucleotide sequence determination of a gene encoding a heat-labile enterotoxin of Escherichia coli. Infect Immunol 1983;39:1167-74.
- Klemm P. Fimbrial adhesions of Escherichia coli. Rev Infect Dis 1985;7:321-40.
- Knutton S, McConnell MM, Rowe B, McNeish A. Adhesion and ultrastructural properties of human enterotoxigenic Escherichia coli producing CFA/III and CFA/IV. Infect Immunol 1989;57:3364-71.
- De Graff FK. Genetic of adhesions fimbriae of intestinal Escherichia coli. Curr Top Microbiol Immunol 1990;151:29-53.
- Willshaw GA, McConnell MM, Smith HR, Rowe B. Structural and regularly genes for coli surface associated antigen 4 (CS4) are encoded by separate plasmids in enterotoxigenic Escherichia coli strains of serotype O25 H42. FEEMS Microbiol Lett 1990;68:225-60.
- Chu SHW, Walker WA. Bacterial toxin interaction with the developing intestine. Gastroenterology 1993;104:916-25.
- Laney DW, Cohen MB. Infectious diarrhea. en: Wyllie R, Hyams JS, eds Pediatric gastrointestinal disease: pathophysiology, diagnosis and management, Philadelphia: WB Saunders, 1993:612-32.
- Levine MM. Escherichia coli infections. N Engl J Med 1985;313:445.
- Sack RB. Enterotoxigenic escherichia coli: identification and characterization. J Infect Dis 1980;142:279.
- Pickering LK, Cleary TG. Gastrointestinal infections: approach to patients with gastrointestinal tract infections and food poisoning. En: Feigin RD, Cherry JD eds Texbook of pediatric infectious diseases. 3 ed. Phyladelphia: WB Saunders, 1992:565-96.
- Nataro JP. Plasmid-mediated factor conferring diffuse and localized adherence of ECEP. Infect Immunol 1985;48:378-83.
- Levine MM. Escherichia coli that cause diarrhea: enetrotoxigenic, enteropathogenic, enteroinvasive, enterohemorrhagic and enteroadherent. J Infect Dis 1987;3:377.
- Levine MM. Modern vaccines, enteric infections. Lancet 1990;1:958.
- Tardelli T, Rassi V, Mac Donald K. Enteropathogens associated with acute diarrheal disease in urban infants in Sao Paulo, Brazil. J Infect Dis 1991;164-331.
- Walsh JH, Mayer EA. Gastrointestinal hormones. En: Sleisenger MH, Fordtran JS, eds. Gastrointestinal disease: pathophysiology, diagnosis and management. 5 ed. Philadelphia: WB Saunders, 1993:18-44.
- Pizarro D, Posada G. Manejo de la enfermedad diarreica aguda. Bol Med Hosp Nac de Niños Costa Rica. 1984;19:69-78.
- Kerzner B. Transmissible gastroenteritis: sodium transport and the intestinal epithelium during the course of viral enteritis. Gastroenterology 1977;72:457.
- Bishop RF, Davidson GP, Holmes IH, Ruck BJ. Virus particles in epithelial cells in duodenal mucosa from children with acute nonbacterial gastroenteritis. Lancet 1973;2:1281-3.
- Flewett TH. Virus particles in gastroenteritis. Lancet 1973;2: 1497.
- Riverón Corteguera RL. Agentes virales. En: Etiología infecciosa de las enfermedades diarreicas agudas. La Habana:Editorial Ciencias Médicas, 1993:3-9.
- Wolfe, MS Giardiasis. N. Engl J Med 1978;298:319-320.
- Lewis DJA Freedman AR. Giardia lamblia as an intestinal pathogen. Dig Dis 1992;10:102-11.
- Thompson SC. Giardia lamblia in children and the child care setting: a review of the literature. J Pediatr Child health 1994;30:202-9.
- Riverón Corteguera RL. Parásitos (protozoos). En: Etiología infecciosa de las enfermedades diarreicas agudas. La Habana: Editorial Ciencias Médicas, 1993:30-5.
- García LS, Current WL. Cryptosporidiosis: clinical features and diagnosis. Crit Rev Clin Lab Sci 1989;27(6):439-60.
- Mannheimer SB Soave R. Protozoal infections in patients with AIDS. Infect Dis Clin North Am 1984;8(2):483-9.
- Riverón Corteguera RL. Avances recientes en los estudios sobre las enfermedades diarreicas agudas. Rev Cub Pediatr 1984;56 (6):1-41.
- Sansonetti PJ Hale TL, Kopecko DJ, d´Hauteville H. Forma SB. Genetic studies on shigella invasiveness. Liss, En: Molecular biology of host-parasite interaction. New York: Alam R. Liss 1984:3331-6.
- Sansonetti PJ, Formal SB, Hale TL, Kopecko DJ. Bases genetiques de la penetration de Shigella flexneri dans les cellules ephiteliales. Ann Immunol 1981;183-9.
- Cantey JR. Infectious diarrea pathogenesis and risk factors. Am J Med 1985;78 (Supp 6B):65-75.
- Dinari G, Hale TL. Pathogenesis of Shigella infection. Front Gastrointest Res 1986;13:331-42.
- Levine MM, Kaper JB, Black RE, Clements ML. New knowledge on pathogenesis of bacterial enteric infections as applied to vaccine development. Microbiol Rev 1983;47(4):510-50.
- Formal SB, Sansonetti PJ: Kopocko DJ. Genetics studies on the virulence of dysentery bacilli. En: Shigellosis. Dhaka, International Center for Dis Control 1984:128-131.
- Sethabutr O, Venkatesan M, Murphy GS, Eampokalap B, Hoge CW, Hechevarría P. Detection of Shigellae and Enteroinvasive Escherichia coli by amplification of the invasion plasmid antigen HDNA sequence in patients with dysentery. J Infect Dis 1993;167:458-61.
- World Health Organization. Enteric infections due to Campylobacter, Yersinia, Salmonella and Shigella. Bulletin 1990;58:519-537.
- Mabassaleh M. Denohue-Rolfe A, Jacewicz RJ, Grand M, Keusch GT. Pathogenesis of Shigella diarrhea: evidence for a developmentally regulated glycolipids receptor for Shigella toxin involved in the fluid secretory response of rabbit small intestine. J Infect Dis 1988;157(5):1023-31.
- TL Hale. The envelope and tissue invasion. En: Easmon medical microbiology. Londres: Acad Press 1983;t3: 87-108.
- Mathías JR. Shigella dysenteriae 1 enterotoxin: proposed role in the pathogenesis of Shigellosis. Am J Physiol 1980;239:382-6.
- Prizont R, Rood WP. Possible role of colonic content in the mucosal association of pathogenic Shigella. Infect Immunol 1980;29:1197-9.
- Levine MM. Bacillary dysentery: mechanisms and treatment, Med Clin North Am 1982;66(3):623-37.
- Riverón Corteguera RL. Shigellosis. En: Mota F, ed. Manejo efectivo de diarreas agudas en niños y cólera. México DF: 1993:180-218. Servicios Editoriales Icaria.
- Levin MM, Mc Ewen, Losonsky G, Reymann M, Marari I, Brown JE, et al. Antibodies to Shiga holotoxin and to two synthetic peptides of the B subunit in sera of patients with Shigella dysenteriae 1 dysentery. J Clin Microbiol 1992;30(7):1636-41.
- Sansonetti PJ. Involvement of a plasmid in the invasive ability of Shigella flexneri. Infect Immunol 1982;35:852-60.
- Fasano A, Kay BA, Russell RG, Enterotoxin and citotoxin production by enteroinvasive Escherichia coli. Infect Immunol 1990;58:3717.
- Hechevarría P, Savarino SJ, Yamamoto T. Escherichia coli diarrhoea. Bailliere. Clin Gastroenterol 1993;7(2):243-62.
- Sansonetti PJ, Kopecko DJ, Formal SB. Involvement of a plasmid in the invasive ability to Shigella flexneri. Infect Immunol 1982;35:852-60.
- WHO. Diarrhoeal Disease Control Programme. The invasive diarrhoeas. Scientific Working Group. Geneva, WHO/CDD/BEI/82.4,6-11, 1984.
- Ruiz Palacios GM. Cholera-like enterotoxins produced by Campylobacter jejuni. Lancet, 1983;2:250-2.
- Robins-Browne RM. Mechanism of action of Yersinia entotoxin. Infect Immunol 1979;25:680-4.
- Riley LW, Remis RE, Helgerson SD, Gree HG, Wells JG, Davis BR, et al. Hemorrhagic colitis associated with a rare E. coli serotype. N Engl J Med 1983;308:681-5.
- Karmali MA, Petric M, Lim C, Fleming PC, Arbus GS, Lior H. The association between hemolityc uremic syndrome and infection by verotoxin producing E. coli. J Infect Dis 1985;151:775-82.
- Karmali MA. Infection by verocytoxin producing Escherichia coli. Clin Microbiol Rev 1989;2(1):15-38.
- Gransden WR, Damm MAS, Anderson JD, Carter JE, Lior H. Further evidence associating hemolytic uremic syndrome with infection by verotoxin producing E. coli O157H7. J Infect Dis 1986;154:522-4.
- Blanco Alvarez J, Blanco Alvarez M, González García EA. Mecanismos patógenos de la Escherichia coli enteropatogénica, enterotoxigénica, enteroinvasiva y enterohemorrágica. Rev Esp Microbiol Clin 1991;6(4):163-76.
- Bell BP, Goldoft M, Griffin PM, Davis MA, Gordon DC, Tar PI. A multistate outbreak of E, coli O157H7 associated with bloody diarrhea and hemolytic uremic syndrome from hamburgers. JAMA 1994;272(17):1349-53.
- Blanco J, González EA, García S, Blanco M, Regueiro B, Hernández I. Production of toxins by E. coli strains isolated from calves with diarrhoea in Galicia. Vet Microbiol 1988;18:297-311.
- González EA, Blanco J. Serotypes and antibiotic resistance of verotoxingenic (VTEC) and necrotizing (NCED) E. coli strains isolated from calves with diarrhoea. Fed Eur Microbiol Soc Lett 1989;60:31-6.
- O´Bryan AD, Holmes RK. Shiga and Shiga-like toxins. Microbiol Rev 1987;51:206-20.
- Boyce TG, Swerdlow DL, Griffin PM. Escherichia coli O157H7 and the hemolytic uremic syndrome. N Engl J Med 1985;333(6):364-8.
- O´Brien AD, Veck GD la. Purification and characterization of a Shigella dysenteriae l-like toxin produced by E. coli. Infect Immunol 1983;40:675-83.
- Levine MM, Xu J, Kaper JB, Lior H, Prado, U Tall, B et al. A DNA probe to identify entero-hemorrhagic colitis, on hemolytic uremic syndrome. J Infect Dis, 1987;156:175-182.
- Mena Miranda VR, Riverón Corteguera RL, Pérez Cruz JA, Salvato Dueñas A. Síndrome hemolítico urémico: una revolución conceptual de la Pediatría contemporánea. Arch Dominicanos Pediatr. 1997;33(2):52-61.
- Neill MA. Pathogenesis of Escherichia coli O157H7 infection. Curr Opin Infec Dis 1994;7:295-303.
- WHO. Consultation report. "Shiga-Like Toxin" producing Escherichia coli, with special emphasis on zoonotic aspects. Geneva. WHO/CDS/VPA/92. 103, 6-7, 1992.
- Center for Disease Control (CDC). Multistate outbreak of E. coli O157 H7 infections. MMWR 1993;42:258-63.
- Berkelman RI. Emerging infectious disease in the United States, 1993. J Infect Dis 1994;170:272-7.
- Scaletsky ICA, Silva MLM, Trabulsi LR. Distintive patterns of adherence of enteropathogenic E.coli to HeLa cells. Infect Immunol 1984;45:534-6.
- Vial PA, Robin-Browne RM, Lior H. Characterization of enteroaggregative Escherichia coli, a putative agent of diarrheal disease. J Infect dis 1987;155:377-89.
- Cravioto A, García JJ, Slava C. Diarrea por Escherichia coli. 1995 (en prensa).
- Nataro JP, Deng Y, Maneval DR. Aggregative adherence fimbriae I of enteroaggregative Escherichia coli mediante adherence to HEp-2 cells and hemagglutination of human erythrocytes. Infect Immunol 1992;60:2297.
- Savarino SJ, Fasano A, Robertson DC. Enteroaggregative Escherichia coli colaborate a heat-stable enterotoxin demostrable in an in vitro rabbit intestinal model. J Clin Invest 1991;87:1450.
- Benítez O, Uribe F, Navarro A. Etiología de la diarrea con sangre en niños de una comunidad rural. Bol Med Hosp Inf México. 1991;48:65-70.
- Cravioto A, Reyes RE, Ortega R, Fernández G, Hernández R, López D. Prospective study of diarrhoeal disease in a cohort of rural Mexican children: incidence and isolated pathogens during the first two years of life. Epidemiol Inf 1988;101:123-34.
- Eslava C, Villaseca J, Morales R. Identification of a protein with toxigenic activity produced by Enteroaggregative E. coli. Abstract B105, Abstract 93 rd American Society for Microbiology General Meeting Washington DC (in press).
- Cravioto A, Tello A, Navarro A. Association of Escherichia coli HEp-2 cell adherence patterns with type and duration of diarrhoea. Lancet 1991;337:262.
- Sherman PN, Petric M, Cohen MB. Infectious gastroenterocolitis in children. An update on emerging pathogens. Ped Clin Nort Am 1996;43(2):391-407.
- Lyerly DM, Saum KE, MacDonald D. Effect of Clostridium difficile toxin A and B given intragastrically to animals. Infect Immunol 1985;47:349.
- Triadafilopoulos G, Pathoulakis C, O´Brien M. Differential effects of Clostridium difficile toxin A and B on rabbit ileum. Gastroenterology, 1987;93:273.
- Eglow R, Pathoulakis C, Itzkowitz S. Diminished Clostridium difficile toxin A sensitivity is associated with toxin A receptor. J Clin Invest 1992;90:822.
- Pothoulakis C, Sullivan R, Meinic DA. Clostridium difficile toxin A stimulates intracellular calcium release and chemotactic response in human granulocytes. J Clin Invest 1988;81:1741.
- Pothoulakis C, La Mont JT. Clostridium difficile colitis and diarrhoea. Gastroenterol Clin North Am 1993;22(3):623-37.
Recibido: 23 de junio de 1998. Aprobado: 5 de octubre de 1998.
Dr. Raúl L. Riverón Corteguera. Hospital Pediátrico Docente "Centro Habana". Benjumeda y Morales, municipio Centro Habana, Ciudad de La Habana, Cuba.
* Debido a la importancia que representaba la publicación de este material por su valor científico, se decidió por la dirección de la revista y de la editora, aun con la cantidad de páginas y figuras que contenía, no de acuerdo con lo establecido en las "Instrucciones al autor", su inclusión en este número de la revista (n. del edit.).
1 Profesor Titular Principal del Departamento de Pediatría. Facultad " General Calixto García". Instituto Superior de Ciencias Médicas.














