Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Pediatría
versión On-line ISSN 1561-3119
Rev Cubana Pediatr v.76 n.3 Ciudad de la Habana jul.-sep. 2004
Centro Nacional de Genética Médica
Instituto Superior de Ciencias Médicas de La Habana
Resultados preliminares del pesquisaje neonatal inmunohistoquímico para la detección del síndrome de frágil X
Dr. Roberto Lardoeyt Ferrer,1 Lic. Remigio Coto Rodeiro,2 Téc. Nereyda González Junco3, Araceli Lantigua Cruz4 y C. Rob Willemsen5
Resumen
El síndrome de frágil X constituye la entidad genética que ocupa el primer lugar como causa de retraso mental hereditario, caracterizado por un fenotipo físico y psiconeuroconductual muy peculiar. Han sido innumerables los estudios que se han realizado con el fin de dilucidar la función del gen y la localización de la proteína que la misma codifica relacionado con esta afección, entre los cuales se encuentran las técnicas inmunohistoquímicas. Se aplicó la técnica inmunohistoquímica con el objetivo de detectar individuos con riesgo genético de presentar el síndrome de frágil X a través de un pesquisaje neonatal en un período de 14 meses. Se pesquisaron un total de 2 914 recién nacidos varones, de los cuales 2 414 obtuvieron resultados inmunohistoquímicos. Diez casos fueron proteína negativos, en los cuales su desarrollo psicomotor fue evaluado exhaustivamente durante un período de 3 años, y fue normal; no se detectó ningún individuo con la enfermedad.
Palabras clave: Pesquisaje neonatal/Síndrome de Frágil X/Retraso Mental/Test Inmunohistoquímico/Anticuerpos Monoclonales.
En el Onceno Simposio Nacional de Pesquisajes Neonatales realizado en Corpus Christi, Texas, se definió el pesquisaje neonatal como aquel procedimiento clínico o de laboratorio que se realiza en una población de recién nacidos (RN) para detectar individuos con riesgo genético incrementado de padecer una enfermedad genética o poseer una condición genética específica que justifique acciones de diagnóstico o seguimiento.1,2
Con el desarrollo de la Genética Humana, se han establecido los pesquisajes neonatales de defectos genéticos como programas esenciales de salud pública con fines preventivos, en los que cada RN es pesquisado para enfermedades, con el objetivo de reducir o eliminar funestas consecuencias, como es el caso de la fenilcetonuria, el hipotiroidismo congénito entre otras.3-5
Con el afán de pesquisar por primera vez el síndrome de frágil X (SFX) en poblaciones de RN varones aparentemente sanos se aplicó una técnica inmunohistoquímica (TIH) que utiliza un anticuerpo monoclonal (AcM) obtenido en el año 1995 por Rob Willemsen y otros en Rotterdan, Holanda, que reconoce la proteína FMRP, producto codificado por el gen responsable de la enfermedad, FMR-1, ubicado en el citoplasma de los linfocitos, entre otros tipos celulares, lo que abre nuevas posibilidades diagnósticas que permiten identificar la presencia o ausencia de la proteína en linfocitos de sangre periférica.6-12
Métodos
Se pesquisaron 2 914 RN varones de los hospitales maternos: Eusebio Hernández y 10 de Octubre de Ciudad de La Habana en un período de 14 meses, y se seleccionó la muestra al tener en cuenta el consentimiento informado por escrito de la pareja.
Se procedió a la obtención de la sangre a través de la punción del cordón umbilical y se depositaron en frascos con el anticoagulante EDTA.
Por cada RN se realizaron 2 extensiones sanguíneas, donde se utilizó la sangre de las primeras 3 horas de nacido, y la lámina se identificó en su zona esmerilada.
Las láminas se sometieron al TIH, y se incluyeron en cada proceso 2 láminas "controles": una de ellas correspondió a una persona con el SFX constatado molecularmente con la mutación completa (control positivo), y la otra lámina de un individuo masculino sano como control negativo.
Se observaron las láminas al microscopio con el lente de inmersión, y se procedió al conteo de 100 linfocitos. Los que resultaron tener un conteo de células marcadas con el anticuerpo por debajo del 50 % se consideraron proteína negativo (alterada), y los que tuvieron por encima del 50 % de células marcadas se consideraron proteína positivo (normal).
Los casos que resultaron ser proteína negativo se siguieron por 3 años en la consulta de Genética Clínica, donde se evaluó su desarrollo psicomotor, con el objetivo de detectar precozmente signos y síntomas del defecto congénito y por tanto realizarles la confirmación molecular.
Resultados
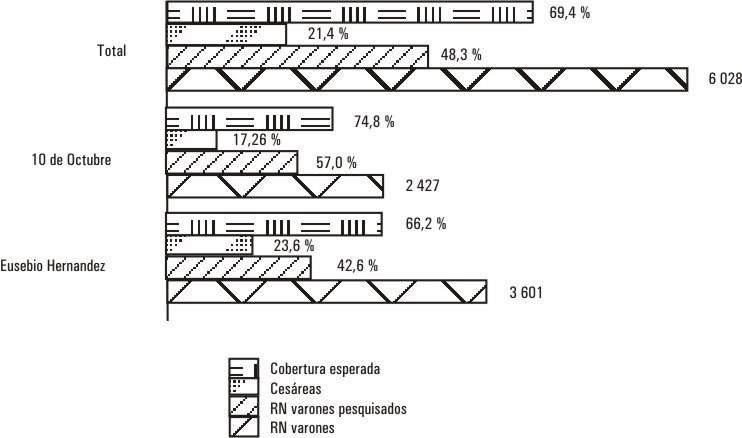
De manera global de 6 028 neonatos varones nacidos en ambas maternidades, solo se pesquisaron 2 914 que representan el 48,3 %, como se muestra en la tabla.
Tabla. Comparación de la cobertura de estudio de RN varones a través de la TIH en ambas maternidades
| Maternidades | RN varones | RN varones pesquisados | Cobertura |
| Eusebio Hernández | 3 601 | 1 535 | 42,6 |
| 10 de Octubre | 2 427 | 1 379 | 57,0 |
| Total | 6 028 | 2 914 | 48,3 |
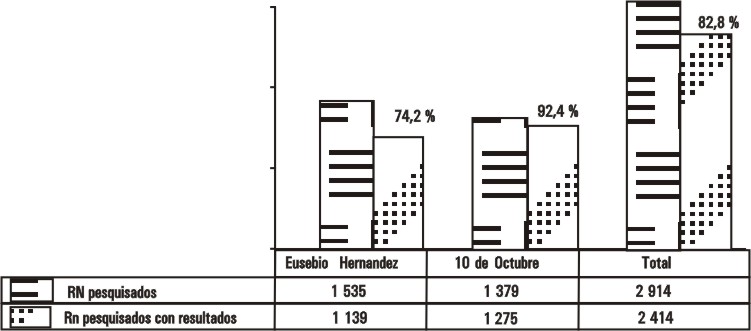
La eficacia de la técnica se evaluó al analizar el número de recién nacidos varones con resultados inmunohistoquímicos, como se puede apreciar en la figura 1.
FIG. 1. Análisis de los RN varones pesquisados a través del TIH con resultados en ambas maternidades.
De los 2 414 neonatos con resultados, se detectaron 10 individuos proteína negativos.
Discusión
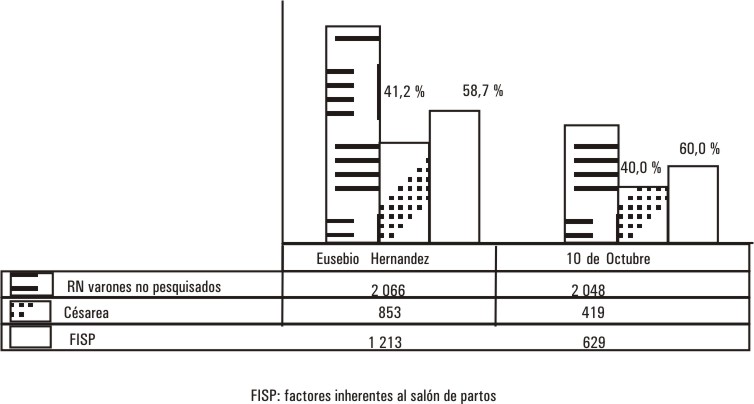
Como podemos apreciar al 51,6 % de los RN no se les tomó la muestra, por factores inherentes al salón de partos como el olvido por parte del personal médico y paramédico, inestabilidad de este, además de la no realización del pesquisaje en la Unidad Quirúrgica en los partos por cesárea.
Estadísticamente algunos de los factores citados anteriormente se comportaron como se observa en la figura 2.
FIG. 2. Análisis de los factores que incidieron en la no recolección de la muestra
FISP. Factores Inherentes al salón de partos.
Los factores inherentes al salón de partos referidos con anterioridad representaron el mayor por ciento si lo comparamos con las cesáreas. Sin embargo la toma de la muestra en los casos que son cesáreas ofrecerían una mayor cobertura de RN varones pesquisados por las excepcionales condiciones del salón de operaciones, por lo que este factor representaría un impacto considerable en la cobertura del pesquisaje.
En la figura 3 se muestra cómo la cobertura se incrementaría del 48,3 al 69,4 %, si se tiene en cuenta este factor, y por tanto repercutiría en la obtención de una muestra lo suficientemente representativa para el pesquisaje de esta afección, de acuerdo con su prevalencia de 1 en 4 000 individuos 13-15 (Fig. 3).
FIG. 3. Impacto de la cesárea en la cobertura del pesquisaje.
Estos resultados se alejan a los obtenidos por el Pesquisaje Neonatal de Fenilcetonuria en los primeros años de aplicación, pues cuando comenzó como pesquisaje neonatal masivo obligatorio a partir del año 1984, tuvo una cobertura del 85-87 %.3
En el caso del SFX, es un pesquisaje neonatal voluntario con fines investigativos, donde se acudió a la voluntariedad de las gestantes. En nuestro proceder el 100 % de nuestras gestantes dieron su consentimiento informado, y este no fue un factor que repercutió en la cobertura.
Existieron 500 neonatos sin resultados inmunohistoquímicos de los pesquisados. Dentro de las causas que repercutieron en ellos la más relevante fue la no presencia de linfocitos en la extensión sanguínea o muy pocas células que imposibilitó un conteo de 100 linfocitos para un 12,04 % de los casos.
La población con riesgo genético incrementado de presentar la enfermedad que detectó el proceder, objetivo esencial de todo pesquisaje, fue de 10 casos. Sin embargo, ninguno de ellos fue caracterizado molecularmente por no tener 2 láminas con resultados inmunohistoquímicos alterados.
En estas situaciones se hizo un seguimiento clínico de su desarrollo psicomotor, el cual fue normal sin presentar manifestaciones clínicas de la afección.
Una hipótesis para explicar el hecho anterior podría ser que estos casos presenten una proteína disfuncional que no reaccione con el AcM anti FMRP o posean un mosaicismo aberrante que ocasionó conteos bajos cercanos al límite inferior.17
Como se puede evidenciar, no se detectó en estos primeros 14 meses de pesquisaje ningún caso con el SFX, a causa, posiblemente, de la muestra insuficiente pesquisada en este período, pues no se llegó a la cifra teórica de 4 000 RN para encontrar un posible caso, al tener en cuenta el estimado de prevalencia de 1:4 000 varones en la literatura médica actual. Se recomienda seguir con el pesquisaje hasta llegar a una cifra representativa.
El TIH como proceder técnico para la detección indirecta de la enfermedad, ha sido aplicado a través de un pesquisaje neonatal masivo voluntario con fines investigativos, pero consideramos que no reúne las condiciones como pesquisaje neonatal obligatorio al no presentar un tratamiento precoz efectivo.
El TIH puede ser un instrumento que permita la labor preventiva y el pesquisaje en cascada, en familias donde se esté segregando el gen. Aquí radica su mayor importancia.
Agradecimientos
Agradecemos al Departamento de Genética Clínica de la Universidad de Erasmus, Rótterdam, Holanda, por la colaboración brindada en el financiamiento para la realización de este novedoso proceder; al personal médico y paramédico de los salones de partos de las maternidades Eusebio Hernández y 10 de Octubre que tuvieron la responsabilidad de la toma de la muestra y realización del smear, y al personal técnico del Centro Nacional de Genética Médica que realizaron la prueba.
Summary
The Fragile X syndrome is the genetic entity that is the first cause of hereditary mental retardation characterized by a very peculiar physical and psychoneuroconductal phenotype. Innumerable studies, including the immunohistochemical techniques, have been conducted aimed at dilucidating the gene's function and the localization of the protein that it codified related to this affection. The immunohistochemical techique was used in order to detect individuals at genetical risk for presenting Fragile X syndrome by neonatal screening in 14 months. A total of 2 914 male infants were screened of whom 2 414 showed histochemical results. 10 cases tested negative protein. Their psychomotor development was exhaustively evaluated for 3 years and it was normal. The disease was not detected in any individual.
Key words: Neonatal screening; Fragile X syndrome; mental retardation; immunohistochemical test; monoclonal antibodies.
.
Referencias bibliográficas
- Cunnergham G, Velazquez K, Lorey F, Morales D, Lerner H, Mc Elvoy E. 11th National Neonatal Screening Simposium 1995;83-90.
- Hofman LF, Naylor EW. Selection of newborn screening parameters. 11th National Neonatal Screening Simposium 1995;95-6.
- Delias MK. Legal issues in newborn screening and informed consent. 11th National Neonatal Screening Simposium 1995;136-9.
- Andrews LB, Fullerton JE, Holtzman NA, Motulsky AG. Assessing genetic risks: Implications for health and social policy. Washington, D.C. National Academy Press 1994.
- Bradford L, Themell JR. Hospital and other newborn screening specimen submitlor guidelines. 11th National Neonatal Screening Simposium 1995;97-100.
- Willemsen R, Oosterwijk JC, Los FJ, Galjaard H, Ostra BA. Prenatal diagnosis of Fragile X Syndrome. Lancet 1996;348:967-8
- Verheig C, Bakker CE, de Graff E. Characterization and localization of the FMR-1 gene product associated with Fragile X Syndrome. Nature 1993;363:722-4.
- Willemsen R, Smits A, Mohkamsing S. Rapid antibody test for diagnosing Fragile X Syndrome: a validation of the technique. Hum Genet 1997;308-11.
- Willemsen R, Mohkamsing S, deVries B. Rapid antibody test for Fragile X Syndrome. Lancet 1995;345:1147-8.
- Naber SP. Molecular diagnosis of Fragile X Syndrome. Diagn Mol Pathol 1995;4:158-61.
- Willemsen R, Los F, Mohkamsing S, Galjaard H, Oostra B. Rapid antibody test for prenatal diagnosis of Fragile X Syndrome on amniotic fluid cells: a new appraisal. J Med Genet 1997;34:250-1.
- Bert, A de Vries, Dicky JH, Ben AO, Mortinus FN. The Fragile X Syndrome. J Med Genet 1998;35:579-89.
- López M. El Síndrome de Frágil X: La causa más común de subnormalidad en el hombre. Mundo Científico 1998;141:1066-8.
- Turner G, Webb T, Wake S, Robinson H. Prevalence of Fragile X Syndrome. Am J Med Genet 1996;64:163-9.
- Lennox N, Cohen J, Slater H, Cook A. The Fragile X Syndrome. Aust Fam Physician 1998;27:163-9.
- Carbonell P, López I, Gabarrón J, Bernabé MJ, Lucas JM, Guitart M, et al. FRAXE mutation analysis in three spanish families. Am J Med Genet 1996;58:903-5.
Recibido: 23 de enero de 2004. Aprobado: 12 de abril de 2004.
Dr. Roberto Lardoeyt Ferrer. ICBP "Victoria de Girón". Ave 146. Esq. a 31, Reparto Cubanacán. Playa. E mail: lardgen@infomed.sld.cu
1Especialista de I Grado en Genética Clínica. ICBP "Victoria de Girón".
2Licenciado en Bioquímica. Jefe del Departamento de SUMA. Hospital Materno"10 de Octubre" .
3Enfermera Reanimadora. Hospital Materno "Eusebio Hernández".
4Especialista de II Grado en Genética Clínica. ICBP "Victoria de Girón".
5 Universidad Erasmus, Rotterdam, Holanda.