Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Pediatría
versión On-line ISSN 1561-3119
Rev Cubana Pediatr v.77 n.3 Ciudad de la Habana jul.-dic. 2005
Artículos originales
Hospital Pediátrico Universitario «José Luis Miranda»
Supervivencia y calidad de vida de pacientes con leucemia linfoide aguda. Resultados del Hospital Pediátrico «José Luis Miranda» (1969-2003)
Dra. Berta Vergara Domínguez,1 Dra. Tamara Cedré Hernández,2 Dra. Liliana Martínez Cárdenas,3 Dra. Carmen López García,4 Dr. Fernando González Seivane5 y Dr. Víctor Pich León6
RESUMEN
Los progresos obtenidos en el tratamiento de la leucemia linfoide aguda del niño han permitido que un número cada vez mayor de pacientes se cure de esta enfermedad. Es objetivo de este trabajo analizar la evolución a largo plazo de los pacientes tratados por leucemia linfoide aguda una vez concluido el tratamiento y correlacionar las recaídas con los factores pronósticos, así como examinar las recaídas en el tratamiento, el protocolo utilizado y la calidad de vida de los pacientes que sobreviven a esta enfermedad. Se realiza el estudio de 103 pacientes diagnosticados de leucemia linfoide aguda, durante su niñez, entre los años 1969 y 2000. Casi todos los pacientes estaban incluidos en alguno de los protocolos del Grupo Latinoamericano de Tratamiento de Hemopatías Malignas (GLATHEM). La clasificación en grupos pronósticos se hizo sobre la base de la edad y de la cifra de leucocitos. Se analizaron las recaídas tardías y se determinó el sitio y momento de su aparición. Prestamos especial atención a la calidad de vida de estos pacientes, grado educacional alcanzado, vínculo laboral y descendencia. Se produjeron 17 recaídas (16,5 % de los pacientes). A partir del primer año de tratamiento las recaídas disminuyeron gradualmente y sólo se produjeron 2 después de los 4 años, que representan menos del 2 % del total de pacientes estudiados. Se mantuvo sin tratamiento el 90 % de los pacientes y sobrevive el 92 % del total. Las complicaciones a largo plazo fueron poco frecuentes. La mayoría de los pacientes han alcanzado nivel educacional superior a la primaria; casi todos los adultos varones tienen vínculo laboral y la descendencia, que asciende a 38 niños, es normal.
Palabras clave: Leucemia linfoide aguda, supervivencia.
La leucemia linfoide aguda (LLA) del niño es una de las primeras enfermedades malignas para las cuales se han hecho estudios clínicos terapéuticos a gran escala y constituye uno de los grandes avances de la moderna oncología pediátrica. En las últimas décadas se ha logrado el aumento del porcentaje de remisiones prolongadas y curaciones de esta enfermedad. En el momento actual se espera que el 70 % o más de los niños que la padecen sobrevivan libres de la enfermedad por 5 años o más y que la mayoría de ellos alcance la curación definitiva.1-3 Los estudios sobre el tema realizados de 1981 a 1995 por un grupo de investigadores alemanes han tenido gran importancia en la mejoría de los resultados obtenidos.3 Sus esquemas de tratamiento han sido adoptados por varios países.
A pesar de los avances terapéuticos alcanzados, la LLA sigue teniendo un peso importante en la mortalidad del niño mayor de un año. Se han identificado numerosos factores al comienzo de la enfermedad, los cuales pueden contribuir a predecir la evolución y el pronóstico.4-6 Entre las alteraciones clínicas y hematológicas, la edad y la cifra de leucocitos se consideran entre las más importantes para la mayoría de los autores.7,8 Los progresos obtenidos en los últimos años con relación a la inmunología, la citogenética y la biología molecular han permitido definir con más exactitud distintos grupos de riesgo,9,10 aunque también es de gran importancia la respuesta temprana al tratamiento analizada según parámetros diversos.11-14
Muchas de las características antes mencionadas permiten clasificar los pacientes en grupos de riesgo, lo que determina variaciones en el tratamiento.15
Una vez concluido su tratamiento, los pacientes con LLA pueden presentar recaídas, lo cual suele ocurrir hasta en el 20 % de los casos.5 Las recaídas se han catalogado como muy precoces cuando ocurren en los primeros 18 meses desde el diagnóstico, precoces entre los 18 y 30 meses y tardías cuando se producen después de los 30 meses.16 También se han considerado recaídas tardías las que aparecen después de suspendido el tratamiento.10
Se ha valorado si las características clínicas y hematológicas al inicio de la enfermedad tienen alguna influencia en la aparición de recaídas tardías, pero en general se considera que éstas pierden su valor predictivo después de los 3 años de remisión completa.17
Desde hace varios años se crean en todo el mundo grupos cooperativos para el tratamiento de la LLA, lo que ha permitido sistematizar los esquemas terapéuticos y obtener mejores resultados. Cuba forma parte desde 1973 del Grupo Latinoamericano de Tratamiento de Hemopatías Malignas (GLATHEM).18 El Hospital Pediátrico Universitario «José L. Miranda» de Santa Clara, junto al Instituto de Hematología e Inmunología, inició los estudios del GLATHEM en 1973. Desde su incorporación al GLATHEM, nuestro centro ha participado en 8 protocolos sucesivos de tratamiento, en los cuales se han incluido 220 niños con LLA.19-21
El incremento de la supervivencia y las posibilidades reales de curación de los niños con LLA ha hecho que se preste más atención a los efectos a largo plazo de su tratamiento. La poliquimioterapia y la radioterapia pueden originar secuelas orgánicas relacionadas con el crecimiento y desarrollo, la capacidad intelectual, la función cardiopulmonar y la función gonadal, y pueden aparecer además neoplasias secundarias y afectaciones de distintos aparatos y sistemas.22-28
Desde el punto de vista psicológico y social, se destacan problemas escolares, dificultades laborales, conflictos psicosociales y crisis de autoestima.29,30 Producto de la terapia transfusional es posible, además, la adquisición de infecciones crónicas sobre todo de naturaleza viral.
MÉTODOS
Se realiza un estudio de 103 pacientes diagnosticados de LLA durante la niñez, entre los años 1969 y 2000. Los pacientes se incluyeron en el estudio una vez concluido el tratamiento y se siguieron evolutivamente hasta diciembre del 2003. La muestra estaba constituida por 63 niñas y 40 varones, que tenían al momento del diagnóstico de 1 a 4 años (68 pacientes) y de 5 a 14 años (33 pacientes). La mayoría de los pacientes se encontraba en la primera remisión completa. Los esquemas de tratamiento variaron según el protocolo vigente al momento del diagnóstico, pero casi todos estaban incluidos en alguno de los protocolos del GLATHEM.
Se establecieron 3 grupos de pacientes según el momento del diagnóstico y el protocolo de tratamiento. La clasificación por grupos pronóstico se hizo fundamentalmente con arreglo a la edad y a la cifra de leucocitos según los criterios utilizados en el protocolo 3-LLA-84 del GLATHEM,31 ya que los estudios citogenéticos, inmunológicos y moleculares, así como la valoración de respuesta al tratamiento, se realizaron sólo en los casos diagnosticados en años recientes.
Los grupos pronósticos considerados fueron:
- Riesgo bajo (estándar): Edad comprendida entre 1 y 8 años; cifra de leucocitos inferior a 10 x 109/L; ausencia de adenopatías mediastinales o infiltración del sistema nervioso central (SNC).
- Riesgo alto: Aquellos con cifras de leucocitos superiores a 50 x 109/L.
- Riesgo intermedio: Los restantes.
Se analizan las recaídas después de suspendido el tratamiento (recaídas tardías) y se correlacionan con los factores pronósticos analizados y las recaídas ocurridas durante el tratamiento. Se investigan las complicaciones a largo plazo presentadas por los pacientes, el grado educacional alcanzado, la vinculación laboral y la descendencia.
Se utiliza la prueba de chi cuadrado para la comparación de proporciones.
RESULTADOS
El grupo I está formado por 37 pacientes, de los cuales 4 fueron tratados antes de los estudios del GLATHEM y los restantes, incluidos en los protocolos clásicos, poco agresivos, de la década de los 70. El grupo II comprende 24 pacientes que fueron tratados con protocolos modernos, más agresivos, semejantes a los del grupo alemán BFM. El grupo III lo constituyen 42 pacientes tratados con protocolos tipo BFM, más modernos, que además utilizan el metotrexato endovenoso en altas dosis (1 a 2 g/m2).
De 1969 al 2000 se había registrado en el grupo de estudio y tratamiento de la LLA en nuestro centro el total de 193 niños, de los cuales 103 suspendieron el tratamiento. Éstos últimos constituyen la muestra de este trabajo. Como se observa en la Tabla 1, la proporción de pacientes que concluyen exitosamente el tratamiento se ha ido incrementando progresivamente del 38 % con los protocolos de la década de los 70 al 75 % con el empleo de los protocolos más modernos.
Tabla 1. Pacientes que suspenden tratamiento, según protocolo utilizado
| Protocolo | Total | Pacientes que suspendieron el tratamiento | |
| N.o | % | ||
| 72, 76, 79 | 97 | 37 | 38,1 |
| 82, 84 | 40 | 24 | 60,0 |
| 87, 90, 96 | 56 | 42 | 75,0 |
| Total | 193 | 103 | 53,3 |
Del total de los pacientes, 60 eran niñas y 43 varones. Predominó el grupo de edad entre 2 y 8 años (82 pacientes); 7 eran menores de 2 años y 14 mayores de 8 años. Respecto al color de la piel, 81 eran de piel blanca, 2 de piel negra y 20, mestizos.
En relación con los grupos pronósticos, predominaron los pacientes de riesgo intermedio con 54 casos (52,5 %), seguidos por los de riesgo bajo con 39 casos. Sólo 10 pacientes pertenecían al grupo de alto riesgo.
Del total de casos, 8 pacientes habían presentado recaídas durante el tratamiento. En 4 pacientes las recaídas fueron en el sistema nervioso central (SNC), en 2 fueron en los testículos y en 2 se trató de lesiones mixtas con participación de la médula ósea.
En la Tabla 2 se observan las recaídas presentadas por los pacientes una vez concluido el tratamiento.
Tabla 2. Recaídas después de terminar el tratamiento
| Lugar | <12 m | 12-24 m | 25-36 m | 37-48 m | >48 m | Total |
| Médula ósea | 2 | - | 2 | 1 | 1 | 6 (4,8 %) |
| SNC | 3 | - | 1 | - | - | 4 (3,8 %) |
| Testículos | 3 | 1 | - | - | 1 | 5 (4,8 %) |
| Ovarios | - | - | 1 | - | - | 1 (1,0 %) |
| Lesiones mixtas | - | - | 1 | - | - | 1 (1,0 %) |
| Otras | - | - | - | - | - | - |
| Total | 8 | 1 | 5 | 1 | 2 | 17 (16,5 %) |
| % | 7,7 | 0,9 | 4,8 | 0,9 | 1,9 |
|
En un período de observación que fluctuó entre 1 y 30 años de después de terminada la terapéutica, se produjeron 17 recaídas, que representan el 16,5 % de los pacientes. Éstas fueron más frecuentes en médula ósea y testículos y predominaron durante el primer año fuera de la quimioterapia. Se observa como las recaídas disminuyen paulatinamente después del primer año de terminado el tratamiento y solo se constataron 2 después de los 4 años, lo que representa menos del 2 % de los pacientes estudiados. Una de las recaídas se produjo a los 20 años de haber finalizado la quimioterapia.
Es de interés señalar que de los 8 pacientes que habían recaído durante el tratamiento, solo 1 presentó recaída después de finalizado. Las 2 recaídas tardías ocurrieron en el sistema nervioso central.
Al correlacionar las recaídas que aparecieron después de finalizado el tratamiento con las características iniciales de los pacientes, se encontró que en relación al sexo éstas predominaron en el masculino con 8 recaídas de 43 pacientes (18,6 %), mientras que en el femenino recayeron 9 de 60 pacientes (15,0 %). No obstante las diferencias no son significativas.
La vísceromegalia (hígado o bazo) superior a 5 cm no constituyó un factor de riesgo de recaída, incluso recayeron en una proporción menor los pacientes que la presentaban.
Las recaídas tardías no guardaron relación con la cifra de leucocitos, ya que no recayó ninguno de los 10 pacientes catalogados de riesgo alto (cifras leucocitarias = 50 x 109/L), mientras que de los 39 de riesgo bajo recayeron 9 (23 %). En los 54 pacientes de riesgo intermedio se produjeron 7 recaídas (13,7 %). Debe tenerse presente que el número reducido de pacientes de riesgo alto no permite aplicar método de significación estadística.
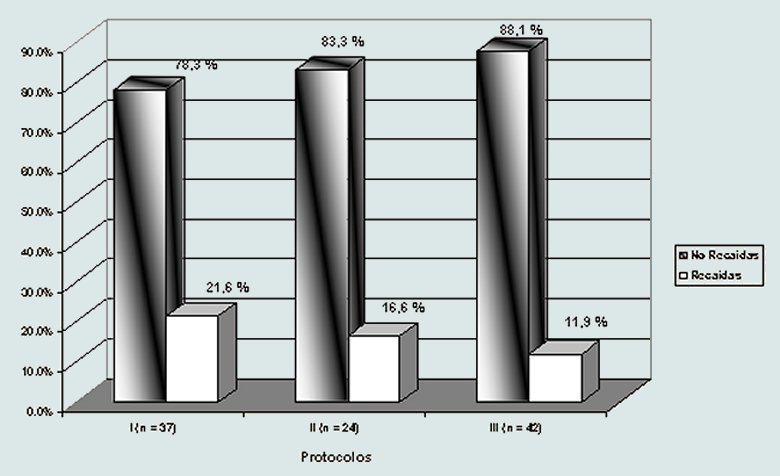
En el Gráfico se observa como va disminuyendo el porcentaje de recaídas tardías a medida que van perfeccionándose los esquemas terapéuticos. Recayó el 21,6 % de los pacientes tratados en la década de los 70 (protocolos tipo I), mientras que sólo recayó el 11,9 % de los incluidos en protocolos más recientes (tipo III). El número reducido de pacientes en algunos subgrupos no permitió análisis estadísticos.
Gráfico. Se observa que el porcentaje de recaídas tardías disminuye en los protocolos modernos, aunque no tiene significación estadística probablemente por el tamaño de la muestra.
La Tabla 3 muestra la situación actual de todos los pacientes. Se encuentra en remisión completa el 84, 4 % y sobrevive más del 90 %. Un número importante de pacientes llevan ya 20 años sin tratamiento y más del 80 % sobrepasa los cuatro años, que es el tiempo de mayor riesgo de la recaída.
Tabla 3. Situación actual de los pacientes que suspendieron tratamiento
| Situación | N.0 | % |
| Sin tratamiento, en remisión completa | 87 | 84,4 |
| Sin tratamiento después de recaída | 6 | 5,8 |
| Total sin tratamiento | 93 | 90,2 |
| En tratamiento por recaída | 2 | 1,9 |
| Vivos | 95 | 92,2 |
| Fallecidos | 8 | 7,7 |
| Total | 103 | 100 |
Entre los efectos tardíos del tratamiento encontrados en estos pacientes se hallan la hepatitis crónica por virus B y C con 15 y 3 casos respectivamente. Estos son pacientes diagnosticados en la década de los 70 y principios de los 80, cuando no se disponía de marcadores serológicos para detectar estos virus en los donantes de sangre. Todos los pacientes recibieron tratamiento con interferón alfa; se normalizaron las aminotransferasas y en la mayoría se normalizó también el estudio histológico hepático; 3 pacientes presentaron hipogonadismo relacionado con irradiación de las gónadas (2 de testículos y 1 de ovario) y en la actualidad desarrollan una vida sexual normal con tratamiento hormonal. Excepto estos dos pacientes que por el daño de las gónadas resultaron estériles, y uno en el que pudo demostrarse azoospermia, los restantes, tanto hembras como varones, han tenido una fertilidad normal. Dos pacientes tienen alteraciones neurológicas importantes, incluídas una obesidad de tipo hipotalámica y una atrofia cortical. Tres pacientes del sexo femenino tienen marcado retraso de la talla.
En relación con las segundas neoplasias, en este estudio se detectaron 2 tumores cerebrales (un neurinoma del acústico y un tumor cerebeloso de crecimiento lento), que aparecieron a los 15 y 20 años de tratamiento suspendido, respectivamente. El paciente con neurinoma del acústico falleció por complicaciones secundarias a la operación. Ambos pacientes habían sido irradiados en el cráneo.
En la Tabla 4 se observa el nivel educacional alcanzado por los 59 pacientes mayores de 15 años. Los restantes se encuentran aún en distintos niveles de la enseñanza primaria. Sólo 4 pacientes adultos no sobrepasaron la enseñanza primaria y 8 tienen nivel universitario.
Tabla 4 . Nivel educacional alcanzado por los 59 pacientes mayores de 15 años
| Nivel alcanzado | N.o de pacientes | % |
| Primario | 4 | 6,8 |
| Secundario | 22 | 37,5 |
| Preuniversitario | 23 | 39,0 |
| Universitario | 7 | 11,9 |
| Ninguno (Síndrome de Down) | 2 | 3,4 |
| Ninguno (Retraso mental) | 1 | 1,6 |
| Total | 59 | 100 |
La mayoría de los pacientes adultos están incorporados a distintas esferas de la vida laboral o están estudiando: 5 son profesionales; 14, técnicos de distintas especialidades incluyendo enfermería; 4 trabajan en diferentes oficios; 10 son obreros y trabajadores agrícolas; 3 son trabajadores por cuenta propia y 13 son amas de casa. Hay 6 estudiando.
Con relación a la descendencia, 18 mujeres son madres de 25 niños y 9 varones son padres de 13 hijos. De los 38 descendientes uno tiene una lesión estática del sistema nervioso central (SNC) por hipoxia perinatal. Los 37 restantes son normales. Seis de estos descendientes tienen más de 10 años de edad.
DISCUSIÓN
En este centro, a lo largo de 30 años, suspendieron el tratamiento 103 de los 193 pacientes incluidos en los estudios del GLATHEM (51 %). Estos resultados son comparables con los de un estudio de 30 años del St. Jude Hospital, en el cual se informa la suspensión del tratamiento en el 54 % de los pacientes tratados por LLA en ese período.17 No obstante, con los protocolos de tratamiento de los últimos años, en nuestro centro el porcentaje de pacientes con LLA que concluye exitosamente el tratamiento se ha ido incrementando progresivamente.
Es bien conocido que los pacientes con LLA que recaen durante el tratamiento tienen una evolución muy desfavorable.32 Es de interés señalar que 8 de nuestros pacientes habían recaído durante el tratamiento y sólo uno de ellos después de finalizado éste. Rivera y colaboradores17 informaron la evolución de 104 pacientes que pudieron concluir la terapéutica de la LLA a pesar de haber recaído durante el tratamiento.
Un indicador importante para predecir la curación de la LLA es determinar la proporción de pacientes que permanecen en remisión completa una vez concluida la quimioterapia, mediante un seguimiento a largo plazo. Desde hace varios años distintos autores y grupos cooperativos han publicado series numerosas de pacientes tratados por LLA con larga supervivencia y encontrado que se producen el 15 - 20 % de recaídas tardías.33,34
En nuestro estudio registramos el 16,5 % de recaídas en un seguimiento entre 2 y 30 años, que coincide con estos resultados. Se ha informado que el 80 % de las recaídas suele ocurrir en los primeros 3 años después de terminada la quimioterapia.34 Lo anterior coincide con este trabajo, ya que 8 de 17 recaídas se produjeron durante el primer año y 14 (82 %) en los primeros tres años luego de finalizado el tratamiento. Sólo 2 pacientes recayeron después de los 4 años, lo cual representa menos del 2 % del total estudiado. Una de estas recaídas se produjo a los 20 años de finalizada la quimioterapia.
Se ha discutido si estas recaídas muy tardías son verdaderas recidivas o una segunda neoplasia. Levasseur y colaboradores35 publicaron el caso de una recaída de LLA a los 14 años del diagnóstico, en la cual pudo demostrarse por técnicas moleculares que se trataba de una reemergencia de la enfermedad original. En los últimos años las técnicas de biología molecular mediante la reacción en cadena de la polimerasa han devenido en valiosa ayuda para diferenciar la recaída de una segunda enfermedad.36 En nuestra paciente que recayó a los 20 años, las células leucémicas eran similares morfológicamente a las de la etapa inicial, pero no pudieron correlacionarse las características inmunológicas y moleculares, ya que no habían sido realizadas al inicio de la enfermedad. No obstante, el hecho de ser las células blásticas de aspecto linfoide y de no haber recibido esta paciente en su primer tratamiento drogas potencialmente oncogénicas tales como el etopósido, nos inclina a pensar que se trata de una recaída, muy tardía, de su enfermedad original.
Los factores pronósticos analizados en este estudio no se relacionaron con la aparición de recaídas tardías, lo que puede estar relacionado con el hecho de que no utilizamos, en la la clasificación por grupos pronósticos, determinados parámetros tales como los estudios citogenéticos y moleculares, el inmunofenotipo y la respuesta al tratamiento.9-12 No obstante, se ha valorado que los factores pronósticos desaparecen después de tres años de remisión completa.17 Esto se aplica en este estudio a la cifra de leucocitos igual a 50 x 109/L, que constituyó un importante valor predictivo en la aparición de recaídas tempranas de los pacientes tratados con iguales esquemas terapéuticos, pero perdió su valor para predecir recaídas después de terminado el tratamiento.
Se ha señalado que la aparición de recaídas en el primer año que sigue a la suspensión del tratamiento parece ser menor con el empleo de una quimioterapia agresiva.37 En este estudio las recaídas fueron disminuyendo en frecuencia conforme los protocolos se fueron intensificando.
En los últimos años se han descrito varios efectos adversos a largo plazo en los pacientes tratados por neoplasias malignas, secundarios a poliquimioterapia o radioterapia. Leung y cols.23 reportaron anormalidades en el crecimiento, función endocrina, trastornos neurocognoscitivos, cardíacos y oftalmológicos. Se señala que la causa principal del retardo en el crecimiento es la radioterapia.23,26 Nosotros tuvimos tres pacientes del sexo femenino que presentaron retraso marcado en la talla final alcanzada, las cuales habían recibido irradiación craneal por recaídas a nivel del sistema nervioso central (SNC). La quimioterapia se considera menos responsable de la reducción final de la talla, porque suele determinar sólo un retraso temporal del crecimiento.32
Se ha planteado una incidencia de neoplasias secundarias de 2,5 % a los 15 años del diagnóstico de una enfermedad maligna. Predominan los tumores cerebrales y son causados principalmente por la radioterapia, sobre todo cuando se aplica a menores de 5 años.38 Las dos neoplasias secundarias ocurridas en nuestros pacientes aparecieron a los 15 y 20 años de finalizados el tratamiento y en los dos casos, los pacientes habían sido irradiados en el cráneo de forma profiláctica a los 4 años de edad.
Los dos pacientes de este estudio que presentaron afectación neurológica importante (obesidad hipotalámica y atrofia cortical), también habían recibido irradiación craneal por infiltración del SNC.
La afectación de las gónadas en los niños tratados por leucemia se produce por los agentes alquilantes o la radioterapia.32 En este estudio las alteraciones más importantes de las gónadas fueron resultado de la radioterapia utilizada para la infiltración de estas. Los pacientes de uno y otro sexo, que han contraído matrimonio, han tenido descendencia, excepto uno en el cual pudo demostrarse azoospermia. En este paciente la causa puede haber sido la ciclofosfamida, ya que no había sido irradiado.
En el presente estudio se constató hepatitis crónica por virus B y C. Matsuzaki y colaboradores encontraron hepatitis C en el 9 % de sus pacientes.
En relación con el nivel educacional alcanzado por estos pacientes vemos que, a pesar de los largos períodos de hospitalización, los resultados se aproximan a los de la población en general y hay 8 de ellos con nivel universitario. Una paciente tiene retraso mental por atrofia cortical y dos tienenn síndrome de Down. En un estudio de 51 sobrevivientes de neoplasias malignas, Schwartz29 reportó 6 pacientes con enseñanza primaria, 31 secundaria, 7 preuniversitaria y 7 de nivel universitario, datos similares a los de este estudio.
En sentido general observamos que los efectos secundarios en los pacientes de este estudio estuvieron relacionados principalmente con la radioterapia. Según nuestros resultados, la calidad de vida de los que sobreviven a una LLA es buena en líneas generales y estos pacientes han alcanzado niveles educacionales comparables con el resto de la población. La mayoría de ellos está incorporada a labores útiles a la sociedad.
Referencias bibliográficas
1. Silverman LB, Delcler L, Gelber RD. Results of Dana-Farber Cancer Institute Consortium protocols for children with newly diagnosed acute lymphoblastic leukemia (1981-1995). Leukemia. 2000; 14:2247-56.
2. Pui CH, Boyett JM, Rivera GK. Long-term results of total therapy studies 11, 12 and 13 A for childhood acute lymphoblastic leukemia at St Jude Childen's Research Hospital . Leukemia. 2000; 14:2286-94.
3. Schrappe M, Reiter A, Zimmermant M. Long-term results of four consecutive trials in childhood ALL-BFM study group from 1981-1995. Leukemia. 2000; 14:2205-22.
4. Smith BM, Arthur D, Camitta AJ, Crist W, Gaynon P. Uniform approach to risk classification and treatment assignment for children whit acute lymphoblastic leukemia. J Clin Oncol. 1996: 14: 18-24.
5. Felix CA, Lange BJ, Pediatric Acute lymphoblastic leukemia: Challenges and controversies in 2000. In: Hematology 2000: American Society of Hematology. Educational Program. San Francisco. California: Ed AMGEN; 2000. pp.285-302.
6. González A, Vergara B. Las leucemias en Pediatría. En: Pediatría Tomo III. La Habana: Ed. Pueblo y Educación; 1997. pp. 25-31.
7. Pui CH. Leucemia Linfoblástica Aguda. Clin Pediatr Norteam. 1997;4: 849-64.
8. Quintero M. Resultados del tratamiento de la leucemia linfoblástica aguda en niños Colombia méd. 1999; 30:146-54.
9. Mori T, Manabee A, Tsuchida M, Banada R, Yabe H, Ohara A, et al. Allogenic bone marrow transplantation in first remission rescues children with Philadelphia chromosome-positive acute lymphoblastic leukemia: Tokyo children's Cancer study group (TCCSG) Studies L89-12 and L92-13. Med Pediatric Oncol. 2001; 37: 426-31.
10. Ford AM, Fasching K, Panzer-Grumayer ER, Koening M, Haa OA, Greaves MF. Origins of late relapse in childhood B-precursor acute lymphoblastic leukemia whit TEL/AML 1 fusion genes. Blood. 2001; 98:558-64.
11. Dordelman M, Reiter A, Borkhadt A. Prednisone response is the strongest predictor of treatment outcome in infant acute lymphoblastic leukemia. Blood. 1999; 94: 1209-17.
12. Gaymon PS, Desai AA, Bostrom BC. Early response to therapy and outcome in childhood acute lymphoblastic leukemia: a review. Cancer. 1997; 80:1717-26.
13. Cave H, Vanderwerff J, Suciu E, Guidal C, Waterkelyn C, Otten J, et al. Clinical significance of minimal residual disease in childhood acute lymphoblastic leukemia. N Engl J Med. 1998; 339:591-98.
14. Nyvold C, Madsen HO, Ryder LP, Seiyfart J, Svejgaard A, Clausen N. et al. Precise quantification of minimal residual disease at day 29 allows identification of children with acute lymphoblastic leukemia and an excellent outcome. Blood. 2002; 89: 1253-58.
15. Vederzo C, Dini G, Locatelli F, Miniero R, Tamargo P. Treatment of childhood acute lymphoblastic leukemia after the first relapse: Curative strategies. Hematológica. 2000; 5:47-53.
16. Vora A. Acute lymphoblastic leukemia: Optimizing treatment strategies in children. Paed Drug. 2002; 4: 405-416.
17. Rivera CK, Pinkel D, Simone JV, Hancok ML, Crist WM. Treatment of acute lymphoblastic leukemia. 30 years experience at St Jude Children Research Hospital. N Engl J Med. 1993; 329: 1289-95.
18. Svarch E, Sackman-Murriel F, González A, Vergara B, Eppinger-Helf M, Pavlovski S. Evolución a largo plazo del tratamiento de la leucemia linfoblástica aguda (LLA): Protocolo 10-LLA-72. Sangre 1982; 27: 730-76.
19. Svarch E, González A, Vergara B, Campos M, Dorticós E, Méndez J, et al. Tratamiento de la leucemia linfoide aguda (LLA) del niño. Sangre. 1993; 38: 25-30.
20. Svarch E, González A, Vergara B, Campos M, Dorticós E, Espinosa E, et al. y Grupo para el Estudio y Tratamiento de las Hemopatías Malignas en Cuba (GETMHAC).Tratamiento de las Leucemias en Cuba 1973-1995. Rev Cubana Hematol Inmunol Hemoter.1996; 12; 112-118.
21. Vergara B, Martirema MT, González A Machín S, Campos M, Mendez J, et al. Cessation of therapy in childhood acute lymphoblastic leukemia. Arch Venezolanos Farmacol Ter. 1997; 16:47 -53.
22. Langerbrake C, Reinhardt D, Ritter J. Minimizing the long-term adverse effects of childhood leukemia therapy. Drug safety. 2002; 25: 1057-77.
23. Leung W, Hudson M, Zhu Y, Rivera GK, Ribeiro RE, Sandlund IT, et al. Late effects in survivors of infant leukemia. Leukemia. 2000; 14: 1185-90.
24. Monesha G, Steinherz PG, Cheung NK, Steinherz L. Late cardiotoxicity after bolus versus infusion antracicline therapy for childhood cancer. Med Pediatr Oncol. 2003; 40: 343-77.
25. Ladier W. Childhood acute lymphoblastic leukemia: Currents perspectives. Oncol Nurs Forum. 2001; 28: 823-33.
26. Bottomley SJ, Kassner E. Late effects of childhood cancer therapy. J Pediatric Nurs. 2003; 18: 126-133.
27. Cicognani A, Pasini A, Pession A, Pirazzoli P, Burnelli R, Barbieri E, et al. Gonadal function and pubertal development after treatment of childhood malignancy. Pediatric Endocrinol Metabolism. 2003; 16: 321-26.
28. Mattos AM, Olyaei AJ, Pharm D, Bennett WM. Nephrotoxicity of immunosuppressive drugs: long-term consequences and challenges for the future. Amer Kidney. 2000; 35: 333-46.
29. Schwartz L. La sobrevida en adolescentes y adultos jóvenes con cáncer en la infancia. Medicina ( Buenos Aires ). 2001; 61: 401-405.
30. Langeveld NE, Stam H, Grootenhuis MA, Last BF. Quality of life in young adults survivors of childhood cancer. Support Care Canc er. 2002; 10: 579-600.
31. González A, Vergara B, Svarch E, Cruz C. Resultados preliminares del tratamiento de la leucemia aguda linfoblástica del niño en Cuba: Prot 3-LLA-82 y 1- LLA-84 del Grupo Latinoamericano de Tratamiento de Hemopatías Malignas. Rev Cubana Hematol Inmunol Hemoter. 1986; 2: 263-71.
32. Matsuzaki A, Ishii E, Nagatoshi Y, Eguchi H, Koga H, Yanai F, et al. Long-term outcome of treatment with protocols AL841, AL851 and ALHR 88 in children with acute lymphoblastic leukemia: Results obtained by the Kiushu-Yamaguchi children's cancer study group. Int J Hematol. 2001;73(3):369-77.
33. George GL, Aur RJA, Mauer AM. A reappraisal of the results of stopping therapy in childhood leukaemia. N Engl J Med. 197 9; 30: 269-73.
34. Moe PJ. Cessation of therapy in childhood. Leukemias: a survey of 160 cases from the Nordic countries. Acta Pediatr Scand. 1981: 70: 609-18.
35. Levasseur M, Maun ZT, Jacson G, Kernahan J, Proctor SJ, Midleton PG. Relapse of acute lymphoblastic leukaemia 14 years after presentation : use of molecular techniques to confirm true re-emergence. Br J Haematol. 1994; 87:437-8.
36. Szczepanski T, Willence MJ, Kamps WA, Van wering ER, Langerak AW, Van Dongein JJ. Molecular discrimination between relapse and secondary acute lymphoblastic leukaemia: Proposal for an easy strategy. Med Pediatric Oncol. 2001; 36:352-8.
37. Lange BJ, Sather H, Weetman R. Double delayed intensification improve outcome in moderate risk pediatrics acute lymphoblastic leukemia. Blood 1997;90:Suppl 1:559-61.
38. Neglia JP, Meadow AT, Robinson LL. Second neoplasm after acute lymphoblastic leukemia. N Engl J Med. (1991); 325: 1220-28.
Recibido: 7 de mayo de 2005. Aprobado: 25 de julio de 2005.
Dra. Berta Vergara Domínguez. Leoncio Vidal N.o 61, entre Maceo y Unión, Santa Clara. Código Postal 50100.
Correo electrónico: bvergara@capiro.vcl.sld.cu
1Doctora en Ciencias Médicas. Especialista de II Grado en Hematología y I Grado en Pediatría. Profesora Titular y Consultante ISCM Villa Clara.
2Especialista de I Grado en Hematología.
3Especialista de I Grado en Pediatría. Profesora Instructora.
4Especialista de I Grado en Pediatría. Profesora Instructora.
5Especialista de II Grado en Pediatría. Profesor Titular y Consultante.
6Especialista de II Grado en Oncología.