Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Pediatría
versión impresa ISSN 0034-7531versión On-line ISSN 1561-3119
Rev Cubana Pediatr v.78 n.1 Ciudad de la Habana ene.-mar. 2006
Hospital Pediátrico Universitario «William Soler»
Síndrome de fuga capilar después de desviación cardiopulmonar en niños
Dr. Luis Bravo Pérez,1 Lic. Yosnaiby Miranda Pérez,2 Dra. Maritza Oliva Pérez,3 Dr. José Manuel Lambert Marisma,4 Dr. Omar Machado Sigler5 y Dr. Javier Ozores Suárez6
RESUMEN
El síndrome de fuga capilar se puede observar en pacientes con cardiopatías congénitas a los que se realiza una derivación cardiopulmonar. Está asociado a un significativo aumento de la morbilidad en el postoperatorio inmediato. Investigamos, mediante análisis univariado y multivariado, los factores preoperatorios y perioperatorios relacionados con la aparición del síndrome de fuga capilar, y también determinamos las características de la evolución del síndrome en lo referente a la duración de la ventilación mecánica, estadía en la unidad de cuidados intensivos y la mortalidad. Se realizó un estudio prospectivo que incluyó a 123 pacientes en edades comprendidas entre los 10 días y los 16 años, quienes fueron operados bajo circulación extracorpórea en el Servicio de Cirugía Cardiovascular del Hospital Universitario «William Soler» durante 2001. En las primeras 48 h, 22 pacientes desarrollaron síndrome de fuga capilar, para una incidencia del 17,89 %. Los pacientes que presentaron síndrome de fuga capilar estuvieron mayor tiempo en ventilación mecánica (259 h contra 29,9 h), tuvieron mayor estadía en la sala de cuidados intensivos (13 días contra 2 días) y mayor mortalidad (50 % contra 9,9 %) en comparación con el grupo control. El tiempo de derivación cardiopulmonar prolongado fue identificado como factor de riesgo independiente para la aparición del síndrome de fuga capilar. Este grupo de pacientes presentó mayor morbilidad y mortalidad.
Palabras clave: Derivación cardiopulmonar, síndrome de fuga capilar, edema postoperatorio, cirugía cardíaca.
La derivación cardiopulmonar (DCP) desencadena la producción y liberación de una amplia variedad de sustancias vasoactivas y mediadoras de la inflamación. Estas reacciones son las causantes de la morbilidad asociada a la DCP.1-5
Los niños reaccionan más al estímulo de la DCP que los adultos. Ellos parecen ser particularmente sensibles a la fuga capilar.6,7 Los mecanismos precisos por los cuales los niños difieren de los adultos en sus respuestas a la DCP aun se desconocen.8 El síndrome de fuga capilar (SFC) se caracteriza por la pérdida de fluido intravascular que conduce a un edema generalizado y a la inestabilidad hemodinámica. Gran cantidad de variables pueden ser asociadas al uso de la DCP y la ocurrencia del síndrome de fuga capilar (SFC) y parecen afectar la respuesta del organismo a la DCP, por ejemplo, la composición de la ceba, del perfusato, la concentración de calcio, la hipotermia, los agentes anestésicos, el tiempo de DCP.8 En los niños el síndrome de fuga capilar después de cirugía cardíaca con DCP constituye un importante problema clínico.
Realizamos un estudio prospectivo con el objetivo de identificar los factores preoperatorios y perioperatorios relacionados con el SFC, así como de caracterizar la evolución en cuanto a la duración de la ventilación mecánica, la estadía hospitalaria y la mortalidad.
MÉTODOS
Estudiamos 123 pacientes, con edades comprendidas entre los 10 días y los 16 años, que fueron operados mediante DCP a causa de cardiopatías congénitas y adquiridas (endocarditis bacteriana), en el Servicio de Cirugía Cardiovascular del Hospital Pediátrico Universitario «William Soler» en el 2001. A la llegada a la unidad de cuidados intensivos (UCI) se obtuvieron de todos los pacientes los datos relacionados con las variables siguientes: edad (meses), peso (kg), diagnósticos, tiempo de DCP (minutos), tiempo de clamp aórtico (minutos), temperatura mínima en el salón (°C), volumen de hemoderivados (mL/kg) y volumen de hemofiltración (mL/kg).
Los médicos del servicio definieron a las 48 horas cuáles pacientes habían desarrollado un SFC. La duración de la ventilación mecánica (horas), la estadía hospitalaria (días) y la mortalidad (si existió o no) se recogieron diariamente. La muestra quedó dividida en dos grupos: casos (SFC) y controles (no SFC).
Definimos el síndrome de fuga capilar como el desarrollo de edemas generalizados, ascitis, efusiones pleurales y pericárdicas y un aumento de peso mayor del 10 %, 48 horas después de la cirugía.
Las técnicas de anestesia y derivación cardiopulmonar utilizadas estuvieron acorde con los protocolos del Servicio. Se realizó la premedicación anestésica con ketamina administrada por vía intramuscular (5 mg/kg) y atropina (0,02 mg/kg), también por vía intramuscular. La inducción se realizó con fentanyl (10 µg/kg) y un relajante muscular no despolarizante (RMND), mientras que el mantenimiento se consiguió con isofluorano y fentanyl (10 µg/[kg · h]) y un RMND. Antes de la derivación se administró una dosis de esteroides a todos los niños, que pudo ser prednisona (1 mg/kg), hidrocortisona (10 mg/kg) o betametazona (1 mg/kg), según la disponibilidad.
Los circuitos de circulación extracorpórea (CEC) utilizados fueron una máquina tipo Polystan con bomba de rodillo, un oxigenador de membrana DIDECO pediátrico, cánulas en aorta, venas cavas y vent en cavidades izquierdas, colocado a través de la vena pulmonar derecha superior. Según el tipo de procedimiento se empleó hipotermia entre 25 ºC y 30 ºC y un flujo calculado a 150 mL/(kg · min) para mantener una presión de perfusión de 40 mmHg. Se empleó cardioplegia anterógrada sanguínea oxigenada fría e intermitente a una dosis de 15 mL/kg, a intervalos de 20 minutos durante 3 minutos cada sesión, a una presión entre 30 mmHg y 40 mmHg en la raíz de la aorta y con una concentración de potasio de 20 mEq/L.
Al finalizar la intervención quirúrgica y antes del despinzamiento aórtico, se administró reperfusión caliente sanguínea asistólica con potasio, a una concentración de 10 mEq/L durante 1 minuto, y sin potasio, durante 10 minutos. En todos los casos se realizó hemofiltración arterio-arterial convencional durante el proceso de recalentamiento y luego de terminar la derivación se cambió a modificada arteriovenosa durante 10 minutos.
La ventilación mecánica se mantuvo con una estación de anestesia Primus (Drager) en volumen corriente o tidal programado de 5 mL/kg, una frecuencia de 10/min y una fracción de oxígeno inspirado (FiO2) del 40 %.
Análisis estadístico
Se realizó un análisis univariado para comparar variables en niños con síndrome de fuga capilar y sin él. Para las variables cuantitativas se empleó la prueba de comparación de medias t de Student y la prueba no paramétrica de independencia (chi cuadrado) fue utilizada para comparar variables cualitativas.
Las variables que mostraron diferencias estadísticamente significativas fueron incluidas en un modelo de regresión logística para identificar factores de riesgo independientes. En ambas pruebas se consideró significativo un valor de p < 0,05. El análisis estadístico fue realizado con el programa SPSS (versión 10.1).
RESULTADOS
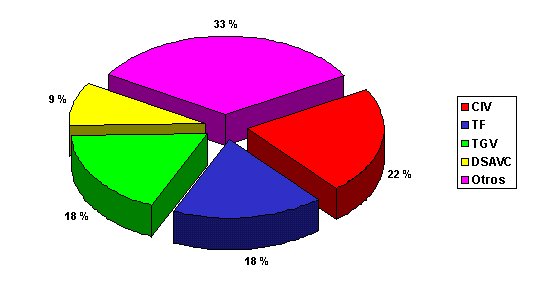
Fueron operados mediante DCP 123 pacientes en total. Se produjo un síndrome de fuga capilar en 22 de estos pacientes, en las primeras 48 horas del postoperatorio (incidencia del 17,89 %). La figura muestra los diagnósticos más frecuentes en el grupo de pacientes que presentó SFC.
Figura. Diagnósticos más frecuentes en los pacientes que presentaron síndrome de fuga capilar.
CIV: comunicación interventricular; TF: tetralogía de Fallot; DSAVC: defecto de septación atrio-ventricular completo.
Fuente: Historias clínicas.
El análisis univariado arrojó resultados que se correlacionaron significativamente con el síndrome de fuga capilar (p < 0,05): la menor edad y temperatura, el mayor tiempo de DCP y de clamp aórtico así como el mayor volumen de hemofiltración (tabla 1).
Tabla 1 . Factores asociados al síndrome de fuga capilar en análisis univariado
| Variables | No SFC | SFC | Valor de p |
| media | media | ||
| Edad (meses) | 61,9 | 26,5 | 0,00 |
| Peso (kg) | 20,7 | 9,5 | 0,05 |
| Tiempo de DDP (min) | 111 | 158 | 0,00 |
| Tiempo de clamp aórtico (min) | 57 | 85 | 0,00 |
| Temperatura mínima ( ºC ) | 27,5 | 24,9 | 0,01 |
| Hemofiltración (mL/kg) | 73,5 | 100 | 0,00 |
| Hemoderivados (mL/kg) | 56 | 95 | 0,09 |
Fuente: Historias clínicas.
No encontramos diferencias significativas en las variables peso (20,7 kg frente a 9,5 kg) y volumen de hemoderivados (73 mL/kg frente a 100 mL/kg) entre los pacientes que presentaron SFC y los que no (p > 0,05). Sin embargo al realizar el análisis de regresión logística (tabla 2), sólo el tiempo de DCP fue identificado como factor de riesgo independiente para el desarrollo de SFC (p < 0,05).
Tabla 2. Análisis multivariado
| Variables | B | Valor de p | Exp. (B) |
| Edad | 0,0096 | 0,66 | 1,00 |
| Tiempo de DCP | 0,0179 | 0,04 | 1,01 |
| Tiempo de clamp aórtico | 0,0008 | 0,94 | 0,99 |
| Temperatura | 0,0977 | 0,37 | 0,90 |
| Hemofiltración | 0,0020 | 0,80 | 0,99 |
Fuente: Historias clínicas.
Los pacientes que presentaron SFC estuvieron durante más tiempo en la ventilación mecánica (259 h frente a 29,9 h), mayor estadía en Cuidados Intensivos (13 d frente a 2 d) y mayor mortalidad (50 % frente al 9,9 %), en comparación con el grupo control (tabla 3).
Tabla 3: Evolución de los pacientes que desarrollaron síndrome de fuga capilar
| Variables | No SFC | SFC | Valor de p |
| Ventilación mecánica (horas) | 29,92 | 258,68 | 0,00 |
| Estadía UCI (días) | 2,6 | 13 | 0,00 |
| Mortalidad (%) | 10 (9,9 %) | 11 (50 %) | 0,00 |
Fuente: Historias clínicas.
DISCUSIÓN
El síndrome de fuga capilar tuvo una incidencia del 17,89 %. Stiller8 encontró una incidencia del 50 % en su estudio, que estuvo limitado a recién nacidos e infantes menores de 1 año.
Los diagnósticos más frecuentes relacionados con el SFC comunicación interventricular (22 %), tetralogía de Fallot (18 %), transposición de grandes vasos (18 %), defecto de septación atrio-ventricular completo (9 %), representaron el 40 % del total de casos operados y se trataron de cirugías correctivas.
Los resultados de este estudio muestran que las variables edad, tiempo de DCP y tiempo de pinzamiento aórtico se correlacionan significativamente con el desarrollo del SFC, lo que confirma los resultados de Stiller8 y Elliot.9 Llama la atención que no encontramos diferencias en el peso corporal al realizar el análisis univariado, aunque esperábamos una fuerte correlación entre la edad y el peso corporal como se observa en personas sanas. Sin embargo, Stiller8 tampoco encontró diferencias en cuanto a peso entre un grupo y otro.
La correlación entre edad y SFC explica la alta incidencia de SFC y fallo multiorgánico descrito en estudios con recién nacidos e infantes pequeños.5,8 La razón de ello parece ser la inmadurez orgánica, de las reacciones de membrana y los sistemas serológicos. El grado de hipotermia estuvo relacionado con el SFC a diferencia de lo reportado por Stiller.8
Los pacientes que recibieron mayores volúmenes de hemofiltración consiste en remover fluidos del organismo durante DCP hasta obtener hematócrito normal presentaron un aumento en la incidencia de SFC. Consideramos que esto se debe al aumento en el tiempo de DCP y al mayor aporte de volumen intraoperatorio. Eising y otros demostraron que la hemofiltración fue ineficaz para mejorar la función cardíaca, atenuar la respuesta inflamatoria de la DCP y disminuir la fuga de proteínas plasmáticas en un modelo de cerdos.10 Sin embargo, en un metaanálisis realizado por Chew que incluyó 24 estudios sobre el empleo de ultrafiltración modificada durante cirugía cardíaca con DCP demuestra una disminución de la morbilidad posoperatoria en cuanto a la reducción de la respuesta inflamatoria sistémica, del sangrado y de los requerimientos de transfusiones, del incremento del gasto cardíaco y la oxigenación, del menor tiempo de ventilación mecánica y de la estadía en UCI.11
Al aplicar la regresión logística, el mayor tiempo de derivación cardiopulmonar fue identificado como un factor de riesgo independiente, similar a lo reportado por Stiller.8 El amplio contacto entre la sangre anticoagulada con heparina y las superficies externas del circuito extracorpóreo durante DCP estimula el sistema inmunitario.12-15 Las citocinas juegan un papel clave en la cascada inflamatoria asociada con la DCP,14,16 por lo que el mayor tiempo de exposición de la sangre a los circuitos extracorpóreos conduce a un incremento de edemas y efusiones posoperatorias.
La evolución del síndrome en cuanto a estadía, duración de la ventilación y mortalidad fue significativamente mayor lo que es de esperar dado la elevada morbilidad y disfunción multiorgánica que lo acompaña. La activación de mediadores de la respuesta inflamatoria, como factor de necrosis tumoral- a (TNF- a ), interleucina (IL)-6 e IL-8 (citocinas proinflamatorias), pueden contribuir a la disfunción miocárdica y aumento de apoptosis,17 a la activación de neutrófilos18 e IL-10, a la depresión inmunitaria19 y al aumento de la susceptibilidad a infecciones.
Finalmente, podemos decir que el síndrome de fuga capilar se desarrolló con mayor frecuencia en pacientes de menor edad, que estuvieron durante más tiempo en circulación extracorpórea y pinzamiento aórtico, menor temperatura y mayor volumen de hemofiltración y que presentaron en el postoperatorio una peor evolución clínica y mayor mortalidad. El tiempo de DCP prolongado fue identificado como un factor de riesgo independiente para la aparición del SFC.
REFERENCIAS BIBLIOGRÁFICAS
1. Westaby S. Aspects of biocompatibility in cardiopulmonary bypass. CRC Crit Rev Biocompatibility. 1987; B: 133-134.
2. Moat NE, Shone DF, Evans TW. Organ Dysfunction and cardiopulmonary bypass: the role of complement regulatory proteins. Eur J Cardiothoracic Surg. 1993, 7:563-573.
3. Greely WJ, Ungerleiden RM. Assessing the effect of cardiopulmonary bypass on the brain. Ann Thorac Surg. 1991, 52:417-419.