Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Pediatría
versión On-line ISSN 1561-3119
Rev Cubana Pediatr v.81 n.2 Ciudad de la Habana abr.-jun. 2009
Valor pronóstico y discriminatorio de la interleucina-6 y la proteína C-reactiva en la meningitis
Interleukin-6 and C-reactive protein and its prognosis and differentiation value in meningitis
Amauri Noda Albelo,I Manuel Araña Rosains,II Arturo Vidal Tallet,III Xiomara Casal Menéndez IV
I Especialista de I Grado en Inmunológica Clínica. Máster en Enfermedades Infecciosas y Tropicales. Instructor. Hospital Pediátrico «Eliseo Noel Caamaño». Matanzas, Cuba.
II Doctor en Ciencias Médicas. Especialista de II Grado en Inmunología. Instituto Nacional de Endocrinología. La Habana, Cuba.
III Especialista de II Grado en Pediatría. Máster en Educación Superior. Profesor Auxiliar. Hospital Pediátrico «Eliseo Noel Caamaño». Matanzas, Cuba.
IV Especialista de II Grado en Microbiología. Asistente. Hospital Pediátrico «Eliseo Noel Caamaño». Matanzas, Cuba.
RESUMEN
INTRODUCCIÓN. La meningitis se caracteriza por una marcada respuesta inflamatoria en el espacio subaracnoideo, que se acompaña de la producción intratecal de múltiples mediadores entre los que se hallan citocinas como el factor de necrosis tumoral alfa, la interleucina-1-beta y la interleucina-6. El objetivo del presente estudio fue estimar la concentración de interleucina-6 (IL-6) y proteína C-reactiva en el líquido cefalorraquídeo y el suero de pacientes con meningitis; determinar la posible relación entre estas concentraciones y la etiología de la meningitis; y precisar si existe asociación entre estas variables y la estadía hospitalaria.
MÉTODOS. Se seleccionó una muestra de 18 pacientes con meningitis: 6 pacientes con diagnóstico de meningitis de etiología bacteriana y 12 pacientes con diagnóstico de meningitis aséptica. A ambos grupos se les realizó cuantificación de IL-6 y proteína C-reactiva en el líquido cefalorraquídeo (LCR) y el suero, además, citología y proteínas en LCR.
RESULTADOS. Las concentraciones de IL-6 en el líquido cefalorraquídeo en la meningitis bacteriana resultaron superiores a las del suero de estos pacientes y a las del LCR y suero de pacientes con meningitis aséptica. La proteína C-reactiva alcanzó cifras superiores en el suero de la meningitis bacteriana. La concentración de IL-6 en líquido se correlacionó directamente con la estadía hospitalaria.
CONCLUSIONES. La concentración de IL-6 en el líquido cefalorraquídeo y de la proteína C-reactiva en el suero puede contribuir a la precisión del diagnóstico diferencial entre meningitis aséptica y bacteriana. La concentración de IL-6 en el LCR permite valorar la envergadura del proceso inflamatorio que tiene lugar en el sistema nervioso central en la meningitis. La concentración de IL-6 selectivamente elevada en el LCR es un marcador de la compartimentalización de la respuesta inflamatoria y un potencial indicador del daño en el sistema nervioso central en la meningitis bacteriana.
Palabras clave: Valor pronóstico, interleucina-6, IL-6, proteína C-reactiva, meningitis.
ABSTRACT
INTRODUCTION: Meningitis is characterized by a marked inflammatory response in subarachnoid space, accompanied by the intrathecal production of many mediators including cytokines as á-tumor necrosis factor, â-interleukin-1 and interleukin-6. The aim of present paper was to estimate the concentration of interleukin-6 and C-reactive protein in the cerebrospinal fluid (CSF), and in serum from meningitis patients; to determine the possible relation among these concentrations, and meningitis etiology, and to set if there is an association among these variables and hospital stay.
METHODS: A sample of 18 patients presenting with meningitis was selected: 6 patients diagnosed with meningitis of bacterial origin and 12 patients diagnosed with aseptic meningitis. In both groups we quantified interleukin-6 and C-reactive protein in CSF and in serum, as well as cytology and proteins in CSF.
RESULTS: Concentrations of interleukin-6 in CSF in bacterial meningitis were higher than those of serum from these patients, and than those of CSF and serum from aseptic meningitis patients. C-reactive protein reached figures higher in bacterial meningitis serum. Interleukin-6 concentration in CSF was directly correlated with hospital stay.
CONCLUSIONS: Interleukin-6 in CSF and of C-reactive protein in serum may to contribute to the accuracy in differential diagnosis between aseptic meningitis and the bacterial one. Interleukin-6 concentration in CSF allows us to assess the significance of inflammatory process in the CNS in meningitis. The selectively high interleukin-6 concentration in CSF is a marker to compartmentalize the inflammatory response, and a potential damage indicator in CNS in bacterial meningitis.
Kew words: Prognostic value, interleukin-6, C-reactive protein, meningitis.
INTRODUCCIÓN
La meningitis se caracteriza por una marcada respuesta inflamatoria en el espacio subaracnoideo, que se acompaña de la producción intratecal de múltiples mediadores, incluidas las citocinas. Existen evidencias sólidas de que las citocinas desempeñan un papel protagónico en la cascada de eventos que conducen al daño neurológico en la meningitis.1,2 Las principales citocinas implicadas en el inicio y mantenimiento de la respuesta inflamatoria en la meningitis son la interleucina 1 (IL-1), la interleucina 6 (IL-6) y el factor de necrosis tumoral alfa (TNFα).3-7 Algunos autores reportan diferencias significativas en cuanto a la concentración de esta última citocina, así como de su receptor soluble en la fase aguda de meningitis de etiología bacteriana y proponen que su concentración en el liquido cefalorraquídeo (LCR) tiene valor discriminatorio.8,9 Otros autores han encontrado diferencias significativas en este mismo sentido en cuanto a las concentraciones de IL-1 e IL-6.10 Se ha informado que los niveles elevados de factor de crecimiento del hepatocito (HGF), otra citocina multifuncional, podría también permitir discriminar entre meningitis bacteriana y aséptica.11
La compleja red regulatoria de citocinas desencadena a su vez la inducción de otro grupo de proteínas que han sido relacionadas con la respuesta temprana del hospedero a la infección, denominadas proteínas de fase aguda. Entre ellas se halla la proteína C- reactiva, una proteína plasmática que se ha vinculado con la gravedad de la infección.12 Sus genes se encuentran bajo control transcripcional fundamentalmente mediado por IL-6 y en menor grado por IL-1β y TNFα.13,14 En el caso de la meningitis, algunos autores han descrito que aunque el aumento de las concentraciones de proteína C-reactiva no es especifico de la meningitis bacteriana, sus niveles séricos pueden ser un indicador de utilidad en el diagnóstico diferencial con la meningitis aséptica.15,16
En conjunto, los factores microbianos, las citocinas y otros mediadores inflamatorios producidos a nivel local y sistémico, que median en gran medida el daño meníngeo de modo directo, así como los profundos cambios en la homeostasis que ellos desencadenan con traducción metabólica, humoral, nutricional y fisiológica, orquestan el cuadro sindrómico individual y favorecen o complican el control de la infección meníngea.
Es de importancia revelar si estos parámetros pueden enriquecer la evaluación clínica tradicional, establecer eventos claves en la fisiopatología de la meningitis o identificar posibles dianas de intervención terapéutica.
MÉTODOS
Se realizó un estudio exploratorio transversal descriptivo. La muestra se seleccionó entre los pacientes que ingresaron en la Unidad de Cuidados Intensivos del Hospital Pediátrico «Juan Manuel Márquez» de La Habana y los que asistieron a la Unidad de Emergencias del Hospital Pediátrico de Matanzas. Se incluyeron los pacientes en los que se constataron los criterios siguientes:
a) Sospecha de infección del sistema nervioso central (SNC) (de acuerdo con los criterios del Programa Nacional de Prevención y Control de Síndromes Neurológicos Infecciosos), debido a:
b) Punción lumbar positiva, según valores de células blancas, proteínas y glucosa en líquido cefalorraquídeo, y teniendo en cuenta los valores de normalidad expresados en el cuadro.
- síndrome meníngeo o encefálico,
- síndrome febril agudo sin localización,
- trastorno inexplicable de la conducta,
- síndrome purpúrico febril,
- convulsión con fiebre,
- síndrome de respuesta inflamatoria sistémica.
Cuadro. Valores de normalidad de parámetros en el líquido cefalorraquídeo de los niños
| Parámetros | Recién nacidos | Lactantes y niños mayores | |
| Pretérmino | A término | ||
| Leucocitos (mm3) | 0-29 | 0-32 | 0-6 |
| Proteínas (mg/dL) | 65-150 | 20-170 | 15-45 |
| Índice glucosa LCR/sangre (%) | 55-105 | 44-248 | 60-90 |
| Glucosa (mg/dL) | 24-63 | 24-119 | 40-80 |
LCR: Líquido cefalorraquídeo.
De acuerdo con el diagnóstico se constituyeron dos grupos: pacientes con meningitis bacteriana y pacientes con meningitis aséptica.
La meningitis bacteriana se identificó por: 1) la presencia de cultivo positivo del líquido cefalorraquídeo; 2) la presencia de estructuras bacterianas identificadas por la tinción de Gram; y 3) cultivo positivo de sangre periférica, asociado a hallazgos anormales en LCR, en cuanto a estudio citológico, niveles de glucosa y proteínas.
Los pacientes que presentaron alteraciones en los niveles de glucosa, proteínas y el conteo celular del LCR, pero en los que no se pudo demostrar la presencia de bacterias en LCR o sangre periférica, se consideraron afectos de meningitis aséptica.
Obtención de los especímenes de sangre periférica y líquido cefalorraquídeo. Las muestras de sangre periférica y LCR se obtuvieron de los pacientes en el momento del ingreso. La extracción de sangre se realizó por punción venosa; se extrajeron 2,5 mL de sangre en tubo seco de 13 x 100 mm y se procedió a su centrifugación. El LCR se obtuvo por punción lumbar. Se realizó estudio citoquímico de forma inmediata. La determinación de la concentración de glucosa en el suero y el LCR se realizó por el método de la glucosa oxidasa.17 Los niveles de proteínas en el LCR se determinaron utilizando el método turbidimétrico basado en la precipitación de proteínas con ácido sufosalisílico. Una vez realizadas estas determinaciones inmediatas, se separaron alícuotas de ambos especímenes y se almacenaron a -20 oC.
Ensayo para cuantificación de IL-6 humana. Se determinó la concentración de IL6 en el LCR y el suero con el uso de un ensayo tipo ELISA que utiliza como anticuerpo de captura un monoclonal específico para IL-6 humana (5E1) y como segundo anticuerpo, un policlonal de conejo anti-IL6 humana conjugado a biotina. Las placas de 96 pozos (Costar, EE.UU.) se recubrieron con el anticuerpo 5E1 (0,5 µg/mL) diluido en solución salina tamponada con fosfatos (PBS), por incubación durante 16 h a 4 oC en cámara húmeda. Luego, se decantó el contenido de las placas, se adicionaron 0,125 mL/pozo de PBS con albúmina de suero bovino (ASB) al 1 % y se incubó por 1 h a temperatura ambiente (TA). Al término de esta incubación, las placas se lavaron 3 veces con solución de lavado (Tween 20 al 0,1 % en agua destilada). Posteriormente, se adicionaron las muestras y la curva patrón de IL-6 humana (5 pg/mL a 5 ng/mL), obtenida por dilución seriada 1:2 en PBS con plasma humano normal (PHN) al 0,1 %. Las placas se incubaron por 2 h a TA, se decantó su contenido y se lavaron 5 veces con solución de lavado. Después, se adicionó a las placas el antisuero de conejo anti-IL6 biotinilado, diluido 1:2000 en PBS con ASB al 0,1%. La incubación procedió por 1 h a TA; la placa se lavó 5 veces con solución de lavado y se añadió a cada pocillo 0,1 mL de una dilución 1:4000 de estreptavidina-peroxidasa en PBS con ASB al 0,1 %. Las placas se incubaron nuevamente por 1 h a TA, luego se lavaron 5 veces y se adicionó la solución de sustrato (tampón citrato-fosfato 0,05 M pH 5,5, dihidrocloruro de 3,3',3,5'-tetrametilbencidina [TMB] al 0,01 %, peróxido de hidrogeno al 0,025 %). Después de 15 min de incubación, se detuvo la reacción al añadir 0,1 mL de ácido sulfúrico 1 M. La absorbancia se determinó por espectrofotometría a 450 nm en un lector de placas.
Ensayo para la determinación de proteína C- reactiva. Para la cuantificación de la proteína C-reactiva en los líquidos biológicos se utilizó el juego diagnóstico suministrado por Dako (EE.UU.). Se procedió de acuerdo con las especificaciones del fabricante. Brevemente: se adicionan 0,011 mL de la muestra o de la curva patrón (4,8 a 160 mg/L) en una placa de 96 pocillos y se diluyen por adición de 0,012 mL de PBS; se añaden 0,175 mL de amortiguador de reacción núm. 4 y se incuba por 120 min. Se añaden 0,019 mL del anticuerpo antiproteína C-reactiva humana y 0,032 mL de PBS; se incuba por 5 h a TA y se mide la absorbancia a 405 nm. Los resultados se expresan en mg/L de proteína C-reactiva.
Análisis estadístico. Los datos obtenidos fueron recolectados en una planilla diseñada con este propósito. En todos los casos se obtuvo y documentó la aprobación por parte de los padres o el tutor para incluir a los pacientes en el ensayo.
Para el análisis de los datos se utilizó el paquete estadístico SPSS para Windows 10.0.5 (SPSS Inc., EE.UU.). Inicialmente, se determinó si los datos experimentales cumplían con los supuestos de normalidad y homogeneidad de varianzas, con el empleo de las pruebas de Shapiro-Wilk y Levene, respectivamente. Cuando no se cumplió el supuesto de normalidad se empleó la prueba U de Mann-Whitney para evaluar probar la hipótesis de igualdad entre los rangos medios de los grupos.
La variable estadía hospitalaria se categorizó en función de valores mayores o menores que la mediana y se construyó la tabla de clasificación cruzada con la prueba de independencia asociada (prueba exacta de Fisher).
Con el propósito de establecer el grado de asociación entre las variables estadía hospitalaria, índice de glucosa o conteo de leucocitos, y las variables independientes (IL-6 y proteína C-reactiva), los datos experimentales se ajustaron a distintos modelos de regresión lineal múltiple con el uso de los distintos predictores. En los casos de las variables estadía hospitalaria y conteo de leucocitos, para garantizar el supuesto de aproximación por una distribución normal se utilizó el logaritmo natural de la variable dependiente.
RESULTADOS
En la presente investigación se incluyeron 18 pacientes, 6 con meningitis bacteriana y 12 con meningitis aséptica. El 72,2 % de los pacientes estudiados fueron del sexo masculino y el rango de edad en el total de la muestra fue de 2 meses a 6 años, con una mediana de 15 meses en los afectos de meningitis bacteriana y de 18 meses en los pacientes con meningitis aséptica (p > 0,05).
En los pacientes con meningitis bacteriana el germen aislado con mayor frecuencia fue el S. pneumoniae (4/6 pacientes; 66,7 %). En los otros dos pacientes se aislaron E. coli y Salmonella paratífica, respectivamente.
Evaluación de las concentraciones de IL6 y PCR asociadas a la respuesta inflamatoria en fluidos biológicos de pacientes con meningitis bacteriana y aséptica
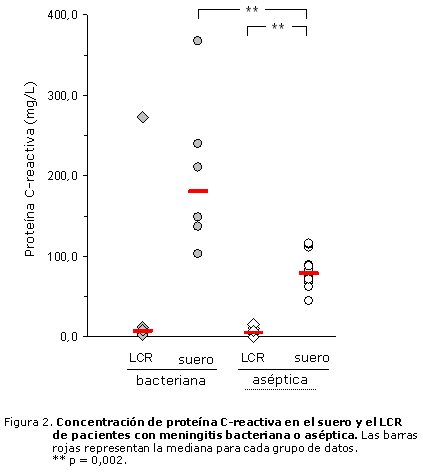
La tabla I recoge los resultados obtenidos en la cuantificación de los niveles de IL-6 y PCR en el LCR y el suero de los pacientes con meningitis bacteriana o aséptica.
Tabla 1. Concentración de IL-6 y PCR en el LCR y el suero de pacientes
con meningitis aséptica y bacteriana *
| Variables | Meningitis aséptica | Meningitis bacteriana | ||
| LCR | Suero | LCR | Suero | |
| IL6 | 0,053 ± 0,02¶ | 0,057 ± 0,007 | 0,233 ± 0,48d,¶ | 0,059 ± 0,01d |
| PCR | 4,88 ± 3,05b | 78,3 ± 37,7b,§ | 7,11 ± 74,2 | 179,6 ± 143,3§ |
* Se presentan la mediana ± rango de quartiles (r.q.).
Diferencias significativas (p < 0,05): prueba de Wilcoxon para datos pareados, bp = 0,002,
dp = 0,046; prueba de la U de Mann-Whitney, ¶p = 0,031, §p = 0,002
En los pacientes con meningitis bacteriana se encontró una diferencia significativa en la concentración de IL-6 entre el LCR y el suero (p = 0,046). Los niveles de esta citocina en estos pacientes fueron superiores en el LCR; la mediana de la concentración de IL-6 en el LCR fue de 0,23 ng/mL, mientras que en el suero fue de 0,059 ng/mL (figura 1). Esta diferencia no se observó en los pacientes con meningitis aséptica, donde la concentración de IL-6 fue en general similar en el LCR y el suero. Asimismo, los niveles séricos de esta citocina fueron semejantes en pacientes con meningitis bacteriana y aséptica, pero la concentración en LCR difirió de modo significativo en relación con el tipo de meningitis (p = 0,031), con valores más altos en los pacientes con meningitis bacteriana (figura 1).

Aunque, en general, la concentración de proteína C-reactiva fue también mayor en el suero que en el LCR en ambos tipos de meningitis (tabla 1), esta diferencia solo alcanzó significación estadística en los pacientes con meningitis aséptica. Como se observa en la figura 2, mientras que todos los pacientes con meningitis bacteriana tuvieron niveles séricos de proteína C-reactiva superiores a 100 mg/L, solo uno de estos pacientes mostró un nivel de proteína C-reactiva en el LCR superior a 15 mg/L (272,1 mg/L). Vale destacar que, entre los niños incluidos en este estudio, este mismo paciente presentó los mayores niveles de IL-6 en LCR (1,3 ng/mL) y el mayor conteo citológico (3000 células/mL). Por otra parte, se encontró una diferencia significativa en la concentración de proteína C-reactiva en el suero entre pacientes con meningitis bacteriana y aséptica. En la primera, la mediana de la concentración fue 179,6 mg/L, mientras que en la aséptica fue de 78,3 mg/L. Los niveles de esta proteína de fase aguda en el LCR no difirieron entre ambos grupos de pacientes.
Relación entre las variables estudiadas, los criterios citoquímicos utilizados en el diagnostico diferencial de la meningitis y la estadía hospitalaria
La estadía hospitalaria fue significativamente superior en el caso de los pacientes con meningitis bacteriana, quienes tuvieron una estadía promedio de 16,0 ± 4,8 días a diferencia de los pacientes con meningitis aséptica cuya estadía media fue de 7,9 ± 3,2 días (p = 0,004). En la meningitis bacteriana la estadía hospitalaria fue superior a los 10 días en todos los pacientes, mientras que solo en el 25 % de los casos (3/12) de meningitis aséptica la estadía se extendió más allá de los 10 días (Tabla IV).
Tabla 2. Relación entre la estadía hospitalaria y el tipo de meningitis
| Estadía | Meningitis aséptica | Meningitis bacteriana |
| < 10 días | 9 (75 %) | 0 (0 %) |
| > 10 días | 3 (25 %) | 6 (100 %) |
Prueba exacta de Fisher: p = 0,009
Con el propósito de estimar la asociación entre la estadía hospitalaria y la concentración de los mediadores y metabolitos estudiados se ajustaron sendos modelos de regresión lineal para los niveles en el suero y en el LCR en pacientes con meningitis aséptica. Debido a los pocos casos incluidos con meningitis bacteriana, no fue posible el ajuste adecuado de un modelo lineal con el objetivo de evaluar la asociación entre estas variables en estos pacientes.
El modelo de regresión lineal que utilizó como predictores la concentración en el LCR de todas las variables estudiadas, mostró un ajuste adecuado (R2 = 0,791; p = 0,047) y resultaron relevantes los niveles de IL-6 (p = 0,026). En el caso del suero no se alcanzó una bondad de ajuste satisfactoria para el modelo de regresión lineal con el empleo de las variables estudiadas en su conjunto (p = 0,093).
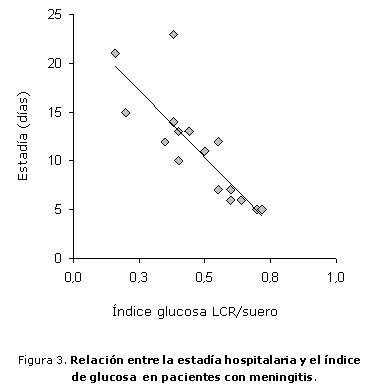
La estimación de la asociación entre la estadía hospitalaria y las variables citoquímicas utilizadas para el diagnóstico de la meningitis mostró una correlación significativa inversa entre la estadía y el índice de glucosa (R = -0,893; p < 0,001; [figura 3]). Asimismo, la valoración del grado de relación entre la estadía hospitalaria y el conteo de células en el LCR en la punción diagnóstica evidenció una asociación significativa positiva (R = 0,848; p < 0,001).
Con el propósito de valorar la asociación entre las variables inflamatorias estudiadas y las variables citoquímicas utilizadas para el diagnóstico de la meningitis aséptica, se ajustaron también modelos de regresión lineal. Se logró evidenciar una asociación relevante (R2 = 0,83; p = 0,001) entre el índice de glucosa y los niveles séricos de la proteína C-reactiva.
DISCUSIÓN
Antes de la introducción de los antibióticos, la meningitis aguda bacteriana resultaba fatal en la mayoría de los casos. El uso de la terapia antimicrobiana redujo en gran medida la mortalidad asociada a esta enfermedad, pero en la actualidad, a pesar del uso de antibióticos de amplio espectro y de tecnologías sofisticadas de apoyo vital, la mortalidad y la morbilidad por meningitis permanecen inaceptablemente altas.18
Durante los últimos años, estudios en modelos experimentales han incrementado sustancialmente el conocimiento relacionado con los complejos mecanismos fisiopatológicos que resultan de la interacción entre gérmenes, células inflamatorias y su entrada en el SNC, así como sobre los mecanismos de disfunción cerebral durante la meningitis aguda. Existen en la actualidad evidencias sólidas de que la citocinas, quimiocinas, agentes oxidantes y enzimas proteolíticas desempeñan un papel protagónico en la cascada de eventos que conducen al daño neurológico en la meningitis,19 lo que explica por qué la eficaz erradicación del germen con el uso de antibióticos competentes no necesariamente conduce a la recuperación de la enfermedad.
El presente trabajo se describe el comportamiento de la IL-6, un importante mediador implicado en la respuesta inflamatoria orquestada en el proceso meningitis, y en este mismo sentido se analiza la PCR.
La IL-6 fue una de las variables seleccionadas por ser una de las citocinas mas importantes implicadas en la meningitis, que desempeña un papel primario en los mecanismos de daño tisular y modulación de la respuesta inflamatoria,20,21 y además por ser esta una de las citocinas de mayor vida media en los fluidos biológicos.22 Nuestros resultados mostraron que este mediador alcanza concentraciones significativamente superiores en el LCR de pacientes con meningitis bacteriana, lo que concuerda con lo informado por otros autores.23,24 Esto es válido cuando se comparan los niveles de IL-6 en el LCR con la concentración en suero de esta citocina en estos pacientes, así como cuando la comparación se establece con los niveles de IL-6 en el LCR de los pacientes con meningitis aséptica.
Teniendo en cuenta estas observaciones, la IL-6 dosificada en LCR podría ser una variable discriminatoria en la meningitis. Además, según los resultados de esta investigación, los niveles de la IL-6 en el LCR son un indicador de actividad inflamatoria compartimentalizada en la meningitis, y su presencia en altas concentraciones en el LCR indica una mayor envergadura de la respuesta inflamatoria en la meningitis bacteriana, si se considera que los niveles de IL-6 se correlacionan directamente con la envergadura de la respuesta inflamatoria.25 Esta última explicación también justificaría, al menos de forma parcial, la relevancia de los niveles de esta citocina en el LCR para la estadía hospitalaria en la meningitis aséptica. Esta asociación se valoró solo para el caso de las meningitis asépticas, pues el número reducido de pacientes con meningitis bacteriana incluidos imposibilitó el ajuste adecuado de un modelo de regresión lineal para analizar esta asociación. La concentración de IL-6 no se correlacionó significativamente con la presencia de células pro-inflamatorias en el LCR. Algunos autores han informado resultados similares,26,27 y otros, resultados contrarios a los nuestros.28 Estas aparentes contradicciones podrían estar determinadas por el momento en que se toma la muestra, la producción local de este mediador, la heterogeneidad de los gérmenes implicados en la meningitis aséptica y las diferencias genéticas de los individuos incluidos en el estudio.26
La glucosa es el principal metabolito energético cerebral y el lactato constituye el más importante marcador neuroquímico de metabolismo anaeróbico. En condiciones fisiológicas existe un acople metabólico energético entre astrocitos y neuronas. Esta unidad metabólica tiene importantes consecuencias para el metabolismo tisular; un incremento en la actividad neuronal conduce a un incremento en la actividad glicolítica del astrocito, el cual libera lactato al espacio extracelular, y este en condiciones de aerobiosis es utilizado por las neuronas. De esta manera los astrocitos compensan el incremento de la actividad neuronal y en condiciones fisiológicas esta actividad compensadora no se acompaña de incremento del lactato extracelular ni de depleción de glucosa.29 En condiciones patológicas tales como la hipoxia, uno de los mecanismos mas importantes de daño neuronal en la meningitis bacteriana,30 existen modificaciones del metabolismo energético cerebral caracterizadas por incremento de la glicólisis anaeróbica y disminución de la eficacia del metabolismo aeróbico vía el ciclo del ácido tricarboxílico.31,32 En estas condiciones, los astrocitos continúan produciendo lactato, incluso hasta que agotan sus propias reservas energéticas; las neuronas no pueden utilizar el lactato y también comienzan a utilizar la glucosa en la producción energética, por lo tanto ambos utilizan glucosa y liberan lactato al medio extracelular. En conclusión, el metabolismo energético cerebral anaeróbico se acompaña de disminución de la concentración de glucosa extracelular e incremento de los niveles de lactato.33 Por otra parte, existe un incremento del lactato que no puede ser explicado por el evento hipóxico, lo cual podría indicar la puesta en marcha de un mecanismo denominado hiperglicólisis.33 Aunque las bases bioquímicas de este evento no están claras, se han invocado mecanismos tales como la disfunción mitocondrial y la glicólisis inducida por glutamato en los astrositos.34 Ambos eventos tienen lugar en la meningitis.19,22
En relación con lo anterior se encontró que el índice de glucosa se correlaciona negativamente con la estadía hospitalaria, lo que parece resultar de la mencionada relación existente entre inflamación en el SNC, alteración metabólica y disminución de la glucosa en el LCR.
La proteína C-reactiva es una proteína plasmática, cuya síntesis en el tejido hepático se regula a nivel de la trascripción, control que es efectuado fundamentalmente por citocinas proinflamatorias.35 Su producción se incrementa en más de 1000 veces en procesos que transcurren con inflamación y daño tisular.36 Este incremento ocurre en las primeras 24 después de iniciada la inflamación, lo que sugiere que esta proteína está asociada con el inicio y modulación de múltiples mecanismos implicados en dicho proceso.37 En particular, la proteína C-reactiva tiene funciones proinflamatorias como la opsonización de bacterias, reconociendo como ligando residuos de fosfocolina; activa el complemento, favorece la fagocitosis y además se ha reconocido su capacidad de inducir la síntesis de citocinas proinflamatorias por los monolitos.38 A pesar de estas propiedades proinflamatorias, el efecto neto de esta proteína es antiinflamatorio por su habilidad de reducir la adhesión de neutrófilos al endotelio mediante la inhibición de la expresión de L-selectina,37 de inhibir la generación de superóxido por los neutrófilos y de estimular la síntesis del antagonista del receptor de IL-1 (IL1ra) por células mononucleares. De manera general, la magnitud de la respuesta de la proteína C-reactiva está relacionada con la intensidad y la extensión de la inflamación,37 por lo cual la proteína C-reactiva es una herramienta clínica útil en el diagnóstico y manejo de entidades que evolucionan con inflamación.39 El estudio realizado muestra concentraciones significativamente superiores de proteína C-reactiva en el suero en ambos tipos de meningitis, pero cuando se compara la concentración de esta proteína en el suero entre ambos grupos de pacientes, se demuestra que los niveles son significativamente mayores en la meningitis bacteriana. Estos resultados se corresponden con los publicados por otros autores.40,41 De esta manera, la cuantificación de la proteína C-reactiva en el suero puede contribuir al diagnóstico etiológico diferencial en la meningitis.
Los resultados de la presente investigación corroboran que la estadía hospitalaria de los paciente con meningitis bacteriana es más prolongada que en los casos con meningitis aséptica, hecho que se relaciona con la envergadura de la inflamación en el SNC y el daño tisular, como indican la mayor concentración de IL-6 en el LCR de los pacientes con infección de origen bacteriano. Por último, este estudio confirma que la demostración temprana de una importante respuesta de fase aguda, a partir de la cuantificación de la proteína C-reactiva en el suero, puede ser un elemento coadyuvante al diagnóstico de la meningitis bacteriana.
REFERENCIAS BIBLIOGRÁFICAS
1. Sato M, Hosoya M, Honzumi K. Cytokine and cellular inflammatory sequence in enteroviral meningitis. Pediatrics. 2003;112(5):1103-7.
2. Møller K, Tofteng F, Qvist T. Cerebral output of cytokines in patients with pneumococcal meningitis. Crit Care Med. 2005;33(5):979-83.
3. Pancewicz SA. Concentrations of pro-inflammatory cytokines IFN-gamma, IL-6, IL-12 and IL-15 in serum and cerebrospinal fluid in patients with neuroborreliosis undergoing antibiotic treatment. Pol Merkur Lekarski. 2007;22(130): 275-9.
4. Krebs VLJ, Okay TS, Okay Y, Vaz FAC. Tumor necrosis factor alpha, interleukin-1 and interleukin-6 in the cerebrospinal fluid of newborn with meningitis. Arq Neuropsiquiatr. 2005;63(1):7-13.
5. Zajkowska J, Grygorczuk S, Pryszmont JM, Kondrusik M. Concentration of interleukin 6 and 10 in tick-borne and purulend encephalomeningitis. Pol Merkur Lekarski. 2006;21(121):29-34.
6. Farah R, Freidzon L, Sela S. Expression of inflammatory mediators in meningitis. Harefuah. 2007;146(6):410-3,504.
7. Beckman JS. Why pus is bad for the brain. Neurology 2001;58(2):330-5.
8. Mukai AO, Krebs VLJ, Bertoli CJ, Okay TS. TNF-alpha and IL-6 in the diagnosis of bacterial and aseptic meningitis inchildren. Pediatr Neurol. 2006 ;34:25-9.
9. Taskin E, Turgut M, Kilic M. Serum procalcitonin and cerebrospinal fluid cytokines level in children with meningitis. Mediators Inflamm. 2004;13(4):269-73.
10. Dulkerian SJ, Kilpatrick L, Costarino AT, McCawley L, Fein J, Corcoran L, et al. Cytokine elevations in infants with bacterial and aseptic meningitis. Journal of Pediatrics 1995;126(6):872-6.
11. Sy C, Tsai H, Wann S. Cerebrospinal fluid hepatocyte growth factor level in meningitis Microbiol Immunol Infect. 2008;41(4):301-6.
12. Saez-Llorens X, Vargas S, Guerra F, Coronado L. Application of new sepsis definitions to evaluate outcome of pediatric patients with severe systemic infections. Pediatr Infect. Dis. J. 1995;14:557-61.
13. Huntley JS, Nelly MB. C-reactive protein: a valuable acute investigation. A case of pneumococcal meningitis presenting as ankle pain Emergency Medicine Journal. 2005;22:602-3.
14. Pepys MB, Hirschfield GM. C-reactive protein: a critical update. J Clin Invest. 2003;111:1805-12.
15. Simon L, Gauvin F, Amre DK. Serum procalcitonin and C-reactive protein levels as markers of bacterial infection: a systematic review and meta-analysis. Clin Infect Dis 2004;39:206- 17.
16. Boutoille D, Arthaud M, Trystram D. Accuracy of the cerebrospinal fluid results to differentiate bacterial from non bacterial meningitis, in case of negative gram-stained smear. American Journal of Emergency Medicine. 2007;25:179-84.
17. Fischbach F. Chemistry studies. En: Fischbach F, Intenzo D, editors. A manual of laboratory diagnostic tests. 4ta. Ed. Philadelpfia: Lippincott Company; 1992. pp.296-99.
18. Hoffmann O, Priller J, Prozorovski T. TRAIL limits excessive host immune responses in bacterial meningitis, J. Clin. Invest. 2007;117(7):2004-13.
19. Koedel U, Schold WM, Pfister HW. Pathophisiology of pneumococcal meningitis. The Lancet Infectious Diceases 2002;2(12) 230-9.
20. Kaplin AI, Deshpande DM, Scott E. IL-6 induces regionally selective spinal cord injury in patients with the neuroinflammatory disorder transverse myelitis. J. Clin. Invest. 2005;115(10):2731-41.
21. Teti G, Mancuso G, Tomasello F, Chiofalo MS. Production of tumor necrosis factor-alpha and interleukin-6 in mice infected with group B streptococci. Circ SOC. 1992;38:138-44.
22. Leib SL, Tauber MG. Pathogenesis of bacterial meningitis. Infectious Disease Clinics of North America. 1999;13(3):527-48.
23. Fida NM, Al-Mughales J, Farouq M. Interleukin-1alpha, interleukin-6 and tumor necrosis factor-alpha levels in children with sepsis and meningitis. Pediatr Int. 2006;48(2):118-24.
24. Aiba H, Mochizuki M, Kimura M, Hojo H. Predictive value of serum interleukin-6 level in influenza virus-associated encephalopathy. Neurology 2001;57:295-9.
25. Paul R, Koedel U, Winkler F. Lack of IL-6 augments inflammatory response but decreases vascular permeability in bacterial meningitis. Brain 2003;126:1873-82.
26. Dalal I, Tzhori S, Somekh E, Mandelberg A, Levin A, Ballin A. Cytokine profile in cerebrospinal fluid of children with echovirus type 4 meningitis. Pediatric Neurology. 2003;29(4):301-9.
27. Dulkerian SJ, Kilpatrick L, Costarino Jr AT. Cytokine elevations in infants with bacterial and aseptic meningitis. J Pediatr. 1995;126:872-6.
28. Azuma H, Tsuda N, Sasaki K. Clinical significance of cytokine measurement for detection of meningitis. J Pediatr 1997;131:463-5.
29. Goodman JC, Valadka AB, Gopinath SP, Uzura M, Robertson CS. Extracellular lactate and glucose alterations in the brain after head injury measured by microdialysis. Critical Care Medicine 1999;27(9):1965-73.
30. Chaudhuri A. Adjunctive dexamethasone treatment in acute bacterial meningitis. The Lancet Neurology 2004;3(1):542-7.
31. Van de Beek D, de Gans J, McIntyre P, Prasad K. Corticosteroids in acute bacterial meningitis (Cochrane Review). In The Cochrane Library, Issue 3, 2003. Oxford: Update Software.
32. Kastenbauer S, Pfister HW. Pneumococcal meningitis in adults: spectrum of complications and prognostic factors in a series of 87 cases. Brain 2003;126:1015-25.
33. Goodman JC, Valadka AB, Gopinath SP, Uzura M, Robertson CS. Extracellular lactate and glucose alterations in the brain after head injury measured by microdialysis. Critical Care Medicine 1999;27(9):1965-73.
34. Bergsneider M, Hovda DA, Shalmon E. Cerebral hyperglycolysis following severe traumatic brain injury in humans: A positron emission tomography study. J Neurosurg 1997;86:241-51.
35. Chaudhuri A. Adjunctive dexamethasone treatment in acute bacterial meningitis. The Lancet Neurology 2004;3(1):501-9.
36. Deutschman CS. Acute-phase responses and SIRS/MODS: the good, the bad, and the nebulous. Critical Care Medicine. 1998;26(10):401-7.
37. Zouki Ch, Beauchamp M, Baron Ch, Filep JG. Prevention of In Vitro Neutrophil Adhesion to Endothelial Cells through Shedding of L-Selectin by C-Reactive Protein and Peptides Derived from C-Reactive Protein. J. Clin. Invest. 1997;100(3):522-9.
38. Kim PK, Deutschman CS. Inflammatory responses and mediators. Surgical Clinics of North America 2000;80(3):701-9.
39. Gabay C, Kushne I. Acute-Phase Proteins and Other Systemic Responses to Inflammation. N Engl J Med 1999;340(6):448-54.
40. Tatara R, Imai H. Serum C-reactive protein in the differential diagnosis of childhood meningitis. Pediatr Int. 2000;42(5):541-6.
41. Prasad C, Nair B M, Kalghatgi L, Childhood bacterial meningitis and usefulness of C-reactive protein. MJAFI 2005;61(1):13-15.
Recibido: 26 de marzo de 2009.
Aprobado: 3 de abril de 2009.
Amauri Noda Albelo. Hospital Pediátrico «Eliseo Noel Caamaño». Santa Isabel y América. Matanzas, Cuba.
Correos electrónicos: amauryn.mtz@infomed.sld.cu y avidalta.mtz@infomed.sld.cu














