Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Pediatría
versión impresa ISSN 0034-7531
Rev Cubana Pediatr vol.83 no.3 Ciudad de la Habana jul.-set. 2011
ARTÍCULOS DE REVISIÓN
Streptococcus pneumoniae, mecanismos de resistencia antimicrobiana
Streptococcus pneumoniae, mechanisms of antimicrobial resistance
Amauri Noda Albelo,I Lázaro Arturo Vidal Tallet,II Joan Iavier Vidal Tallet,III Leanet Hernández ÁlvarezIV
IEspecialista de I Grado en Inmunología Clínica. Máster en Infectología y Enfermedades Tropicales, y en Atención Integral al Niño. Asistente de Pediatría. Hospital Pediátrico "Eliseo Noel Caamaño". Matanzas, Cuba.
IIEspecialista de II Grado en Pediatría. Máster en Ciencias de la Educación Superior y en Enfermedades Infecciosas. Profesor Auxiliar y Consultante. Hospital Pediátrico "Eliseo Noel Caamaño". Matanzas, Cuba.
IIIEspecialista de I Grado en Medicina General Integral. Máster en Urgencias Médicas. Hospital Pediátrico "Eliseo Noel Caamaño". Matanzas, Cuba.
IVEspecialista de I Grado en Medicina General Integral. Hospital Militar "Mario Muñoz". Matanzas, Cuba.
RESUMEN
El Streptococcus pneumoniae, principal agente causal de la neumonía comunitaria, líder en la etiología de la otitis media y la meningitis, en las últimas 3 décadas ha incrementado, de manera importante, su resistencia a los agentes terapéuticos más utilizados, como los betalactámicos, macrólidos, azálidos y fluroquinolonas. La versatilidad adaptativa del microorganismo le ha permitido crear mecanismos capaces de sobreponerse a cualquiera de estas agresiones terapéuticas con un grado variable de eficacia. Se realiza una revisión de los mecanismos más importantes implicados en la adquisición de resistencia antimicrobiana por S. pneumoniae, y se precisan algunos de los factores de riesgo implicados en infección por S. pneumoniae resistente.
Palabras clave: streptococcus pneumoniae, mecanismos de resistencia antimicrobiana, betalactámicos, macrólidos, fluroquinolonas, neumococo.
ABSTRACT
The Streptococcus pneumoniae, the main causal agent of community pneumonia, leader in the etiology of the otitis media and the meningitis, during the past three decades has increase in a significant way its resistance to the more used therapeutic agents including the beta-lactamase, macrolides, azalides and fluroquinolones. Adaptive versatility of the microorganism allows it to create mechanisms able to overcome to any of these therapeutical aggressions with a variable degree of effectiveness. Authors made a review of the more important mechanisms involved in acquisition of the antimicrobial resistance by S. pneumoniae and some of risk factors involved in the infection due to resistant S. pneumoniae are specified.
Key words: strepcoccus pneumoniae, mechanisms of antimicrobial resistance, macrolides, fluroquinolones, pneumococcus.
INTRODUCCIÓN
El Streptococcus pneumoniae fue identificado en 1881, en el año 1926 se le asigna el nombre de Diplococcus pneumoniae,1-6 pero la denominación actual, Streptococcus pneumoniae, se le otorgó en el año 1976.1 Sus características de tinción con la técnica de Gram lo clasifican como un germen Gram positivo, produce una toxina llamada neumolisina (alfa hemolisina) que metaboliza la hemoglobina hasta un pigmento verdoso, que permite clasificarlo dentro de los estreptococos alfa hemolíticos.4,5 Streptococcus pneumoniae es reconocido como agente etiológico líder en neumonía, meningitis, sinusitis y otitis media;1-3 con menos frecuencia es el agente causal de la endocarditis, la artritis séptica, la peritonitis, y de manera infrecuente, otras enfermedades infecciosas. Se reportan anualmente 1,6 millones de casos fatales debido a este agente etiológico.2 Se reconocen 91 serotipos de Streptococcus pneumoniae según el sistema americano, y se agrupa en 46 serogrupos en el sistema dinamarqués.1
En las últimas 3 décadas la resistencia antimicrobiana del Streptococcus pneumoniae ha escalado dramáticamente a nivel mundial. En 1943 se describen las primeras clonas resistentes a sulfamidas, y la reducción de susceptibilidad a la penicilina es reconocida por primera vez en Australia en 1967. En el año 1975 ocurre un brote epidémico por clonas resistentes a la penicilina en Johannesburgo,7 a principios de la década de 1980 se disemina la resistencia en Europa y Asia, mientras que el continente americano es afectado a finales de esta década y principios de la década de los 90.8 La resistencia a macrólidos, y a otras clases de antimicrobianos, se incrementa en asociación con la resistencia a penicilina. Seis clonas internacionales son responsables de más del 80 % de los aislamientos resistentes (serotipos 6A, 6B, 9V, 14, 19F, 23F).9,10
DESARROLLO
Patogénesis
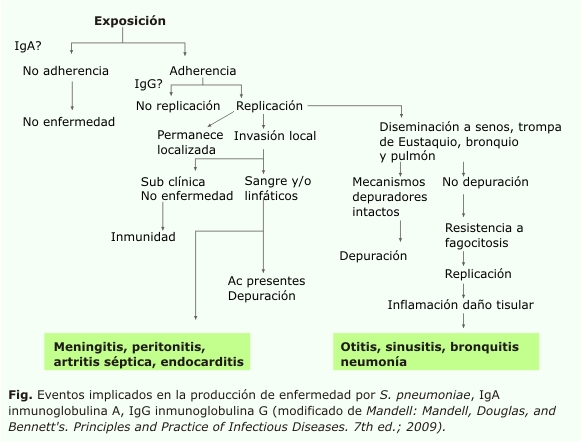
La transmisión del germen ocurre por contacto estrecho de un individuo a otro. El proceso de colonización y el desarrollo de enfermedad dependen de múltiples factores que implican al microorganismo y el hospedero.9 El S. pneumoniae debe ser capaz de adherirse y colonizar, y una vez que esto ocurre, puede replicarse localmente o diseminarse por contigüidad a senos paranasales, trompa de Eustaquio, bronquios y alveólos, provocando neumonía, sinusitis, otitis media y bronquitis; o puede invadir el torrente sanguíneo o linfático, para causar meningitis, peritonitis, artritis séptica o endocarditis. La posibilidad de ocurrir cualquiera de estos eventos, lo determina la solución dada a la compleja interrelación germen/hospedero. Depende del hospedero: la competencia inmune, la integridad de las barreras de resistencia y el estado de funcionalidad de sus sistemas depuradores (figura); a esta interacción aporta el microorganismo la presencia en él de determinados factores de virulencia, destacándose la cápsula, la toxina neumolisina, la neuraminidasa, las glicoproteínas y las adhesinas de la pared celular, que ayudan a evadir los sistemas de protección del individuo y desencadenan potente respuesta inflamatoria, al interactuar con determinados receptores de patogénicos en la células del hospedero. El Streptococcus pneumoniae, a diferencia de otros gérmenes como el estafilicoco, no se caracteriza por la producción de toxinas, de manera que la enfermedad es determinada por la respuesta inflamatoria, independientemente del sitio de infección.9
Mecanismos de resistencia
Los principios terapéuticos en la infección por S. pneumoniae no difieren de los aplicados en infecciones por otros gérmenes. Estos principios son:
- El antimicrobiano indicado debe lograr en el sitio de infección las concentraciones necesarias para inhibir o destruir el microorganismo.
- Se deben evacuar los espacios cerrados si es necesario.
- Continuar el tratamiento, al menos, hasta que el huésped sea capaz de completar la recuperación.
- El terapeuta debe conocer la respuesta, de ser efectivo el tratamiento.
- Estar preparados para revaluar si la respuesta no es la esperada.
Cuando el primer principio no se cumple, o sea el germen tiene una concentración mínima inhibitoria (CMI) no alcanzable por el antimicrobiano en su perfil farmacocinético en humanos, el microorganismo es considerado resistente, resistencia que puede ser intrínseca o adquirida. La intrínseca es constitutiva propia de la especie, por ejemplo S. pneumoniae es resistente constitutivamente a aminoglucósidos, pues la pared bacteriana impide que la droga penetre y alcance su sitio diana en el ribosoma; la resistencia adquirida, no es predecible, no es constitutiva, se establece en una serie de pasos que parten de un evento que reduce la susceptibilidad del germen a un antimicrobiano en cuestión, en situación de presión de selección (fundamentalmente con el uso del antimicrobiano). Estos gérmenes muestran ventajas de sobrevida, sustituyen a la cepa salvaje en ese nicho ecológico, y posteriormente, si se mantienen las condiciones, esta cepa se propaga en la población.10 La resistencia antimicrobiana es el resultado inevitable de la evolución darwiniana.
La reducción de la susceptibilidad de un microorganismo frente a drogas antimicrobianas puede originarse por mutaciones a nivel genómico que implican la síntesis de una proteína (diana para la droga), con reducida afinidad por el antimicrobiano en cuestión, este tipo de resistencia se puede trasmitir verticalmente a su descendencia. La transmisión de la resistencia puede también ocurrir horizontalmente, en este caso el microorganismo adquiere material genético que porta información para la síntesis de dianas no susceptibles. Existen diversos mecanismos que explican este fenómeno, y, por ejemplo, en el S. pneumoniae tiene gran importancia el conocido como transformación, que consiste en la adquisición de genes que provienen de bacterias que han sufrido bacteriólisis, las bacterias donadoras pueden ser incluso de otra especie, como S. viridans, o S. mitis. Una vez incorporados estos fragmentos de ADN, se recombinan con el genoma de la bacteria aceptora, adquiriendo un fenotipo resistente. Otros mecanismos no menos importantes de adquisición de resistencia horizontalmente incluyen la adquisición de material genético a través de plásmidos, transposones o integrones. Los plásmidos consisten en material genético extracromosómico, que se replica independientemente de los cromosomas bacterianos, y pueden portar genes que codifican elementos de resistencia antimicrobiana; los transposones son secuencia de ADN, que portan información que implica resistencia, y además posee genes relacionados con la transposición a otros sitios del cromosoma o a plásmidos; y los integrones son grandes fragmentos de ADN, capaces de ser transferidos de un organismo a otro, y contienen grupos de genes que pueden tener múltiples determinantes de resistencia.10
Los antimicrobianos más utilizados en la infección por S. pneumoniae principalmente interfieren con la síntesis del peptidoglucano (betalactámicos, glucopéptidos), inhiben la síntesis proteica (macrólidos, azálidos, oxazolidonas), bloquean la síntesis de ADN (fluroquinolonas, rifamicinas), o interfieren en la síntesis de folatos (cotrimoxazol). La versatilidad adaptativa del microorganismo le ha permitido crear mecanismos capaces de sobreponerse a cualquiera de estas agresiones terapéuticas con un grado variable de eficacia.
Resistencia a betalactámicos
Los antibióticos betalactámicos inhiben competitivamente las enzimas transpeptidasas, cuya función es entrelazar las grandes moléculas de peptidoglucano para formar una estructura rígida en forma de un estuche que protege a la célula bacteriana de los cambios extremos de osmolaridad en el medio extracelular, estas enzimas reciben el nombre de PBP, del inglés penicillin-binding proteins. La inhibición competitiva de las enzimas PBPs por los betalactámicos ocurre debido a que estos antibióticos son similares, espacialmente, al sustrato natural de la enzima PBP, este sustrato es un pentapéptido que termina en los aminoácidos D-alanina-D-alanina. En S. pneumoniae se han descrito 6 PBPs (1a, 1b, 2a, 2b, 2x, 3), alteraciones en las PBPs (2x, 2b, y 1a, adquiridas fundamentalmente por transformación), y son responsables de la resistencia a todos los betalactámicos.10 Es importante conocer que en el proceso de adquisición de resistencia, conjuntamente con la reducción de la afinidad de las PBPs por los antibióticos betalactámicos, estas enzimas también reducen su afinidad por su sustrato natural. Consecuentemente con este fenómeno, el germen resistente puede formar un peptidoglucano con un menor grado de estructuración, lo que le resta competencia biológica. La afinidad de las PBPs con respecto a los betalactámicos no es homogénea, algunos antibióticos dentro de este grupo se unen con más afinidad que otros determinando mayor o menor potencia. El mecanismo de resistencia descrito anteriormente para antibióticos betalactámicos puede ser superado, terapéuticamente, utilizando dosis más altas del medicamento, o utilizando un antibiótico de mayor potencia como es la ceftriaxona. Es importante señalar que la utilización de inhibidores de betalactamasas, obviamente, no tiene ninguna repercusión clínica en este escenario.10
Resistencia a los macrólidos y azálidos
Los macrólidos/azálidos inhiben la síntesis de proteínas, y se insertan en una ranura en el rRNA 23S perteneciente a la subunidad 50S ribosomal, específicamente se unen al dominio V de la enzima peptidil transferasa, son drogas que tienen actividad bactericida en el S. pneumoniae. La metilación del sitio diana en el ribosoma codificado por el gen erm(B) confiere resistencia a macrólidos/azálidos, lincosaminas y estreptograminas. Los gérmenes con este gen adquieren el fenotipo denominado MLSB. La resistencia a macrólidos también puede deberse a la adquisición del gen mef(A), que codifica para una proteína integral de membrana que tiene actividad de bomba de eflujo, y funciona expulsando la droga del citoplasma celular para impedir que interactúe con su diana. Este fenotipo se denomina fenotipo M, ya que esta resistencia se limita solo a macrólidos/azálidos, la resistencia a macrólidos/azálidos no se solventa con incremento de la dosis del medicamento.10
Resistencia a las fluoroquinolonas
El mecanismo de acción de las fluoroquinolonas se sustenta en la inhibición de la síntesis de ADN, bloqueando la actividad de la DNA-girasa o de la topoisomerasa IV. En S. pneumoniae esta última es el sitio diana para la ciprofloxacina y la levofloxacina, mientras que DNA-girasa es la diana de moxiflosacina. La resistencia a estas drogas es debido a mutaciones espontáneas en la región del genoma, conocido como región determinante de resistencia a quinolonas, donde se encuentra el gen gyrA y parC. La mutación más común es en el gen parC, a la que se debe 67 % de los S. pneumoniae resistentes a quinolonas, las mutaciones en el gen gyrA solo contribuyen con el 8 %, y ambos genes son afectados en el 25 % de S. pneumoniae resistentes a quinolonas.11 Las mutaciones en parC determinan resistencia de bajo grado, que afectan solo a la ciprofloxacina. Se mantiene susceptibilidad a la levofloxacina, la gatifloxacina, la moxiflosacina y la gemifloxacina.12 El mecanismo de adquisición de este tipo de resistencia es por mutaciones espontáneas, no es soluble con dosis elevadas del medicamento. El principal riesgo para resistencia a quinolonas en S. pneumoniae es la exposición previa a fluoroquinolonas, y, principalmente, el uso de drogas de menor potencia como es la ciprofloxacina. La actividad intrínseca a las fluoroquinolonas, en orden decreciente, es el que sigue: gemifloxacina > moxifloxacina > gatifloxacina > levofloxacin ³ ciprofloxacina.13,14
Resistencia y virulencia
La modificación de los sitios de interacción con los antimicrobianos implica un costo biológico, que en muchas ocasiones, trae aparejada una disminución de la adaptabilidad del germen, y por tanto, de sus posibilidades de lucha contra los mecanismos naturales de defensa del hospedero. Por ejemplo, en el caso de resistencia a betalactámicos, las enzimas PBPs modificadas disminuyen su afinidad por los antibióticos de esta familia, pero también por la D-alanina-D-alanina (su sustrato natural), de tal manera que los aminoácidos utilizados para la síntesis del peptidoglucano son aminoácidos ramificados como serina,15,16 que producen enlaces internos y desestructura el peptidoglucano que pierde en solidez y eficacia.17 Esto se demuestra en la práctica, la prevalencia de resistencia es menor entre los aislamientos de sangre y líquido cefalorraquídeo (LCR), donde la necesidad de robustez biológica es imprescindible para subsistir, los mejores adaptados son los menos resistentes, lo contrario ocurre entre los aislamientos de nasofaringe u oído medio.18-22
Los factores de riesgo para enfermedad por S. pneumoniae resistente, de cierta manera, se explican por las posibles desventajas de adaptabilidad de estos gérmenes.23,24 El S. pneumoniae resistente encuentra mejores oportunidades de sobrevida en pacientes que presentan compromiso de la respuesta inmune, como es el caso de pacientes infectados por VIH, trasplantados, pacientes afectados por enfermedades crónicas debilitantes, pacientes en extremos de la vida, o, por otro lado, es más factible encontrarlo en nichos ecológicos sometidos a presión de selección, como uso previo de antibióticos en los últimos 90 días, la adquisición del germen en el nosocomio, y condiciones de hacinamiento, donde coincide la presión de selección y la facilidad para la transmisión interpersonal (guarderías y hogares de ancianos), por lo que la virulencia propia del germen más competente para enfrentar los mecanismos de defensa del hospedero, en muchas ocasiones, es contraria a la resistencia antimicrobiana.25
S. pneumoniae continúa incrementando su resistencia a agentes antimicrobianos comunes, limitando opciones terapéuticas e incrementando el potencial de fallos terapéuticos. Consecuentemente, la utilización juiciosa de los agentes antimicrobianos, actualmente disponibles, es la principal arma contra la proliferación y diseminación de cepas resistentes y multirresistentes de este germen.
REFERENCIAS BIBLIOGRÁFICAS
1. Hsieh YC, Lee WS, Shao PL, Chang LY, Huang LM. The transforming Streptococcus pneumoniae in the 21st century. Chang Gung Med J. 2008;31:117-24.
2. Centers for Disease Control and Prevention. Epidemiology and Prevention of Vaccine-Preventable Diseases. Atkinson W, Wolfe S, Hamborsky J, eds. 12th ed. Washington DC: Public Health Foundation; 2011. p. 233-45.
3. Song JH. Respiratory infections due to drug-resistant bacteria. Infect Dis Clin North Am. 01-SEP-2010;24(3):639-53.
4. Heffron R. Pneumonia with Special Reference to Pneumococcus Lobar Pneumonia. New York: Commonwealth Fund; 1939. p. 308-12.
5. Felton LD. Studies on the immunizing substances in pneumococci. J Immunol. 1934;27:379-93.
6. Smillie WG, Wornock GH, White HJ. A study of a type I pneumococcus epidemic at the State Hospital at Worcester, Mass. Am J Publ Health. 1938;28:293-302.
7. MacLeod CM, Hodges RG, Heidelberger M, Bernhard WG. Prevention of pneumococcal pneumonia by immunization with specific capsular polysaccharides. J Exp Med. 1945;82:445-65.
8. Appelbaum PC, Bhamjee A, Scragg JN, Hallett AF, Bowen AJ, Cooper RC. Streptococcus pneumoniae resistant to penicillin and chloramphenicol. Lancet. 1977;2(8046):995-7.
9. Caputo GM, Appelbaum PC, Liu HH. Infections due to penicillin-resistant pneumococci. Clinical, epidemiologic and microbiologic features. Arch Intern Med. 1993;153(11):1 301-10.
10. Ronald N, Jonesa RN, Jacobsb MR, Sadera HS. Evolving trends in Streptococcus pneumoniae resistance: implications for therapy of community-acquired bacterial pneumonia. J Antimicrob Agents. 2010;36:197-204.
11. Musher DM. How contagious are common respiratory infections? N Engl J Med. 2003;348:1 256-66.
12. Mulvey MR, Simor AE. Antimicrobial resistance in hospitals: how concerned should we be? CMAJ. 2009 February 17;180(4):408-15.
13. Fraimow HS, Tsigrelis S. Antimicrobial Resistance in the Intensive Care Unit: Mechanisms, Epidemiology, and Management of Specific Resistant Pathogens. Crit Care Clin. 2011;27:163-205.
14. Brueggemann AB, Coffman SL, Rhomberg P. Fluoroquinolone resistance in Streptococcus pneumoniae in United States since 1994-1995. Antimicrob Agents Chemother. 2002;46:680-8.
15. Fernandez-Moreira E, Balas D, Gonzalez I, de la Campa AG. Fluoroquinolones inhibit preferentially Streptococcus pneumoniae DNA topoisomerase IV than DNA gyrase native proteins. Microb Drug Resist. 2000;6:259-67.
16. Jones RN, Rubino CM, Bhavnani SM, Ambrose PG. Worldwide antimicrobial susceptibility patterns and pharmacodynamic comparisons of gatifloxacin and levofloxacin against Streptococcus pneumoniae: report from the Antimicrobial Resistance Rate Epidemiology Study Team. Antimicrob Agents Chemother. 2003;47:292-6.
17. Lynch JP III, Zhanel GG. Escalation of antimicrobial resistance among Streptococcus pneumoniae: implications for therapy. Semin Respir Crit Care Med. 2005;26:575-616.
18. Garcia-Bustos J, Tomasz A. A biological price of antibiotic resistance: major changes in the peptidoglycan structure of penicillin-resistant pneumococci. Proc Natl Acad Sci USA. 1990;87(14):5 415-9.
19. Filipe SR, Tomasz A. Inhibition of the expression of penicillin resistance in Streptococcus pneumoniae by inactivation of cell wall muropeptide branching genes. Proc Natl Acad Sci USA. 2000;97(9):4 891-6.
20. Jacobs MR, Anon J, Appelbaum PC. Mechanisms of resistance among respiratory tract pathogens Clin Lab Med. 2004;24:419-53.
21. Doern GV, Richter SS, Miller A. Antimicrobial resistance among Streptococcus pneumoniae in the United States: have we begun to turn the corner on resistance to certain antimicrobial classes? Clin Infect Dis. 2005;41:139-48.
22. Feikin DR, Schuchat A, Kolczak M. Mortality from invasive pneumococcal pneumonia in the era of antibiotic resistance, 1995-1997. Am J Public Health. 2000;90:223-9.
23. Karlowsky JA, Thornsberry C, Jones ME, Evangelista AT, Critchley IA, Sahm DF. Factors associated with relative rates of antimicrobial resistance among Streptococcus pneumoniae in the United States: results from the TRUST Surveillance Program (19982002). Clin Infect Dis. 2003;36:963-70.
24. Johnson CN, Briles DE, Benjamin WH Jr, Hollingshead SK, Waites KB. Relative fitness of fluoroquinolone-resistant Streptococcus pneumoniae. Emerg Infect Dis. 2005;11:814-20.
25. Lynch JP, Zhanel GG. Streptococcus pneumoniae: Does Antimicrobial Resistance Matter? Semin Respir Crit Care Med. 2009;30(2):210-38.
Recibido: 18 de marzo de 2011.
Aprobado: 13 de junio de 2011.
Amauri L. Noda Albelo. Hospital Pediátrico "Eliseo Noel Caamaño". Santa Isabel y América, Matanzas, Cuba. Correo electrónico: amauryn.mtz@infomed.sld.cu














