Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Pediatría
versión impresa ISSN 0034-7531
Rev Cubana Pediatr vol.84 no.4 Ciudad de la Habana oct.-dic. 2012
ARTÍCULO DE REVISIÓN
Atresia pulmonar con septum interventricular intacto
Pulmonary atresia with intact ventricular septum, a thematic review
MSc. Dr. Adel Eladio González Morejón, MSc. Dra. Giselle Serrano Ricardo, Dr. Francisco Díaz Ramírez, Dr. Luis Marcano Sanz
Cardiocentro Pediátrico "William Soler". La Habana, Cuba.
RESUMEN
La atresia pulmonar con septum interventricular intacto es una cardiopatía congénita cianótica aparentemente sencilla caracterizada por incorporar diversas variantes morfológicas y lesiones asociadas que conllevan a un diagnóstico y tratamiento más complejo del que inicialmente podría esperarse. La elevada mortalidad antes de los 6 meses de edad obliga a instaurar una conducta agresiva y precoz. Con esta revisión nos hemos propuesto efectuar la evaluación integral de la enfermedad desde sus elementos conceptuales hasta las variantes terapéuticas a adoptar, para lo cual se describen los aspectos más importantes en cuanto a morfología, fisiopatología, diagnóstico y tratamiento. Se discute, asimismo, el papel de la ecocardiografía, de la cirugía y de las técnicas de cardiología intervencionista. La estrategia fundamental del tratamiento es separar las circulaciones sistémica y pulmonar sin provocar disminución del gasto cardíaco ni aumentos en la presión venosa central. Se pretende, además, rescatar al ventrículo derecho para el circuito pulmonar siempre que la circulación coronaria no sea dependiente de aquel. Se resalta, mediante algoritmo, la importancia que reviste la integración de modalidades quirúrgicas, intervencionistas e híbridas en el acometimiento terapéutico de esta cardiopatía.
Palabras clave: atresia pulmonar, ecocardiografía pediátrica, cardiología intervencionista, cirugía cardiovascular.
ABSTRACT
Pulmonary atresia with intact ventricular septum is an apparently simple cyanotic congenital cardiopathy, characterized by several morphological variants and associated lesions leading to a complex diagnosis and treatment. The high mortality rate recorded in under 6 months-old infants demands an early aggressive management to face this situation. This review was intended to make a comprehensive assessment of the disease from its basic conceptual elements to the therapeutic variants to be adopted. To this end, the most important elements of morphology, physiopathology, diagnosis and treatment were addressed, in addition to discussing the roles of echocardiography, surgery and interventional cardiology techniques. The fundamental strategy of treatment is to separate the systemic circulation from the pulmonary circulation, causing neither reduction of the cardiac output nor increase of the central venous pressure. It is also aimed to return the right ventricle to the pulmonary circuit, provided that the coronary circulation does not depend on it. The algorithm presented in this paper underlined the importance of the integration of the surgical, interventional and hybrid modalities for the therapeutic management of this cardiopathy.
Key words: pulmonary atresia, pediatric echocardiography, interventional cardiology, cardiovascular surgery.
INTRODUCCIÓN
Concepto
La atresia pulmonar con septum interventricular intacto (APSI) consiste en una cardiopatía congénita cianótica con flujo pulmonar disminuido y cardiomegalia. Puede también conceptualizarse como una cardiopatía congénita crítica, ductos-dependiente, en la que se presenta atresia de la válvula y/o infundíbulo pulmonares asociada a septum interventricular íntegro y grados variables de hipoplasia ventricular derecha. Cursa con hipoxemia severa dadas sus características morfológicas y hemodinámicas.1,2
Embriología
En esta entidad se invoca hipotéticamente la presencia de endocarditis embrio-fetal, provocada por virus u otros organismos, como causante de hipodesarrollo inicial de la entrada del ventrículo derecho (VD) en el corazón embrionario. Este trastorno inicial de la entrada ventricular derecha pudiera provocar entonces, desde una óptica hemodinámica, las alteraciones del resto de dicha cavidad que se observan en esta entidad.3
Es necesario puntualizar que en la actualidad el origen embriológico coronario resulta desconocido. Los canales sinusoidales intratrabeculares constituyen la vía para llevar sangre al miocardio durante la fase temprana pre-coronaria del desarrollo del corazón normal. Con el transcurso del tiempo, y a medida que se produce el desarrollo evolutivo, los canales sinusoidales se obliteran. En los corazones que presentan esta enfermedad los sinusoides pueden permanecer abiertos total o parcialmente, porque la presión en el VD resulta mayor que en ventrículo izquierdo (VI).4-6
Historia
El primer reporte de la entidad lo realizó Hunter en 1784, al describir un corazón atrésico pulmonar con VD sumamente hipertrófico e hipoplásico.7,8 Posteriormente, en 1866, Peacock señaló la presencia de hipoplasia tricuspídea como factor morfológico concomitante en gran número de casos.9 En el pasado siglo Peck y Wilson (1949) estudiaron la naturaleza y peculiaridades del tractus de salida del VD atrésico, Williams (1951) documentó la existencia de sinusoides en algunos pacientes con la enfermedad y Greenwold (1956) clasificó la morfología ventricular derecha presente en esta cardiopatía.7,8,10
En la actualidad el desarrollo científico-investigativo alcanzado, traza, cada vez con mayor énfasis, pautas tendientes a la realización de estudios multicéntricos en aras de la obtención de un universo de estudio mucho más amplio.11-13
Epidemiología e incidencia
A esta entidad corresponde solamente el 1 % del total de las cardiopatías congénitas. Existe un ligero predominio del sexo masculino.1,2,11-13
Anatomía
La APSI constituye un espectro de alteraciones que involucra las válvulas pulmonar y tricúspide, VD y circulación coronaria (Fig. 1).
1) Válvula pulmonar: puede observarse un espectro morfológico variable, que abarca desde el aparato valvular con desarrollo aceptable, pero atrésico por constitución de diafragma a expensas de fusión valvar (80 % de los casos), hasta la situación extrema de hipodesarrollo significativo de la válvula asociado a severa atresia o hipoplasia infundibular (20 % de los pacientes).1,2,7,8,14
2) Válvula tricúspide: el anillo tricuspídeo frecuentemente es hipoplásico y correlaciona con el nivel de hipodesarrollo del VD. La válvula tricúspide puede ser displástica, presentar valvas prolapsadas o exhibir configuración tipo Ebstein. Raramente se observa la ausencia congénita de válvula tricúspide.1,2,7,8,15,16
3) VD: clasificado por Greenwold en 1956 en dos tipos:10
Tipo I. VD hipoplásico con paredes gruesas y diminuta capacidad volumétrica. Se asocia con orificio tricuspídeo hipoplásico (82 % de los pacientes).
Tipo II. VD con tamaño normal o dilatado (18 % de los casos).
En la práctica la gran mayoría de los casos pertenece al tipo I. El tipo I correlaciona con un VD uni-bipartito y el tipo II con un VD tripartito. Ambos tipos constituyen los extremos del espectro que incluye formas intermedias.3,8,12,14,17,18 Se debe señalar la asociación excepcional de la anomalía de Uhl (VD papiláceo de paredes muy delgadas) a la entidad que nos ocupa.8
Existe en el mundo científico de nuestros tiempos una gran controversia acerca de la capacidad o no de desarrollo posquirúrgico del VD.11,13-18
4) Circulación coronaria: su definición y análisis morfológico resultan de vital importancia en esta entidad. En ella puede observarse:
- Presencia de estenosis o atresia de una o más de las arterias coronarias principales (10 % de los casos).
- Existencia de fístulas sinusoidales, concomitando o no, con estenosis o atresia coronarias anteriormente enunciadas. En caso de existir estas últimas, las fístulas sinusoidales irrigan la circulación coronaria distal a la atresia (o estenosis) presente.
- Presencia de sinusoides aislados.
Se ha planteado que las anomalías coronarias se observan con mayor frecuencia en situación de disminución del tamaño del anillo tricuspídeo y de la capacidad volumétrica del VD.4-6,19,20
5) Otras peculiaridades anatómicas asociadas a la entidad son:1,2,8,11,13
- Aurícula derecha (AD) dilatada.
- Presencia más frecuente de foramen oval, que de verdadera comunicación interauricular (CIA).
- Arco aórtico siempre a la izquierda.
- Ramas pulmonares siempre confluentes.
- Relaciones víscero-atrial, atrio-ventricular y ventrículo-arterial normales.
- Persistencia de conducto arterioso (PCA) relativamente pequeño.
- Las dimensiones del tronco arterial pulmonar (TAP) pueden oscilar desde magnitudes casi normales, hasta situaciones de severa hipoplasia, concordando con mayor o menor desarrollo del infundíbulo o del anillo pulmonar.
Fisiopatología1,2,12,21
En el feto:
- El retorno venoso sistémico alcanza el corazón izquierdo vía foramen oval.
- El gasto del VD no forma parte del gasto cardíaco efectivo, excepto en casos de grandes fístulas sinusoidales.
- El VI provee el gasto cardíaco fetal total. La aorta y su istmo están dilatados por recibir la totalidad del gasto cardíaco.
- No existe impedancia al flujo de la AD.
En el recién nacido:
- La presencia y dimensiones del ductus arterioso son determinantes para la supervivencia posnatal.
- Aumenta impedancia al flujo de la AD. Ello provoca mayor presión en dicha cavidad.
- Cuando el flujo por el ductus arterioso se torna insuficiente, ocurren las denominadas crisis de hipoxemia profunda e hipoxia tisular.
Cuadro clínico1,2,11
- Presencia de cianosis severa generalizada desde el nacimiento.
- Existe discreta hiperventilación, e inter crisis hipoxémicas debido a acidosis metabólica subcompensada mantenida.
- Se ausculta segundo ruido único (correspondiente al cierre valvular sigmoideo aórtico), mejor precisado en el foco aórtico y en el segundo foco aórtico.
- Pueden no auscultarse en la base cardíaca soplos sistólicos o continuos del ductus arterioso (incluso este puede presentar soplo sistólico).
- En algunos pacientes son denotados signos clínicos de insuficiencia cardíaca congestiva derecha (taquicardia, hepatomegalia, edemas en miembros inferiores).
Complementarios
1) Gasometría: en neonatos sin crisis hipoxémica se encuentran valores del rango de Ph (7,20-7,35), PO2 (30-40 mmHg) y HbO2 (< 50 %).11-13,22
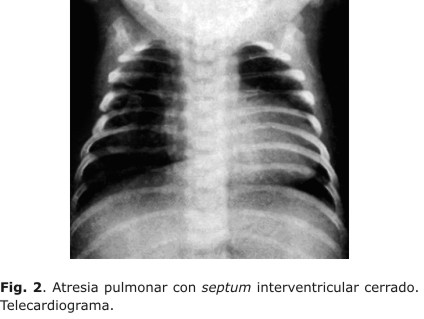
2) Telecardiograma (Fig. 2):1,2,14
- Al momento del nacimiento el 50 % de los exámenes son normales.
- Puede haber cardiomegalia marcada que progresa paulatinamente.
- Existe oligohemia pulmonar significativa.
- Se denota crecimiento de AD y de VI.
3) Electrocardiograma:2,23
- No resulta típico, varía de acuerdo al tamaño y grosor del VI.
- Exhibe crecimiento de AD.
- El eje eléctrico (AQRS) se sitúa entre 0º y + 60º, aunque puede ubicarse a la derecha (sobre todo de forma evolutiva).
4) Ecocardiografía (Fig. 3):5,21,24,25
- Realiza el diagnóstico morfológico de la enfermedad y de sus peculiaridades hemodinámicas.
- Su principal limitante radica en el estudio del árbol arterial coronario para la detección de vasos coronarios atrésicos u estenóticos y en la pesquisa de la existencia de fístulas sinusoidales. En estos casos necesita el auxilio complementario del estudio hemodinámico.
- Caracteriza la morfología del VD.
- Aporta datos del tractus de salida del VD, sus peculiaridades y morfología, así como de la distancia de este al TAP.
- Valora configuración y dimensiones del TAP y de sus ramas pulmonares.
- Analiza la disposición del septum interauricular, el tamaño del ductus arterioso y de la CIA (foramen oval).
- Precisa existencia y severidad de la insuficiencia tricúspidea.
5) Cineangiogardiografía (Fig. 4): debe complementar a la ecocardiografía y avanzar en la definición de la naturaleza del sistema coronario y de la existencia de fístulas sinusoidales (circulación coronaria sinusoides-dependiente).1,2,13,14
- Ventriculografía derecha: importante en la búsqueda de sinusoides (fístulas), presencia y magnitud de regurgitación tricuspídea y características del VD.
- Aortografía: define propiedades del árbol arterial coronario.
6) Cateterismo: mediante este proceder se realiza la atrioseptostomía de balón, a fin de favorecer equiparidad de presiones y volúmenes auriculares. El estudio hemodinámico posquirúrgico se efectuará analíticamente y tomando en consideración las variantes quirúrgicas adoptadas en cada paciente; resulta, por ello, un estudio casuístico.
Complicaciones11,12,22
Son similares a las que se producen en la atresia pulmonar con septum interventricular abierto. Fundamentalmente se circunscriben a:
- Crisis de hipoxemia profunda (forma parte del cuadro clínico).
- Edema cerebral.
- Abscesos cerebrales.
Diagnóstico diferencial
Debe realizarse en recién nacidos fundamentalmente con:
- Atresia pulmonar con septum interventricular abierto.
- Atresia tricuspídea tipos I o II-A de la clasificación de Edwards.
- Transposición simple de las grandes arterias.
- Tetralogía de Fallot severa.
- Estenosis pulmonar crítica del recién nacido.
Se debe, no obstante, hacer hincapié fundamental en los aspectos que discriminan la entidad con la estenosis pulmonar crítica del recién nacido. En niños mayores el diagnóstico diferencial debe realizarse con todas aquellas cardiopatías congénitas complejas que cursan con estenosis pulmonar severa.
Tratamiento
1) Tratamiento médico basal: de instauración inmediata al realizarse el diagnóstico de la cardiopatía en el recién nacido. Persigue, como objetivo fundamental, la estabilización integral del estado del paciente mientras se decide la estrategia quirúrgica a adoptar de acuerdo con los resultados de las investigaciones diagnósticas.26,27 Consta de:
- Soporte nutricional: aporte alimentario adecuado, incluyendo contenido calórico requerido. Debe incluir vitaminoterapia si necesario.
- Soporte metabólico: luchar por el mantenimiento del equilibrio hidroelectrolítico del paciente (recordar que se trata, en la mayoría de los casos, de un recién nacido). Mantener en estado de acidosis subcompensada.
- Soporte inotrópico: administración de aminas simpaticomiméticas como apoyo hemodinámico si es necesario.
- Soporte antibiótico: combatir infecciones intercurrentes de forma enérgica.
- Soporte ventilatorio: vigilar adecuada permeabilidad de vías aéreas, pues debemos recordar que esta entidad constituye, básicamente, un problema de perfusión pulmonar y no de ventilación.
- Soporte pediátrico integral: combatir, de forma vigorosa, cualquier enfermedad concomitante que pueda complicar la situación del paciente. Mantener hemoglobina en cifras aceptables.
- Administración de prostaglandinas (PGE1), como parte del tratamiento médico de transición en esta enfermedad, previo a la cirugía: mantiene permeabilidad de la PCA. Dosis endovenosa (EV): 0,05 µg/kg de peso/minuto. Dosis oral: 40 µg/kg de peso/3 horas.
Las reacciones secundarias a la administración de PGE1 pueden ser: fiebre, diarreas, convulsiones, episodios de apnea e hipersensibilidad a las infecciones. Debe tenerse en cuenta que la terapéutica con PGE1 se concibe con una óptica de "transición", dando tiempo a la realización del acto quirúrgico, intervencionista o híbrido, no como terapia semi-permanente por muchos días. Después de los 15 días de edad, el inicio de tratamiento con PGE1 no arroja los resultados deseados, y posteriormente al mes de edad, el fármaco no surte efecto.
2) Tratamiento de las crisis de hipoxemia profunda:26,27
- Mantenimiento de todas las medidas descritas anteriormente en el tratamiento médico. Buscar causas de la crisis.
- Administración de alcalinos por vía EV:Bicarbonato de sodio al 4 % (mEq): 0,3 x kg de peso (BE- 2,5)
Bicarbonato de sodio al 4 %: 1 mL= 0,5 mEq.
Bicarbonato de sodio al 8 %: 1 mL= 1 mEq.
Bicarbonato de sodio al 4 %: 7 mL x kg de peso.
Bicarbonato de sodio al 8 %: 4 mL x kg de peso.
- Sedación:
Morfina: 0,01-0,02 mg/kg de peso/dosis. Vías: SC/IM. Administrar bajo vigilancia, debido a riesgo de depresión del centro respiratorio bulbar.
Diazepam: 0,25-0,5 mg/kg de peso/dosis. Vía: EV. No pasar más de 10 mg/dosis.
- De ser necesario, acudir a la relajación muscular que, sumada a la sedación con morfina, lleva al paciente a un estado de metabolismo basal con requerimientos mínimos (hibernación).
Metilbromuro de pancuronio: 0,1 mg/kg de peso/dosis. Vía: EV. Obviamente debe intubarse y ventilarse mecánicamente al paciente. Eventualmente, si la crisis no cesa, aquel puede requerir ser anestesiado.
- Vigilar aparición de edema cerebral, y si se aprecian signos clínicos de este, administrar:
Manitol 25 %: 0,5 g/kg de peso/dosis que puede repetirse.
Betametasona: 0,4 mg/kg de peso/24 horas. Vía: EV. Dosis máxima: 8 mg/día.
Albúmina humana: 3-5 mL/kg de peso/24 horas, o dextrán: 10 mg/kg de peso/24 horas. Estos últimos por vía EV. La albúmina humana y el dextrán son deshidratantes cerebrales y expansores plasmáticos con uso preferencial, en lugar del manitol y la furosemida, cuando el hematócrito se encuentra elevado.
3) Realización de atrioseptostomía de balón: debe añadirse este proceder en los casos que lo requieran (ver aspectos inherentes al cateterismo en Complementarios).12,13
4) Tratamiento quirúrgico, híbrido o por cardiología intervencionista (Fig. 5. a y b, c y d, e y f). Posee algoritmo basado en los aspectos siguientes:28
- Existencia o no de anomalías coronarias.
- Morfología del VD.
- Presencia y severidad de insuficiencia tricuspídea.
- Características y dimensiones de ramas pulmonares y TAP.
Su filosofía se apoya básicamente en la separación de las circulaciones sistémica y pulmonar sin disminuir el gasto cardíaco ni aumentar la presión venosa central, así como en el rescate, siempre que sea posible, del VD en función del circuito pulmonar cuando la circulación coronaria no sea dependiente de aquel.19,22,29,30,31
REFERENCIAS BIBLIOGRÁFICAS
1. Shinebourne EA, Rigby ML, Carvalho JS. Pulmonary atresia with intact ventricular septum: from fetus to adult. Heart. 2008;94:1350-7.
2. Portela F, Marcos S. Atresia pulmonary con septo íntegro. Circ Cardiov. 2008;15(4):337-44.
3. Gittenberger de Groot AC, Jongbloed MRM, Wisse LJ, Poelmann RE. Pulmonary atresia with intact ventricular septum: Second heart field derived myocardial and epicardial developmental clues. Progress in Pediatric Cardiology. 2010;29(1):3-9.
4. Grittenberger de Groot AC, Eralp I, Lie-Venema H, Bartelings MM, Poelmann RE. Development of the coronary vasculature and its implications for coronary abnormalities in general and specifically in pulmonary atresia without ventricular septal defect. Acta Paediatr Suppl. 2004;93:13-9.
5. Satou GM, Perry SB, Gauvreau K, Geva T. Echocardiographic predictors of coronary artery pathology in pulmonary atresia with intact ventricular septum. Am J Cardiol. 2000;85:1319-24.
6. Freedom RM, Anderson RH, Perrin D. The significance of ventriculocoronary arterial connections in the setting of pulmonary atresia with an intact ventricular septum. Cardiol Young. 2005;15:447-68.
7. Bull C, De Leval MR, Mercanti C, Macartney FJ, Anderson RH. Pulmonary atresia and intact ventricular septum: a revised classification. Ann Thorac Surg. 2004;77:1087-8.
8. Zuberbuhler JR, Anderson RH. Morphological variations in pulmonary atresia with intact ventricular septum. Heart. 1979;41:281-8.
9. Peacock TB. Malformation of the heart: atresia of the orifice of the pulmonary artery. Trans Pathol Soc Lond. 1869;20:61-8.
10. Greenwold WE, DuShane JW, Burchell HB, Bruwer A, Edwards JE. Congenital pulmonary atresia with intact ventricular septum: two anatomic types. Circulation. 1956;14:945-6.
11. Daubeney PE, Wang D, Delany DJ. UK and Ireland collaborative study of pulmonary atresia with intact ventricular septum. Pulmonary atresia with intact ventricular septum: predictors of early and medium-term outcome in a population-based study. J Thorac Cardiovasc Surg. 2005;130:1071-8.
12. Joelsson E, Hanseus SJ, Jonzon BH, Jogi A, Lundell B. The outcome of children born with pulmonary atresia and intact ventricular septum in Sweden from 1980 to 1999. Scand Cardiovasc J. 2001;35:192-8.
13. Dyamenahalli U, McCrindle BW, McDonald C. Pulmonary atresia with intact ventricular septum: management of, and outcomes for, a cohort of 210 consecutive patients. Cardiol Young. 2004;14:299-308.
14. Daubeney PE, Delany DJ, Anderson RH. Pulmonary atresia with intact ventricular septum: range of morphology in a population-based study. J Am Coll Cardiol. 2002;39:1670-9.
15. Salvin JW, McElhinney DB, Colan SD, Del Nido P. Fetal Tricuspid Valve Size and Growth as Predictors of Outcome in Pulmonary Atresia With Intact Ventricular Septum. Pediatrics. 2006;118:415-20.
16. Huang SC, Ishino K, Kasahara S, Yoshizumi K, Kotani Y, Sano S. The potential of disproportionate growth of tricuspid valve after decompression of the right ventricle in patients with pulmonary atresia and intact ventricular septa. J Thorac Cardiovasc Surg. 2009;138:1160-6.
17. Yoshimura N, Yamaguchi M, Ohashi H. Pulmonary atresia with intact ventricular septum: strategy based on right ventricular morphology. J Thorac Cardiovasc Surg. 2003;126:1417-26.
18. Muñoz-Castellanos L, Galindo-Herrera M, Kuri-Nivon M. Hipoplasia ventricular derecha. Estudios morfométrico y morfológico. Archivos de Cardiología de México. 2007;77:181-93.
19. Calder AL, Peebles CR, Occleshaw CJ. The prevalence of coronary arterial abnormalities in pulmonary atresia with intact ventricular septum and their influence on surgical results. Cardiol Young. 2007;17:387-96.
20. Guleserian KJ, Armsby LB, Thiagarajan RR. Natural history of pulmonary atresia with intact ventricular septum and right ventricle-dependent coronary circulation managed by the single ventricle approach. Ann Thorac Surg. 2006;81:2250-7.
21. Drant SE. The echocardiographic evaluation of pulmonary atresia with intact ventricular septum. Prog Pediatr Cardiol. 2001;13:165-75.
22. Ashburn DA, Blackstone EH, Wells WJ. Determinants of mortality and type of repair in neonates with pulmonary atresia and intact ventricular septum. J Thorac Cardiovasc Surg. 2004;127:1000-8.
23. Ansari A, Goltz D, McCarthy KP. The conduction system in hearts with pulmonary atresia and intact ventricular septum. Ann Thorac Surg. 2003;75(5):1502-5.
24. Burch TM, Mizuguchi KA, Wesley MC, Swanson TM. Echocardiographic Features of Pulmonary Atresia with Intact Ventricular Septum. International Anesthesia Research Society. 2008;107:1509-11.
25. Lee YS, Kim YH, Hyum MC. Echocardiographic parameters of pulmonary atresia with intact ventricular septum. J Korean Pediatr Soc. 2003;46:484-9.
26. Mi YP, Chau AKT, Chiu CSW. Evolution of the management approach for pulmonary atresia with intact ventricular septum. Heart. 2005;91:657-63.
27. McLean KM, Pearl JM. Pulmonary Atresia With Intact Ventricular Septum: Initial Management. Ann Thorac Surg. 2006;82:2214-20.
28. Alwi M. Management algorithm in pulmonary atresia with intact ventricular septum. Catheterization and Cardiovascular Interventions. 2006;67(5):679-86.
29. Gonçalves A. Atresia pulmonar con septo íntegro, tratamiento quirúrgico a corto y largo plazo. Anales de Cirugía Cardíaca y Vascular. 2004;10(4):252-6.
30. Cheung YF, Leung MP, Chau AKT. Usefulness of laser-assisted valvotomy with balloon valvoplasty for pulmonary valve atresia with intact ventricular septum. Am J Cardiol. 2002;90:438-42.
31. Miyaji K, Shimada M, Sekiguchi A, Ishizawa A, Isoda T. Pulmonary Atresia With Intact Ventricular Septum: Long-Term Results of "One and a Half Ventricular Repair". Thorac Cardiovasc Surg. 2004;127:1000-8.
Recibido: 24 de mayo de 2012.
Aprobado: 22 de junio de 2012.
Adel Eladio González Morejón. Cardiocentro Pediátrico "William Soler". Ave. San Francisco, # 10 112, reparto Altahabana, municipio Boyeros. La Habana, Cuba. Correo electrónico: adelgonzalez@infomed.sld.cu