Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Pediatría
versión impresa ISSN 0034-7531
Rev Cubana Pediatr vol.85 no.1 Ciudad de la Habana ene.-mar. 2013
ARTÍCULO DE REVISIÓN
Complicaciones de las otitis medias agudas y crónicas en el niño
Complications of acute and chronic otitis media in the child
MSc. Dra. Julianis Loraine Quintero Noa,I MSc. Dra. Ileana Álvarez Lam,I Dra. María del Carmen Hernández Cordero,II Dra. Loraine Lilia Meléndez QuinteroIII
IHospital Pediátrico Docente Universitario "William Soler". La Habana, Cuba.
IICentro de Neurociencias. La Habana, Cuba.
IIIInstituto Superior de Ciencias Médicas. Facultad "Dr. Enrique Cabrera". La Habana, Cuba.
RESUMEN
Gracias al descubrimiento de los antibióticos, la incidencia de complicaciones en las otitis medias agudas y crónicas ha descendido significativamente, aunque continúan siendo un peligro potencial de morbilidad y mortalidad. La disminución de las complicaciones puede condicionar retrasos diagnósticos por falta de sospecha clínica, enmascaramiento por tratamientos antibióticos previos y mal pronóstico, por lo cual siguen siendo procesos graves que ponen en peligro la vida del enfermo. Se definen actualmente con igual sistema de clasificación: extracraneales e intracraneales. Las primeras se subdividen en extratemporal e intratemporal, y constituyen un problema de salud en la población pediátrica a pesar del uso extendido de antibióticos. La evaluación clínico-otomicroscópica e imaginológica se reporta como criterio diagnóstico predictivo de sospecha y de confirmación. La parálisis facial, el vértigo, los vómitos, la cefalea, el dolor irradiado a la mastoides o a la región temporoparietal, y la hipertermia, deben alertar al médico sobre la presencia de una complicación supurada.
Palabras clave: otitis media aguda, otitis media crónica, complicaciones, colesteatoma.
ABSTRACT
Thanks to the discovery of antiobiotics, the incidence of complications in the chronic and acute otitis media has significantly decreased, though they remain a potential mortality and morbidity risk. The reduction of complications can be conditional on some diagnostic delays, on account of lack of clinical suspicions, symptoms disguised by previous antibiotic treatments and wrong prognosis; therefore, the complications continue to be severe processes that endanger the patient's life. They are currently classified as extracranial and intracranial. The former are divided into extratemporal and intratemporal and represent a health problem for the pediatric population despite the extended use of antibiotics. The clinical, otomicroscopic and imaging assessment is reported as a diagnostic criterion predictive of suspicions and of confirmation. Facial paralysis, vertigo, vomiting, headache, pain irradiated to the mastoids, or to the temporoparietal region, and hyperthermia should be alerts to the physician about suppurative otitis complication.
Key words: acute otitis media, chronic otitis media, complications, cholesteatoma.
INTRODUCCIÓN
Aunque la incidencia de complicaciones en las infecciones agudas y crónicas del hueso temporal ha disminuido dramáticamente, continúan siendo un peligro potencial de morbilidad y mortalidad.1,2 La otitis media (OM) es la inflamación del oído medio que, según reportes actuales, es responsable anualmente en los Estados Unidos de 24 millones de consultas pediátricas y de 4 billones de dólares estadounidenses por atención médica y cirugía otológica.3
Se reporta, que con excepción de la mastoiditis, el resto de las complicaciones descritas en relación con la otitis media aguda (OMA) han disminuido desde la utilización de antibióticos, y se consideran excepcionales en la actualidad, pero se describe el déficit auditivo como la complicación o secuela más frecuente en la OMA a medio y a largo plazo.2,4,5 La OMA recurrente (OMAR) se define como la OMA que se repite con una frecuencia de al menos 3 episodios en los últimos 6 meses, o 4 en 12 meses, siempre que el último se haya producido en los últimos 6 meses. Debe reunir los criterios diagnósticos de OMA aislada, con frecuencia mínima del nuevo episodio de 30 días después del inicio del proceso anterior.2,4-6
La OM con derrame o efusión crónica (OMEC) se define como la persistencia de exudado bilateral más de 3 meses en oído medio, lo cual conlleva trastornos del aprendizaje y problemas en el desarrollo del lenguaje.4 Se reporta menos morbilidad y mortalidad de las complicaciones en las OM desde la era antibiótica, pero se señala a partir del 1970 un alza de estas, incluyendo la muerte, lo que se justifica por el índice de pobreza en países subdesarrollados, que presentan factores socioeconómicos desastrosos.6,7 Esto determina una alerta médica, ya que el diagnóstico tardío y un incorrecto tratamiento con antibióticos favorecen la aparición de complicaciones.
La OM crónica (OMC) supurada se define como un proceso inflamatorio crónico del oído medio sin tendencia a la curación (más de 3 meses), que suele ocasionar lesiones estructurales: secuela cicatrizal definitiva de la membrana timpánica (MT), destrucción y anquilosis de la cadena osicular, tímpanoesclerosis o colesteatoma, y se caracteriza clínicamente por hipoacusia conductiva, otorrea recurrente a través de una perforación permanente, central o marginal de la MT, con gran repercusión en la esfera social de los individuos, más frecuente en edades pediátricas.3,7
Se describe clásicamente la OMC simple (OMCS) la que presenta a la otoscopia una perforación central, mucosa de la caja timpánica normal, lisa rosada, con leve vascularización (sin reinfección) o edematosa, roja y granulosa (con supuración activa), y la OMC colesteatomatosa (OMCC). La complicación más severa de las otitis corresponde con al colesteatoma,2,8 definida como la presencia de epitelio escamoso queratinizado que sustituye o recubre la mucosa normal dentro de las cavidades del oído medio y ápex petroso, que produce destrucción e infecciones persistentes dentro del hueso temporal y complicaciones del sistema nervioso central (SNC).3,7 Clásicamente se reconocen 3 formas clínicas:
- Colesteatoma congénito: se desarrolla detrás de una MT intacta.
- Colesteatoma adquirido primario: el epitelio epidérmico invade el oído medio sin existir perforación previa.
- Colesteatoma adquirido secundario: la epidermis del conducto auditivo externo (CAE) y del tímpano invaden el oído medio a través de una perforación preexistente marginal posterosuperior o atical.3,8
Los signos y síntomas de colesteatoma pueden pasar inadvertidos durante muchos años en todos los grupos etarios, pero en niños el problema es mayor, pues rara vez refieren hipoacusia (si la enfermedad es unilateral) u otalgia, y clínicamente puede demorar meses o años en manifestar complicaciones. Los criterios diagnósticos se basan en el cuadro clínico, que corresponde con infecciones repetidas, otorrea fétida persistente, en ocasiones continua, refractaria a tratamiento médico, y en general asociada a hipoacusia de distinta intensidad. La otoscopia se considera fundamental, si se observa una perforación marginal o periférica (llega hasta la inserción de la MT, marco timpanal), mesotimpánica posterosuperior o atical, con presencia en la mucosa de la caja de granulaciones o contenido epidérmico nacarado.3,4,8-10 La parálisis facial, el vértigo severo, los vómitos, la cefalea y la hipertermia, deben alertar al médico sobre la presencia de una complicación supurada otógena.1,9,10
Las complicaciones infecciosas de la OMA y OMC se clasifican en extracraneales e intracraneales. Las primeras se subdividen en extratemporal e intratemporal: las extracraneales extratemporales (absceso subperióstico mastoideo, cigomático, absceso de Bezold); las intratemporales (mastoiditis, fístula laberíntica, laberintitis, petrositis, parálisis facial [PF] e hipoacusia [conductiva, neurosensorial y mixta]). Las complicaciones intracraneales comprenden: meningitis, absceso epidural y subdural, absceso cerebral, trombosis del seno lateral (TSL) e hidrocéfalo ótico.1,9-11 Actualmente constituyen un problema de salud en la población pediátrica, a pesar del uso extendido de antibióticos, ya que el oído medio, por su localización en la porción petrosa del hueso temporal, en íntima relación anatómica con la base del cráneo, condiciona que la OMA y la OMC agudizada puedan evolucionar potencialmente a una complicación.2,9-11 En la mayoría de las series actuales, las OMCC no controladas se reportan responsables de complicaciones intracraneales.10 Su disminución actual puede condicionar retrasos diagnósticos por falta de sospecha clínica, enmascaramiento por tratamientos antibióticos previos, y mal pronóstico, por lo cual siguen siendo procesos graves que ponen en peligro la vida del enfermo. El diagnóstico de las OM complicadas se valora correlacionando los indicadores clínicos, otoscópicos, otomicroscópicos, las lesiones anatómicas observadas en estudios radiológicos (simples de mastoides y la tomografía axial computarizada [TAC] de alta resolución del oído [cortes axiales y coronales]), que ofrecen el diagnóstico certero de la extensión de la lesión.1-3,10-13 El presente trabajo, muestra una revisión de la literatura en relación con las complicaciones de las OMA y OMC.
EPIDEMIOLOGÍA
La incidencia de las complicaciones de las OMA pasó de ser frecuente y habitualmente mortal, a rara, con bajo índice de morbilidad y mortalidad a partir de la aparición de los antibióticos.2,11 Zalzal G2 reporta que el índice de complicaciones en la OMA ha declinado significativamente: 25 a 50 % (era preantibiótica), y después de los años 80 (0,02 a 0,04 %), cuando todas fueron tratadas con antimicrobianos. Después de 1980 se publican nuevamente índices importantes de complicaciones, especialmente en países subdesarrollados con extrema pobreza.9,14-16
Según datos de la OMS se describe la OMA como enfermedad generalmente inocua, pero muy prevalente, ya que hay en el mundo actualmente 120 millones de personas, principalmente en países en vías de desarrollo, que la padecen, y estas cifras incluyen 7 millones de niños.3 Se reporta recientemente el aumento de la incidencia de complicaciones extracraneales e intracraneales en la OMCC asociada a pérdida auditiva en pacientes pediátricos.17 Reportes actuales describen, según estudio de 22 años, 285 pacientes con OMA y OMC asociadas a complicaciones otógenas,1 y en otra serie, complicaciones infecciosas del hueso temporal en pacientes menores de 20 años.18 En Cuba se desconoce su frecuencia, aunque es motivo de consulta en las instituciones pediátricas.
ETIOLOGÍA
La OMA se considera un proceso infeccioso frecuente durante los 2 primeros años de la vida. La mayoría de los niños padecen, al menos, un episodio antes de la edad escolar, y un tercio desarrolla OMA, que puede producir complicaciones graves (mastoiditis, meningitis) e hipoacusia.2,4 Los factores favorecedores de OMAR se relacionan con el sexo masculino, las alteraciones de la respuesta inmunitaria por parte del huésped, la corta edad (mayor frecuencia entre 6 y 24 meses), e inicio precoz del primer episodio de otitis antes de los primeros 4-6 meses de vida, características anatómicas de la trompa de Eustaquio (TE) -ancha, corta, casi horizontal, soporte cartilaginoso flexible y mecanismo de apertura ineficaz por inmadurez del músculo periestafilino externo-, tamaño de la nasofaringe, mayor cantidad de tejido linfoide regional que se hipertrofia por infecciones rinofaríngeas repetidas, que favorece la disfunción tubárica y ascenso de secreciones al oído medio. Hay también factores ambientales que alteran la respuesta inmunitaria y modifican la carga microbiana del huésped: cuidado fuera del hogar, lactancia artificial, fumadores en el medio familiar, número de hermanos, adenoiditis, uso de tetes en > 6 meses, época del año (meses invernales) y hábitat socioeconómico; así como la predisposición genética: trisomía 21, antecedentes familiares de otitis, hermanos con OMAR; y también las enfermedades asociadas (inmunodeficiencias primarias o secundarias, atopia, malformaciones craneofaciales, fisura palatina aparente u oculta [úvula bífida], el reflujo gastroesofágico, las infecciones de vías respiratorias superiores [IVRS] frecuentes, el recién nacido pretérmino con persistencia del líquido amniótico en oído medio, ventilado en unidades de cuidados intensivos [UCI]).2,4
Los defectos del desarrollo, como fisura palatina o secuencia labio-paladar hendidos, afectan el funcionamiento de la TE, la ventilación y el drenaje de la cavidad del oído medio. Se produce una OM con efusión crónica, y posteriormente formación de bolsas de retracción con invasión de la piel, infección crónica, colesteatoma y posibles complicaciones extracraneales e intracraneales, según reportes de Bluestone CD15 y Quintero JL.19,20 Se ha demostrado por Alves AL,21 en estudios histológicos de colesteatoma del oído medio, la presencia de epitelio escamoso queratinizado alrededor de la perimatriz. Hilton CW,22 reporta recientemente, en estudios inmunohistoquímicos, el factor de necrosis tumoral alpha-1 (TNF a-1) y la interleuquina 8 (IL-8) en muestras de tejido colesteatomatoso.
Entre los factores genéticos se discute si lo que trasmiten los genes puede ser la propensión a la enfermedad.23 James y otros24 reportan novedosas investigaciones sobre el origen genético del colesteatoma pediátrico y su relación con las mutaciones del gen GJB2 y GJB6. La etiología del colesteatoma adquirido es actualmente motivo de grandes controversias, y aún se encuentra en el campo de la investigación.25 Se señala que las OMAR, inadecuadamente tratadas durante la infancia, suelen preceder a la OMC, pueden dejar la MT perforada y atrófica, con infección crónica secundaria, y facilitar, por esta vía de contaminación, la colonización bacteriana polimicrobiana. Factores constitucionales, como las alteraciones del sistema inmunológico del paciente, se reportan como condiciones importantes que favorecen las OMA y las OMC asociadas a complicaciones.4,22 Los patógenos más frecuentes en las complicaciones se describen como los mismos de las OMA: Streptococcus pneumoniae, Haemophilus infuenzae no capsulados y Moraxella catarrhalis.2,26 Otros gérmenes implicados en la OMA complicada, como Streptococcus pyogenes, se reporta actualmente que raramente causa mastoiditis.27 El Staphylococcus aureus tiene un papel menos significativo, y otros como E. coli, Pseudomonas aeruginosa y anaerobios se consideran menos frecuentes.4 Bakhos5 y Zernotti16 describen el Streptoccocus pneumoniae como el principal causante de las OMA complicadas en pacientes pediátricos, y su resistencia a las penicilinas está en franco aumento en el mundo. Similares resultados informan Alvarez I y otros.26 En la OMC complicada se reportan Pseudomona aeuruginosa, Proteus sp, Staphylococus aureus, Klebsiella sp y anaerobios, con predominio de los Gram negativos,3,7,17,20 y se describen 3 vías de infección: al mantenerse la MT perforada la mucosa del oído medio deja de ser aséptica y se contamina a través del CAE; se alteran las condiciones normales de ventilación tubárica, y se transforma la TE en una vía de infección; y también se describe la hematógena.15
La disfunción tubárica, con afectación del intercambio gaseoso, el desequilibrio de presión y la falta de aireación del oído medio, produce una presión negativa en la caja timpánica, alteraciones inflamatorias en el revestimiento mucoso, edema y trasudación, de gran importancia en la génesis de la OMEC. Las enzimas proteolíticas del líquido acumulado en el oído medio producen una reabsorción de la capa fibroelástica de la MT, y en esta zona depresible, se produce perforación espontánea habitualmente mesotimpánica. Si la OMEC evoluciona a la atelectasia, el tímpano atrofiado se desplaza hacia la caja a nivel del ático, y da lugar a la formación de bolsillos de retracción con retención de detritus epidérmicos, infección, y posterior perforación marginal, con mayor riesgo de complicaciones por colesteatoma.15
Entre los factores que influyen en las complicaciones de las OMA se señalan el tipo y virulencia del microorganismo infectante (Streptococcus pneumoniae y diferentes serotipos), disminuye la resistencia del huésped, la susceptibilidad a medicamentos antibacterianos disponibles para el tratamiento o dosis insuficiente, así como un tiempo de administración inadecuado y selección del medicamento menos efectivo.2,4,15,27
El colesteatoma está formado histológicamente por la matriz: epitelio escamoso queratinizado bien diferenciado, enzimas proteolíticas que incluyen las metaloproteinasas de la matriz (MMPs), que inducen proliferación y migración de queratinocitos (células que sintetizan la queratina, precursora de esta presentes en la capa basal de la piel), y perimatriz: fibras colágenas, fibras elásticas y células inflamatorias. La enzima colagenaza, producida por los queratinocitos, se considera más activa y responsable de erosión ósea y colesteatomas complicados en edades pediátricas.25,28
Las vías de diseminación de la infección en las OM complicadas pueden ser:
I- Extensión por osteotromboflebitis: conductos vasculares en el hueso intacto en los primeros días de la infección.
II- Extensión por erosión ósea: OMA (en temporales neumatizados, mastoiditis coalescente) y en la OMCC.
III- Extensión por vías preformadas: ventanas oval y redonda, conducto auditivo interno (CAI), conducto perilinfático o endolinfático, congénitas como las dehiscencias óseas, fracturas craneales, posquirúrgicas (estapedectomía, laberintectomia, y mastoidectomía). Se presentan tempranamente.15 La patogénesis se considera multifactorial, ya que incluye factores individuales, anatómicos, genéticos, ambientales, infecciosos e inflamatorios.1-4,15,27
COMPLICACIONES
Las complicaciones de la OMA y OMC pueden poner en riesgo la vida de los pacientes, y se precisa una estrecha colaboración entre atención primaria de salud y atención secundaria, para ofrecer tratamiento hospitalario multidisciplinario de otocirujanos, infectólogos, pediatras y neurocirujanos. Actualmente la mastoiditis aguda se reporta en la OMA como una de las complicaciones más comunes,2,5,11 y el colesteatoma pediátrico más extenso, agresivo y susceptible de complicarse.3,21,28
Se describen como signos y síntomas de alarma de complicación otógena, frente a una OMA con evolución tórpida, las siguientes: aparición de otalgia intensa resistente a tratamiento, acompañada de aumento de volumen retroauricular que desplaza el pabellón hacia abajo y hacia delante15 (la otoscopia en las fases iniciales indica cambios en las características de la otorrea, que aparece en forma profusa o cesa bruscamente, y una caída de la pared posterosuperior del CAE); trastornos de la motilidad de la cara, que en el transcurso de pocas horas se hace completa y aparece el signo de Bell; vértigo periférico, de aparición espontánea o a los movimientos de la cabeza; así como también el nistagmo horizonto-rotatorio.11,15
Las complicaciones intracraneales se consideran muy graves, y el diagnóstico temprano influye en las cifras de mortalidad.1 El médico estará alerta ante el cuadro de una OMA que coincide con cefalea intensa inexplicable, irritabilidad, fotofobia y otros signos meníngeos; en caso de TSL, la aparición de una fiebre en agujas se describe como clásica.2,5,11
Complicaciones extracraneales
Mastoiditis aguda: se considera la complicación extracraneal más frecuente en la otitis media supurada (aguda y crónica),29 aunque ha declinado significativamente. Prácticamente todos los niños presentan en el curso de la OMA inflamación de las celdas aéreas mastoideas y tendrán fluido en mastoides; en consecuencia, la mastoiditis aguda constituye una extensión y una parte natural del proceso infeccioso agudo del oído medio. En este estadio muy común de la mastoiditis, no hay signos ni síntomas específicos de infección mastoidea ni evidencia de osteítis mastoidea en la TAC, el proceso suele ser reversible si se resuelve el derrame de oído medio y mastoides, después del tratamiento de la infección aguda; pero si esto no ocurre, puede sobrevenir mastoiditis aguda con periostitis y osteítis mastoidea aguda (con absceso subperióstico o sin él).2,5,9
Cuando se trata de una mastoiditis aguda con periostitis, la infección de las celdas aéreas mastoideas se propaga hacia el periostio. En la periostitis (tromboflebitis del periostio) la vía de infección corresponde con los vasos venosos, fundamentalmente la vena emisaria mastoidea. Clínicamente se manifestará con otalgia (dolor posauricular o mastoideo), espontáneo o a la palpación, pulsátil, resistente a los analgésicos habituales, fiebre, eritema, hiperestesia, ligera tumefacción posauricular con borramiento del surco retroauricular, y pabellón desplazado en los sentidos inferior y anterior.2,5,9,15
En la mastoiditis coalescente aguda (osteítis mastoidea aguda o mastoiditis quirúrgica aguda), la infección de las estructuras óseas de la mastoides progresa, generalmente en las muy neumatizadas, se produce acúmulo de secreciones en la cavidad mastoidea, aumento de la presión y necrosis de trabéculas o tabiques óseos, con la consiguiente coalescencia de pus (empiema mastoideo). El pus se puede extender, con exteriorización en las direcciones siguientes: lateralmente, retroauricular (absceso subperióstico); raíz del cigoma; laterocervical (absceso de Bezold), por detrás del músculo esternocleidomastoideo; medial, hacia las celdas aéreas petrosas (petrositis); y posterior, hacia el hueso occipital (absceso de Citelli). Clínicamente los principales signos de osteítis mastoidea reflejan la inflamación subyacente: tumefacción, hiperestesia, eritema de la región mastoidea y pabellón desplazado. En la otoscopia se puede observar secreción ótica purulenta persistente, a través de la perforación, caída de la pared posterosuperior del CAE, absceso subperióstico mastoideo fluctuante, o fístula retroauricular. En ocasiones el paciente puede presentar síntomas de toxicidad. Es importante señalar que en algunos casos no se evidencia la otitis, el niño puede presentar un síndrome febril de causa desconocida y el estado de la MT puede no ser una indicación confiable de infección mastoidea. En estos pacientes el estudio imaginológico de la mastoides constituye una herramienta diagnóstica importante para detectar osteítis.9,13,15
Absceso posauricular o absceso subperióstico mastoideo: más frecuente y común en edades pediátricas (50 % de los niños con mastoiditis, especialmente si el diagnóstico fuese tardío y el tratamiento inadecuado). Existe diseminación por los conductos vasculares diminutos en área cribosa, el pabellón auricular se desplaza hacia delante, afuera y abajo.
Absceso cigomático: inflamación por arriba y delante del oído, el diagnóstico diferencial se realiza con el edema parotídeo.
Absceso de Bezold: aunque actualmente se considera raro, todavía puede observarse. Ocurre cuando la infección penetra en la cresta digástrica y se perfora el vértice de la mastoides, con infección entre el músculo esternocleidomastoideo y digástrico. Presenta edema del triángulo posterior del cuello.
Absceso de Mouret o yugulodigástrico: colección de pus entre el músculo digástrico y la vena yugular interna, asociado a dolores cervicales profundos, fiebre, odinofagia y disfagia. En el examen de orofaringe se evidencia abombamiento de la pared lateral faríngea que desplaza la amígdala hacia adentro. La TAC confirma el diagnóstico.9,15
Absceso de Luc: se produce por extensión a la cortical del CAE y la apertura en la luz del conducto. Puede confundirse con una otitis externa, pero la TAC proporciona el diagnóstico.9
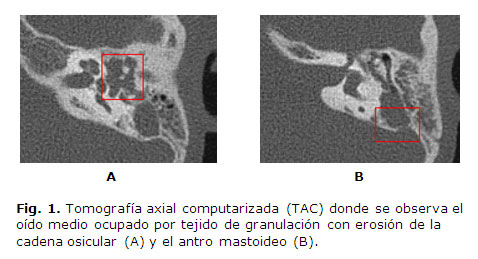
La conducta en la OMA consiste en ingreso, tímpanocentesis inmediata para aspiración y estudio microbiológico del derrame de oído medio-mastoides, y miringotomía. Otros autores recomiendan colocar tubo de timpanostomía, que mejorará el drenaje. Se debe indicar antibioticoterapia por vía intravenosa contra S. pneumoniae y H. influenzae. Se realizará tratamiento quirúrgico (mastoidectomía simple) en los casos en que persistan los síntomas de infección aguda como fiebre, otalgia y respuesta inadecuada al antibiótico; si no mejora progresivamente el compromiso retroauricular; o en los casos que no se indica un tratamiento oportuno, y se produce una osteítis mastoidea aguda y un escape de la secreción purulenta hacia zonas contiguas, extracraneal o intracraneal.2,5,9,11,15 Cuando se produce la infección aguda mastoidea en un niño con OMC, sin o con colesteatoma, está indicado el tratamiento quirúrgico.10,18,20,28 Se ilustra, con TAC de oído (Fig. 1), una paciente de nuestra serie que fue operada por una OMCC complicada con mastoiditis, absceso subperióstico mastoideo y fístula posauricular.
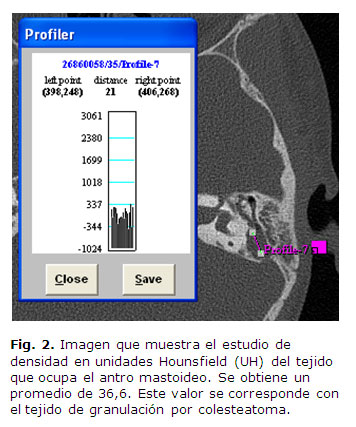
Se destaca la importancia del estudio por imágenes para la evaluación de estos pacientes, pues este caracteriza el estado de las estructuras del oído, en este caso utilizando la TAC para visualizar los detalles anatómicos de densidad ósea. Nótese la erosión de las paredes del antro y la presencia de tejido, donde se incluye un análisis de la densidad en unidades Hounsfield con valores medios correspondientes a los observados en el colesteatoma (Fig. 2). Los valores de densidad descritos en la imagen coinciden con los reportes de investigaciones que tratan el tema, y se obtuvo una densidad de 42,68±24,42 en el colesteatoma, y de 86,07±26,50 en pacientes con otitis media crónica no osteítica.13
Parálisis facial: la PF secundaria a una OM es una conocida complicación que ocurre en infecciones agudas o crónicas del oído medio. Puede aparecer como complicación relativamente frecuente en lactantes y niños con OMA. Su fisiopatología se encuentra en discusión, pero la osteítis, invasión bacteriana y la neurotoxicidad, podrían estar involucradas. Además, cerca del 50 % de la población presenta dehiscencia ósea congénita en la porción horizontal del nervio facial (NF).1,9,15,30 En lactantes y niños durante un episodio de OMA puede haber PF, de inicio precoz, y se describe como vía de infección directa la dehiscencia de la pared ósea del canal de Falopio. En la OMC generalmente se produce por osteolisis del acueducto de Falopio con invasión del NF por colesteatoma.1,10 En la era preantibiótica esta complicación fue frecuente en la OM, con una incidencia estimada (0,5 a 0,7 %), pero actualmente se ha vuelto un fenómeno excepcional, y su incidencia se ha reducido al 0,005 % en la evolución de una OMA.30 En la OMC la frecuencia alcanza 0,16 a 5,1 %,30,31 y otros autores reportan como hallazgo quirúrgico común la asociación de fístula laberíntica con exposición del NF.1 Esta complicación constituye una emergencia médico-quirúrgica, por lo que es de suma importancia su diagnóstico oportuno para iniciar el tratamiento adecuado: tímpanocentesis, miringotomía y el uso de antibiótico intravenoso contra S. pneumoniae y H. influenzae, que generalmente conlleva una mejoría progresiva y completa en OMA complicada con PF, sin requerir cirugía adicional (descompresión del NF). No está indicada la mastoidectomía, a menos que exista agravamiento por mastoiditis coalescente aguda.2 Cuando sobreviene PF en un niño con OMC supurada con o sin colesteatoma, está indicada la intervención quirúrgica: mastoidectomía con descompresión del NF.15,30,31
Laberintitis: se produce cuando la infección se propaga hacia el aparato coclear y vestibular, y se reporta recientemente como la complicación extracraneal más frecuente.1 La presencia de vértigos es un síntoma de alarma de laberintitis. La puerta de entrada habitualmente corresponde con ventana redonda, menos frecuente ventana oval, fístula laberíntica en canal semicircular horizontal (CSH), o colesteatoma sobre platina del estribo en la OMCC.1,10 La laberintitis serosa se reporta más leve que la supurativa, la primera secundaria a productos inflamatorios en el oído interno (OI), la segunda, debido a infección directa del OI. En la forma serosa se observa vértigo temporal y pérdida auditiva leve, y en la supurativa se evidencia vértigo grave, que generalmente se compensa, y pérdida auditiva permanente y grave.2,15
La laberintitis serosa aguda (con fístula perilinfática o sin ella), se considera una de las complicaciones más comunes de la OM.1,2 Se describe como una inflamación intralaberíntica difusa, sin pus, reversible. Las toxinas bacterianas provenientes de la infección del oído medio entran en el OI, principalmente a través de la ventana redonda indemne o por un defecto congénito, un defecto adquirido del laberinto (traumatismos de cráneo, cirugía otológica previa), o alteraciones bioquímicas dentro del laberinto.2,7,10,15 El cuadro clínico, en especial cuando hay fístula perilinfática, consiste en vértigo, hipoacusia neurosensorial súbita, leve o moderada, progresiva o fluctuante, en asociación con OM complicada con osteítis mastoidea. Generalmente, cuando la laberintitis se produce como complicación de una OM, la hipoacusia suele ser mixta. El vértigo en lactantes y niños puede no ser evidente, o se manifiesta con caídas o torpeza al caminar. Si se produce en el curso de OMA, se indica tratamiento médico, pero si es secundaria a OMC, el tratamiento debe ser quirúrgico.1,10,15
La perilaberintitis (fístula laberíntica), está condicionada a la erosión ósea colesteatomatosa del CSH o promontorio, frecuentemente asociada a PF, y después de tratamiento quirúrgico (mastoidectomia simple o radical, laberintectomia o estapedectomía).1 El signo de la fístula laberíntica se considera positivo, si los cambios de presión en CAE producen vértigo y nistagmo. La extensión, localización y el tamaño, deben ser considerados, pues se reporta que el 35 % puede producir sordera profunda si la fístula se extiende al promontorio, y solo un 3 % si está limitada al CSH.10 Es importante señalar que la falta de síntomas y signos no garantiza ausencia de lesión ósea en el laberinto. Esta se puede evidenciar por TAC.7,10,11,13,15
La laberintitis supurativa o purulenta, por su parte, se define como la infección intralaberíntica difusa, con pérdida de la función auditiva y vestibular permanente. Las bacterias pasan del oído medio a través de una de las ventanas del laberinto hacia el líquido perilinfático. Esto implica que la infección ha invadido el líquido del OI y puede propagarse al espacio subaracnoideo a través del acueducto coclear, acueducto vestibular o CAI. El cuadro clínico generalmente se presenta como un cuadro muy agudo: nistagmo espontáneo horizonto-rotatorio, inicialmente el componente rápido se dirige hacia el oído afectado, y cuando existe pérdida completa de la función vestibular hacia el oído sano, vértigos intensos, hipoacusia que progresa en el curso de pocas horas a la cofosis, náuseas, vómitos y acúfenos. La importancia del diagnóstico precoz reside en que la laberintitis supurada puede ser seguida de PF, y constituye muchas veces, la antesala de una meningitis, y en estadios más tardíos, de un absceso cerebeloso. El tratamiento en OMA consiste en miringotomía y antibióticos intravenosos. En los casos de OMC, sobre todo la OMCC, se debe pensar en fístula laberíntica, y su tratamiento quirúrgico es inmediato, pero siempre asociado con antimicrobianos efectivos contra microorganismos Gram negativos (P. Aeruginosa y especies de Proteus).1,2,5,10,11,18
Petrositis: la inflamación de la porción petrosa del temporal se considera una complicación muy grave y rara, producida por la extensión de la infección desde el oído medio y la mastoides hacia la porción petrosa neumatizada del hueso temporal. Se describe que alrededor del 30 % de las personas tienen los huesos petrosos bien neumatizados, y que generalmente esta neumatización no se produce antes de los 3 años de edad.15 Clínicamente se caracteriza por dolor retroocular, otalgia, secreción ótica y parálisis del VI par, que provoca diplopía, y se conoce como el síndrome de Gradenigo.32 El dolor ocular se debe a irritación de la rama oftálmica del V par craneal, existe otorrea profusa, persistente y otalgia profunda. Generalmente ocurre en niños mayores. Se considera importante destacar que si después de la mastoidectomía (por mastoiditis), el paciente adulto o niño no mejora, se debe pensar en infección de la porción petrosa de la mastoides. La OMC supurada con o sin colesteatoma puede complicarse con osteomielitis petrosa crónica. Es más común que el tipo agudo, ya que no es necesario que exista neumatización de la porción petrosa, pues la infección progresa por tromboflebitis u osteítis, y puede invadir la cavidad endocraneana y complicarse con meningitis o absceso extradural. Se describen como signos clínicos menos frecuentes la debilidad facial transitoria, el vértigo leve recurrente y la fiebre.11,32 La TAC y la resonancia magnética nuclear (RMN) se consideran esenciales para el diagnóstico, tratamiento y seguimiento. Si coexiste osteomielitis petrosa aguda y osteítis mastoidea aguda, será necesario el tratamiento quirúrgico.11,15,32
Complicaciones intracraneales
Se reportan como las más graves, raras y de mayor peligro, la mayoría de las veces por colesteatoma.1,9,10,33
Meningitis: las complicaciones intracraneales más frecuentes incluyen meningitis, absceso cerebral y TSL.34-36 En la OMA de tórpida evolución se observa una diseminación a través de una erosión ósea, ventanas oval o redonda, o por flebitis retrógrada.15,34 La OMA causa más meningitis, pero la OMC genera mayor mortalidad, y esta debe vigilarse estrictamente.1-3,10,34 Se conoce como meningitis a la inflamación de las meninges y del líquido cefalorraquídeo (LCR) que contienen. En la meningitis bacteriana los microorganismos pueden llegar al espacio subaracnoideo por 3 vías: hematógena, a partir de un foco de vecindad, secundarios a otitis o fístula pericraneal; propagación retrógrada, mecanismo que envía un trombo pequeño infectado a través de la vena emisaria, cuando la infección está próxima al SNC, como ocurre en las sinusitis, otitis o mastoiditis; y diseminación directa o por contigüidad, se propaga la infección proveniente de focos infecciosos próximos, como celulitis orbitaria, osteomielitis craneal, infecciones de tejidos blandos, senos paranasales o de senos dérmicos o mielomeningoceles (malformaciones congénitas que comunican al SNC con el exterior). Se describe otra vía congénita preformada, sobre todo, en neonatos y lactantes, por persistencia de la sutura petroescamosa.15,34
Los traumatismos craneoencefálicos, con fisura de base craneal, rotura de duramadre y fístula de LCR, por la nariz (rinorraquia) o por el oído (otorraquia), favorecen el acceso directo de microorganismos desde estas cavidades sépticas a la cavidad craneal.2,15 En el cuadro clínico se presenta irritabilidad meníngea, con los correspondientes signos de rigidez de nuca, Kernig y Brudzinski, acompañados de cefalea, vómitos, fiebre y deterioro del nivel de conciencia. En el lactante puede observarse abultamiento de fontanelas. Raramente se producen signos focales neurológicos, pero sí puede haber convulsiones. Las meningitis, independientemente de su origen, pueden provocar laberintitis a través de las vías naturales, especialmente el CAI, que cursarán con cofosis bilateral y serán causa de sordera en edades prelocutivas. Se diagnostica mediante TAC que evalúa anomalías del oído interno (fístula), RMN para evaluar tejidos blandos del SNC, y punción lumbar (PL) para estudio citoquímico y cultivo del LCR, donde se aprecia: pleocitosis, abundantes polimorfonucleares, disminución de la glucorraquia y aumento moderado del nivel proteico. Se debe realizar tinción mediante técnica de Gram, estudio microscópico y cultivo con antibiograma, para detectar el germen causal y tratamiento adecuado.2,7,15 Actualmente se describe OMA y meningitis en niños con implantes cocleares.37 El tratamiento antibiótico de una meningitis otógena dependerá del germen causal y el antibiograma, pero generalmente se recomienda la administración de altas dosis de antimicrobianos apropiados. En la OMA los gérmenes relacionados corresponden con el Streptoccocus pneumoniae y Haemophilus influenzae tipo B, aunque este último prácticamente ha desaparecido en muchos países desde el uso generalizado de la vacuna de polisacárido conjugado.34 Se recomienda tratamiento intravenoso con cefalosporinas de tercera generación, de elección la ceftriazona, tímpanocentesis y miringotomía para cultivo y drenaje. En caso de confirmarse infección por S. pneumoniae, está protocolizado el uso de vancomicina intravenosa.2,3,15,34 En la OMC las bacterias relacionadas corresponden con Proteus sp., Klebsiella sp. y anaerobios.3 En la OMCC la otocirugía es imprescindible si el estado del paciente lo permite. Está indicado el tratamiento antibiótico con ceftazidima y vancomicina, esta última si hay presencia de Staphylococcus meticillin resistente (SMR).2,10,15,34-37
Trombosis del seno lateral: Zalzal G la reporta más frecuente, a pesar del uso de antibióticos.2 El seno lateral (SL) recibe la sangre de la mastoides y el oído medio a través de pequeñas venas emisarias, y produce la trombosis del seno lateral, secundariamente a procesos óticos agudos y crónicos por erosión de la pared ósea del seno, como resultado de una mastoiditis coalescente o crónica.38 Se observó como una complicación común en niños (1970-1992) y la tasa de mortalidad actualmente es de 17-24 %.2 Se caracteriza clínicamente por otalgia y cefalea acompañada o no de vómitos, diplopía, fotofobia, vértigo y rigidez de nuca. Fiebre en agujas con mejoría interpicos y escalofríos en un paciente con otorrea, sugiere una TSL.15 Cuando se ocluye la luz del seno, puede observarse cefalea, papiledema e incremento de la presión del LCR; al extenderse al bulbo de la yugular y vena yugular interna, se evidencia dolor cervical, más intenso con los movimientos de rotación. Al examen otológico en la TSL se observa edema en la punta de la mastoides y dolor, causados por obstrucción de las venas emisarias mastoideas (signo de Griesinger).2,38 En la TAC de cráneo se observa el signo delta vacío y la RMN muestra el sigmoide bloqueado.2,39 El tratamiento consiste en la administración de antibióticos apropiados y la solución quirúrgica del foco otológico. Se debe realizar la mastoidectomía, exponer el SL, resecar el trombo y drenar el absceso perisinusal, colocar una aguja en este, y si se observa salida de sangre y esta se coagula, significa que se recanalizó el seno. En ocasiones puede ser necesaria la intervención conjunta con el neurocirujano. Raras veces se tiene que ligar la vena yugular interna a nivel cervical para aislar la infección y prevenir la formación de émbolos.38-40
Hidrocefalia otítica: se asocia generalmente con la TSL. Se describe como un síndrome de hipertensión endocraneana, sin absceso cerebral, y la patogenia aún se encuentra en investigación.41 Clínicamente el niño presenta cefalea persistente, alteraciones visuales, parálisis del VI par (ipsilateral o bilateral), ocasionalmente náuseas, vómitos, visión borrosa, diplopía, papiledema y aumento de la presión del LCR, sin signos meníngeos. La TAC puede mostrar el signo delta.38,39 Si no existe mejoría, aparecen complicaciones: pérdida de la visión por atrofia óptica, parálisis de los pares IX, X, XI y émbolos sépticos en pulmón. El tratamiento médico consiste en antibióticos, esteroides, disminuir la presión del LCR (punciones lumbares repetidas) y manitol. El tratamiento quirúrgico se basa en mastoidectomía amplia y exposición del SL.2,9,15
Absceso epidural (extradural): se debe a la erosión del hueso adyacente a la duramadre por un colesteatoma, una infección o ambos, colección de pus y presencia de tejido de granulación entre la cara externa de la duramadre y el hueso temporal. El cuadro clínico consiste en otalgia severa, hipertermia leve o ausente, cefalea persistente en la región temporal, pulsátil, malestar general, anorexia, otorrea abundante, cremosa y pulsátil. No existen signos neurológicos específicos. La TAC simple y contrastada constituye una herramienta importante que puede mostrar el absceso epidural.42 Por lo general cursa en forma asintomática. El tratamiento antimicrobiano puede ayudar a su prevención, pero el tratamiento conjunto entre otocirujano y neurocirujano, para drenaje neuroquirúrgico del absceso y mastoidectomía, está indicado en forma inmediata, y debe ser informado a padres o tutores.1,2,16,18,42,43
Absceso subdural: se describe como una colección de pus dentro del espacio virtual entre la duramadre por fuera y la aracnoides por dentro. Se reporta, como una complicación poco frecuente, que puede producirse como extensión directa o tromboflebitis a través de los vasos venosos. El cuadro clínico se caracteriza en los niños por fiebre, estado tóxico, cefalea severa temporoparietal y signos neurológicos (como hemiplejia y convulsiones recurrentes). Otros hallazgos del SNC comprenden somnolencia, estupor, desviación de los ojos, rigidez de nuca y signo de Kernig positivo. La TAC permite confirmar el diagnóstico. El recuento leucocitario periférico se encuentra aumentado. La presión del LCR se evidencia elevada, existe pleocitosis, aumento de leucocitos polimorfonucleares y glucorraquia normal. El tratamiento consiste en antibioticoterapia intravenosa intensiva, drenaje neuroquirúrgico y mastoidectomía.1,2,15
Absceso cerebral: se define como una colección purulenta localizada en el parénquima cerebral. Puede sobrevenir directamente de una infección aguda o crónica del oído medio, mastoides, o una infección adyacente (TSL, petrositis o meningitis). Se reportan, como entidad infrecuente en edad pediátrica, secundaria a meningitis neonatal, complicaciones de infecciones óticas y rinosinusales.34 La TAC, nuevas técnicas quirúrgicas y la disponibilidad de mejores antimicrobianos, han reducido notablemente la mortalidad del absceso cerebral. Las localizaciones más frecuentes corresponden con el temporal y cerebelo, y generalmente se asocian con parálisis de nervios craneales.34,44 La OMC, con o sin colesteatoma, puede provocar entrada de microorganismos al tejido cerebral, a través del tegmen-tympani. Se señalan entre los gérmenes causales cocos grampositivos: Streptoccocus pyogenes, S. pneumoniae, S. viridans y Staphylococcus aureus; cocobacilos gramnegativos: Haemophilus influenzae; bacilos entéricos gramnegativos: Escherichia coli, especies de Proteus, Enterobacter aerogenes, Enterobacter cloacae y bacterias no fermentadoras como Pseudomona aeruginosa; y bacterias anaeróbicas: especies de Eubacterium y especies de Peptostreptococcus.9,15,34 Los signos de invasión del SNC como hipertermia y escalofríos, pueden estar presentes o ausentes. Si se generaliza la infección aparecen los signos de esta generalización, que son: cefalea severa, continua, vómitos, somnolencia, convulsiones, irritabilidad, cambios de personalidad, alteración del sensorio, anorexia, pérdida de peso y meningismo. Aparecen, además, los signos de una lesión endocraneana en expansión, y otros específicos de compromiso de los lóbulos temporal y cerebeloso como vértigo, convulsiones focales, defectos del campo visual y nistagmo. Los abscesos del lóbulo temporal pueden ser silentes.44,45 Puede existir secreción ótica purulenta y persistente, lo que sugiere que este es el sitio primario de la infección. Los signos terminales son coma, papiledema y alteraciones cardiovasculares. El diagnóstico se basa en los hallazgos clínico-otológicos y tomográficos. El tratamiento, conjuntamente entre otocirujanos y neurocirujanos, consiste en drenaje del absceso y mastoidectomía.15,34,44,45
El estudio por los residentes, médicos generales y especialistas noveles de Otorrinolaringología y Pediatría, de las OMA y crónicas y sus complicaciones, es fundamental para lograr un diagnóstico precoz y una intervención temprana, lo cual contribuye a evitar o disminuir las complicaciones de las OM, de gran impacto en la calidad de vida de los niños.
REFERENCIAS BIBLIOGRÁFICAS
1. Wu JF, Jin Z, Yang JM, Liu YH, Duan ML. Extracranial and intracranial complications of otitis media: 22 year clinical experience and analysis. Acta Otolaryngology. 2012;132:261-5.
2. Zalzal G. Complicaciones de la otitis media aguda. En: Sih T, Chinski A, Eavey R, Godinho R, editores. Manual de Otorrinolaringología Pediátrica de la IAPO. Brazil: Vida & Consciência; 2007. p. 280-2.
3. Quintero JL. Otitis media crónica. En: De la Torre E, Pelayo EJ, editores. Pediatría. V6. La Habana: Editorial Ciencias Médicas; 2011. p. 2644-54.
4. De la Flor J. Infecciones de vías respiratorias altas II. Otitis media: etiología, clínica, diagnóstico, complicación y tratamiento; otitis media recurrente y otitis media crónica; otitis externa. En: Prandi F, Del Pozo J, Hidalgo I, De la Flor J, editores, et al. Pediatría Integral. V XIII. Madrid: Ergon; 2009. p. 333-55.
5. Bakhos D, Trijolet JP, Morinieri S, Pondaven S, Al Zahrani M, Lescanne E. Conservative management of acute mastoiditis in children. Arch Otolaryngol Head Neck Surg. 2011;137(4):346-50.
6. Garcés-Sánchez M, Diez-Domingo J, Álvarez de Labiada T, Planelles V, Graullera M, Baldo JM, et al. Epidemiología e impacto de la otitis media aguda en la comunidad Valenciana. An Pediatr Barc. 2004;60(2):125-32.
7. Dubey SP, Larawin V. Complications of chronic suppurative otitis media and their management. Laryngoscope. 2007;117(2):264-7.
8. Olszewska E, Sudhoff H. Comparative cytokeratin distribution patterns in cholesteatoma epithelium. Histol Histopathol. 2007;22:37-42.
9. Jiménez I, Hernández-Sampelayo MT. Complicaciones de la otitis media. An Pediatr, Monogr. 2003;1(1):13-23.
10. Smith JA, Danner CJ. Complications of Chronic Otitis Media and Cholesteatoma. Otolaryngol Clin North Am. 2006;39(6):1237-55.
11. Pelegrini S, González ME, Sommerfleck PA, Bernáldez PC. Diecisiete casos de complicaciones intratemporales de otitis media aguda en niños en dos años. Acta Otorrinolaringol Esp. 2012;63(1):21-5.
12. De Foer B, Vercruysse JP, Pouillon M, Somers T, Casselman JW, Offeciers E. Value of high-resolution computed tomography and magnetic resonance imaging in the detection of residual cholesteatomas in primary bony obliterated mastoids. Am J Otolaryngol. 2007;28(4):230-4.
13. Park MH, Rah YC, Kim YH, Kim JH. Usefulness of computed tomography Hounsfield unit density in preoperative detection of cholesteatoma in mastoid ad antrum. Am J Otolaryngol-Head Neck Med Surg. 2011;32(3):194-7.
14. Hoberman A, Paradise Jl, Rockette HE, Shaikh N, Wald ER, Kearney DH, et al. Treatment of Acute Otitis Media in Children under 2 Years of Age. N Engl Med. 2011;364:105-15.
15. Bluestone CD, Klein JO. Otitis media en lactantes y niños. 2da. ed. Buenos Aires: Panamericana; 2000. p. 243-304.
16. Zernotti ME, Casarotto C, Tosello ML, Zernotti M. Incidencia de complicaciones de otitis media. Acta Otorrinolaringol Esp. 2005;56:59-62.
17. Madana J, Yolmo D, Kalaiarasi R, Gopalakrishnan S, Sujatha S. Microbiological profile with antibiotic sensitivity pattern of cholesteatomatous chronic suppurative otitis media among children. Int J Pediatr Otorhinolaryngol. 2011;75(9):1104-8.
18. El-Kashlan HK, Harker LA, Shelton C, Aygun N, Niparko JK. Otology, Neuro-otology, and Skull Base Surgery. Middle Ear, Mastoid, and Temporal Bone. Complications of Temporal Bone Infections. In: Flint PW, Haughey BH, Lund VJ, Niparko JK, Richardson MA, Robbins KT, et al. Cummings Otolaryngology-head and Neck Surgery. 5th ed. Philadelphia: Mosby; 2010. p. 1979-98.
19. Quintero-Noa JL, García-Martínez DA, Hernández-Cordero MC, Valls-Pérez O. Colesteatoma asociado a secuencia de labio y paladar hendidos. Rev Cubana Pediatr [serie en Internet]. 2008 Jun [citado 20 de junio de 2012];80(2). Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S0034-75312008000200013&lng=es&nrm=iso&tlng=es
20. Quintero-Noa JL, Álvarez-Lam I, Hernández-Cordero MC, Carrillo- Valdés B, Yepe-Oliveros M, Cordero-López G. Manejo clínico quirúrgico de la otitis media crónica colesteatomatosa en el niño. Rev Cubana Pediatr [serie en Internet]. 2007 Dic [citado 8 de junio de 2012];79(4). Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S0034-75312007000400001&lng=es&nrm=iso&tlng=es
21. Alves AL, Pereira CS, Ribeiro FA, Fregnani JH. Analysis of histopathological aspects in acquired middle ear cholesteatoma. Braz J Otorhinolaryngol. 2008;74:835-41.
22. Hilton CW, Ondrey FG, Wuertz BR, Levine SC. Interleukin-8 Production in Response to Tumor Necrosis Factor-Alpha by Cholesteatoma Keratinocytes in Cell Culture. Laryngoscope. 2011;121:372-4.
23. Depreux FS, Darrow K, Conner DA, Eavey RD, Liberman MC, Seidman CE, et al. Eya 4-deficient mice are a model for heritable otitis media. J Clin Investigation. 2008;118:651-8.
24. James AL, Chadha NK, Papsin BC, Stockley TL. Pediatric Cholesteatoma and Variants in the Gene Encoding Connexin 26. Laryngoscope. 2010;120:183-7.
25. Quintero-Noa JL, Macias-Abraham C, Hernández-Cordero MC, Meléndez-Quintero LL. Etiología del colesteatoma ótico. Rev Cubana Pediatr [serie en Internet]. 2011 Dic [citado 8 de junio de 2012];83(4). Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S0034 -75312011000400007&lng=es&nrm=iso&tlng=es
26. Álvarez-Lam I, Quintero-Noa J, Villavicencio-Cordovés E, Ponce-Bittar J, Tamargo-Martínez I, Quiñones-Pérez D, et al. Caracterización clínico-epidemiológica de la otitis media aguda en pacientes pediátricos. Rev Cubana Pediatr [serie en Internet]. 2011 Sep [citado 20 de junio de 2012];83(3). Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S0034-75312011000300006&lng=es&nrm=iso&tlng=es
27. Klein JO. Is Acute Otitis Media a Treatable disease? N Engl J Med. 2011;364(2):168-9.
28. Yung M, Jacobsen NL, Vowler SL. A 5-years observational study of the outcome in pediatric cholesteatoma surgery. Otol Neurotol. 2007;28(8):1038-40.
29. Mostafa BE, El Fiky LM, El Sharnouby MM. Complications of suppurative otitis media: still a problem in the 21st century. ORL J Otorhinolaryngol Relat Spec. 2009;71(2):87-92.
30. Royer M, Stott C, Paz M. Parálisis facial en otitis media: Revisión bibliográfica. Otorrinolaringol Cir Cabeza Cuello. 2007;67:225-63.
31. Quintero JL, Paz A, Hernández MC, Yepe M, Cordero G, Meléndez P. Descompresión del nervio facial en la otitis media crónica colesteatomatosa complicada. Rev Habanera Ciencias Médicas [serie en Internet]. 2005 ene-mar [citado 25 de enero de 2012];4(12). Disponible en: http://bvs.sld.cu/revistas/rhab/articulorev12/julianis.htm
32. Guedes V, Gallegos P, Ferrero A, García M, Casanovas A, Georgetti B, et al. Síndrome de Gradenigo: comunicación de un caso. Arch Argent Pediatr. 2010;108(3):74-5.
33. Hafidh MA, Keogh I, Walsh RM, Rawluk D. Otogenic Intracranial Complication. A 7-year retrospective review. Am J Otolaryngol. 2006;27(6):390-5.
34. Fernández-Viladrich PF, Cabellos C, Navas E, Martinez-Lacasa J, Gatell JH. Protocolo II. Infecciones del sistema nervioso central. Sociedad Española de Enfermedades Infecciosas y Microbiología Clínica [homepage en Internet]. Hospital Bellvitge, Barcelona [citado 10 de mayo de 2012]. Disponible en: http://www.seimc.org/documentos/protocolos/clinicos/proto2.htm
35. O'Connor TE, Perry CF, Lannigan FJ. Complications of otitis media in Indigenous and non-Indigenous children. Med J Aust. 2009;191(9 Suppl):S60-4.
36. Wanna GB, Dharamsi LM, Moss JR, Bennett ML, Thompson RC, Haynes DS. Contemporary management of intracranial complications of otitis media. Otol Neurotol. 2010;31(1):111-7.
37. Rubin LG. Prevention and Treatment of Meningitis and Acute Otitis Media in Children with Cochlear Implants. Otology Neurology. 2010;31:1331-3.
38. Alonso-Ojembarrena A, Amigo C, Martínez-Pérez J, Rubio de Villanueva JL. Trombosis del seno sigmoide tras una otitis media. An Pediatr Barc. 2006;65(5):500-10.
39. Ernil J, Lee Y. The Empty Delta Sign. Radiology. 2002;224(3):788-9.
40. Matar NE, Rassi SJ, Melkane AE, Haddad AC. Lateral sinus thrombosis in the pediatric population: multiple presentations for a potentially lethal disease. Pediatr Emerg Care. 2009;25(10):681-3.
41. Viswanatha B. Otitic hydrocephalus: a report of 2 cases. Ear Nose Throat J. 2010;89(7):34-7.
42. Hernández-Cordero MC, Quintero-Noa JL, Valls- Pérez O, Alvarez-Lam I. Importancia de la evaluación clínico-imaginológica en el diagnóstico del colesteatoma: presentación de dos casos. Rev Cubana Pediatr [serie en Internet]. 2008 Mar [citado 20 de junio de 2012];80(1). Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S0034-75312008000100011&lng=es&nrm=iso&tlng=es
43. Quintero-Noa JL, Más-García MN, Morera-Barrios LM. El consentimiento informado en pacientes pediátricos con indicación de otocirugía por colesteatoma. Rev Habanera Ciencias Médicas [serie en Internet]. Ene-Mar, 2007 [citado 7 de junio de 2012];6(1). Disponible en: http://scielo.sld.cu/ scielo.php?script=sci_arttext&pid=S1729-519X2007000100012&lng=es&nrm=iso&tlng=es
44. Szyfter W, Kruk-Zagajewska A, Borucki L. Results of treatment of 101 otogenic brain abscesses-56-years experience. Otolaryngol Pol. 2011;65(2):88-96.
45. Vikram B. Cerebrospinal fluid otorrhea presenting in complicated chronic suppurative otitis media. Ear Nose Throat J. 2007;86(4):223-5.
Recibido: 12 de julio de 2012.
Aprobado: 4 de septiembre de 2012.
Julianis Loraine Quintero Noa. Hospital Pediátrico Docente Universitario "William Soler". San Francisco y Perla # 10 112. Reparto Altahabana, municipio Boyeros. La Habana, Cuba. Correo electrónico: julianis@infomed.sld.cu