Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Pediatría
versión impresa ISSN 0034-7531
Rev Cubana Pediatr vol.86 no.1 Ciudad de la Habana abr.-jun. 2014
Revista Cubana de Pediatría. 2014; 86(1)
ARTÍCULO ORIGINAL
Categorías de riesgo de meningitis bacteriana y tratamiento con antibióticos en neonatos con pleocitosis del líquido cefalorraquídeo
Categories of bacterial meningitis risk and antibiotic treatment for neonates with cerebrospinal fluid pleocytosis
Dr. Manuel Díaz Álvarez
Hospital Pediátrico Universitario "Juan Manuel Márquez". La Habana, Cuba.
RESUMEN
Introducción: recientemente se desarrolló y validó el Modelo de Predicción de Meningitis Bacteriana Neonatal, lo cual provee de una herramienta efectiva en la toma de decisiones médicas para la indicación de tratamiento antibiótico ante un neonato con pleocitosis del líquido cefalorraquídeo.
Objetivo: conocer cómo se procedió retrospectivamente con la indicación de tratamiento antibiótico en neonatos con pleocitosis del líquido cefalorraquídeo, antes de desarrollar el modelo mencionado, y fortalecer y fundamentar una estrategia del tratamiento antibiótico, basados en nuestro Modelo de Predicción de Meningitis Bacteriana Neonatal, ante un neonato con pleocitosis del líquido cefalorraquídeo.
Métodos: estudio retrospectivo y aplicado, que incluyó 290 neonatos evaluados por probable infección, 44 con meningitis bacteriana y 246 con meningitis aséptica, ingresados en el Servicio de Neonatología del Hospital Pediátrico "Juan Manuel Márquez", entre febrero/1992 y diciembre/2009. Se verificó la efectividad del Modelo de Predicción de Meningitis Bacteriana Neonatal, lo que permitió clasificar los pacientes en alto o bajo riesgo de meningitis bacteriana. Se determinó retrospectivamente la indicación y los motivos de tratamiento antibiótico ante un neonato con pleocitosis del líquido cefalorraquídeo, así como análisis de asociación para distintas circunstancias clínicas, entre ellas, la clasificación de riesgo de infección bacteriana severa.
Resultados: se precisó que el Modelo de Predicción de Meningitis Bacteriana Neonatal tuvo una sensibilidad y valor predictivo negativo de 100 % para meningitis bacteriana. Hubo concordancia estadísticamente significativa entre la predicción por el modelo y la clasificación de riesgo de infección bacteriana severa. Se comprobó un uso racional del tratamiento antibiótico, pues se utilizó de inmediato al diagnóstico de meningitis bacteriana en 100 % de los casos, y solo en una cuarta parte de los neonatos con meningitis aséptica, identificando como causas principales de indicación en estos casos con meningitis aséptica, tener resultados del examen del líquido cefalorraquídeo sospechosos de meningitis bacteriana sin calificar como positivos por el modelo, y hallazgos positivos para alto riesgo por los criterios de riesgo de infección bacteriana severa.
Conclusiones: la indicación de tratamiento antibiótico ha sido bastante racional, pero en algunos casos innecesario. El modelo propuesto facilita y fundamenta la indicación de tratamiento antibiótico solo cuando existe un alto riesgo de meningitis bacteriana, y también limitar con confianza su uso cuando la predicción es de bajo riesgo de meningitis bacteriana, aunque puede haber situaciones clínicas excepcionales que lo justifiquen de manera transitoria.
Palabras clave: recién nacido, meningitis bacteriana, meningitis aséptica, modelos de predicción, infección bacteriana severa, líquido cefalorraquídeo.
ABSTRACT
Introduction: recently, the neonatal bacterial meningitis predicting model was developed and validated, which provides an effective tool in medical decision-making to prescribe antibiotic treatment to neonates with cerebrospinal fluid pleocytosis.
Objective: to find out retrospectively the procedure to indicate the antibiotic treatment for neonates with cerebrospinal fluid pleocytosis prior to the development of the stated model, and to strengthen and substantiate an antibiotic treatment strategy, based on our neonatal bacterial meningitis prediction model of a newborn with cerebrospinal fluid pleocytosis.
Methods: retrospective and implemented study of 290 neonates with probable infection; 44 had bacterial meningitis and 246 aseptic meningitis. They were all admitted to the neonatology service of "Juan Manuel Marquez" pediatric hospital from February 1992 to December 2009. The effectiveness of the neonatal bacterial meningitis prediction model was verified, which allowed classifying the patients into high or low bacterial meningitis risk. The indication and the reasons for antibiotic treatment of a neonate with cerebrospinal fluid pleocytosis were retrospectively determined, as well as the analysis of the association of different clinical circumstances such as the classification of severe bacterial infection risk was made.
Results: the neonatal bacterial meningitis prediction model showed negative sensitivity and predictive value of 100 % for the bacterial meningitis. There was statistically significant agreement of the model prediction and the classification of severe bacterial infection risk. The rational use of antibiotic treatment was confirmed, since it was immediately applied to 100 % of cases after the diagnosis of bacterial meningitis, but just in one fourth of neonates with aseptic meningitis. The main causes of indication in cases of aseptic meningitis were suspected bacterial meningitis results of the cerebrospinal fluid test, which were not rated as positive in the model, and positive findings for high risk according to the risk of severe bacterial infection criteria.
Conclusions: the indication of antibiotic treatment was pretty rational, but unnecessary in some cases. The suggested model facilitates and endorses the indication of antibiotic treatment when there is high risk of bacterial meningitis and also reliably restricts its application when low risk of bacterial meningitis is predicted, although there might be exceptional clinical situations that warrant it temporarily.
Keywords: newborn, bacterial meningitis, aseptic meningitis, prediction model, severe bacterial infection, cerebrospinal fluid.
INTRODUCCIÓN
La diferenciación por emergencia entre una meningitis bacteriana (MB) y meningitis aséptica (MA), cuando se identifica pleocitosis del líquido cefalorraquídeo (LCR) en la evaluación de un recién nacido (RN) por sospecha de una infección, es a veces difícil, tanto en los aspectos clínicos como de los resultados de los exámenes de laboratorio, incluidos los indicadores del mismo LCR. Si bien la identificación temprana e instauración de un tratamiento antibiótico y de sostén inmediato es esencial para aminorar las consecuencias adversas de una MB, también es mucho más frecuente la MA, una infección del sistema nervioso central (SNC) provocada generalmente por virus y particularmente con mayor relevancia por enterovirus,1 la cual tiene un curso benigno y de muy buen pronóstico a largo plazo, en la que es innecesario el tratamiento con antibióticos.
Desde la apertura del Servicio de Neonatología en 1992 se ha utilizado de manera racional el tratamiento con antibióticos ante un RN febril con pleocitosis del LCR,2 por lo general guiados por los elementos clínicos y resultados del examen citoquímico del LCR con las características clásicas de una infección de origen viral,3,4 además de tener en consideración el resultado de la evaluación de riesgo de infección bacteriana severa (IBS) de todo RN febril sin signos de focalización (SSF).
Recientemente se ha desarrollado y validado un Modelo de Predicción de MB Neonatal (MPMBN) que alcanzó a tener una sensibilidad y valor predictivo negativo de 100 % para MB,5 resultados que nos proveen de una herramienta efectiva para la toma de decisiones médicas, en el sentido de la indicación de tratamiento antibiótico ante un paciente neonatal con pleocitosis del LCR con mucha mayor confianza. Por ello, se decidió realizar el presente estudio acerca de cómo se ha procedido en la utilización de tratamiento antibiótico ante un RN con pleocitosis del LCR, antes de desarrollar el modelo de predicción mencionado, y fortalecer una estrategia del tratamiento antibiótico, basados en nuestro MPMBN ante un RN habitualmente febril con pleocitosis del LCR.
MÉTODOS
Se realizó una investigación retrospectiva, aplicada, aprobada por el Consejo Científico del Hospital, que incluyó RNs febriles provenientes de la comunidad, evaluados por probable infección, e ingresados en el Servicio de Neonatología del Hospital Pediátrico Universitario "Juan Manuel Márquez" desde febrero de 1992 hasta diciembre de 2009, todos los cuales tuvieron pleocitosis del LCR y egresaron con el diagnóstico de meningitis.
Los criterios de exclusión fueron: haber recibido tratamiento antibiótico dentro de las 72 horas precedentes a la evaluación con punción lumbar (PL), la presencia de elementos clínicos (manifestaciones de encefalitis, lesiones dérmicas vesiculosas, púrpuras, hepato-esplenomegalia, etc.) y/o de laboratorio que orientaran a una infección del SNC prenatal o posnatal causada por herpes virus simplex, citomegalovirus u otros agentes STORCH, y también pacientes con afecciones neuroquirúrgicas. Para los pacientes con diagnóstico de MA se excluyeron los que tuvieron una infección del tracto urinario concurrente, y quienes no tuvieron todos los aspectos clínicos y de laboratorio para poder ser clasificados por nuestros criterios de riesgo de IBS.6
El Servicio de Neonatología del Hospital Pediátrico Universitario "Juan Manuel Márquez", situado en la provincia de La Habana, Cuba, es centro de referencia para los municipios del oeste de la provincia y de toda la provincia de Artemisa, con una población aproximada de 2,0 millones entre ambas, y se ha establecido funcione en la recepción de RNs egresados de los hospitales maternos, quienes resultan posteriormente enfermos en la comunidad.
El diagnóstico de MB se hizo ante la presencia de pleocitosis >30 x 10-6/L y/o hipoglucorraquia e hiperproteinorraquia del LCR, con cultivo bacteriológico positivo del LCR y/o sangre, o bien, test de aglutinación de partículas de látex específico a patógenos bacterianos positivos, si se realizó. No se incluyeron los pacientes con cultivos positivos para bacterias generalmente consideradas como contaminantes (Staphylococcus coagulasa negativo, Streptococcus viridans, diphteroides, o microorganismos mezclados) y clínica ajena a una MB. En el caso de la MA, se definió así a la presencia de manifestaciones clínicas de infección junto con pleocitosis en el LCR > 30 x 10-6/L, y necesariamente además un cultivo bacteriológico de sangre y del LCR negativo para patógenos bacterianos.
Los estudios microbiológicos se circunscribieron a la identificación de patógenos bacterianos, y no se efectuaron para identificar patógenos virales, excepto en casos clínicos con sospecha de infección por agentes STORCH. Cuando la PL resultó traumática, pero útil para conteo celular, se hizo corrección del conteo de leucocitos tomando una relación de 1:500 de leucocitos a hematíes en el LCR, lo cual equivale a la relación existente en sangre periférica. Esta fórmula ha sido aplicada en estudios anteriores.7,8
La información se obtuvo de una base de datos creada a propósito de una investigación sobre meningitis neonatal, que se lleva a cabo en el Servicio de Neonatología, en la que se van incluyendo periódicamente los pacientes en la medida que se presenten. Las variables obtenidas incluyeron información de la edad cronológica, edad gestacional, peso al nacer, sexo y manifestaciones clínicas; así como también, los resultados del examen citoquímico, la tinción de Gram y cultivo bacteriológico del LCR, cultivos bacteriológicos de otras fuentes, resultado de la aplicación del MPMBN y de los criterios de riesgo de IBS, indicación y motivo de antibioticoterapia, y estado al egreso.
La PL que estableció el diagnóstico de MA en el RN pudo realizarse al ser evaluado el paciente en emergencia debido a manifestaciones clínicas de infección, o en reevaluaciones requeridas por el mismo proceso inicial que motivó el ingreso durante su estancia en el Servicio de Neonatología, y siempre comprendida en las primeras 72 horas de admisión. Como práctica médica habitual, a todos los pacientes que recibieron una PL se les realizó examen citoquímico (conteo de células y determinación de proteínas y glucosa), junto con cultivo bacteriológico del LCR, y en los casos con resultados de sospecha de meningitis, un examen del LCR con coloración de Gram. En determinados pacientes, se realizó prueba específica de látex para diversos patógenos bacterianos, de acuerdo con la disponibilidad de este recurso. Adicionalmente, se tomaron muestras de sangre para exámenes analíticos de pesquisa de infección, incluidos los reactantes de fase aguda y hemocultivo, como es usual en todo RN febril SSF. Se utilizaron métodos tradicionales para medir conteo de leucocitos, concentraciones de proteínas y glucosa en el LCR, y todas las técnicas de obtención de las muestras para cultivos microbiológicos se realizaron cumpliendo las debidas medidas de asepsia y antisepsia.
Lo ocurrido retrospectivamente sobre la decisión de indicar tratamiento antibiótico ante un paciente, obedeció a las consideraciones particulares del médico evaluador respecto a la interpretación de la clínica y resultados de exámenes de laboratorio, que determinaron la apreciación diagnóstica y tratamiento del caso.
Los pacientes fueron clasificados en alto o bajo riesgo por categoría de riesgo de MB por el MPMBN:
- 1: alto riesgo de MB, cuando tenía presente alguna de las variables del MPMBN: apariencia de estado tóxico-infeccioso, convulsiones en el transcurso de la enfermedad, tinción de Gram del LCR positiva, glucorraquia < 1,0 mmol/L, y proporción de leucocitos polimorfonucleares en el LCR > 80 %.
- 2: bajo riesgo de MB, cuando ninguna de las anteriores variables del MPMBN estaban presentes.5
También, atendiendo a la categoría de riesgo de IBS:
- 1: alto riesgo de IBS, cuando tenía presente alguna de las variables de los criterios creados en nuestra institución: apariencia de estado tóxico-infeccioso, antecedentes de riesgo de infección perinatal, fiebre ³ 39 ºC, fiebre persistente o recurrente, conteo global de leucocitos sanguíneos < 5,0 x 109/L o ³ 20,0 x 109/L, y velocidad de sedimentación globular ³ 20 mm/h,
leucocituria >10 000/mL.
- 2: bajo riesgo de IBS, cuando ninguna de las anteriores variables de los criterios de riesgo de IBS estaban presentes.6
La apariencia tóxico-infecciosa se definió por consenso entre los médicos de asistencia del Servicio de Neonatología, para el RN que presentaba hiporreflexia, letargia, signos de pobre perfusión periférica, y marcada hiperventilación, hipoventilación o cianosis, tal como ha sido establecido por otros autores.9,10
Se calcularon frecuencias absolutas y relativas, así como medidas de resumen (mediana y media) y de dispersión (intervalo intercuartil, rango y desviación estándar), al presentar las variables demográficas y el tiempo de tratamiento antibiótico. También se calculó la sensibilidad, especificidad, valor predictivo positivo (VPP) y valor predictivo negativo (VPN) para el MPMBN. Se compararon distintas variables y asociación entre ellas, mediante el cálculo de la odds ratio (OR) con su intervalo de confianza (IC) al 95 %, y los tests chi2 y exacto de Fisher para variables categóricas, o bien, mediante el test de la t de student para variables cuantitativas. Igualmente, se utilizó el test de concordancia para el análisis de la predicción de riesgo de IBS con riesgo de MB. El criterio de decisión estadística estuvo en función del nivel de error fijado a priori (0,05). Los programas que utilizamos en los diferentes cálculos estadísticos fueron InStat 2,2 y Epidat 3,1.
RESULTADOS
En la base de datos se encontraban 403 pacientes registrados con diagnóstico de meningitis, tanto probablemente viral (MA), como bacteriana (MB) confirmada por cultivos. De los egresados con diagnóstico de MA se excluyeron 42 casos por haber recibido tratamiento antibiótico dentro de las 72 horas precedentes a la PL diagnóstica, otros 38 RNs portadores de infección del tracto urinario concurrente, 3 más se excluyeron porque llevaron tratamiento antiviral por supuesta causa herpética, y adicionalmente 30 casos a quienes faltaba algún resultado de laboratorio que impedía determinar la categoría de riesgo por el MPMBN o de los criterios de riesgo de IBS. Con estos criterios de exclusión quedaron fuera del análisis 113 casos, y resultó entonces para el estudio una población de 290 pacientes, entre los que hubo 44 con MB y 246 con MA.
Como características de la población de estudio, la mediana, intervalo intercuartil (IIC) y rango fueron para: edad cronológica 17 días (IIC: 12-22; 3 a 30 días), peso al nacer 3 205 g (IIC: 2 946-3 500; 1 880 a 4 660 g), edad gestacional 40 semanas (IIC: 39-40; 35 a 43 semanas). Hubo 152 varones y 138 hembras.
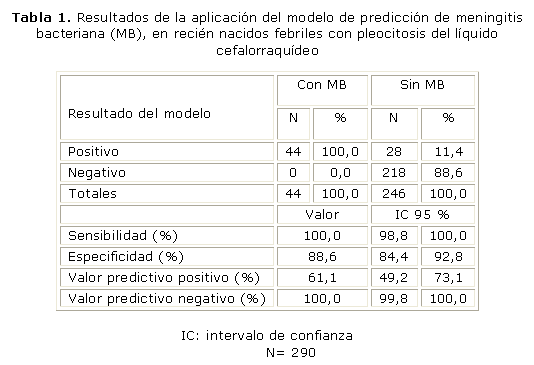
Los microorganismos causantes de la MB fueron Streptococcus agalactiae (grupo B de Lancefield) en 34 (77,3 %) y E. coli en 4 (9,1 %). El resto de las MB fueron causadas por una diversidad de agentes patógenos bacterianos muy puntuales. El MPMBN fue óptimamente efectivo en identificar los pacientes con MB, y así quedó reflejado en la evaluación diagnóstica (tabla 1). La sensibilidad y en VPN fueron de 100 %.
Al aplicar los criterios de riesgo de IBS comparando el grupo de pacientes con MB respecto a aquellos con MA, resultó que todos los RNs portadores de MB calificaron para alto riesgo de IBS, mientras que de aquellos 246 RNs con MA, 183 (74,4 %) calificaron para alto riesgo de IBS y 63 (25,6 %) como bajo riesgo de IBS (p< 0,001).
Atendiendo a los aspectos de evaluación por el MPMBN se clasificaron a los RNs con pleocitosis del LCR en 2 grupos: 1) alto riesgo de MB cuando tenía presente alguna de las variables del MPMBN; 2) bajo riesgo de MB cuando no tenía presente ninguna de las variables del MPMBN. En el primer grupo se integraron todos los pacientes con MB y 28 pacientes neonatales con MA. El otro grupo lo integraron 218 RNs, todos con MA.
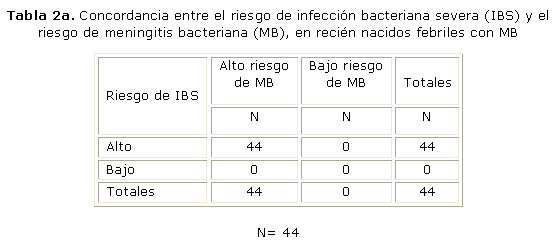
Se evaluó la concordancia entre los criterios de riesgo de IBS y la predicción de MB por el MPMBN que muestra aceptable concordancia (Kappa= 0,104; IC 95 %: 0,048-0,158) con significación estadística p= 0,0015. Para precisar un poco más, se puede ver si este análisis es igual cuando se particulariza para cada causa de meningitis. En esta tabla 2a se pueden notar el agrupamiento de todos los casos cuando por ambas clasificaciones se categorizan de alto riesgo, por lo que es obvia la concordancia. El programa no ejecuta el análisis por tener 3 casillas en 0. Si se añade 1 a cada una de ellas es muy significativa la concordancia. En la tabla 2b se analizan solo los pacientes con MA. Es notorio que no existe tal concordancia entre ambas clasificaciones de riesgo. El intervalo de confianza incluye el 0, va desde un valor negativo hasta un valor positivo y la p no significativa.
Ya que el interés va dirigido al conjunto integrado por la mayor parte de los RNs con MA y conocer cómo se trató la indicación del antibiótico, vista desde un análisis retrospectivo del modo de proceder, pero en un cotejo para distintas variables y grupos de clasificación que se establecieron en el presente para el estudio, es que se revisó la indicación de tratamiento antibiótico. En cuanto a este aspecto, los 44 pacientes con MB recibieron antibioticoterapia inmediatamente después de la PL que llevó al diagnóstico de la meningitis, ya que todos ellos mostraron estado tóxico-infeccioso y/o elementos del examen citoquímico del LCR muy típicos de una MB, y la mayor parte de estos, con resultados en los exámenes hematológicos reactantes de fase aguda, en consonancia con una causa infecciosa bacteriana. Por otra parte, entre los 246 neonatos con diagnóstico definitivo de MA, a 62 de ellos (25,2 %) se les indicó tratamiento antibiótico, a algunos de inmediato a la PL con hallazgo de pleocitosis del LCR, y en otros, de manera mediata por distintos motivos que más adelante se analizan; pero también se evidencia que en cerca del 75 % de los casos la interpretación de la pleocitosis del LCR fue que su origen era no bacteriano, por lo que no se indicó en estos pacientes tratamiento antibiótico (OR: 262,7 con un IC 95 % de 15,9-4332,4; p< 0,001). El promedio de tratamiento antibiótico en los neonatos con MA fue de 3,69±2,21 días.
Con el propósito de comprobar la probable asociación de la indicación de tratamiento antibiótico con la categoría de riesgo con que fue calificado el paciente portador de pleocitosis del LCR y diagnóstico definitivo de MA (tabla 3), se realizó el siguiente análisis, y se determinó que la calificación de alto riesgo de IBS, alcanzada al evaluar inicialmente el RN febril SSF, se asoció significativamente con el comienzo de antibioticoterapia (OR= 2,4 con un IC 95 % de 1,1-5,3; p= 0,014). El promedio de tratamiento antibiótico para los RNs con calificación de alto riesgo de IBS fue de 3,64±2,15 días, mientras que para aquellos con la categoría bajo riesgo de IBS fue 4,00±2,64 sin diferencias significativas (t= 0,44, p= 0,65).
Los motivos de la indicación de tratamiento antibiótico de manera general y según la calificación de riesgo de IBS del RN febril SSF con pleocitosis del LCR, en los casos quienes finalmente tuvieron MA, también son analizados (tabla 4). La motivación predominante fue tener resultados del examen del LCR sospechosos de MB, sin calificar en la actualidad como positivos por el MPMBN, al ser aspectos no evaluables por este modelo, o por no alcanzar los valores límites (por ejemplo, pleocitosis importante, predominio de leucocitos polimorfonucleares entre más de 60 % y menos de 80 %, relación del nivel de glucosa en sangre/LCR en menos de 50 % y otros). Otro motivo importante fue haber tenido hallazgos positivos que calificaran para alto riesgo de IBS por los criterios de riesgo de IBS aplicados (fiebre ³ 39 ºC, estado tóxico-infeccioso, velocidad de sedimentación globular ³ 20 mm/h y otros). Menos frecuentes resultaron ser los informes verbales de cultivos bacterianos de otras fuentes que parecían ser positivos en las primeras horas de cultivo, mediante la comunicación diaria que se establecía en el seguimiento y evolución del paciente, entre nuestro Servicio de Neonatología y el Laboratorio de Microbiología; pero que, finalmente, estos cultivos identificaron gérmenes no patógenos, como contaminantes, y se concluyeron como negativos. En estos casos la indicación de tratamiento antibiótico fue mediata al recibir esa comunicación, y por lo general, se interrumpió el tratamiento con el informe definitivo comprobatorio de lo antes dicho. Finalmente, existieron disímiles causas que determinaron la indicación de tratamiento antibiótico de manera inmediata en unos, y mediata en otros.
Hubo 9 pacientes fallecidos, todos ellos con MB, y como ya se comprobó, identificados con alto riesgo de MB por nuestro MPMBN. Ningún RN con MA resultó fallecido.
DISCUSIÓN
La población de estudio reúne las características de estar integrada en general por RNs a término y con buen peso, los que, como niños sanos, egresaron de sus respectivos hospitales maternos donde nacieron y pasaron a convivir en la comunidad. Todos estos pacientes se evaluaron posteriormente por emergencia e ingresados en el Servicio de Neonatología, donde se hizo el diagnóstico de meningitis.
La frecuencia predominante del Streptococcus agalactiae como microorganismo causal de nuestros casos de MB coincide con muchos otros reportes de la literatura en pacientes neonatales, tales como May y otros en Australia,11 y Garges y otros en EE.UU.12 El MPMBN que desarrollamos mostró una sensibilidad y VPN de 100 %, lo que demuestra su efectividad en la predicción de MB. Esto quiere decir que el modelo detectó todos los RNs con pleocitosis del LCR de causa bacteriana, y con especificidad muy buena, aunque suma poco más de un 10 % de falsos positivos, pues algunos casos resultaron tener una MA, los que, junto a los anteriores, serían pacientes que califican de alto riesgo de MB. Por otro lado, el VPN traduce que aquellos RNs con pleocitosis del LCR que no presentan ninguno de los elementos clínicos y de laboratorio integrados en el MPMBN, realmente no tienen una MB, sino que la pleocitosis es causada por una infección probablemente viral, nominada comúnmente como MA. No hubo falsos negativos, lo cual da un margen de confiabilidad excelente por no perder un solo caso con MB. Este MPMBN será el basamento para la toma de decisiones en la indicación de tratamiento antibiótico ante un paciente neonatal con pleocitosis del LCR.
En la literatura internacional se encontraron reportes de modelos y puntajes para la diferenciación entre MB y MA, con la intención de preservar la indicación de tratamiento antibiótico para los que realmente tienen esta necesidad, quiere decir, para los pacientes con una infección bacteriana, y evitar el uso de esta terapéutica en casos que se relegara esta causa, según la predicción de la estrategia empleada.
Oostenbrink y otros desarrollaron una regla de decisión clínica mediante la combinación de un score de riesgo clínico con un score del LCR, y se aplicó en validación a una nueva población de niños de 1 mes a 15 años de edad,13 lo que conforma una regla de discriminación entre pacientes con MB y sin ella, favorecido por la estructuración de distintos umbrales para cada score que asegura no perder casos portadores de MB. De acuerdo con ello se establece una estrategia de indicación o no de antibioticoterapia, con lo cual se lograría una reducción de tratamiento antibiótico empírico a pacientes sin tener MB. Esta regla de decisión clínica obliga a realizar varios cálculos matemáticos que establecerían los rangos de puntuación, tanto para el score de riesgo clínico como para el del LCR, además de que surge de una población pediátrica sin incluir neonatos y no se ajusta a este grupo de edad.
De Cauwer y otros14 crearon una fórmula de cabecera para distinguir entre MB y MA, y así limitar el número de pacientes tratados con antibióticos innecesariamente, a la vez que garantiza tratar a todos los pacientes con MB. Estudiaron niños de 0 a 15 años de edad con MB y MA, y examinaron cuál fue el mejor umbral práctico de los diferentes parámetros para diferenciar estas infecciones. Con ello se desarrolló un modelo basado en la proteína C reactiva cuantitativa (³ 2,0 mg/dL) en sangre periférica, así como la concentración de proteínas (³ 100 mg/dL) y glucosa (< 53 mg/dL) en el LCR. Cuando se alcanzaba el valor para cada parámetro, se daba 1 punto, y si no se alcanzaba se daba 0 puntos. Un puntaje de ³ 1 predijo MB con una exactitud de 100 % (verdaderos positivos) con solo 23 % de falsos positivos, y un puntaje de 0 puntos predijo MA con una exactitud de 100 % y especificidad de 100 %. Los autores aplican conjuntamente a la misma población el test de Nigrovic, conocido por Bacterial Meningitis Score (BMS), y de los 21 pacientes con MB hubo 5 (23,8 %) que no reunieron los criterios y se calificaron de baja probabilidad de MB, por lo que pudieron haber sido potencialmente no tratados. Al referirse a los resultados comparativos cuando aplicó el BMS a sus casos, comenta que hay que ser cautelosos en la aplicación de resultados y recomendaciones en la práctica clínica para otros grupos de estudio o espacios clínicos. De la misma manera, sus propios resultados no pueden ser transferidos fácilmente a otros grupos de estudio, particularmente a pacientes neonatales.
El modelo BMS de Nigrovic y otros tiene mayor aceptación en la comunidad internacional, pero igualmente, siempre se ha aplicado en poblaciones infantiles más allá del período neonatal.7,15-18 Los propios autores del BMS recomiendan tener precaución en aplicar este modelo en lactantes menores de 2 meses de edad, ya que su predictibilidad es menos exacta, sobre la base que los pacientes mal clasificados por el BMS en su estudio de validación, fueron lactantes entre 1 y 2 meses de edad con MB a E. coli.7
Una ventaja práctica de nuestro MPMBN es que, se sustenta principalmente en elementos clínicos, identificables por interrogatorio a los familiares y un buen examen físico del RN, y los aspectos de exámenes de laboratorio están al alcance de los servicios de emergencia, en cualquier nivel de atención de salud.
En la práctica clínica se enfrentan a estos RNs, por lo general, cuando acuden a solicitar asistencia médica por un evento febril sin mostrar en un comienzo manifestaciones de focalización de la infección. Como tal, estos pacientes son sometidos a una evaluación de riesgo de IBS, con el propósito de estimar o predecir la probabilidad de que sea portador de una infección de esta envergadura, entre las que no solo está la MB, sino también la bacteriemia, la infección del tracto urinario, etc.19 En este estudio todos los pacientes portadores de MB alcanzaron la calificación de alto riesgo de IBS por el método de evaluación empleado,6 y cuando se analizó la concordancia entre la predicción de MB por nuestro MPMBN5 con los criterios de riesgo de IBS, resultó en una notable concordancia. Esto evidencia que, de cualquier manera, estos pacientes muestran un cuadro clínico y humoral que destaca la presencia de una infección de origen bacteriano, por lo que son identificados por estas estrategias de predicción.
Cuando se mira atrás para saber cómo se procedió ante un RN febril con pleocitosis del LCR y la decisión de indicar tratamiento antibiótico, se pudo conocer que todos los pacientes con MB fueron identificados clínicamente como portadores de una infección de esta causa, pues a todos se les inició tratamiento antibiótico inmediatamente después de la PL diagnóstica. Está bien resaltado en la literatura que el tratamiento antibiótico precoz contribuye a una mejor evolución del paciente con una MB, tanto para su supervivencia, como para disminuir las complicaciones y secuelas.20,21 En este aspecto no hay controversias, lo detectado también fue que un grupo de RNs con pleocitosis del LCR y que finalmente resultó ser una MA, llevaron tratamiento antibiótico, casi una cuarta parte de los casos con este tipo de meningitis. Es precisamente en este punto en el que se deben precisar las cosas.
En los análisis subsiguientes también se comprobó que la indicación de tratamiento antibiótico en los RNs con MA se asoció a la categoría de riesgo de IBS, y de cierta manera, la categoría de alto riesgo de IBS compulsa a esta decisión. No obstante, no todos los pacientes con pleocitosis del LCR quienes finalmente tuvieron una MA, pero que fueron calificados de alto riesgo de IBS en la evaluación inicial, recibieron tratamiento antibiótico de inmediato. La categoría de alto riesgo de IBS en un RN febril SSF implica la indicación de la terapéutica antibiótica, pero ocurre que al identificarse el foco de la infección a nivel del SNC, después realizar la PL diagnóstica y comprobar pleocitosis del LCR, se justifica el origen del evento febril, y solo queda precisar si la meningitis es de causa bacteriana o no. Retrospectivamente se interpreta que en estos RNs la consideración médica fue que estaban ante la presencia de una meningitis probablemente viral, y por lo tanto, se decidió no indicar tratamiento antibiótico. Esto ya dejaba un poco sin efecto la categoría alcanzada en la evaluación de riesgo de IBS, pues era evidente el origen del evento febril y probable causa. El MPMBN encaja precisamente entonces en esta predicción, y con el que se respalda la toma de decisiones para la indicación de tratamiento antibiótico.
Al escudriñar más exactamente en cuáles fueron los motivos en la decisión de iniciar tratamiento antibiótico, se precisa que existieron elementos clínicos y de laboratorio, relacionados con la evaluación y predicción de riesgo de IBS, que justificaron tomar la decisión de inicio de la antibioticoterapia; pero, principalmente, fue el encontrar resultados del examen del LCR sospechosos de MB sin calificar como positivos por el MPMBN.
En las descripciones de los libros de texto clásicos de Pediatría y de enfermedades infecciosas, se ilustran muy bien las características diferenciales del examen citoquímico del LCR entre una causa bacteriana y una viral;3,4 no obstante, también está destacado en la literatura internacional las desviaciones de las características para estas infecciones y la frecuencia de solapamiento de valores, tanto en el resultado del examen citoquímico del LCR, como de los reactantes de fase aguda determinados en sangre en pacientes con MB y MA.15,22-25 Respecto a los indicadores del examen citoquímico del LCR, se debe tener presente que, en algunos tipos de MA, particularmente las ocasionadas por enterovirus, se pueden expresar alteraciones en el LCR de forma similar a como ocurre con la MB, tal es el caso de encontrar a veces predominio de polimorfonucleares en el conteo diferencial de leucocitos del LCR.22
El considerable solapamiento que existe de las variables predictoras entre los pacientes con MA y MB,13,22,26,27 limita su capacidad discriminatoria cuando se aplican como variables predictoras de manera individual, sin embargo, al evaluar en conjunto varias de ellas, de manera que se contemplen aspectos clínicos e indicadores de examen del LCR, se logra optimizar la predicción de MB, que en el modelo propuesto resulta en un 100 % de sensibilidad y VPN. El hecho de contar con una herramienta precisa, mediante el uso de variables clínicas y de laboratorio, las cuales tendrían que estar disponibles al momento de la evaluación del paciente, y que identifica cuál de ellos con pleocitosis del LCR tiene un riesgo nulo para MB, orienta en esta toma de decisiones y permite limitar el uso de antibióticos innecesarios.
Esta mirada retrospectiva verifica que la indicación de tratamiento antibiótico frente a un RN habitualmente febril y con pleocitosis del LCR, ha sido utilizada de manera conservadora, basado fundamentalmente en las descripciones clásicas de las características clínicas y del LCR causadas por bacterias y virus, además de la experiencia del médico evaluador del caso. Extrapolando este modo de actuar al presente y contando con el MPMBN, se puede establecer con mayor claridad y confianza la indicación de tratamiento antibiótico cuando el MPMBN resulte en alto riesgo de MB, y limitar el uso de esta terapéutica cuando el MPMBN resulte en bajo riesgo de MB. Como quiera, el tratamiento antibiótico podría estar indicado para aquellos casos que han recibido tratamiento antibiótico previo a la realización de la toma de muestras de LCR por PL, y cuando, a juicio del médico, existe una presunción muy fuerte de la posibilidad de una causa bacteriana, pues más que todo vale la intuición y experiencia del médico, lo cual sería verificable en corto plazo y determinaría la suspensión del tratamiento antibiótico. Estas situaciones excepcionales pueden presentarse cuando el paciente es calificado de alto riesgo de IBS, o cuando los resultados del examen citoquímico del LCR están cercanos a alcanzar los valores límites que establece el MPMBN.
Un modelo o puntaje de predicción que surge y se valida en una población determinada, puede ser efectiva para otro grupo humano similar, pero no quiere decir que sea factible para cualquier otro tipo de población. Esto es precisamente lo que limita este trabajo en la generalización de sus resultados, ya que el estudio involucra un grupo de edad muy particular, y lo que deriva de esto en el plano de considerar el MPMBN como sostén para la decisión de indicar antibióticos ante un paciente con pleocitosis del LCR y en el que se predice con exactitud una MB, sería factible de aplicar en una población semejante, o sea, en pacientes neonatales, y sobre todo, aquellos que adquieren la infección en la comunidad. Otra limitación de este estudio es que se trata de un estudio con carácter retrospectivo, aun así, se escogió este enfoque debido a que fue el único modo factible de ejecutar la investigación, dada la baja frecuencia de MB neonatal y la necesidad de contar con una casuística que soportara resultados más consistentes. Como fortaleza cuenta con que es la primera investigación que evalúa una población de pacientes neonatales y con una casuística extensa.
Se concluye que, de manera retrospectiva, la toma de decisiones médicas respecto a la indicación de tratamiento antibiótico ante un RN evaluado por sospecha de infección y en quien se encontró pleocitosis del LCR ha sido bastante racional, pero en algunos casos innecesario. El MPMBN propuesto descansa en variables de evaluación rutinarias, y permitió identificar inequívocamente la totalidad de los pacientes neonatales con MB, lo cual facilita y fundamenta la indicación de tratamiento antibiótico solo cuando existe un alto riesgo de MB por el MPMBN, y limitar con confianza su uso cuando la predicción es de bajo riesgo de MB, aunque puede haber situaciones clínicas excepcionales que lo justifiquen de manera transitoria.
Agradecimientos
Nuestro especial agradecimiento al Licenciado Humberto Martínez Canalejo por sus valoraciones en la consulta estadística. A las enfermeras del Servicio de Neonatología por ser las vigilantes insomnes de nuestros pacientes, y al personal del Laboratorio de Terapia Intensiva y Microbiología de nuestro hospital, por la calidad de su trabajo.
REFERENCIAS BIBLIOGRÁFICAS
1. Tee WS, Choong CT, Lin RV, Ling AE. Aseptic meningitis in children-the Singapore experience. Ann Acad Med Singapore. 2002;31(6):756-60.
2. Díaz Álvarez M, Arango Arias MI, Rivera Alés L, Claver Isás D, Medina García M, Moreno Vázquez O. Tratamiento sin antibióticos en recién nacidos febriles con pleocitosis del líquido cefalorraquídeo y presunta meningitis viral. Rev Cubana Pediatr. 2010;83(1):1-13.
3. Abzug MJ. Nonpolio Enteroviruses. En: Kliegman RM, Behrman RE, Jenson HB, Stanton BF editors. Nelson. Textbook of Pediatrics. 18th Edition. Philadelphia, PA: WB Saunders Publisher; 2007. p. 1350-6.
4. Long S, Pickering L, Prober C. Principles and Practice of Pediatric Infectious Diseases. New York, NY: Churchill Livingstone Inc; 1997.
5. Díaz Álvarez M. Un modelo de predicción de meningitis bacteriana en recién nacidos con pleocitosis del líquido cefalorraquídeo. Rev Cubana Pediatr [serie en Internet]. 2013 [citado 28 de agosto de 2012];85(3). Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S0034-75312013000300010&lng=es&nrm=iso&tlng=es
6. Díaz Álvarez M, Benitz WE, Martínez Canalejo H, Moreno Vázquez O. Validación de criterios para bajo riesgo de infección bacteriana grave en recién nacidos febriles. Rev Cubana Pediatr [serie en Internet]. 2007 [citado 28 de febrero de 2012];79(3). Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S0034-75312007000300001&lng=es&nrm=iso&tlng=es
7. Nigrovic LE, Kuppermann N, Malley R. Development and validation of a multivariable predictive model to distinguish bacterial from aseptic meningitis in children in the post-Haemophilus influenzae era. Pediatrics. 2002;110:712-9.
8. Meehan WP, Bachur RG. Predictors of cerebrospinal fluid pleocytosis in febrile infants aged 0 to 90 days. Pediatr Emerg Care. 2008;24(5):287-93.
9. Dubos F, Moulind F, Raymonde J, Gendrela D, Bréartf G, Chalumeau M. Distinction entre les méningites bactériennes et virales chez l'enfant: affinement d'une règle de décision clinique. Arch Pédiatr. 2007;14(5):434-8.
10. Baraff LM, Bass JW, Fleisher CG. Practice guideline for the management of infants and children 0 to 36 months of age with fever without source. Pediatrics. 1993;92:1-12.
11. May M, Daley AJ, Isaacs D, Australasian Study Group for Neonatal Infections. Early onset neonatal meningitis in Australia and New Zeland, 1992-2002. Arch Dis Child Fetal Neonatal Ed. 2005;90:F324-F327.
12. Garges HP, Moody MA, Cotten CM, Smith PB, Tiffany KF, Lenfestey R, et al. Neonatal meningitis: what is the correlation among cerebrospinal fluid cultures, blood cultures, and cerebrospinal fluid parameters? Pediatrics. 2006;117:1094-100.
13. Oostenbrink R, Moons KG, Derksen-Lubsen AG, Grobbee DE, Moll HA. A diagnostic decision rule for management of children with meningeal signs. Eur J Epidemiol. 2004;19(2):109-16.
14. De Cauwer HG, Eykensb L, Hellinckx J, Mortelmans LJM. Differential diagnosis between viral and bacterial meningitis in children. Eur J Emerg Med. 2007;14:343-7.
15. Agüero G, Davenport MC, del Valle MP, Gallegos P, Kannemann AL, Bokser V, et al. Validación de una regla de predicción clínica para diferenciar meningitis bacteriana de meningitis aséptica. Arch Argent Pediatr. 2010;181(1):40-4.
16. Nigrovic LE, Kuppermann N, Macias CG, Cannavino CR, Moro-Sutherland DM, Schremmer RD, et al. Clinical prediction rule for identifying children with cerebrospinal fluid pleocytosis at very low risk of bacterial meningitis. JAMA. 2007;297(1):52-60.
17. Dubos F, Lamotte B, Bibi-Triki F, Moulin F, Raymond J, Gendrel D, et al. Clinical decision rules to distinguish between bacterial and aseptic meningitis. Arch Dis Child. 2006;91(8):647-50.
18. Pierart J, Lepage P. Value of the "Bacterial Meningitis Score" (BMS) for the differential diagnosis of bacterial versus viral meningitis. Rev Med Liege. 2006;61(7-8):581-5.
19. Huppler AR, Eickhoff JC, Wald ER. Performance of low-risk criteria in the evaluation of young infants with fever: review of the literature. Pediatrics. 2010;125:228-33.
20. Tunkel AR, Hartman BJ, Kaplan SL, Kaufman BA, Roos KL, Scheld WM, et al. Practice guidelines for the management of bacterial meningitis. CID. 2004;39:1267-84.
21. Heath PT, Okike IO, Oeser C. Neonatal Meningitis: Can We Do Better? [homepage en Internet]; 2011 [citado 10 de mayo de 2012]. Disponible en: http://link.springer.com/chapter/10.1007%2F978-1-4614-0204-6_2
22. Negrini B, Kelleher KJ, Wald ER. Cerebrospinal fluid findings in aseptic versus bacterial meningitis. Pediatrics. 2000;105(2):316-9.
23. Nussinovitch M, Finkelstein Y, Elishkevitz KP, Volovitz B, Harel D, Klinger G, et al. Cerebrospinal fluid lactate dehydrogenase isoenzymes in children with bacterial and aseptic meningitis. Translational Research. 2009;154:214-8.
24. Tatara R, Imai H. Serum C-reactive protein in the differential diagnosis of childhood meningitis. Pediatr Int. 2000;42:541-6.
25. Dubos F, Korczowski B, Aygun DA, Martinot A, Prat C, Galetto-Lacour A, et al. Distinguishing between bacterial and aseptic meningitis in children: European comparison of two clinical decision rules. Arch Dis Child. 2010 Dec;95(12):963-7.
26. Spanos A, Harrell FE Jr., Durack DT. Differential diagnosis of acute meningitis. An analysis of the predictive value of initial observations. JAMA. 1989;262(19):2700-7.
27. Díaz Álvarez M, Medina González T, Sánchez Jiménez A, Rivera Alés L, Rodríguez Castillo O. Características clínicas y epidemiológicas de la meningitis aséptica en recién nacidos. Rev Cubana Pediatr [serie en Internet]. 2012 [citado 10 de mayo de 2012];84(1). Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S0034-75312012000100004&lng=es&nrm=iso&tlng=es
Recibido: 8 de abril de 2013.
Aprobado: 24 de junio de 2013.
Manuel Díaz Álvarez. Hospital Pediátrico "Juan Manuel Márquez". Ave 31 y 76, municipio Marianao. La Habana, Cuba. Correo electrónico: mfdiaz@infomed.sld.cu