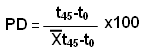Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Pediatría
versión impresa ISSN 0034-7531
Rev Cubana Pediatr vol.86 no.2 Ciudad de la Habana abr.-jun. 2014
Revista Cubana de Pediatría. 2014; 86(2)
ARTÍCULO ORIGINAL
Fenotipo de la reparación por escisión de nucleótidos en pacientes cubanos con hipersensibilidad al sol
Phenotype of the nucleotide excision repair in Cuban sun-hypersensitive patients
Dra. C. Judith Beatriz Pupo Balboa,I MSc. Lic. Reinaldo Gutiérrez Guriérrez,I Dra. Araceli Lantigua Cruz,I Dra. Neysi Luisa Suárez Pérez,II MSc. Lic. Tatiana Acosta Sánchez,I Lic. Anamarys Pandolfi Blanco,I Téc. Aimara de Armas SantiestebanI
ICentro Nacional de Genética Médica. La Habana, Cuba.
IIPoliclínico "Luis Pasteur". La Habana, Cuba.
RESUMEN
Introducción: deficiencias en los mecanismos de reparación del ácido desoxirribonucleico constituyen un factor de riesgo para el desarrollo del cáncer, como ocurre en el xeroderma pigmentoso.
Objetivos: evaluar el fenotipo de la reparación por escisión de nucleótidos en pacientes cubanos con una elevada hipersensibilidad al sol, y la sospecha clínica de xeroderma pigmentoso en la fase eritematopigmentaria, mediante la variante alcalina del ensayo cometa.
Métodos: se estudiaron 28 pacientes, con predominio de las edades pediátricas. Como inductor del daño al ácido desoxirribonucleico se utilizó la radiación ultravioleta C (254 nm) a una dosis de 40 J/m2. El daño del ácido desoxirribonucleico se cuantificó inmediatamente, después de irradiar las células (tiempo 0 minutos) y un tiempo después de la irradiación, incubado a 37 ºC en medio de cultivo, enriquecido con suero fetal al 10 % (tiempo 45 min). Con estos datos se determinó el por ciento de la diferencia en las unidades arbitrarias (UA) entre ambos momentos.
Resultados: no se obtuvieron diferencias significativas (p= 0,080976) entre el grupo de pacientes (224,23 UA) y el grupo de sujetos controles (195,43 UA). Los pacientes reconocieron y escindieron el daño inducido en el ácido desoxirribonucleico por luz ultravioleta C, con una eficiencia similar a la de los controles.
Conclusiones: el ensayo cometa alcalino acoplado a radiación ultravioleta C permitió identificar, claramente y de forma indirecta, el funcionamiento de los mecanismos de reparación por escisión de nucleótidos, donde actúan las proteínas XPA a XPG. Los sujetos en estudio fueron excluidos de presentar la forma clásica de la enfermedad.
Palabras clave: daño del ADN, reparación del ADN, reparación por escisión de nucleótidos, electroforesis en gel de células individuales o ensayo cometa, xeroderma pigmentoso.
ABSTRACT
Introduction: deficiencies in the deoxyribonucleic acid repair mechanisms are a risk factor for cancer as is the case of xeroderma pigmentosum.
Objectives: to evaluate the phenotype of nucleotide excision repair in Cuban sun hypersensitive patients with clinical suspicion of xeroderma pigmentosum at erythematopigmentary phase, by using the Comet assay alkaline variant.
Methods: twenty eight patients mainly at pediatric ages were studied. The used DNA damage inducer was ultraviolet radiation C (254 nm) at 40 J/m2 dose. The DNA damage was quantified immediately after cell irradiation (0 minutes) and some time afterwards, then cultured at 37 ºC and enriched with 10 % fetal serum (45 minutes). This data allowed determining the percentage of difference in arbitrary units (AU) between both moments.
Results: there was no significant differences (p= 0.080976) between the group of patients (224.23 AU) and the control group (195.43 UA). The UV-C induced DNA damage was recognized and excised in the patients with similar effectiveness to that of the controls.
Conclusions: the UV-C radiation-coupled alkaline comet assay allowed clearly and indirectly identifying the functioning of the nucleotide excision repair mechanisms in which XPA to XPG proteins influence. The studied subjects did not show the classical form of this disease.
Keywords: DNA damage, DNA repair, nucleotide excision repair, single cell gel electrophoresis or Comet repair, xeroderma pigmentosum.
INTRODUCCIÓN
La reparación del ácido desoxiribonucleico (ADN) constituye un sistema de defensa para proteger la integridad del genoma y garantizar la supervivencia celular. Deficiencias en este sistema pueden resultar en el desarrollo del cáncer, como ocurre en el xeroderma pigmentoso (XP).1-4 Esta enfermedad es un raro defecto de la reparación del ADN, que presenta una herencia autosómica recesiva, se ha reportado en todos los continentes, y afecta los dos sexos y todas las etnias. A nivel internacional la incidencia es de 1:250 000 nacimientos en Estados Unidos, mientras que en el Medio Oriente es de 2,3 por millón de nacimientos. Se caracteriza por una severa sensibilidad a las radiaciones ultravioletas (uv), cambios pigmentarios progresivos, y un riesgo de más de 10 000 veces de padecer cáncer de piel y de las membranas mucosas en las zonas expuestas al sol, con respecto a la población normal. Aproximadamente el 25 % de los pacientes presentan también degeneración neurológica progresiva.5-7
De acuerdo con el defecto molecular que esté presente, la enfermedad se manifiesta molecularmente de 2 formas. En la forma clásica está alterado alguno de los genes implicados (grupos de complementación XPA a XPG) en los pasos iniciales de la reparación por escisión de nucleótidos (REN).5-7 En la no clásica, o XP variante (XPV), está afectado el gen POLH que codifica la polimerasa h (eta), encargada de la replicación del ADN que contiene daño inducido por radiación uv no reparado, o síntesis de ADN translesión.8,9
En Cuba, una comisión nacional multidisciplinaria de médicos especialistas ha identificado un grupo de más de 80 individuos, que presenta manifestaciones clínicas similares a la fase I de XP. Es una enfermedad mutilante grave, en la que los pacientes requieren de un manejo pediátrico y dermatológico especiales. Por lo que, la existencia de este grupo numeroso de personas con sospecha clínica de XP -mayoritariamente niños- se ha convertido en un problema de salud. La enfermedad los conduce a llevar una vida limitada y de extremos cuidados, lo que inherentemente trae implicaciones psíquicas, sociales y clínicas para estos pacientes y sus familias. Establecer el correcto diagnóstico, desde los primeros síntomas de la enfermedad, resulta muy valioso para estos pacientes.
Es importante señalar que las manifestaciones clínicas en la primera etapa de la enfermedad pueden ser comunes a otras entidades, por lo que el diagnóstico puede resultar poco preciso en esta etapa del XP. Consecuentemente, sería oportuno realizar un análisis diagnóstico apoyado en técnicas de laboratorio para definir, tempranamente, a los pacientes XP, al iniciarse su estudio.
El ensayo cometa, o electroforesis en gel de células individuales, es una técnica sensible y versátil muy utilizada internacionalmente como método estándar para la detección de diferentes tipos de daño y la reparación del ADN en células nucleadas.10-12 Varios autores han reportado su aplicación en estudios de genotoxicidad y biomonitoreo humano, así como en el análisis de situaciones clínicas.13-16
Para contribuir al diagnóstico del XP, en el presente trabajo se aplicó el ensayo cometa alcalino acoplado a radiación uv C (uv-C) en el estudio de pacientes cubanos con diagnóstico presuntivo de XP. Se evaluó la competencia de los mecanismos de la REN, lo que permitió definir, de forma indirecta, el fenotipo de reparación de estos individuos.
MÉTODOS
La inclusión de los pacientes y controles estuvo sujeta al proceso de consentimiento informado establecido para la investigación, lo que permitió dar constancia de su voluntariedad para participar en el estudio. La investigación siguió los principios éticos establecidos por la Declaración de Helsinki, y fue aprobada por el Comité de Ética de la Investigación del Centro Nacional de Genética Médica.
Se incluyeron 28 pacientes procedentes de diferentes regiones del país, de los cuales 82,14 % perteneció a la provincia de Villa Clara. Las edades comprendieron entre 4 y 44 años, con predominio de las edades pediátricas: 25 niños (10,44 ± 3,2 años) y 3 individuos adultos (36,6 ± 8 años). Los pacientes acudieron a la Consulta de Genética Clínica del Hospital "Juan Manuel Márquez". Como criterio de selección se consideró que los pacientes estuvieran identificados como individuos con clínica similar a la fase eritematopigmentaria de XP, por la comisión multidisciplinaria que atiende la enfermedad en Cuba.
Participaron 19 sujetos controles procedentes de La Habana en el rango de edad de los pacientes. Fueron seleccionados mediante encuesta, teniendo en cuenta que refirieran la presencia de antecedentes de salud aparente, específicamente que no presentaran hipersensibilidad al sol, enfermedades crónicas, infecciones agudas, hábito de fumar, así como la no ingestión de medicamentos, ni exposición a radiaciones en los últimos 30 días, previos a la toma de la muestra de sangre.
Los participantes de la investigación donaron 3 mL de sangre total, que fueron colectados por punción venosa en condiciones de asepsia y antisepsia en tubos heparinizados a cargo de personal capacitado de laboratorio clínico. Las muestras se transportaron hacia el laboratorio, refrigeradas, protegidas de la luz, y debidamente identificadas, antes de las 3 horas de realizada la flebotomía. Los linfocitos de la sangre se aislaron utilizando el reactivo Histopaque 1077 (Sigma Aldrich) por centrifugación a 2 200 rpm durante 30 minutos. Se colectó la capa de la interfase mediante micropipeta en un tubo separado, y se realizaron 3 lavados con tampón fosfato salino frío (PBS), por centrifugación. El sedimento de células se resuspendió en un volumen apropiado de tampón PBS frío, para obtener una concentración aproximada de 1 × 105 células/mL. La supervivencia celular se determinó con azul tripán y fue ³ 90 %.
Se desarrolló la variante alcalina del ensayo cometa siguiendo las condiciones descritas por Collins y otros, con algunas modificaciones.16 Los linfocitos aislados se mezclaron con agarosa de bajo punto de fusión al 0,5 %, y se aplicaron sobre duplicados de láminas portaobjetos, previamente codificadas y cubiertas con agarosa regular al 0,75 %. Se evaluaron varios momentos en los sujetos controles: 0, 35, 45, 120 y 180 minutos; mientras que en los pacientes se analizaron solo 2 momentos: 0 y 45 minutos. Las células embebidas en agarosa de bajo punto de fusión se irradiaron con uv-C (254 nm) a una dosis de 40 J/m2 para provocar daño en el ADN, utilizando una lámpara germicida Camag. Seguidamente, las células de tiempo 45, 120 y 180 minutos se incubaron en medio de cultivo RPMI-1640 (Sigma Aldrich), suplementado con suero fetal de ternero al 10 %, mientras que las células en el tiempo 0 no recibieron este tratamiento.
Los pasos siguientes (lisis de las células, desenrollamiento del ADN, electroforesis, neutralización) se realizaron según establece el procedimiento referido.16 Se utilizó la tinción con nitrato de plata (AgNO3) (Sigma Aldrich) para teñir los núcleos.
Cuantificación del daño en el ADN. Los núcleos teñidos con nitrato de plata se observaron al microscopio óptico de campo claro con un aumento de 400x. Se visualizaron 100 núcleos por lámina, de forma que se abarcó toda la lámina, evitando los bordes y las burbujas. En total, se observaron 200 núcleos por cada tiempo. El daño del ADN se cuantificó en UA, para lo que se establecieron 5 niveles de daño (0, 1, 2, 3 y 4) desde la no presencia de daño (nivel 0), hasta la mayor evidencia de este (nivel 4).15
Reconocimiento y escisión del daño inducido por uv-C. El diseño experimental empleado permitió evaluar la eficiencia de la REN frente al daño inducido in vitro en el ADN por la radiación uv-C. Específicamente, se evaluó la competencia de los mecanismos de la REN que reconocen y escinden el daño inducido. Para ello, se utilizó la fórmula que se presenta más adelante,14,17 la cual permitió determinar el por ciento de la diferencia (PD) en las UA entre los momentos estudiados t0 y t45 de los pacientes, con respecto a los controles. El valor calculado es igual al por ciento de reconocimiento y escisión del daño al ADN con el que los pacientes respondieron a la radiación uv-C.
t0: daño del ADN de los pacientes en tiempo 0, inmediatamente después de la irradiación (cuantifica el daño basal).
t45: daño del ADN de los pacientes a los 45 minutos de incubación en medio de cultivo RPMI-1640 suplementado con suero fetal de carnero al 10 %, posteriores a la irradiación (cuantifica el daño inducido).
t45-t0: diferencia de los promedios de las UA cuantificadas entre los momentos t45 y t0de los sujetos controles.
Los valores del ensayo cometa se expresaron como la media de las UA cuantificadas ± error típico de la media (ETM). Para determinar si existieron diferencias significativas entre el grupo de pacientes y los controles, se determinó el estadígrafo U de Mann Whitney. Se utilizó el paquete estadístico Statistica 7.
RESULTADOS
Fenotipo de la REN en sujetos sanos
Antes de evaluar la competencia de los mecanismos moleculares de la REN en los pacientes, se determinó la cinética completa en sujetos sanos no fumadores, que no manifestaran hipersensibilidad al sol. Esta última se refiere a la aparición de lesiones en la piel en relación con la exposición al sol, como enrojecimiento de la piel o ampollas, y cambios de pigmentación (efélides, sequedad de la piel, hiperqueratosis, atrofia de la piel, máculas hipopigmentadas e hiperpigmentadas).6
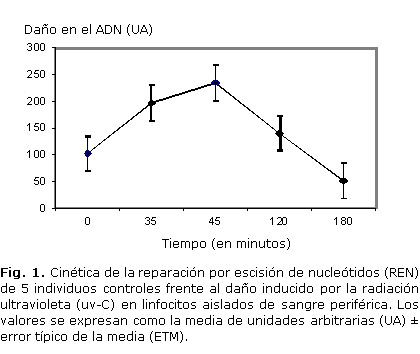
El daño del ADN inducido por uv-C en los linfocitos aislados, se cuantificó en diferentes tiempos de incubación para analizar las fases de la REN, de reconocimiento y escisión del daño (primera fase); y de síntesis y unión de la brecha del ADN (segunda fase), en el mismo experimento. La figura 1 muestra que el daño del ADN fue cuantificado inmediatamente después de la irradiación (tiempo 0), y a diferentes tiempos de incubación (35, 45, 120 y 180 minutos) a 37 ºC en medio con suero fetal de ternero, después de provocar el daño.
La cinética completa de la REN describió 2 intervalos fundamentales en los individuos controles, frente al daño inducido en el ADN por radiación uv-C. Un intervalo mostró aumento de las UA sobre los niveles basales (tiempo 0), que alcanzó un incremento máximo a los 45 minutos para todos los sujetos. Este incremento evidenció que el daño inducido fue reconocido y escindido. A continuación, el otro intervalo, exhibió una disminución gradual del daño a los 120 minutos, y alcanzó niveles basales a los 180 minutos de incubación. La disminución de las UA refleja que ha ocurrido la síntesis de ADN y unión de los extremos, como evidencia de que el proceso de reparación del ADN se completó.
Fenotipo clínico y de la REN de los pacientes en estudio
Se estudiaron 28 pacientes con manifestaciones clínicas similares a la fase eritematopigmentaria de XP, en los que predominó el sexo masculino (64,28 %). Desde el punto de vista clínico, se distinguieron por presentar hipersensibilidad al sol como rasgo clínico relevante, que se manifestó como efélides (100 %), eritema intenso tras la exposición solar de corta duración (83,3 %) y sequedad de la piel (50 %). Además, se observó que los pacientes presentan los fototipos de piel I y II. Se identificó consanguinidad en 1 solo paciente.
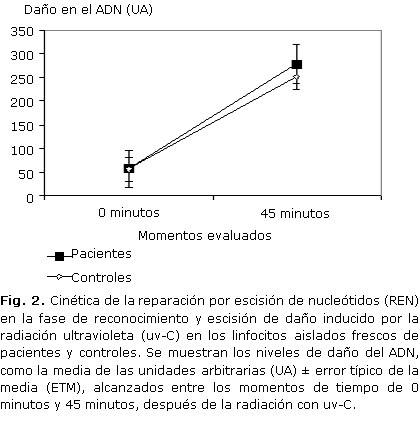
Teniendo en cuenta que en los controles, 45 minutos de incubación fueron suficientes para verificar los mecanismos de la REN que reconocen y escinden el daño del ADN, en los pacientes en estudio se analizaron solamente 2 momentos experimentales: 0 y 45 minutos. Como resultado, se obtuvo que los pacientes mostraron un aumento de las UA a los 45 minutos de incubación, con respecto al daño medido en el tiempo 0, sin incubación (figura 2). No existieron diferencias significativas entre los intervalos de tiempo 0 y tiempo 45 minutos de ambos grupos, después de la radiación con uv-C (p= 0,080976). Igualmente no hubo diferencias entre los niños y los adultos, dentro del grupo de pacientes (p= 0,0956). El por ciento de reconocimiento y escisión del daño del ADN con el que los pacientes respondieron al daño inducido con uv-C in vitro fue similar al de los controles (tabla), en correspondencia con el aumento de las UA a los 45 minutos de incubación. La tabla resume el fenotipo clínico y de la REN de los pacientes, comparado con el de los controles.
DISCUSIÓN
La capacidad de reparación del ADN en los humanos se define como la reparación o eliminación de los diferentes tipos de daños que se producen en el ADN, a través de diferentes vías bioquímicas. El análisis de la capacidad de reparación constituye un biomarcador de interés en las investigaciones clínicas, debido a que, alteraciones en estas vías de reparación, pueden estar vinculadas a enfermedades heredables o esporádicas en el humano.18 La información que describe la literatura internacional acerca de la metodología del ensayo cometa para evaluar in vitro la capacidad de reparación del ADN por escisión de nucleótidos, frente a la radiación uv, es muy amplia.12,14,19,20 En este trabajo se aplicó el ensayo cometa alcalino acoplado a radiación uv-C para evaluar, de forma indirecta, la competencia de los mecanismos moleculares de la REN, en un grupo de pacientes con hipersensibilidad al sol y sospecha clínica de la fase eritematopigmentaria de XP. Previamente, se realizaron experimentos para analizar el comportamiento de la REN en sujetos controles.
Las lesiones que se producen en el ADN debido a la radiación uv, ocurren en regiones de pirimidinas adyacentes formando aductos que distorsionan la doble hélice del ADN (dímeros de ciclobutano de pirimidina y dímeros de pirimidina 6-4 pirimidona); estas son consideradas de mayor relevancia biológica debido a su efecto mutagénico y carcinogénico.21-23 En este trabajo, el daño del ADN cuantificado inmediatamente después de la exposición a la radiación uv-C y el observado en las células no tratadas, fueron similares (datos no mostrados), indicando que la radiación uv-C no indujo roturas de simple hebra o sitios lábiles al álcali de forma directa en el ADN. El ph alcalino (> 13) utilizado en el ensayo cometa durante el desenrollamiento y electroforesis, no provocó migración de lazos de ADN por roturas de hebras, debido a la presencia de los dímeros de pirimidinas en las células irradiadas. Consiguientemente, no se produjo un aumento de las UA. Resultados similares han sido descritos por otros autores, que explican que las rupturas que se originan en el ADN mediante los mecanismos de la REN frente a un daño inducido, surgen como rupturas intermediarias de corta vida, en el intento de las células por repararlas.9,11,20 Esto es posible evidenciarlo, solo si las células se incuban a 37 ºC en medio de cultivo, durante un tiempo, para propiciar que las proteínas que interviene en la REN, entre ellas, XPA a XPG, actúen eliminando el daño.19,24,25
En correspondencia con lo anterior, la cinética de la REN en los sujetos controles se manifestó en el tiempo, a través de 2 intervalos: uno en el que se reconoce y escinde el daño, seguido de otro en el que este se repara (síntesis y unión de la brecha). Estos resultados fueron similares a los descritos por Cipollini y Zheng.20,26
En el presente estudio, 45 minutos de incubación en el medio de cultivo fueron suficientes para evidenciar la competencia de los mecanismos que reconocen y escinden el daño inducido al ADN por radiación uv-C, en los sujetos controles. Es en estas fases de la REN, donde están implicadas las proteínas XPA a XPG.19,24,25 De manera análoga, Alapetite y otros describieron resultados parecidos al evaluar la cinética REN frente a la radiación uv-C en fibroblastos y amniocitos de sujetos sanos.14 En comparación, Cipollini20y Zheng26 reportaron tiempos de incubación de 60 y de 90 minutos, respectivamente, necesarios para constatar la eficiencia de estos mecanismos.
Tiempos de incubación posteriores, de 120 y 180 minutos, mostraron una notable recuperación del daño en las células irradiadas de los sujetos controles, incluso por debajo de los valores cuantificados en tiempo 0, que corresponden al daño basal (figura 2). Cipollini y otros obtuvieron resultados semejantes, al estudiar la cinética de reparación de la REN en un grupo de sujetos sanos.20 Por otra parte, Zheng y otros necesitaron 240 minutos para conseguir la recuperación completa de las células tratadas con la radiación uv-C.26
Las diferencias en los tiempos de incubación reportados por Cipollini20 y Zheng26 para verificar los mecanismos de la REN se explican, probablemente, por el hecho de que cada laboratorio establece sus condiciones experimentales propias, que determinan el comportamiento de los resultados. Varios estudios de ensayo cometa han mostrado que la capacidad de reparación del ADN está disminuida en pacientes con síndromes en los cuales los mecanismos de reparación del ADN están alterados, como en el XP.14,18 Al estudiar el fenotipo de la REN en los pacientes con clínica similar a la fase eritematopigmentaria del XP, se evidenció que fue muy semejante, incluso superior, a la de los sujetos controles. Estos resultados indicaron que los pacientes no presentan la forma clásica de la enfermedad, referida a la presencia de mutaciones en algunos de los genes de los grupos de complementación XPA a XPG, implicados en los mecanismos de reconocimiento y escisión del daño al ADN, por la vía de la REN. El razonamiento anterior se apoya en los trabajos de Alapetite y otros14 y Green y otros,15 que reportan la aplicación del ensayo cometa para realizar el diagnóstico de la enfermedad, excepto para el XPV.
El XPV se caracteriza por mutaciones puntuales en el gen POLH, que codifica la enzima polimerasa eta. Esta enzima interviene en los mecanismos de síntesis de translesión, que, al estar mutada, se afecta la síntesis de hebras hijas de ADN sin errores, a partir de un ADN molde tras la exposición a rayos uv.8,27,28
En el XP existe una amplia variabilidad clínica entre los grupos de complementación, y a su vez, dentro de estos. Las manifestaciones clínicas, la severidad de la enfermedad y la edad de comienzo, son, en parte, dependientes de la exposición al sol, del grupo de complementación afectado, y de la mutación puntual presente. Los defectos moleculares en los pacientes XP resultan en un reconocimiento y reparación alterados del daño inducido en el ADN por la radiación uv, con una inducción incrementada de mutaciones en las zonas expuestas al sol. Esta frecuencia de mutaciones explica los cambios pigmentarios y los cánceres de piel y mucosas (carcinoma de células basales, queratosis solar, carcinoma de células escamosas y melanoma) en los pacientes XP. Sin embargo, no todos los grupos de complementación manifiestan una respuesta exagerada y severa a la luz solar, como XPC, XPE y XPV. Los pacientes XP clásicos (grupos de complementación XPA a XPG) desarrollan cáncer de piel antes de los 20 años, mientras los pacientes XPV desarrollan cáncer de piel en la segunda o tercera década de la vida, dado que la REN no está afectada. Estos últimos, además, no cursan con alteraciones óseas ni neurológicas, por lo que el pronóstico es más favorable en relación con las formas clásicas XPA, XPB, XPD y XPG, que presentan degeneración neurológica.8,27,28 Con el tiempo todos los pacientes desarrollan sequedad de la piel e hiper o hipopigmentación.8
De acuerdo con lo descrito anteriormente, a las características clínicas de los pacientes incluidos en este trabajo y a los resultados del ensayo cometa alcalino acoplado a uv-C para evaluar la reparación por la REN, es posible considerar que estos pacientes, podrían ser XPV. El estudio de esta variante requiere la implementación y aplicación de técnicas moleculares (por ejemplo, Western blot, Dotblot, ELISA, secuenciación) para identificar si la proteína XPV está mutada o no.
Teniendo en cuenta la baja frecuencia reportada de XP en el mundo,5-7 cómo explicar la presencia de un grupo numeroso de pacientes XP variante, procedentes, en su mayoría, de la provincia de Villa Clara. En este caso, cabría descartar la presencia de un efecto fundador, que haya provocado que un alelo mutado para XPV, se haya establecido en el acervo genético de esta población, con una frecuencia más alta que en el resto de la población cubana. Roblejo y otros concordaron en considerar la presencia de un posible efecto fundador en el estudio de un grupo de pacientes cubanos con características similares.17 No obstante, la enfermedad no se ha registrado, previamente, en esta provincia, como consecuencia de este fenómeno genético, al que puede estar asociado un alto grado de consanguinidad. Sin embargo, se debe señalar que esta estuvo presente solo en 1 paciente.
Por otro lado, en el grupo de pacientes estudiados predominó el sexo masculino, y todos los pacientes presentaron color de la piel blanca, específicamente los fototipos de piel I y II, lo cual contrasta con lo descrito en la literatura reportada sobre XP. La población afectada por XP en el mundo presenta una amplia distribución entre las etnias y el color de la piel, y tampoco muestra distinción por un sexo determinado.5,7,27,28 Los fototipos de piel I y II condicionan una respuesta pobre de la piel a la exposición solar, dada por la insuficiente pigmentación de la piel, que conlleva un nivel bajo de bronceado y, consecuentemente, a sufrir lesiones por hipersensibilidad al sol,3,21 como podría ser en el caso de los pacientes estudiados. Razonablemente, todo lo antes expuesto, conduce a conjeturar que, probablemente, la mayoría de estos pacientes no sean XP variante.
No obstante, al no disponer de pruebas moleculares que permitan la confirmación de este planteamiento, y ante el hecho de que todos los pacientes presentan los fototipos de piel I y II, cabe indicar la recomendación de sugerir en el tratamiento a estos pacientes una protección estricta contra la radiación uv para prevenir complicaciones.
Estudios epidemiológicos en la población normal han demostrado una estrecha relación entre la exposición a la radiación solar y el desarrollo de cáncer de piel.27 Uno de los rasgos característicos del melanoma es su desarrollo tras la exposición crónica a radiación uv. En la actualidad, la incidencia y la mortalidad por este tipo de cáncer se han incrementado rápidamente en el mundo.26 El estudio de pacientes con XP consolida esta relación, en los que la frecuencia incrementada y el comienzo temprano de cánceres de piel de tipo melanoma y no melanoma, tiene lugar tras la exposición a la luz uv.27
Por consiguiente, como medidas de protección contra la luz solar, los pacientes con hipersensibilidad al sol y clínica semejante a la fase eritematopigmentaria de XP, deben ser instruidos en el uso de pantallas solares con un alto valor de factor de protección solar, de ropas con mangas y pantalones largos, sombrero, gafas protectoras contra radicación uv, cuando se expongan al sol. De este modo, realizando la protección completa a la radiación uv, es posible detener la progresión de los cambios pigmentarios y suprimir el desarrollo de tumores malignos de la piel.29
En los pacientes XP, esta medida -que debe ser de por vida- provoca una calidad de vida alterada, que se incrementa con el surgimiento de las complicaciones, por lo que, finalmente, estos pacientes y sus familias sufren de estrés físico, mental y económico. Razonablemente, el adecuado cuidado de estos pacientes no puede ser aportado por los médicos especialistas solamente, sino que es oportuno promover la fundación de grupos, con el objetivo de compartir conocimientos sobre la enfermedad, ideas de cómo llevar la vida diaria, así como los momentos de diversión y socialización entre los pacientes, para incrementar el cuidado de la salud.29 A su vez, en el manejo a estos pacientes y sus familias, el asesoramiento genético y el apoyo psicológico son esenciales, al informar sobre la etiología y la herencia de la enfermedad, la probabilidad de ocurrencia en embarazos futuros, y el incremento del riesgo de ocurrencia en matrimonios consanguíneos.27
Finalmente, los resultados de este trabajo confirman la utilidad del ensayo cometa en el estudio de pacientes con sospecha clínica de XP. Los criterios moleculares indirectos, determinados mediante este ensayo, permitieron delinear el fenotipo de la REN de los pacientes, que al ser análogo al de los controles, fue posible descartarlos como pacientes XP clásicos. Estos resultados les confieren un mejor pronóstico de vida, y sugieren una reevaluación clínica de estos pacientes, y por ende, un cambio en el tratamiento y seguimiento, por el grupo multidisciplinario de médicos especialistas.
REFERENCIAS BIBLIOGRÁFICAS
1. Neher TM, Turchi JJ. Current Advances in DNA Repair: Regulation of Enzymes and Pathways Involve in Maintaining Genomic Stability. Antioxidants & Redox Signaling. 2011;14(12):2461-4.
2. Coppedè F, Migliore L. DNA Repair in Premature Aging Disorders and Neurodegeneration. Current Aging Science. 2010;3:3-19.
3. D'Orazio J, Jarrett S, Amaro-Ortiz A, Scott T. UV Radiation and the Skin. Int J Mol Sci. 2013 Jun 7;14(6):12222-48.
4. Budden T, Bowden NA. The Role of Altered Nucleotide Excision Repair and UVB-Induced DNA Damage in Melanomagenesis. Int J Mol Sci. 2013;14(1):1132-51.
5. Meeting report. Xeroderma pigmentosum and other diseases of human premature aging and DNA repair: Molecules to patients. Mechanisms of Ageing and Development. 2011;132:340-7.
6. Lehmann AR, McGibbon D, Stefanini M. Xeroderma pigmentosum. Orphanet Journal of Rare Diseases. 2011;6(70):1750-117.
7. Kraemer KH, Sander M, Bohr VA. Meeting report. New areas of focus at workshop on human diseases involving DNA repair deficiency and premature aging. Mechanisms of Ageing and Development. 2007;128:229-35.
8. Inui H, Oh KS, Nadem C, Ueda T, Khan SG, Metin A, et al. Xeroderma pigmentosum-variant patients from America, Europe, and Asia. J Invest Dermatol. 2008 Aug;128(8):2055-68.
9. Chou K. DNA Polymerase Eta and Chemotherapeutic Agents. Antioxidants & Redox Signaling. 2011;14(12):2521-9.
10. Singh NP, McCoy MT, Tice RR, Schneider EL. A simple technique for quantitation of low levels of DNA damage in individual cells. Exp Cell Res. 1988;175:184-91.
11. Rojas E, Lopez MC, Valverde M. Single cell gel electrophoresis assay: methodology and applications. Journal of Chromatography B. 1999;722:225-54.
12. Collins AR. The Comet Assay for DNA Damage and Repair. Principles, Applications, and Limitations. Molecular Biotechnology. 2004;26:249-61.
13. Nadin SB, Vargas-Roig LM, Drago G, Ibarra J, Ciocca, DR. DNA damage and repair in peripheral blood lymphocytes from healthy individuals and cancer patients: a pilot study on the implications in the clinical response to chemotherapy. Cancer Letters. 2006;239:84-97.
14. Alapetite C, Benoit A, Moustacchi E, Sarasin A. The comet assay as a repair test for prenatal diagnosis of Xeroderma pigmentosum and trichothiodystrophy. J Invest Dermatol. 1997;108:154-9.
15. Green MH, Lowe JE, Harcourt SA, Akinluyi P, Rowe T, Cole J, et al. UV-C sensitivity of unstimulated and stimulated human lymphocytes from normal and xeroderma pigmentosum donors in the comet assay: a potential diagnostic technique. Mutat Res. 1992;273:137-44.
16. Collins AR, Ma AG, Duthie SJ. The kinetics of repair of oxidative DNA damage (strand breaks and oxidised pyrimidine) in human cells. Mutat Res. 1995;336:69-77.
17. Roblejo H, Cuétara E, Acosta T, Lantigua A, Gutiérrez R, Pupo J, et al. Descripción clínica y capacidad de reparación del ADN por escisión de nucleótidos en pacientes cubanos con Xeroderma Pigmentoso. Rev Cubana Genet Comunit. 2009;3(1):35-41.
18. Trzeciak AR, Barnes J, Ejiogu N, Foster K, Brant LJ, Zonderman AB, et al. Age, sex, and race influence single-strand break repair capacity in a human population. Free Radic Biol Med. 2008 December 15;45(12):1631-41.
19. Loock KV, Decordier I, Ciardelli R, Dominique H, Kirsch-Volders M. An aphidicolin-block nucleotide excision repair assay measuring DNA incision and repair capacity. Mutagenesis. 2010;25(1):25-32.
20. Cipollini M, He J, Rossi P, Baronti F, Micheli A, Barale R. Can individual repair kinetics of UVC-induced DNA damage in human lymphocytes be assessed through the comet assay? Mutation Research. 2006;601:150-61.
21. Soehnge H, Ouhtit A, Ananthaswamy ON. Mechanisms of induction of skin cancer by uv radiation. Frontiers in Bioscience. 1997;2:538-51.
22. D'Errico M, Lemma T, Calcagnile A, De Santis LP, Dogliotti E. Cell type and DNA damage specific response of human skin cells to environmental agents. Mutation Research. 2007;614:37-47.
23. Ikehata H, Oo T. The Mechanisms of UV Mutagenesis. J Radiat Res. 2011;52:115-25.
24. Fousteri M, Mullenders L. Transcription-coupled nucleotide excision repair in mammalian cells: molecular mechanisms and biological effects. Cell Research. 2008;18:73-84.
25. Cleaver JE. Cancer in xeroderma pigmentosum and related disorders of DNA repair. Nature Reviews Cancer. 2005 July;5:564-73.
26. Zheng W, He JL, Jin LF, Lou JL, Wang BH. Assessment of human DNA repair (NER) capacity with DNA repair rate (DRR) by comet assay. Biomed Environ Sci. 2005 Apr;18(2):117-23.
27. Fassihi H. Spotlight on xeroderma pigmentosum. Photochem Photobiol Sci. 2013;12:78-84.
28. Tanioka M, Masaki T, Ono R, Nagano T, Otoshi-Honda E, Matsumura Y, et al. Molecular Analysis of DNA Polymerase Eta Gene in Japanese Patients Diagnosed as Xeroderma Pigmentosum Variant Type. Journal of Investigative Dermatology. 2007;127:1745-51.
29. Moriwaki S. Hereditary Disorders with Defective Repair of UV-Induced DNA Damage. Jpn Clin Med. 2013;4:29-35.
Recibido: 9 de agosto de 2013.
Aprobado: 12 de noviembre de 2013.
Judith Beatriz Pupo Balboa. Laboratorio de Estrés Oxidativo del Centro Nacional de Genética Médica. Calle 146, esquina 31, No. 3 102, reparto Cubanacán, municipio Playa. La Habana, Cuba. Correo electrónico: judith.pupo@infomed.sld.cu