Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Pediatría
versión On-line ISSN 1561-3119
Rev Cubana Pediatr vol.87 no.3 Ciudad de la Habana jul.-set. 2015
ARTÍCULO ORIGINAL
Escala predictora de fallo de medro en lactantes
Predictive scale of failure to thrive in breastfed babies
MSc. Carlos Enrique Piña Borrego,I Dr.C. Mercedes Esquivel Lauzurique,I MSc. María de Lourdes Fernández Fernández,I Dr.C. Lázaro Silva Ramos,I MSc. Rolando Uranga Piña,I Lorena Karla Piña RodríguezII
IPoliclínico Universitario “Manuel González Díaz”. Artemisa, Cuba.
IIEstudiante de Medicina. Facultad de Ciencias Médicas de Artemisa. Artemisa, Cuba.
RESUMEN
Introducción: el fallo de medro es identificado en niños con crecimiento significativamente menor que sus semejantes.
Objetivos: identificar la incidencia y características del fallo de medro en la población estudiada, y desarrollar una escala predictora de esta entidad en lactantes.
Métodos: se efectuó un estudio de cohorte prospectivo, en el Policlínico “Manuel González Díaz”, del municipio Bahía Honda, en el período 2009-2013, en 3 etapas: en la primera, se efectuó la captación de los niños que formaron parte del estudio, se identificó la incidencia, y se obtuvo la descripción de las características relevantes de la entidad en 1 490 lactantes nacidos durante la etapa investigada; la segunda, posibilitó el diagnóstico de los factores de riesgo; y en la tercera, se elaboró y validó una escala predictora.
Resultados: la incidencia del fallo de medro fue del 19,4 %. Al aplicar la escala a la muestra A se obtuvo una sensibilidad del 72,1 % y una especificidad del 90,2 %; en la muestra B, la sensibilidad fue 76,34 y la especificidad 92,75.
Conclusiones: el fallo de medro es una entidad frecuente, con mayor incidencia en el segundo y tercer trimestre, en su mayoría es de causa orgánica, y resulta la afectación del peso, la variante antropométrica más frecuente. Se identificaron 13 factores de riesgo asociados a esta entidad. Se obtuvo una escala que permite predecir el riesgo de desarrollar fallo de medro en lactantes, con una sensibilidad aceptable y elevada especificidad.
Palabras clave: lactantes, fallo de medro, escala predictora.
ABSTRACT
Introduction: the failure to thrive is identified in children whose growth is significantly lower than their fellows.
Objectives: to identify the incidence and the characteristics of the failure to thrive in the studied population and to develop a predictive scale of this illness in nursing babies.
Methods: a prospective cohort study was conducted in “Manuel Gonzalez Diaz” polyclinics in Bahia Honda municipality in three phases in the 2009 to 2013 period. In the first phase, the screening of children who participated in the study and of the incidence of disease together with the description of the relevant characteristics in 1 490 breastfed babies born in the studied phase; in the second one, the diagnosis of risk factors was possible and in the third phase, a predictive scale was designed and validated.
Results: the incidence of the failure to thrive was 19.4 %. When applying the scale to the sample A, the sensitivity was 72.1 % and the specificity reached 90.2 % whereas in the sample B, the sensitivity was 76.34 and the specificity 92.75 %.
Conclusions: the failure to thrive is a common entity, with higher incidence in the second and third trimesters; it is mostly of organic cause and the most frequent anthropometric variant is the impaired weight. Thirteen risk factors associated to this illness were detected. The final scale allows predicting the risk of developing failure to thrive in breastfed babies with acceptable sensitivity and high specificity.
Keywords: breastfed babies, failure to thrive, predictive scale.
INTRODUCCIÓN
El fallo de medro (FDM) es identificado cuando un niño presenta un crecimiento significativamente menor que sus semejantes. Usualmente se refiere a un crecimiento por debajo del tercer o quinto percentil, o a una variación en el crecimiento mayor a menos 2 desviaciones estándar en un corto período. Recientemente ha sido dividida en 4 categorías: FDM orgánico, marcado por una condición médica; FDM inorgánico o psicosocial, sin una condición médica demostrada; FDM multifactorial; y falso FDM, constituido por variantes de la normalidad que simulan un FDM, y se citan el retardo constitucional del crecimiento y el crecimiento intrauterino retardado.1,2
El FDM presenta una incidencia variable, dependiendo de la definición aceptada y de la población estudiada. Del 5 al 10 % de los niños con bajo peso al nacer y de los que viven en situación de pobreza, presentan FDM. En Estados Unidos la prevalencia es de un 10 %,3 y en Cuba de un 16 % en algunas investigaciones.4,5 En esta entidad se han identificado un grupo de factores que incrementan el riesgo de padecerla, los cuales, detectados y modificados en forma temprana, podrían evitar su aparición o la de sus secuelas.4,5
En el nivel primario y secundario de salud, el uso de escalas ha sido un instrumento cotidiano en el trabajo de los especialistas que allí laboran.6 Atendiendo a que no existe hasta hoy uniformidad de criterios para definir el FDM, y considerando que en ocasiones pasa inadvertida o no se buscan en la consulta de puericultura los criterios que permiten su identificación temprana, sus posibles secuelas o los factores de riesgo que favorecen su aparición, es que se realizó el trabajo siguiente, con el objetivo de identificar la incidencia y características del FDM en la población estudiada, y desarrollar una escala predictora de esta entidad en lactantes.
MÉTODOS
Se realizó un estudio de cohortes prospectivo en el Policlínico “Manuel González Díaz”, del municipio Bahía Honda, en la provincia de Artemisa, en el período de enero de 2009 a octubre de 2013. El universo estuvo constituido por los 1 490 lactantes que cumplieron los criterios de inclusión del estudio.
Se realizó un muestreo aleatorio estratificado, y se dividió a la población en 2 estratos en dependencia de la presencia o no de FDM, con el objetivo de conformar 2 muestras: una constituyó la muestra para la elaboración y validación interna de la escala (muestra A, período de enero de 2009 a mayo de 2011); y la otra, formó la muestra para la validación externa (muestra B, período de junio de 2011 a octubre de 2013). La muestra A estuvo integrada por un grupo de casos, constituido por 158 lactantes, en los que se identificó la presencia de FDM; y un grupo de control, formado por 316 lactantes sin FDM, en proporción de 2 controles por cada caso, elegidos por muestreo aleatorio simple probabilístico (MASP), a partir de la base de datos establecida para esta investigación, una vez excluidos los niños con FDM. La muestra B, estuvo integrada por 131 lactantes con FDM; y un grupo control, conformado por 262 niños, en proporción de 2 controles por cada unidad de estudio, elegidos por MASP, a partir de la base de datos establecida para esta investigación, una vez excluidos los niños con FDM. El trabajo se desarrolló en 3 etapas.
Primera etapa: los lactantes fueron seguidos durante su primer año en una consulta centralizada, en la que se le abrió a cada niño una planilla de recogida de datos con las variables necesarias para la investigación, se identificó la incidencia, y se obtuvo la descripción de las características más relevantes del FDM en los 1 490 lactantes. Las fuentes de información fueron el carné obstétrico, las historias clínicas individuales, las fichas familiares, el interrogatorio y el examen físico directo a los lactantes (antropometría): peso, talla, circunferencia cefálica, determinación del peso para la talla, peso para la edad, talla para la edad y circunferencia cefálica para la edad. El procesamiento estadístico de esta etapa incluyó números absolutos y por cientos, así como el test de chi cuadrado de Pearson, con un intervalo de confianza (IC) del 95 %.
Los criterios de inclusión del grupo de casos fueron los lactantes en los que se identificó la presencia de FDM en cualquier período de su etapa de estudio, según los criterios propuestos por Oberby;7 y los criterios de inclusión del grupo control fueron lactantes en los que no se identificó la presencia de FDM, en todo el período de su etapa de estudio. En ambos grupos se excluyeron los lactantes en los que se identificó o no la presencia de FDM en cualquier período de su etapa de lactante, y que interrumpieron por cualquier motivo el seguimiento. Se operacionalizaron 34 variables:
- Sexo del niño(a): masculino o femenino.
- Color de la piel del niño(a): mestiza, blanca o negra.
- Asentamiento humano (lugar de residencia): rural o urbano.
- Estado conyugal de la pareja: madre no acompañada (madres divorciadas y solteras), o madre acompañada (unión estable y el vínculo matrimonial legal).
- Edad de la madre: 19 años o menos, o 20 o más.
- Edad de del padre: 19 años o menos, o 20 o más.
- Nivel de escolaridad: primario, medio, medio superior, universitario.
- Ingreso per cápita familiar: bajo (menos de 50 pesos), o normal (50 o más pesos).
- Clasificación de la familia según la ontogénesis: extensa-ampliada, o nuclear.
- Funcionalismo familiar: la funcional incluyó categorías de funcional y moderadamente funcional; y la disfuncional, las categorías de disfuncional y severamente disfuncional, según test FF-SIL.
- Tipo de vivienda: insalubre o saludable (dependiendo de si cumple o no con todos los requisitos de vivienda saludable, según establece la OMS).
- Hacinamiento: sí o no. Índice superior a dos, calculado según la división entre el número de dormitorios de la vivienda y el número de personas que viven en ella.
- Calidad del agua de consumo: buena calidad, cuando procedía de acueducto con planta potabilizadora, o de pozos certificados (se exigió además el tratamiento domiciliario de hervirla y/o clorar con hipoclorito); y mala calidad, si el agua procedente de otras fuentes.
- Fumador pasivo: sí o no, y niños que convivían al menos con un fumador.
- Control sanitario de excretas y de residuales líquidos: suficiente, si había alcantarillados o sistemas individuales con arrastre hídrico; y deficiente, si era a través de sistemas individuales sin arrastre hídrico. En cuanto al control sanitario de residuales sólidos, si no había microvertederos dentro de los límites de la vivienda, se consideró adecuado; y con microvertederos dentro de los límites de la vivienda, se consideró inadecuado.
- Bajo peso materno al inicio de la gestación: sí o no (índice de masa corporal < 18,5).
- Ganancia de peso insuficiente durante el embarazo: sí o no, para lo cual se revisaron los carnés obstétricos.
- Anemia gestacional: sí o no (hemoglobina < 11 g/dL, y el hematócrito < 33 %).
- Hipertensión arterial materna: sí o no, para lo cual se revisaron los carnés obstétricos.
- Hábitos tóxicos durante la gestación: sí o no; si consumía sistemáticamente al menos uno (alcohol, tabaco, café u otra sustancia estupefaciente).
- Parto distócico: sí o no, reflejado en el carné del recién nacido.
- Prematuridad: sí o no, nacido con menos de 37 semanas de gestación.
- Bajo peso al nacer: sí o no, nacido con menos de 2 500 g.
- Asfixia perinatal: sí o no, reflejado en el carné infantil o en el resumen de egreso.
- Morbilidad neonatal grave: sí o no. Se consideró grave cuando estuvo ingresado en Unidad de Cuidados Intensivos o Intermedios.
- Lactancia materna exclusiva al egreso de la maternidad: sí o no.
- Morbilidad infecciosa posneonatal recurrente: sí o no. Rinofaringitis febriles (más de 6 a 10 episodios en lactantes), amigdalitis (más de 7 episodios en un año), otitis media aguda (más de 3 episodios en 6 meses, o 4 en un año), sinusitis (2 episodios en 6 meses, o 3 en un año), neumonías o bronconeumonías (2 veces en un año, o 3 en cualquier tiempo), bronquiolitis (3 o más en un año), crup infeccioso (3 o más en un año), enfermedades infecciosas gastrointestinales (3 o más ingresos durante el primer año y/o diagnóstico de diarrea persistente).
- Diagnóstico de anemia a los 6 meses: sí o no (hemoglobina < 11 g/L, y el hematócrito < 33 %).
- Enfermedad crónica: sí o no, e inicio de cualquier enfermedad crónica.
- Lactancia materna exclusiva hasta el sexto mes: sí o no.
- Calidad de la alimentación complementaria: eficiente, si se introdujo alimentación complementaria a partir de los 6 meses, llevándose por la guía de alimentación del carné de salud infantil; y deficiente, si se introdujo la alimentación complementaria antes de los 6 meses, o a partir de los 6 meses, no llevándose por la guía de alimentación del carné de salud infantil.
- FDM: con FDM, sin FDM. Se emplearon los criterios de Oberby con modificaciones puntuales en 3 de sus aspectos, como se muestra a continuación:
Criterios estáticos (relacionados con crecimiento alcanzado), la detección inicial de al menos uno ya confirmó la presencia de FDM sin límite de tiempo:
1. Peso/edad < tercer percentil de las curvas de crecimiento.
2. Peso/talla < tercer percentil de las curvas de crecimiento.
Criterios dinámicos (relacionados con la velocidad de crecimiento), al menos uno, o mejor varios, tenían que persistir en un intervalo mayor de dos meses:
1. Disminución de la ganancia de peso: < 20 g/día de 0 < 3 meses de edad, < 15 g/día de 3 < 6 meses de edad, < 12 g/día entre 6 < 9 meses, o < 9 g/día entre 9 y 12 meses.
2. Descenso en las curvas de crecimiento previamente establecidas: caída de ≥ 2 percentiles mayores de las curvas de crecimiento, y/o constatación de pérdida de peso
- Tipo de FDM según patrón antropométrico. a) compromiso de peso, talla y perímetro cefálico (PC); b) PC normal, peso normal y talla pequeña; y c) disminución del peso con PC y talla normales.
- Tipo de FDM según etiología. a) orgánico: se identificaron causas puramente orgánicas (alteraciones oronasofaríngeas congénitas o motoras, alteración del SNC, enfermedades crónicas, infecciones banales a repetición, sepsis, traumatismos, vómitos persistentes por reflujo gastroesofágico y malabsorción/diarrea crónica); b) no orgánico (solo se identificaron factores psicosociales), y se consideró disfuncionalidad familiar, bajos ingresos económicos, padres separados y hacinamiento; c) multifactorial (además de trastornos orgánicos se identificaron desórdenes psicosociales); d) falso FDM, cuando se demostró talla y/o peso bajos de origen genético familiar, retraso constitucional de crecimiento y desarrollo, prematuros según edad biológica, prematuros pequeños para la edad gestacional, niños con crecimiento intrauterino retardado simétrico y catch-down de niños nacidos con pesos superiores a su potencial genético, y que alcanzan su percentil en los 2 primeros años.1
Segunda etapa: luego de la recogida de las variables en la muestra A, se realizó un análisis univariado para la identificación de aquellas relacionadas significativamente con el FDM, lo que posibilitó identificar los factores de riesgo asociados a esta entidad, según los valores de sus odds ratios (OR crudos). A estas últimas se les realizó un análisis multivariante, a través de la regresión logística múltiple, con respuesta dicotómica, con lo que se pudo valorar cuáles variables contribuyeron a un riesgo significativo independiente de FDM (OR ajustado), a la vez que se diseñó un modelo pronóstico. Para la calibración del modelo se realizó la prueba de bondad de ajuste de Hosmer y Lemeshow.Tercera etapa: concluido el análisis de regresión logística, se realizó la evaluación por expertos (Primer panel) para determinar los componentes de la escala, en la que fueron propuestos a su consideración 13 factores de riesgo (ítems). Se efectuaron 4 rondas de expertos, durante las cuales fueron eliminados 4 ítems: hijo de madre no acompañada, disposición inadecuada de residuales líquidos, bajo peso materno al inicio de la gestación, e hipertensión arterial materna, resultando un coeficiente Alfa de Cronbach General de 0,8182, con excelente concordancia, y se decidió que los 9 ítems restantes integraran la escala.
Para la obtención de las ponderaciones se asignó un peso estimado de puntos por ítem, partiendo de cero como condición de normalidad (ausencia del factor de riesgo), y asignándose un punto cuando el factor de riesgo estuvo presente. El puntaje final se consideró con la suma del valor de los 9 factores (cuadro y anexo).
Fueron propuestas diferentes categorías de riesgo de acuerdo con el resultado del cálculo de cuartiles, con los valores de la escala, con vistas a establecer 4 categorías. Bajo riesgo: valor inferior al percentil 25; riesgo moderado: valor igual o superior al percentil 25, pero inferior al percentil 50; alto riesgo: valor igual o superior al percentil 50, pero inferior al percentil 75; y riesgo extremo: valor superior al percentil 75.
Para evaluar la capacidad de discriminación de la escala se representaron los resultados en una curva receiver operating characteristic (ROC) simple, realizando estimaciones puntuales y por IC del 95 %, del área bajo la curva (ABC). Se consideró que si el ABC-ROC alcanzó un valor superior a 0,75, el instrumento poseería un buen nivel discriminante. Se estimó un punto de corte óptimo a partir de un criterio netamente cuantitativo, dado por el valor de la escala, donde se obtuvo mayor sensibilidad y especificidad.
La validez de presentación y contenido se exploraron juntas mediante una encuesta a 20 nuevos expertos (Segundo panel). Se les entregó un resumen de los aspectos fundamentales de la investigación. Para efectuar la validación de la escala se empleó la metodología Delphy. Los 20 expertos concordaron en el grado de coincidencia de la efectividad de la escala. Para constatar la equivalencia de la escala se aplicó un test inter-observadores mediante dos “jueces” (pediatras), que, de forma independiente, aplicaron la escala con las variables seleccionadas a las mismas 100 planillas de datos.
Para evaluar la concordancia se obtuvo el coeficiente Tau-b de Kendall, el cual expresa el grado de asociación entre un número determinado de variables semejantes. Una vez conformada la escala, esta fue aplicada a la muestra B para determinar la sensibilidad, la especificidad, el valor predictivo y la razón de verosimilitud. Para el procesamiento estadístico de las 3 etapas se utilizó el Epidat 3.1.
Se solicitó el consentimiento informado de los padres de los niños para participar en la investigación. Se garantizó la confidencialidad de los datos. Se contó con la aprobación del Comité de Ética de las Investigaciones en Salud.
RESULTADOS
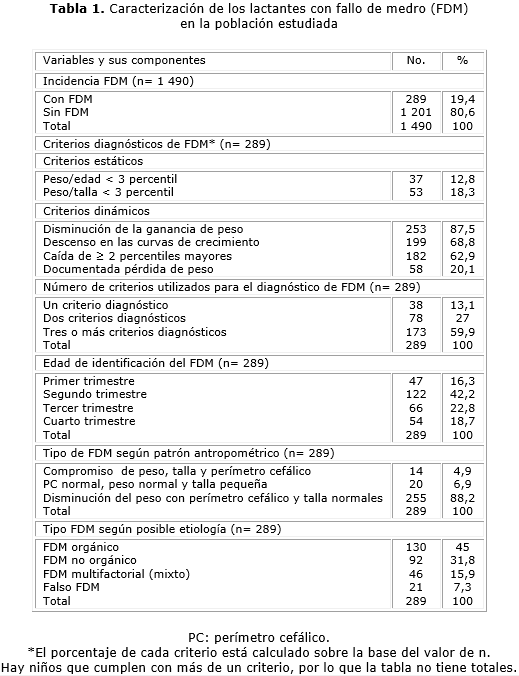
En la presente serie el FDM tuvo una incidencia de 19,4 %. De los criterios estáticos usados en su identificación, el peso/talla < 3 percentil fue el más frecuente, con 53 niños (18,3 %), mientras que de los criterios dinámicos sobresalió la disminución de la ganancia de peso con 253 lactantes (87,5 %). En 59,9 % de los niños el FDM fue identificado por 3 o más criterios diagnósticos. El trimestre de mayor incidencia fue el segundo, con 42,2 %. El FDM orgánico estuvo presente en el 45 % (tabla 1).
Una vez realizado el análisis multivariante, fueron 13 los factores de riesgo asociados significativamente al FDM: hijo de madre no acompañada (OR: 1,9, IC 95 %: 1,2-2,9), disfuncionalidad familiar (OR: 4,5, IC 95 %: 2,9-6,9), hacinamiento (OR: 1,8, IC 95 %: 1,1-2,7), mala calidad del agua de consumo (OR: 1,7, IC 95 %: 1,1-2,5), fumador pasivo (OR: 1,6, IC 95 %: 1,1-2,4), disposición inadecuada de residuales líquidos (OR: 4,3, IC 95 %: 2,7-6,7), bajo peso materno al inicio de la gestación (OR: 1,7, IC 95 %: 1,1-2,5), hipertensión arterial materna durante la gestación (OR: 2,4, IC 95 %: 1,3-4,2), prematuridad (OR: 1,9, IC 95 %: 1,2-2,8), bajo peso al nacer (OR: 9,2, IC 95 %: 4,7-17,5), calidad deficiente de la alimentación complementada (OR: 1,5, IC 95 %: 1,1-2,4), abandono de la lactancia materna exclusiva antes del sexto mes (OR: 5,1, IC 95 %: 3,2-8,1) y morbilidad infecciosa recurrente (OR: 1,7, IC 95 %: 1,1-2,6) (tabla 2).
Tabla 2. Resumen de los factores de riesgo asociados a fallo de medro (FDM) en lactantes de la muestra A
| Variables y sus componentes | Con FDM | Sin FDM | OR | IC | OR | IC | ||
| n= 158 | % | n= 316 | % | |||||
| Estado conyugal | | |||||||
| Madre no acompañada | 94 | 59,5 | 69 | 21,8 | 5,21 | 3,45-7,88 | 1,9 | 1,24-2,91 |
| Madre acompañada | 64 | 40,5 | 247 | 78,2 | ||||
| Funcionalismo familiar | | |||||||
| Familia disfuncional | 103 | 65,2 | 94 | 29,7 | 4,39 | 2,9-6,58 | 4,5 | 2,94-6,95 |
| Familia funcional | 55 | 34,8 | 222 | 70,3 | ||||
| Hacinamiento | ||||||||
| Sí | 116 | 73,4 | 119 | 37,7 | 4,57 | 3-6,95 | 1,76 | 1,14-2,73 |
| No | 42 | 26,6 | 197 | 62,3 | ||||
| Calidad del agua | ||||||||
| Mala | 96 | 60,8 | 85 | 26,9 | 4,2 | 2,8-6,3 | 1,68 | 1,09-2,57 |
| Buena | 62 | 39,2 | 231 | 73,1 | ||||
| Fumador pasivo | ||||||||
| Sí | 51 | 32,3 | 30 | 9,5 | 4,54 | 2,74-7,51 | 1,57 | 1,03-2,4 |
| No | 107 | 67,7 | 286 | 90,5 | ||||
| Residuales líquidos | ||||||||
| Inadecuado | 93 | 58,9 | 56 | 17,7 | 6,64 | 4,3-10,2 | 4,27 | 2,71-6,74 |
| Adecuado | 65 | 41,1 | 260 | 82,3 | ||||
| Bajo peso al inicio de la gestación | ||||||||
| Sí | 33 | 20,9 | 29 | 9,2 | 2,61 | 1,52-4,48 | 1,69 | 1,12-2,56 |
| No | 125 | 79,1 | 287 | 90,8 | ||||
| Hipertensión arterial materna durante la gestación | ||||||||
| Sí | 35 | 22,2 | 29 | 9,2 | 2,81 | 1,64-4,81 | 2,38 | 1,33-4,24 |
| No | 123 | 77,8 | 287 | 90,8 | ||||
| Prematuridad | ||||||||
| Sí | 26 | 16,5 | 14 | 4,4 | 4,24 | 2,15-8,39 | 1,85 | 1,22-2,83 |
| No | 132 | 83,5 | 302 | 95,6 | ||||
| Bajo peso al nacer | ||||||||
| Sí | 47 | 29,7 | 15 | 4,7 | 8,49 | 4,56-15,8 | 9,24 | 4,86-17,55 |
| No | 111 | 70,3 | 301 | 95,3 | ||||
| Alimentación complementaria deficiente | ||||||||
| Deficiente | 112 | 70,9 | 88 | 27,8 | 6,3 | 4,13-9,62 | 1,54 | 1,01-2,38 |
| Eficiente | 46 | 29,1 | 228 | 72,2 | ||||
| No lactancia materna exclusiva hasta sexto mes | ||||||||
| No | 113 | 71,5 | 75 | 23,7 | 8,06 | 5,23-12,4 | 5,06 | 3,17-8,08 |
| Sí | 45 | 28,5 | 241 | 76,3 | ||||
| Morbilidad infecciosa recurrente | ||||||||
| Sí | 96 | 60,8 | 75 | 23,7 | 4,97 | 3,29-7,5 | 1,69 | 1,1-2,6 |
| No | 62 | 39,2 | 241 | 76,3 | ||||
Nótese que al distribuir a los lactantes con y sin FDM, según categorías de riesgo propuestas para el uso de la escala en la muestra A, se encontró que el 30,4 % de los enfermos obtuvo entre 5 y 6 puntos, y el 41,7 %,7 o más. En el caso de los lactantes sanos, el 70,9 % obtuvo menos de 3 puntos y el 19,3 % entre 3 y 4 puntos. Al analizar los resultados de la aplicación de la escala predictora en lactantes de la muestra A, considerando como punto de corte un valor de 5 puntos, se comprobó que en 72,1 % de los niños con FDM la prueba resultó positiva, y fue negativa en el 90,2 % de los niños sin FDM (tabla 3). Los resultados mostraron un nivel de sensibilidad de 72,15 y una especificidad del 90,19, lo que, unido a la razón de verosimilitud, indica que los lactantes con una puntuación de 5 o más, tienen 7 veces más probabilidad de desarrollar FDM, que sus congéneres.
Utilizando los valores establecidos en el instrumento y los resultados de su aplicación en la muestra A, se obtuvo una curva ROC para obtener el punto de corte óptimo, el que mostrara la mayor sensibilidad y especificidad, considerándose un valor de 5 puntos o más, para el cual el ABC-ROC fue de 0,86, con un EE= 0,0183 y un IC del 95 % (0,8248-0,8966), valor superior a 0,75, que indica que la escala mostró un buen nivel discriminante.
Con la realización del test inter-observadores a 2 pediatras, que actuaron como jueces aplicando la escala predictora de FDM a las mismas 100 fichas de datos elegidas al azar de la muestra A, se comprobó un coeficiente Kappa de Cohen (test inter-observadores) de 0,8371, con un EE= 0,05 y un IC del 95,0 % (0,7292-0,9450), un X2 de 8,3986 y una Tau-b de Kendall de 0,8399, lo cual demostró, con 95 % de confiabilidad, que la concordancia inter-observadores fue excelente, asegurando la equivalencia de la escala.
Al realizar la distribución de lactantes con y sin FDM de la muestra B, por categorías de riesgo de la escala predictora de FDM, el 34,4 % de los enfermos obtuvo entre 5 y 6 puntos, y el 42 %, 7 o más. En el caso de los lactantes sanos, el 73,3 % obtuvo menos de 3 puntos y el 19,5 % entre 3 y 4 puntos. Al aplicar la escala predictora en lactantes de la muestra B, considerándose como punto de corte un valor de 5 puntos, se comprobó que en 76,4 % de los niños con FDM la prueba resultó positiva, y negativa en 92,8 % de los niños sin FDM (tabla 3).
Los resultados mostraron un nivel de sensibilidad de la escala de 76,34 y una especificidad del 92,75, lo cual valida que el instrumento desarrollado permite predecir la posibilidad de desarrollar FDM en lactantes con una sensibilidad aceptable, y una alta especificidad, que coinciden con los resultados obtenidos de su aplicación en la muestra A.
DISCUSIÓN
El FDM es un problema frecuente en la práctica clínica pediátrica y su incidencia es muy variable, dependiendo de la definición aceptada y de la población estudiada. Según Kersten, en Estados Unidos, supone alrededor del 3-10 % de los casos remitidos a hospitales pediátricos o centros hospitalarios terciarios.8 Se trata de una condición en la que el criterio usado para su identificación influye notablemente en las diferencias estadísticas presentadas por diversos autores. Algunos consideran que para la valoración de un paciente con FDM se debe recurrir a definiciones más precisas basadas en criterios antropométricos estáticos.9 En la última década, sin embargo, se ha incrementado el uso de los criterios dinámicos, sobre todo, la disminución en la ganancia de peso.10
Según García, al menos un criterio tiene que persistir en un intervalo mayor de 2-3 meses, y ocurrir a una edad inferior a los 3 años.1 Borrás reportó que la mayoría de los niños de su estudio se encontraban en el grupo de 3 a 5 meses (40,4 %), siguiéndole en orden de frecuencia el grupo de 6 a 8 meses, con 30,5 %,11 resultados que coinciden con la presente serie.
El 80 % de los niños con FDM en Colombia no tienen una causa orgánica demostrable.12 La insuficiencia en encontrar una causa orgánica convierte a la negligencia como causa fundamental del FDM, sin embargo, las diferencias apreciadas podrían estar determinadas por la falta de consenso en cuanto a la definición de esta entidad. Múltiples han sido los factores de riesgo asociados al FDM.
Fragoso halló que el 75 % de los lactantes desnutridos viven en el seno de una familia disfuncional.13 Los lactantes requieren de un ambiente familiar favorable para su normal crecimiento y desarrollo. Maldonado asoció la insalubridad y el hacinamiento con las enteroparasitosis en desnutridos graves.14 Este factor eleva la probabilidad de contraer múltiples y repetidas enfermedades de tipo infeccioso con deterioro del crecimiento. Según Fuentes, la calidad del agua es un factor determinante para las enfermedades transmisibles, las cuales son causas inmediatas de desnutrición infantil,15 pues su mala calidad incrementa el riesgo de infecciones digestivas, e incide indirectamente sobre el crecimiento. Valón encontró asociación entre la insuficiencia respiratoria aguda en niños fumadores pasivos (77,5 %) y la desnutrición (67,5 %).16
La prematuridad está asociada a múltiples complicaciones: síndrome de distrés respiratorio, hemorragia intracraneal, ductus arterioso persistente y enterocolitis necrotizante, entre otros; todos ellos provocan un compromiso nutricional, con disminución del ritmo de crecimiento.17
Según UNICEF, durante el período 2008-2012, el 15 y 9 % de los niños presentó insuficiencia ponderal moderada y grave respectivamente, el 25 % cortedad de la talla, y el 8 % emaciación; el 15 % de estos niños fueron, además, bajo peso al nacer.18 Está demostrado que tanto los niños prematuros como los de bajo peso, son más susceptibles a padecer infecciones a repetición, debido a su reducida capacidad de respuesta inmunológica, lo cual compromete su óptimo crecimiento.
El inicio precoz de la alimentación complementaria implica riesgos para la salud del niño, y puede conducir a una sobrecarga renal de solutos e interferir con la lactancia materna, lo cual conduce al destete definitivo; como también, la incorporación de alimentos más allá de los 6 meses puede ocasionar trastornos en el crecimiento, debido al insuficiente aporte nutricional y alteraciones de la conducta alimentaria. En Cuba, la lactancia materna exclusiva hasta los 6 meses se logra en 48,6 %,19 lo que constituye un riesgo para la salud y favorece la aparición de diarreas agudas, desnutrición y anemia.
Lo anterior explica que en la presente investigación la calidad deficiente de la alimentación complementaria y el abandono precoz de la lactancia materna, constituyan factores de riesgo de FDM en lactantes.
Torres relaciona a las enfermedades infecciosas con la desnutrición en la infancia.20 Estos reportes coinciden con los hallazgos del presente trabajo.
Se puede concluir que el FDM es una entidad de frecuente presentación en lactantes del municipio Bahía Honda, con mayor incidencia en el segundo y tercer trimestre de la vida, y es, en su mayoría, de causa orgánica. Para su identificación se utilizaron fundamentalmente los criterios estáticos, y resultó la afectación del peso, con talla y perímetro cefálico normales, la variante antropométrica más frecuente.
Ser hijo de madre no acompañada, la disfuncionalidad familiar, el hacinamiento, la mala calidad del agua de consumo, la condición de ser fumador pasivo, la disposición inadecuada de residuales líquidos, el bajo peso materno al inicio de la gestación, la hipertensión arterial materna durante la gestación, la prematuridad, el bajo peso al nacer, la calidad deficiente de la alimentación complementada, el abandono de la lactancia materna exclusiva antes del sexto mes y la morbilidad infecciosa recurrente, constituyeron factores de riesgo asociados a esta entidad.
Como resultado de esta investigación se obtuvo una escala que permite predecir el riesgo de desarrollo de FDM en lactantes, con una sensibilidad aceptable y elevada especificidad.
Instructivo para el llenado de la Escala Predictora de FDM en Lactantes
1. Para la aplicación de la escala usted puede utilizar como fuentes de información el interrogatorio a la madre o tutora, la historia clínica individual, la ficha familiar y la historia obstétrica (tarjetón de la embarazada).
2. La escala puede ser aplicada de forma seriada, es decir, en cada consulta de puericultura por parte del médico de la familia, o en consultas de evaluación o reevaluación por el especialista en Pediatría.
3. Marcar con una X en la casilla 1 cuando el factor de riesgo esté presente, y en la casilla 0 cuando no esté presente.
4. Sumar la totalidad de los puntos obtenidos y escribir el resultado en la última casilla.
5. La prueba se considera positiva cuando el valor es de 5 puntos o más.
6. La disfuncionalidad familiar se considera con puntaje del FF-SIL ≤ 42 puntos.
7. Se considera de mala calidad al agua procedente de fuentes diferentes a acueducto o pozos certificados, sin hervir y/o clorar.
8. Para considerar la morbilidad infecciosa recurrente use los criterios siguientes: enfermedades respiratorias (rinofaringitis febriles: más de 6 a 10 episodios en lactantes, amigdalitis: más de 7 episodios en un año, otitis media aguda: más de 3 episodios en 6 meses o 4 en un año, sinusitis: 2 episodios en 6 meses o 3 en un año, neumonías o bronconeumonías: 2 veces en un año, o 3 en cualquier tiempo, bronquiolitis: 3 o más en un año, crup infeccioso: 3 o más en un año). En enfermedades gastrointestinales (enfermedades diarreicas agudas: 3 o más ingresos durante el primer año y/o diagnóstico de diarrea persistente).
9. Se considera alimentación complementaria deficiente a su introducción a partir de los 6 meses, no seguir la guía de alimentación del carné de salud infantil, o antes de los 6 meses.
10. Interpretación del resultado según categorías de riesgo:
- Bajo riesgo............... < 3 puntos
- Riesgo moderado....... 3-4 puntos
- Alto riesgo................ 5-6 puntos
- Riesgo extremo......... ≥ 7 puntos
REFERENCIAS BIBLIOGRÁFICAS
1. García C, Moreno JM. Inapetencia y fallo de medro: ¿flaquito o enfermo? En: PapAEed. Curso de Actualización Pediatría 2012. Madrid: Exlibris Ediciones; 2012. p. 115-27.
2. Nangia S, Tiwari S. Failure to Thrive. Indian J Pediatr. 2013;80(7):585-9.
3. Hebel E. El niño que no progresa. Revista Gastrohnup. 2012;14(2):55-8.
4. Piña CE, Fernández ML, Uranga R. Factores biológicos prenatales y perinatales asociados al pobre crecimiento físico en lactantes, Bahía Honda, 2010. Panorama Cuba y Salud. 2012;7(2):15-21.
5. Piña CE, Fernández ML, Uranga R. Comportamiento de algunos factores ambientales de riesgo de pobre crecimiento físico en lactantes. Panorama Cuba y Salud. 2013;8(2):3-9.
6. Flores BA, De León JL, Bulux J. Ecuaciones predictivas de peso y talla para niños de dos a seis años de edad, de Guatemala. Avances en Seguridad Alimentaria y Nutricional. 2008;(3):53-7.
7. Rudolph AM, Kormei RK. Fundamentals of pediatrics. New York: McGraw-Hill; 2002. p. 7.
8. Kersten B, Bennett D. A Multidisciplinary Team Experience with Food Insecurity & Failure to Thrive. Journal of Applied Research on Children: Informing Policy for Children at Risk [serie en Internet]. 2012 [citado 4 de agosto de 2013];3(1). Disponible en: http://digitalcommons.library.tmc.edu/childrenatrisk/vol3/iss1/6
9. Jaffe A. Failure to Thrive: Current Clinical Concepts. Pediatr Rev. 2011;32:100-7.
10. Spencer NJ. Failure to think about failure to thrive. Arch Dis Child. 2007;92:95-6.
11. Borrás T, Santiesteban M. Caracterización del fallo de medro en menores de un año. Correo Científico Médico de Holguín [serie en Internet]. 2010 [citado 5 de agosto de 2013];14(2). Disponible en: http://www.cocmed.sld.cu/no142/no142ori03.htm
12. Velasco CA. Falla para progresar. Revista Gastrohnup. 2012;14(supl 1):4-6.
13. Fragoso T, Torres NC, Orcasita AM. Factores asociados a la malnutrición por defecto en los menores de un año. Área urbana de Cabaiguán, 2010. Revista Infociencia. 2012;16(3):1-12.
14. Maldonado A, Bracho A, Rivero Z, Atencio T, De Molano N, Acurero E, et al. Enteroparasitosis en niños desnutridos graves de un hospital de la ciudad de Maracaibo, Venezuela. Kasmera. 2012;40(2):134-45.
15. Fuentes M, Galíndez L, García D, González N, Goyanes J, Herrera E, et al. Frecuencia de parasitosis intestinales y características epidemiológicas de la población infantil de 1 a 12 años que consultan al Ambulatorio Urbano Tipo II de Cerro Gordo. Barquisimeto, estado Lara. Enero-junio 2007. Kasmera. 2011;39(1):31-42.
16. Valón AO, Ricardo FM, Herrero H, Legrá R. Caracterización clínico epidemiológica de pacientes con insuficiencia respiratoria aguda en una unidad de cuidados intensivos pediátricos. MEDISAN. 2013;17(7):1087-94.
17. Simeoni U. Prematuridad: del período perinatal a la edad adulta. EMC-Tratado de medicina. 2014;18(1):1-7.
18. Fondo de Naciones Unidas para la Infancia. El estado mundial de la infancia en cifras de 2014 en cifras. New York: UNICEF; 2014.
19. Ministerio de Salud Pública. Cuba. Dirección Nacional de Estadísticas del Ministerio de Salud Pública/UNICEF. Encuesta de Indicadores Múltiples por Conglomerados. Monitoreo de la situación de los niños y las mujeres. La Habana: Minsap; 2011.
20. Torres A. Factores de riesgo asociados con las infecciones respiratorias bajas complicadas en la infancia. CCM. 2012;16(1):21-2.
Recibido: 2 de marzo de 2015.
Aprobado: 20 de marzo de 2015.
Carlos Enrique Piña Borrego. Policlínico Universitario “Manuel González Díaz”. Avenida 23, No. 2048, municipio Bahía Honda. Artemisa, Cuba.
Correo electrónico: lk9604@infomed.sld.cu