Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Pediatría
versión On-line ISSN 1561-3119
Rev Cubana Pediatr vol.89 no.2 Ciudad de la Habana abr.-jun. 2017
Rev Cubana Pediatr. 2017;89(2)
ARTÍCULO DE REVISIÓN
Influencia en el balance energético de los factores que regulan el control del apetito y la saciedad a corto plazo
Influence of the regulating factors of short-term control of appetite and satiety on energy balance
José María Basain Valdés,I María del Carmen Valdés Alonso,II Margarita Pérez Martínez,I Rosa María Marrero Rodríguez,II Alicia Martínez Izquierdo,II Ivis Mesa MartínIII
IPoliclínico Universitario "Carlos Manuel Portuondo Lambert". La Habana, Cuba.
IIHospital Pediátrico Docente "Juan Manuel Márquez". La Habana, Cuba.
IIIFacultad de Ciencias Médicas "Finlay-Albarrán". La Habana, Cuba.
RESUMEN
Introducción: el mantenimiento de un nivel constante de energía almacenada es gracias a los factores que regulan el apetito y la saciedad, los cuales influyen en el estado del balance energético.
Objetivo: describir la influencia en el balance energético de los factores que regulan el control del apetito y la saciedad a corto plazo.
Métodos: se realizó una búsqueda en Medline/PubMed, Bireme, ediciones DOYMA y Elsevier, de artículos publicados en inglés y español en el período comprendido entre enero de 1973 y junio de 2016. Los términos de búsqueda fueron food intake, energy balance, regulation, nutritional homeostasis.
Desarrollo: la ingesta de alimentos es una conducta humana que resulta de la compleja interacción entre múltiples factores, en que los más importantes son los fisiológicos y, en el plano humoral, está bien establecido el papel de la ghrelina en la iniciación de la ingesta. Al unísono se ponen en marcha diferentes órganos desde este mismo momento para establecer el momento en el que se debe dejar de comer, mecanismo en el cual intervienen hormonas como colecistoquinina, péptido similar al glucagón tipo 1, oxintomodulina, péptido YY, bombesina, enterostatina, amilina y polipéptido pancreático.
Consideraciones finales: existen diferentes mecanismos implicados en la regulación del control a corto plazo del apetito y la saciedad, los cuales se encuentran íntimamente relacionados, e influyen y determinan el estado del balance energético.
Palabras clave: apetito; saciedad; ingesta alimentaria; balance energético; homeostasis nutricional.
ABSTRACT
Introduction: steady level of stored energy is kept thanks to regulating factors of appetite and satiety which also influence on the state of energy balance.
Objective: to describe the influence of regulating factors of appetite and satiety at short-term on the energy balance.
Methods: a literature search was made in Medline/PubMed, Bireme, DOYMA editions and Elsevier to find English and Spanish articles in the period of January 1973 to June 2016. The search terms were food intake, energy balance, regulation, nutritional homeostasis.
Development: food intake is human behavior resulting from the complex interaction of multiple factors, being the most important the physiological ones and at the humoral level, the role of ghrelina in the onset of intake is well-established. At the same time, various organs set in motion to fix the moment when one should stop eating, a mechanism in which several hormones are involved such as cholecystokinin, a peptide similar to type 1 glycagon, oxyntomodulin, peptide YY, bombesin, enterostatin, amyline and pancreatic polypeptide.
Final thoughts: there are several mechanisms involved in the regulation of the short-term control of appetite and satiety which are closely related, have an effect on and determine the state of the energy balance.
Keywords: appetite; satiety; food intake; energy balance; nutritional homeostatis.
INTRODUCCIÓN
La conducta alimentaria se define como un conjunto de actos relacionados con hábitos de ingesta energética, selección de alimentos consumidos, preparaciones culinarias y cantidad de alimentos ingeridos. Esta conducta responde a diferentes factores, tales como: necesidades biológicas, sensación de placer, parámetros socioculturales, entre otros. Se ha establecido que el desarrollo de la conducta alimentaria se determina por disponibilidad de alimentos, preferencias alimentarias, tamaño de la porción, aspectos culturales, comportamientos familiares y estilos de vida. De esta manera, esos factores condicionan la conducta alimentaria, principalmente, en los primeros años de vida. La conducta alimentaria se estructura a través de un conjunto de comportamientos denominados "dimensiones", relacionados con la comida. De esta manera se han definido distintas dimensiones de la conducta alimentaria, tales como: alimentación emocional, disfrute de los alimentos, respuesta a la saciedad y restricción cognitiva, entre otras.1
Los estilos de vida actuales, que parten del incremento del consumo de alimentos ricos en energía, el bajo gasto energético y el número de factores que incluyen la industrialización del entorno (uso de automóvil, reducción de mano de obra, proximidad a la comida rápida), así como el medio ambiente social (nivel socioeconómico, publicidad, presión de los consumidores), han dado lugar a hábitos de vida más sedentarios y a la abundancia calórica disponible gratuitamente.2 Este estilo de vida, podría haber contribuido al denominado ambiente "obesogénico", que podría haber dado lugar a un subgrupo de población que es genéticamente más susceptible a la ganancia de peso y llegar a ser excesivamente obesos,3 de ahí que la incorporación de determinados hábitos en el estilo de vida son definitivos para el mantenimiento de la salud en la población general, de hecho, se erigen como primera opción en las recomendaciones terapéuticas de las diferentes enfermedades subsidiarias de tratamiento en la práctica clínica.4
La obesidad es una enfermedad frecuente a nivel global, creciente, que afecta a países desarrollados y en vías de desarrollo, a ambos sexos y a todas las edades y grupos sociales,5-9 y que genera importantes costos al sistema de salud. Evoluciona de forma crónica, es compleja y su etiología es multifactorial,5 dada por la interacción de factores genéticos y factores ambientales causados por el estilo de vida, en el cual la conducta alimentaria es un elemento importante,1 y se desarrolla por un desequilibrio entre la energía ingerida y la energía gastada, y como consecuencia, se produce una acumulación anormal o excesiva de energía en forma de grasa en el tejido adiposo.5
La obesidad se ha consolidado como uno de los mayores problemas de salud pública que se enfrenta hoy en día a nivel mundial. Es cada vez más común ver que se consuman alimentos con mayor cantidad de grasas en la dieta occidental por su facilidad de obtención, que repercuten en la salud de la comunidad,10 motivo por el cual se están dedicando grandes esfuerzos al entendimiento de los mecanismos responsables del control del apetito y el balance energético.
Teniendo en cuenta este último aspecto, la presente revisión bibliográfica tiene como objetivo describir la influencia en el balance energético de los factores que regulan el control del apetito y la saciedad a corto plazo.
MÉTODOS
La revisión bibliográfica se llevó a cabo en función de criterios cronológicos, temáticos y de autor, tanto para los artículos publicados en revistas nacionales, como internacionales. Se escogieron como punto de partida aquellos trabajos publicados sobre la influencia en el balance energético de los factores que regulan el control del apetito y la saciedad a corto plazo.
Se tomaron en cuenta los descriptores MESH (food intake, energy balance, regulation, nutritional homeostasis), y DESH (ingesta alimentaria, balance energético, regulación y homeostasis nutricional), para conformar la estrategia de búsqueda, con los calificadores: mecanismos, componentes, elementos, regulación y funciones, entre otros, para recuperar información pertinente y relevante. Finalmente, la revisión se complementó con la búsqueda de los autores y grupos de investigación con los trabajos más relevantes, relacionados con el estudio de la regulación del control del apetito y la saciedad a corto plazo en nuestro medio.
El período revisado abarcó los últimos 40 años (desde enero de 1973 hasta junio de 2016), y las bases de datos consultadas fueron Medline/PubMed, Bireme (Scielo, Lilacs, Comed), ediciones DOYMA y Elsevier. Se revisaron los artículos publicados en inglés y español.
El número total de citas bibliográficas recuperadas fue de 183 y se utilizaron las de mayor importancia; en el caso de las internacionales, se seleccionaron aquellas en función del factor de impacto de la revista en la cual fueron publicadas y la potencia del diseño del estudio (por ejemplo, estudios prospectivos). Este criterio también se estimó en las nacionales, además de hacer mención de aquellas con gran valor histórico dentro del período que abarcó la búsqueda. También se consideraron trabajos realizados en la población general, y grupos o poblaciones específicas.
Con los elementos antes mencionados, la segunda revisión del total de títulos recuperados, permitió seleccionar 29 de 76 trabajos que cumplían con los criterios expuestos, teniendo en cuenta su especificidad y relevancia, así como los puntos en común y controversias planteadas por los diferentes autores en torno a los principales mecanismos implicados en la regulación del control del apetito y la saciedad a corto plazo.
DESARROLLO
Alimentarse ha sido siempre una de las principales funciones de nuestro organismo. A la sensación placentera de la ingesta de alimento le acompaña siempre la necesidad imprescindible de proporcionar nutrientes al organismo para preservar la vida y la especie. La principal llamada para iniciar el consumo de alimento es la sensación de apetito, expresión corporal de la que cada vez conocemos más numerosos y complicados mecanismos reguladores.11
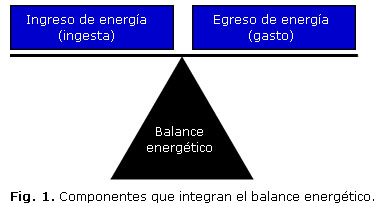
El balance energético es la diferencia que existe entre el ingreso de energía (ingesta de alimento) y su egreso (gasto), para mantener un nivel constante de energía almacenada, principalmente en forma de adiposidad (figura 1).12
Aun cuando el balance somático de energía, resultante de la relación entre aporte y gasto, debe ser extraordinariamente preciso y dinámico, particularmente cuando se consideran las variaciones que día a día pueden sufrir la ingesta de alimentos y el gasto calórico. Es evidente que existe una marcada tendencia evolutiva a facilitar la acumulación de tejido adiposo, ya que es preferible tener un exceso de reservas que no se utilice, a necesitar un aporte rápido de calorías en condiciones de ayuno, de estrés o ambos, y no poder disponer de él y, por lo tanto, la regulación del apetito y del gasto calórico muestran una tendencia epigenética a favorecer el consumo de nutrientes y el ahorro de energía.13
La ingesta de alimentos es una conducta humana que resulta de la compleja interacción entre factores metabólicos, humorales, sociales, ambientales, culturales, genéticos, circadianos, y su influencia sobre la percepción de hambre y la decisión consciente de iniciar la alimentación (figura 2).12
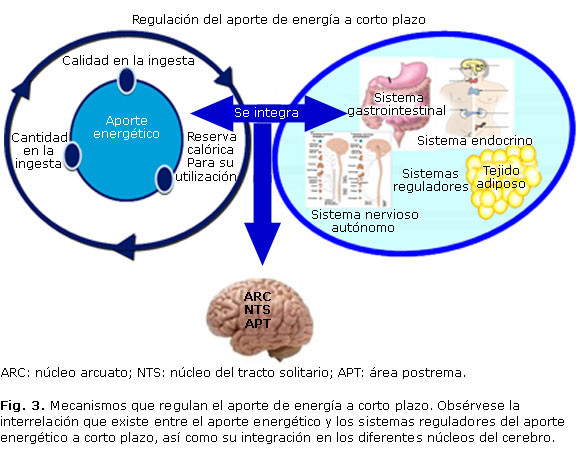
La regulación del ingreso de energía a corto plazo intenta graduar la ingesta de alimento esencialmente como adaptación al volumen de este y al tipo de nutrimentos ingeridos,12 por lo que el aporte energético depende tanto de la calidad y cantidad de la ingesta, como de la existencia de reservas calóricas para su utilización en el corto, mediano y largo plazo, y se regula a través de señales hormonales procedentes del tejido adiposo, y de los sistemas: nervioso (simpático y parasimpático), gastrointestinal y endocrino, que son integradas principalmente a nivel del núcleo arcuato o núcleo infundibular del hipotálamo, aunque también en el núcleo del tracto solitario y en el área postrema (figura 3).13
En el corto plazo, las señales provenientes del sistema gastrointestinal y nervioso ajustan el apetito para impedir el sobrepeso y la pérdida ponderal ante situaciones agudas que comprometen la disponibilidad de energía, en tanto que, a mediano y largo plazo, son más importantes los mediadores que censan los depósitos totales de energía, el estado endocrino y las condiciones generales de salud.13
Cuando el aporte de nutrientes es escaso o nulo, y las reservas se encuentran disminuidas, el organismo debe inducir al mismo tiempo períodos de alimentación en el corto plazo y disminución de la utilización de energía, en tanto que cuando el consumo de alimentos es excesivo y las reservas están aumentadas, debe evitar la ingesta de alimentos y aumentar el metabolismo basal.13
Sería difícil establecer con precisión cuándo empiezan los primeros trabajos en relación con la regulación del apetito, pero durante años se consideró clave la existencia de dos teorías: la que explicaba la regulación de la ingesta a corto plazo, y la que lo hacía a largo plazo.11
La teoría de la regulación de la ingesta a corto plazo hace referencia a una serie de factores encargados de determinar el inicio y el final de una comida. Estos factores son de índole variada, y van desde lo cultural o social, a la implicación específica de los diferentes sentidos. Así, el inicio de una comida puede estar motivado por la visualización de alimentos apetitosos, organolépticamente atractivos, por la presencia en la mesa de una buena compañía o por un ambiente agradable, entre otros. Ya los trabajos de Paulov pusieron en evidencia que estímulos elementales, como la luz o el sonido, eran capaces de poner en marcha de forma refleja la alimentación de los animales. La hora de la comida (¡¡¡es la hora de comer!!!) es uno de los principales estímulos para el ser humano, mientras que para otros animales puede ser el tamaño de la ingesta anterior. Dentro de los factores nutricionales es de gran interés la saciedad específica de los sentidos, así, uno puede estar saciado para un determinado tipo de alimento ingerido recientemente, pero si a continuación le presentan otro alimento apetecible a sus sentidos, se reactiva el apetito y se puede seguir comiendo. Este fenómeno de saciedad específica nos protege contra las deficiencias nutricionales de las dietas monótonas. Del mismo modo, existen aversiones condicionadas a un determinado sabor, mediadas habitualmente por experiencias negativas al consumo de un determinado alimento.11
Quizás los mecanismos reguladores de la ingesta más importantes a corto plazo sean los fisiológicos; las señales que recibe el cerebro respecto a nuestras reservas de nutrientes son claves para la señalización del apetito. La aparición de hipoglucemia, como importante agresión nutricional sobre todo al cerebro, pone en marcha una serie de medidas fisiológicas destinadas a contrarrestar la situación, entre las que se encuentra la aparición de la sensación de hambre. Cuando demoramos el momento de iniciar una comida -o voluntariamente omitimos una o más de una toma de alimento- la caída de la glucemia induce una sensación de hambre progresivamente mayor, y nos incita a que la siguiente ingesta tenga un volumen anormalmente mayor de lo habitual para recuperar las reservas perdidas durante ese período de ayuno. Algún autor, sin embargo, confiere mayor relevancia a las reservas fisiológicas de otros nutrientes como los lípidos, o incluso, los aminoácidos.11
En el plano humoral, está bien establecido el papel de la ghrelina en la iniciación de la ingesta.12
Ghrelina
La ghrelina se produce en el estómago14 (cerca de dos tercios de la concentración de este péptido)15 y el intestino delgado,14 en respuesta a los estadios de hambre e inanición, circula en la sangre y sirve como una señal periférica y, dando información al sistema nervioso central, estimula la ingesta de alimentos16 (apetito) en el período interpandrial, cuando no hay alimentos ocupando la luz del tubo digestivo,14 por lo que se le atribuye una función orexígena, es decir, que al secretarse eleva el consumo de alimento y genera ganancia de peso corporal.17
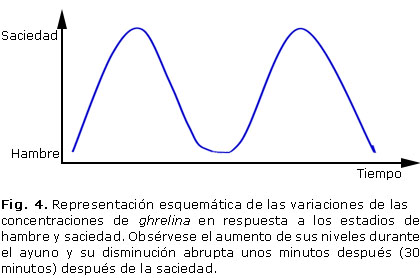
Posee una característica única que la diferencia de otros péptidos, y parece ser crucial para su actividad biológica: la presencia de un grupo octanoil unido a la serina en posición 3. Este residuo altamente hidrofóbico le confiere la capacidad de atravesar la barrera hematoencefálica y unirse al subtipo 1a del receptor de la hormona de crecimiento. Dentro de los efectos de este péptido se encuentran la regulación de la motilidad y secreción acídica gástrica, la secreción pancreática, el metabolismo lipídico y de la glucosa. Los niveles de ghrelina aumentan con el ayuno y decaen abruptamente 30 minutos después de comer, lo que sugiere que esa hormona pueda actuar como una señal para el inicio de la ingesta (figura 4).15
Esta hormona estimula el apetito y ejerce su acción en varios núcleos hipotalámicos como el núcleo arcuato, núcleo paraventricular e hipotálamo lateral. El núcleo arcuato contiene dos poblaciones neuronales involucradas en el control de la ingesta alimentaria; el primero, contiene neuronas que expresan neuropéptido Y (NPY) y la proteína asociada a agouti (AGRP), ambas estimulan el apetito; el segundo grupo se refiere al de las neuronas que expresan propiomelanocortina (POMC), el precursor de la hormona estimulante de alfa-melanocitos (α-MSH), y el transcrito regulado por cocaína-anfetamina (CART), los cuales inhiben el apetito. El núcleo paraventricular del hipotálamo y el hipotálamo lateral contienen hormonas que producen neuropéptidos orexígenos. La expresión de ghrelina se ha identificado en neuronas del núcleo arcuato, y también en un grupo neuronal adyacente al tercer ventrículo entre los núcleos dorsal, ventral, paraventricular y arcuato. Estas neuronas envían fibras eferentes a neuronas productoras de NPY, AGRP, POMC y orexinas, así que este péptido parece estimular acciones tanto en las vías orexígenas como anorexígenas del hipotálamo.15
A nivel experimental, la administración intracerebroventricular de esta hormona aumenta la ingesta de alimentos y disminuye el gasto de energía, lo que resulta en el aumento del peso corporal. Por otro lado, en la vía anorexígena, ejerce un efecto inhibidor sobre las neuronas productoras de POMC, suprimiendo la liberación del péptido anorexigénico α-MSH.16
Además de participar en la regulación de la ingesta a corto plazo, también juega un papel importante en la regulación del peso corporal a largo plazo, pues los niveles plasmáticos de ghrelina están inversamente correlacionados con el índice de masa corporal. Se pueden observar aumentados en la anorexia nerviosa y caquexia, mientras que en individuos obesos están disminuidos. Los niveles plasmáticos de ghrelina fluctúan de una manera compensatoria según las variaciones en el peso corporal, de manera que la concentración en plasma disminuye cuando el peso corporal aumenta como consecuencia de un aumento en la ingesta de grasas. Por el contrario, la pérdida de peso induce un incremento en los niveles plasmáticos, como en la pérdida de peso por restricción alimentaria, ejercicio crónico a largo plazo, caquexia inducida por anorexia, entre otros.15
En sujetos sanos se han detectado altos niveles de ghrelina en estados de vigilia, sin embargo, en personas con anorexia nerviosa, reducción de la dieta o cirugía bariática, también se presenta elevación de esta enzima. La ghrelina está relacionada con la obesidad ya que funciona como reguladora de otras enzimas orexígenas como el NPY, lo que sugiere que una descompensación en la producción de ghrelina o en los receptores ubicados en el núcleo arcuato del hipotálamo, podría predisponer una ganancia de peso.18
En pacientes con síndrome de Prader-Willi, cuya característica es la hiperfagia que conduce a la obesidad, los niveles plasmáticos de ghrelina están más elevados que en sujetos sanos, y no disminuyen después de la ingesta de alimentos; esta disminución puede deberse a una supresión del incremento posprandial del péptido YY (PYY). La administración continua de ghrelina induce un aumento en el tejido adiposo, lo que trae como consecuencia, un incremento en el peso corporal, no solo como consecuencia de un acrecentamiento de la ingesta alimentaria, sino por una reducción del consumo energético, además de una disminución de la utilización de grasas y aumento en el de carbohidratos. También inhibe la oxidación lipídica, genera un aumento en la lipogénesis y fomenta el almacenaje de triglicéridos por el tejido adiposo blanco.16
Mecanismos de la saciedad a corto plazo
Los mecanismos de saciedad a corto plazo son diferentes a los del apetito,11 y, en términos de saciedad, el panorama ha sido mejor clarificado.12
Desde la entrada del alimento al organismo, diferentes órganos y estímulos se ponen en marcha para establecer el momento en el que se debe dejar de comer. Así, nariz (olfato), lengua (gusto), faringe (tamaño del bolo), estómago (distensión gástrica, baro y quimiorreceptores),11 péptidos derivados de células enteroendocrinas del tracto gastrointestinal, tales como, la colecistocinina12 (la cual actúa en el control del vaciamiento gástrico, sobre la secreción biliar y sobre todo es señal para el cerebro de la cantidad de grasa que recibe el duodeno),11 péptido similar al glucagón (GLP-1, por sus siglas del inglés glucagon-like peptide 1), oxintomodulina, PYY, apolipoproteína A-IV y enterostatina, inducen saciedad a través de reflejos vagales aferentes al tallo. El polipéptido pancreático, la amilina y el glucagón, secretados por el páncreas endocrino, también inducen saciedad.12
Colecistoquinina (CCK)
La CCK es otra enzima de tipo anorexígena17 producida por las células I de la mucosa intestinal ante la presencia en el duodeno de los primeros fragmentos de la digestión de las proteínas y los lípidos alimenticios, y estimula de forma potente la actividad enzimática del jugo pancreático. La CCK también promueve el vaciamiento de la vesícula biliar, y el crecimiento celular normal del páncreas.14
El efecto saciante de la CCK, fue descrito por primera vez por Gibbs y otros,19 en 1973, quienes observaron cómo su administración vía peritoneal suprimía la ingesta alimentaria en la rata, y posteriormente, en el humano. Su liberación tiene lugar por las células enteroendocrinas de la mucosa duodeno-yeyunal como respuesta a la ingesta de grasas (ácidos grasos no saturados y de cadena larga principalmente) y proteínas.20 Su actuación vendrá mediada por dos tipos de receptores: receptores del tipo colecistoquininina tipo 1 (CCK-1) y receptores del tipo colecistoquinina tipo 2 (CCK-2). Los receptores del tipo CCK-1, anteriormente denominados CCK-A (alimentary), dada su localización en el tracto alimentario, concretamente a nivel de las terminales aferentes vagales desde donde estimulan la transmisión nerviosa enviando un mensaje de saciedad al núcleo del tracto solitario, se hallan igualmente presentes en el páncreas, la vesícula biliar, el píloro y en múltiples localizaciones del sistema nervioso central (SNC), de entre las que destacan el núcleo del tracto solitario, área postrema e hipotálamo dorsomedial.21 Los receptores de los tipos CCK-2, anteriormente denominados como CCK-B (brain), sobre los cuales actúa la CCK liberada cerebralmente para alcanzar así un efecto anorexígeno, se localizan en el nervio vago y en el SNC.22 La CCK está involucrada a la estimulación de la secreción del PYY y la inhibición de la ghrelina, lo que desencadena la conducta de saciedad en animales de laboratorio.17
Péptido similar al glucagón (GLP-1)
El GLP-1, por sus siglas del inglés glucagon-like peptide 1, es uno de los péptidos intestinales que potencian la secreción de insulina en respuesta a la ingestión de nutrientes. Esta propiedad se conoce con el nombre de "efecto incretina". Es liberado en las células L enteroendocrinas del intestino delgado distal y del colon, específicamente cuando la glucemia está elevada, y su vida media es muy corta (inferior a dos minutos), debido a que es rápidamente inactivada por la enzima proteolítica dipeptidil peptidasa IV (DPP-IV). Las múltiples acciones del GLP-1, que se resumen a continuación, se producen cuando se une a su receptor acoplado a proteína G (GLP-1R), el cual está localizado en varios tejidos:23
- Páncreas: aumento de la secreción de insulina tras la ingestión de alimentos, inhibición de la secreción de glucagón por las células alfa, aumento de la proliferación y prevención de apoptosis de las células beta (esta última propiedad demostrada en animales de experimentación o en islotes humanos in vitro).
- Estómago: disminución del vaciamiento gástrico.
- Cerebro: disminución del apetito.
El GLP-1 es un producto de la actividad hormonal de las células L del íleo distal, como el producto de la transcripción del gen del pre-pro-glucagón; se secreta rápidamente después de la ingestión de alimentos, y las concentraciones del péptido crecen de forma proporcional a la energía ingerida. El GLP-1 tiene efecto sacietógeno, y probablemente afecta el peso a largo plazo; además, tiene efectos específicos sobre las células α del páncreas, el hipotálamo, y los sistemas cardiovascular y gastrointestinal. Aparte del control del hambre, el GLP-1 también aumenta la secreción pancreática de insulina por estimulación de la transcripción del gen de la hormona, y potencia todos los pasos de su biosíntesis. Además, el GLP-1 reduce la motilidad gástrica y la secreción pancreática de glucagón. Después de concluidos estudios en modelos murinos, se tiene evidencia experimental que sugiere que el GLP-1 induce la proliferación y neogénesis de la célula β del islote pancreático, e inhibe su apoptosis, lo que sugiere un efecto protector de la reserva funcional de esta glándula. El GLP-1 mejora el uso tisular de glucosa y disminuye su producción hepática, lo que se traduce en una respuesta insulínica adecuada ante una sobrecarga endovenosa de glucosa. En consecuencia, el GLP-1 juega un importante papel en la homeostasis de la glucosa, y evita el incremento del peso corporal.14
Oxintomodulina (OXM)
La OXM es otra de las hormonas descritas en relación con la inhibición del apetito.14 Es un péptido formado por 37 aminoácidos, su estructura contiene los 29 aminoácidos que forman el glucagón, seguidos por una extensión octapéptido carboxilo terminal (llamada también SP-1, espaciador de péptido-1, KA-8 o IP-1). La OXM es el resultado de la conversión del pro-glucagón, la cual se lleva a cabo cuando se escinde por convertasas de pro-hormonas 1 y 2 en diferentes productos de degradación. En las células α pancreáticas la pro-hormona convertasa 2 genera predominantemente glucagón; en el intestino y neuronas del núcleo del tracto solitario en el cerebro, el resultado del procesamiento postransduccional es la producción de glicentina, GLP-1 y péptido similar al glucagón-2. La glicentina (también conocida como enteroglucagón), se descompone para producir OXM, llamada así por su capacidad para modular la secreción de ácido gástrico en glándulas gástricas oxínticas.24
La OXM es liberada desde el intestino al plasma, a partir de las células L intestinales, como respuesta a la ingesta de alimentos, y origina una disminución en el tamaño de la porción de alimento ingerida. La OXM se eleva posprandialmente en relación directa con el consumo calórico, observándose el pico máximo 30 minutos después de ingerir alimentos. La concentración circulante de esta proteína presenta una variación durante el día, muestra sus niveles más altos por la noche y los más bajos por la mañana. Su vida media es de aproximadamente 4 a 8 minutos.25
La OXM inhibe el vaciado gástrico, asimismo, reduce significativamente el apetito, además, incrementa el gasto de energía en el organismo.24 La administración de OXM en roedores, ya sea vía intraperitoneal o a nivel de ventrículos cerebrales, núcleo paraventricular o núcleo arcuato del hipotálamo, genera a corto plazo, una reducción en la ingesta de alimentos. Por otra parte, la administración repetida de OXM por más de 7 días reduce la ganancia de peso corporal y los niveles de adiposidad. Los animales tratados con OXM mostraron perder más peso, que los animales control que consumen la misma cantidad de calorías, lo que sugiere que la OXM aumenta el gasto de energía.24 En humanos obesos, los estudios realizados demuestran que la administración de OXM reduce tanto la ingesta de alimentos como el peso corporal.17
Péptido YY (PYY)
El PYY se produce en el tracto digestivo en respuesta a la llegada del alimento, e inhibe el apetito.14 Él (por la abreviación del aminoácido tirosina, PYY) está formado por 36 aminoácidos,17 con un residuo de tirosina en los extremos amino y carboxilo terminales,15 y es producido principalmente por células del tracto gastrointestinal distal, llamadas células L.17 Este péptido permanece en bajas concentraciones en el intestino delgado, mientras que la concentración más alta se encuentra en el recto, seguido por el íleon y el colon, actuando a través del hipotálamo al unirse a su receptor, provocando un efecto anorexígeno.15 Este péptido tiene dos isoformas: PYY1-36 y PYY3-36;17 el primero, formado por 36 aminoácidos; y el segundo, por 34. Ambos son liberados por el intestino a la circulación,15 de las cuales la segunda es la mayormente presente en sangre en los estados de ayuno y alimentación, además ha sido relacionado con el consumo de energía, la regulación del peso corporal a largo plazo, y la sensación de saciedad dependiente de la carga calórica. Estudios realizados en personas obesas demuestran que necesitan mayor ingesta calórica para que los niveles sanguíneos de PYY3-36 alcancen los niveles necesarios para generar la sensación de saciedad, en comparación con personas sanas.17
El patrón de secreción de PYY sugiere que este juega un papel importante en la saciedad, ya que es liberado en respuesta a la ingesta de alimentos, alcanzado una meseta 1-2 horas después de la ingesta. Los niveles de PYY son más bajos en la mañana y se elevan después del desayuno, suben aún más después del almuerzo, y alcanzan su concentración más alta un par de horas después de la cena. La liberación de esta proteína no solo es proporcional a la ingesta de alimentos, sino que también está influida por la composición de estos, ya que se han observado concentraciones plasmáticas más elevadas después de la ingesta de grasas, en comparación con la ingesta de proteínas o carbohidratos. Además de los nutrientes, la liberación de PYY es estimulada por factores humorales, como son la gastrina y CCK, lo que ocurre, incluso, antes de que los nutrientes hayan alcanzado la parte distal del estómago.15
Posterior a su liberación, PYY es metabolizado por la enzima dipeptidil peptidasa-IV para la formación de PYY3-36, que cruza la barrera hematoencefálica, donde se une a receptores Y2 en las neuronas que expresan NPY en el núcleo arcuato del hipotálamo. Y2 es uno de los receptores de Y (Y1, Y2, Y3, Y4 y Y5); este receptor presináptico metabotrópico pertenece a la superfamilia de receptores acoplados a proteína G altamente expresado en neuronas NPY del núcleo arcuato.26 Recientemente, se ha demostrado la actividad anoréxica de PYY, ya que tras la administración directa de PYY3-36 en el núcleo arcuato en un modelo murino, se inhibe la ingesta de alimentos. En el núcleo arcuato PYY3-36 inhibe a las neuronas NPY, cuya actividad es mediada por el NPY, y este último es uno de los péptidos con actividad orexígena más importante en el organismo, por lo que su inhibición se traduce en la disminución del apetito.15
Se ha observado que las concentraciones plasmáticas de PYY se ven alteradas en algunas enfermedades y en pacientes con obesidad. Por ejemplo, en los estados de mala absorción, tales como, esprúe tropical, insuficiencia pancreática e infecciones intestinales agudas, los niveles plasmáticos de PYY son altos. Contrario a lo anterior, existen registros de pacientes con obesidad mórbida en los que los niveles de PYY son bajos o nulos, por lo que se puede suponer que la deficiencia de PYY puede contribuir al desarrollo de la obesidad, ya que su ausencia supone un desequilibrio en la homeostasis energética.15
Bombesina
La bombesina, por su parte, actúa disminuyendo el volumen de alimentos ingerido en cada comida.22
Enterostatina
La enterostatina, cuyo origen radica en la fragmentación de lipasa pancreática a nivel intestinal, provoca una disminución en la duración de las comidas.22
Amilina
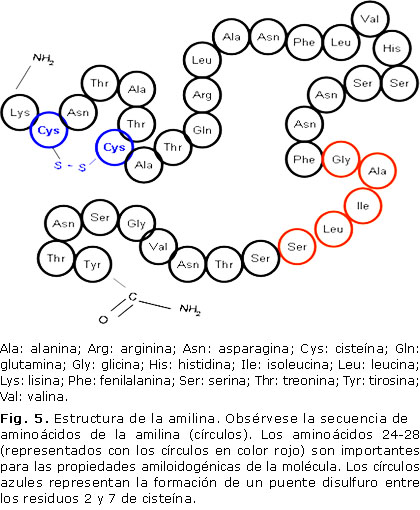
La amilina es un péptido de 37 aminoácidos (figura 5), que constituye el principal componente de los depósitos de amiloide detectados en los islotes pancreáticos de pacientes con diabetes mellitus tipo 2. Se trata de un péptido sintetizado y co-secretado por la célula β pancreática, en respuesta a los mismos estímulos secretagogos,27 es decir, es secretado de manera simultánea con la insulina desde las células beta del páncreas en respuesta a la ingestión de nutrientes, incremento hormonal y estímulo neuronal, y está relacionada a la regulación de glucosa, inhibición de la secreción de glucagón posprandial y retraso en el vaciado gástrico.17
Presenta una homología estructural del 43 y 49 % respectivamente con los neuropéptidos CGRP (CGRP, por sus siglas del inglés calcitonin gene-related-peptides) tipo 1 (CGRP-1) y CGRP tipo 2 (CGRP-2), sintetizados por las células C de la glándula tiroides, como resultado de un proceso de empalme alternativo de los genes CALC, ubicados en el cromosoma 11. Los tres péptidos tienen una longitud idéntica, y presentan dos modificaciones postraduccionales homólogas (amidación del residuo carboxiterminal y un puente disulfuro intramolecular).27
La amilina es sintetizada a partir de un precursor prepropeptídico de 89 aminoácidos, la preproamilina. Mientras que los residuos 1-37 presentan un alto grado de conservación entre las diferentes especies, los propéptidos amino y carboxiterminal presentan un mayor grado de variabilidad, lo que indica una probable ausencia de actividad biológica. La escisión proteolítica de la secuencia de 22 aminoácidos del péptido señal en el retículo endoplasmático rugoso, libera la proamilina de 67 aminoácidos. Las modificaciones postraduccionales incluyen la liberación de amilina madura por la escisión proteolítica de la molécula en las señales dibásicas lisina-arginina, con pérdida de los propéptidos aminoterminal (11 aminoácidos), y carboxiterminal (19 aminoácidos), y la formación de un puente disulfuro entre los residuos 2 y 7 de cisteína. En el extremo carboxiterminal, la señal dibásica está precedida de una glicina, lo que permite la amidación de la tirosina en posición 37 de la amilina madura. Estas modificaciones postraduccionales son fundamentales para la actividad biológica del péptido. No se conoce con certeza qué endoproteasas son responsables del procesamiento in vivo de la proamilina humana; no obstante, el hecho de que la amilina esté colocalizada con la insulina en los gránulos de las células β, y que la proinsulina sea procesada por la acción combinada de las proteasas PC2 y PC3, sugiere que estas endopeptidasas podrían ser también responsables del procesamiento de la pro-amilina.27
La amilina, por su interacción con el área postrema, induce a una reducción en la ingesta de alimentos.22
Polipéptido pancreático (PP)
El PP es otra de las hormonas descritas en relación con la inhibición del apetito.14 Está formado por 36 aminoácidos, y es secretado en su mayoría por células F, localizadas en la periferia de los islotes de Langerhans en el páncreas, y en menor medida, por el colon. El estímulo primario para la liberación de esta sustancia es la ingesta de nutrientes, aunque otros factores como la estimulación adrenérgica, o el ejercicio en conjunto con CCK, pudieran afectar su liberación.17,26,28
Aunque PP puede funcionar en todos los receptores de Y, se ha demostrado que tiene la mayor afinidad por el receptor Y4, presente en el núcleo arcuato del hipotálamo. Cuando PP es liberado del páncreas endocrino, después de la ingesta, actúa a través de su receptor, e inhibe el vaciamiento gástrico a través de una acción que implica el nervio vago, además de ejercer una acción inhibidora sobre la actividad motora intestinal y el peristaltismo;28,29 igualmente, inhibe la movilidad de la vesícula y secreción exocrina pancreática.17 Sin embargo, se ha observado que en las personas obesas, los niveles de PP son más bajos, lo cual es un indicador de que la ausencia de esta proteína contribuye, de manera significativa, a la acumulación de grasa corporal. En seres humanos se ha observado que, tras la administración de PP en personas con peso corporal normal, inhibe el apetito a las dos horas de ser administrado, lo que indica que PP es un importante anorexígeno, y que su presencia es netamente necesaria para mantener la homeostasis energética,28,29 es decir, la administración por distintas vías del PP en humanos, demuestra que en individuos sanos se presenta una disminución de la ingesta de nutrientes, y que esta inhibición se conserva en roedores y humanos mórbidamente obesos.17
CONSIDERACIONES FINALES
La obesidad es un problema de salud pública a nivel mundial que ha alcanzado cifras que hacen considerarla una pandemia, de ahí la importancia de conocer el sistema regulador del peso corporal de nuestro organismo y, específicamente, las funciones específicas que cumplen los mecanismos que regulan el apetito y la saciedad a corto plazo, ya que la ausencia de alguna de estas hormonas involucradas en la señalización de este sistema regulador, conlleva a un desequilibrio energético, favorece la acumulación de grasa en el organismo y un pobre consumo de esta, para desencadenar el aumento de peso corporal y el desarrollo de obesidad.
En los últimos años se ha dado un importante avance en el conocimiento de los mecanismos neurohormonales y bioquímicos que regulan el apetito y la saciedad a corto plazo, y en los numerosos estudios realizados para ello, se han puesto de manifiesto la complejidad fisiopatológica de la regulación de la ingesta alimentaria y el balance energético. En este sentido, el mejor conocimiento de los procesos fisiológicos por los que estas moléculas regulan la ingestión de alimentos, resulta fundamental para el desarrollo de nuevas estrategias y tratamientos frente a trastornos alimentarios como la obesidad. Sin embargo, es necesario insistir que el actual estilo de vida, en el cual la interacción de factores ambientales, así como, las dietas ricas en grasas y carbohidratos, y bajas en fibra dietética, asociadas con un alto nivel de sedentarismo, siguen predisponiendo a la población a desarrollar esos estados de malnutrición por exceso.
Conflicto de intereses
Los autores declaran no tener conflicto de intereses en la realización del estudio.
REFERENCIAS BIBLIOGRÁFICAS
1. Valladares M, Obregón AM, Weisstaub G, Burrows R, Patiño A, Ho-Urriola J, et al. Asociación entre la conducta alimentaria y polimorfismos genéticos de la leptina y su receptor en niños obesos chilenos. Nutr Hosp. 2015;31(3):1044-51.
2. Phillips C. Nutrigenetics and Metabolic Disease: Current status and implications for personalized nutrition. Nutrients. 2013;5:32-57.
3. Quintero Y, Bastardo G, Angarita C. La nutrición molecular y sus aportes al estudio de la obesidad. Rev Venez Endocrinol Metab. 2015;13(1):14-24.
4. Rodríguez C, Quezada-Feijoo M, Toro C, Barón-Esquivias G, Segura E, Mangas A, et al. Comportamiento del eje entero-insular en una población deportista; influencia de la dieta y el ejercicio. Nutr Hosp. 2015;31(5):2187-94.
5. Hernández Rodríguez J, Licea Puig ME, Castelo Elías-Calles L. Medicamentos que favorecen la pérdida de peso y el control metabólico en las personas obesas con diabetes mellitus tipo 2. Rev Cubana Endocrinol. 2013;24(2):323-52.
6. Rodríguez E, López B, López AM, Ortega RM. Prevalencia de sobrepeso y obesidad en adultos españoles. Nutr Hosp. 2011;26:355-63.
7. Laux TS, Bert PJ, González M, Unruh M, Aragon A, Torres C. Prevalence of obesity, tobacco use, and alcohol consumption by socioeconomic status among six communities in Nicaragua. Rev Panam Salud Pública. 2012;32:217-25.
8. Catarina E, Moreira R. Estimates of obesity trends in Brazil, 2006-2009. Internat J Public Health. 2012;57:127-33.
9. Yang ZJ, Liu J, Ge JP, Chen L, Zhao ZG, Yang WY, et al. Prevalence of cardiovascular disease risk factor in the Chinese population: the 2007-2008 China National Diabetes and Metabolic Disorders Study. Eur Heart J. 2012;33:213-20.
10. Domínguez Hernández LE, Alba Betancourt C. Efecto de la metformina sobre las pruebas de función hepática durante la obesidad. Verano de la Investigación Científica. 2015;1(2):292-6.
11. Tébar Massó FJ, Garaulet Aza M, García Prieto MD. Regulación del apetito: nuevos conceptos. Rev Esp Obes. 2003;I(1):13-20.
12. Chiquete E, Tolosa P. Conceptos tradicionales y emergentes sobre el balance energético. Revista de Endocrinología y Nutrición. 2013;21(2):59-68.
13. Calzada-León R, Altamirano-Bustamante N, Ruiz-Reyes ML. Reguladores neuroendocrinos y gastrointestinales del apetito y la saciedad. Bol Med Hosp Infant Mex. 2008;65:468-87.
14. Ochoa C. El intestino delgado, las incretinas y el metabolismo glucídico en la diabetes mellitus. Rev Cubana Aliment Nutr. 2012;22(2):301-13.
15. Acosta-Hernández ME, Lozada-Sosa MC, Gasca-Pérez E, Ramos-Morales FR, Croda-Todd MT, Escobar-Henríquez JBH, et al. Hormonas del eje intestino-cerebro como sistema regulador del peso corporal y su relación con la obesidad. Revista Electrónica Medicina, Salud y Sociedad. 2015;5(3):280-95.
16. Sato T, Nakamura Y, Shiimura Y, Ohgusu H, Kangawa K, Kojima M. Structure, regulation and function of ghrelin. Journal of Biochemistry. 2012;151:119-28.
17. Acosta-Hernández ME, Gasca-Pérez E, Ramos-Morales FR, García-Rodríguez RV, Solís-Páez F, Evaristo-Portilla G, et al. Factores, causas y perspectivas de la obesidad infantil en México. Revista de los Estudiantes de Medicina de la Universidad Industrial de Santander. 2013;26(1):59-68.
18. Sam AH, Troke RC, Tan TM, Bewick GA. The role of the gut/brain axis in modulating food intake. Neuropharmacology. 2012;63(1):46-56.
19. Gibbs J, Young RC, Smith GP. Cholecystokinin decreases food intake in rats. Journal of Comparative and Physiological Psychology. 1973;84(3):488-95.
20. Fromentin G, Darcel N, Chaumontet C, Marsset-Baglieri A, Nadkarni N, Tomé D. Peripheral and central mechanisms involved in the control of food intake by dietary amino acids and proteins. Nutr Res Rev. 2012;29:1-11.
21. Wen D, Ma CL, Zhang YJ, Meng YX, Ni ZY, Li SJ, Cong B. Cholecystokinin receptor-1 mediates the inhibitory effects of exogenous cholecystokinin octapeptide on cellular morphine dependence. BMC Neurosci. 2012;13(1):63.
22. González-Jiménez E, Schmidt Río-Valle J. Regulación de la ingesta alimentaria y del balance energético; factores y mecanismos implicados. Nutr Hosp. 2012;27(6):1850-9.
23. Feliciano Alfonso JE, Sierra Ariza ID. Nuevas terapias en diabetes: más allá de la insulina inyectable y de los antidiabéticos orales. Rev Assoc Med Bras. 2008;54(5):447-54.
24. Pocai A. Unraveling oxyntomodulin, GLP1's enigmatic brother. Journal of Endocrinology. 2012;215:335-46.
25. Bak MJ, Albrechtsen NJ, Pedersen J, Hartmann B, Christensen M, Vilsbøll T, et al. Specificity and sensitivity of commercially available assays for glucagon and oxyntomodulin measurement in human. European Journal of Endocrinology. 2014;170(4):529-38.
26. Te Kamp V, Linder R, Jahne HG, Krinke KB, Kostelnik KB, Beck-Sickinger AG, et al. Quantitative impedimetric NPY-receptor activation monitoring and signal pathway profiling in living cells. Biosensors and Bioelectronics. 2014;67:386-93.
27. Rojas I, Novials A. Amilina: del estudio molecular a las acciones fisiológicas. Endocrinología y Nutrición. 2001;48(8):234-45.
28. Holzer P, Reichmann F, Farzi A. Neuropeptide Y, peptide YY and pancreatic polypeptide in the gut-brain axis. Neuropeptides. 2012;46:261-74.
29. Perry B, Wang Y. Appetite regulation and weight control: the role of gut hormones. Nutrition and Diabetes. 2012;2:e26.
Recibido: 9 de agosto de 2016.
Aprobado: 9 de octubre de 2016.