Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Pediatría
versión On-line ISSN 1561-3119
Rev Cubana Pediatr vol.89 supl.1 Ciudad de la Habana 2017
ARTÍCULO ORIGINAL
Colonización nasofaríngea por neumococos en la población infantil cubana, evidencias basadas en estudios de prevalencia
Nasopharyngeal colonization of pneumococci in the Cuban infant population, prevalence study-based evidence
María Eugenia Toledo-Romaní,I Dunia Chávez Amaro,II María Felicia Casanova González,III Gilda Toraño Peraza,IV Nivaldo Linares-PérezV
IDepartamento de Epidemiología. Instituto de Medicina Tropical "Pedro Kourí" (IPK). La Habana, Cuba.
IIUniversidad de Ciencias Médicas de Cienfuegos. Cienfuegos, Cuba.
IIIHospital Pediátrico Universitario "Paquito González Cueto". Cienfuegos, Cuba.
IVLaboratorio Nacional de Referencia para Streptococcus pneumoniae. Instituto de Medicina Tropical "Pedro Kourí" (IPK). La Habana, Cuba.
VDirección de Investigaciones Clínicas y Evaluación de Impacto. Instituto Finlay de Vacunas (IFV). La Habana, Cuba.
RESUMEN
Introducción: una nueva vacuna cubana contra neumococos se encuentra en fase de evaluación en Cuba y su introducción constituye una prioridad para el sistema de salud. Datos poblacionales sobre la carga de colonización nasofaríngea son limitados.
Objetivo: estimar la prevalencia de colonización e identificar los serotipos circulantes entre niños de 2-18 meses de edad y de 1-5 años, del municipio Cienfuegos, entre 2013 y 2015 previo a la introducción de la vacunación antineumocócica, para medir el impacto de la nueva vacuna y monitorear el fenómeno de reemplazo.
Métodos: fueron conducidas dos encuestas transversales que incluyeron niños entre 2 y 18 meses (etapa I) y entre 1 y 5 años de edad que asisten a círculos infantiles (etapa II). Se evaluaron criterios de inclusión y se obtuvo el consentimiento informado de los padres. Las muestras de exudado nasofaríngeo se tomaron siguiendo los protocolos establecidos. Se estimó la prevalencia de colonización y se identificaron los serotipos más frecuentes en ambos estratos de edad. El análisis de datos incluyó la distribución de frecuencias y la comparación de proporciones.
Resultados: la prevalencia global de colonización entre 984 niños de 2 y 18 meses incluidos en la primera etapa fue de 21,6 %. Los serotipos más frecuentemente encontrados fueron: 6A (23,1 %), 23F (10,8 %), 6B (10,3 %), 19F (8,5 %) y 14 (3,3 %). Fueron reclutados en la segunda etapa 1 135 niños entre 1 y 5 años de edad. La prevalencia global de colonización se incrementa significativamente (31,01 %) en niños que asisten a círculos infantiles. En ambos grupos de estudio los serotipos vacunales fueron predominantes y el patrón de circulación fue similar.
Conclusiones: los hallazgos sugieren que la carga de enfermedad neumocócica y la colonización nasofaríngea en niños menores de 5 años pudiera ser significativamente impactada por la introducción de la nueva vacuna cubana contra neumococos.
Palabras clave: Streptococcus pneumoniae; colonización nasofaríngea; serotipos; vacunas conjugadas antineumocócica; Cuba.
ABSTRACT
Introduction: a new Cuban pneumococcal vaccine undergoes the evaluation phase in Cuba and its introduction represents a health care system priority. Population-based data on the burden of nasopharyngeal colonization are scarce.
Objective: to estimate the prevalence of colonization and to identify the circulating serotypes in children aged 2 to 18 months and 1 to 5 years from Cienfuegos municipality in the period of 2013 through 2015 before the introduction of pneumococcal vaccination, in order to measure the impact of the new vaccine and to monitor the serotype replacement phenomenon.
Methods: two cross-sectional surveys comprising children aged 2 to 18 months (phase I) and 1 to 5 years-old, who go to daycare centers (phase II), were made. The inclusion criteria were evaluated and the parents gave their informed consent. The nasopharyngeal exudate samples were taken according to the set protocols. The colonization prevalence was estimated as well as the most common serotypes in both age strata were identified. The data analysis included the frequency distribution and the ratio comparison.
Results: the global prevalence of colonization in 984 children aged 2 to 18 months in the first stage was 21.6 %. The most common serotypes were 6A (23.1 %), 23F (10.8 %), 6B (10.3 %), 19F (8.5 %) and 14 (3.3 %). In the second phase of the study, 1 135 one-five years old children participated. The global colonization prevalence significantly increase (31.01 %) in children going to day care centers. In both study groups, the vaccinal serotypes were predominant and the circulation pattern was similar.
Conclusions: the findings suggest that the burden of pneumococcal disease and the nasopharyngeal colonization in children under five years could be significantly influenced by the introduction of the new Cuban pneumococcal vaccine.
Keywords: Streptococcus pneumoniae; nasopharyngeal colonization; serotypes; pneumococcal conjugate vaccines; Cuba.
INTRODUCCIÓN
La infección por Streptococcus pneumoniae es una causa común de enfermedad invasiva e infecciones del tracto respiratorio. Se asocia a una alta morbilidad y mortalidad en todo el mundo, especialmente en los niños pequeños, los adultos mayores de 65 años y los individuos imunocomprometidos.1 Cada año, 1 millón de niños menores de 5 años mueren de neumonía, meningitis y enfermedad neumocócica invasiva (ENI), y es la colonización nasofaríngea (NF), que se produce principalmente en el primer año de vida, un factor de riesgo.2
La prevalencia de colonización por neumococos en niños menores de 2 años de edad varía del 30 al 62 %, y constituye una fuente importante de propagación horizontal de este patógeno dentro de la comunidad.3-6 El acceso combinado de la colonización nasofaríngea y la enfermedad invasiva, forma parte de la estrategia para limitar la transmisión a nivel poblacional.
La vacunación antineumocócica es la herramienta de salud pública más eficaz para prevenir la enfermedad neumocócica y la colonización NF. Constituye un paso importante para la prevención y control de enfermedades invasivas y no invasivas, y de los síndromes de enfermedad asociados a la infección por neumococo (neumonía, meningitis, otitis media aguda). La nueva generación de vacunas conjugadas antineumocócica (PVC por sus siglas en inglés) es altamente inmunogénica en niños menores de 2 años.7-11 Estas se han introducido en varios países con gran éxito, y se ha registrado una disminución sustancial en la incidencia de la ENI en la población < 5 años vacunada y no vacunada.10,11
En Cuba todavía no ha sido introducida vacunación antineumocócica, pero una nueva vacuna cubana -actualmente en fase de evaluación clínica- se espera pueda comenzar a utilizarse entre 2017 y 2018. Estudios previos a su introducción, incluyen la exploración de las tasas de colonización NF por neumococo en niños lactantes y preescolares en Cuba (Nivaldo Linares-Pérez. Clinical research and impact evaluation strategy of a new pneumococcal conjugate Cuban vaccine (PCV7-TT). 2nd Symposium Pneumococcal Vaccines.VacciPharma; 2015. Varadero, Cuba).
La nueva vacuna conjugada heptavalente cubana antineumocócica (PVC7-TT) fue desarrollada por investigadores del IFV.12,13 Su composición incluye 2 g de los serotipos 1, 5, 14, 18C, 19F, 23F, y 4 g de 6B, cada uno conjugado con el toxoide tetánico (TT) (García-Rivera D, Puga R, Paredes B, González N, Rodríguez L, editor. Phase I studies to evaluate the safety and immunogenicity of the new Cuban pneumococcal vaccine candidate, 2012-2014. VacciPharma; 2015. Varadero, Cuba). La vacuna incluye los serotipos que más frecuentemente causan ENI en todo el mundo.14,15
El objetivo de este artículo es estimar la prevalencia de colonización e identificar los serotipos circulantes entre niños de 2-18 meses de edad y de 1-5 años, del municipio Cienfuegos, entre 2013 y 2015, previo a la introducción de la vacunación antineumocócica, lo que resulta esencial para medir el impacto de la nueva vacuna y monitorear el fenómeno de reemplazo de serotipos vacunales por no vacunales.
MÉTODOS
Se realizaron dos encuestas transversales en el municipio de Cienfuegos, en los periodos comprendidos entre octubre y diciembre de 2013 (niños entre 2 y 18 meses, etapa I), y junio de 2014 a noviembre de 2015 (niños entre 1 y 5 años institucionalizados en círculos infantiles, etapa II).
Fueron involucradas 8 áreas de salud del municipio Cienfuegos teniendo en cuenta: los datos de incidencia anual de las meningitis neumocócicas y neumonías adquiridas en la comunidad reportadas, la capacidad de laboratorio provincial para la toma de muestras y el aislamiento de neumococo, y la experiencia previa en la ejecución de estudios epidemiológicos.
En ambas etapas, a partir de la identificación del universo de niños elegibles, fueron incluidos los que cumplieron los criterios de inclusión asociados al rango de edad, el consentimiento informado de los padres y la condición de asistencia a círculos infantiles (etapa II). La selección para completar el tamaño de la muestra fue realizada de forma aleatoria. Se consideraron como criterios de exclusión: la presencia de defecto anatómico que limitara la toma de muestra en el paciente; las enfermedades o trastornos de la sangre referidos por los padres; el tratamiento antibiótico 7 días antes de que se recogieron muestras clínicas; o historia previa de vacunación contra neumococo.
El investigador principal del estudio fue el pediatra de cada área de salud participante, quien fue el responsable de comunicar a los padres, obtener el consentimiento informado y hacer la evaluación clínica de cada niño elegible para el estudio.
Los exudados NF fueron colectados recogidos por el técnico de laboratorio del área de salud, previamente entrenado, utilizando hisopos flexibles de nylon estéril flocados (Copan, Italia). Se siguió el procedimiento establecido de insertar el hisopo en la parte posterior de la nasofaringe y girar 5 s, antes de ser retirado. Este se colocó directamente en un tubo conteniendo un 1 mL de medio de caldo de 1,0 mL de leche descremada triptona-glucosa-glicerol (LTGG). Las muestras NF fueron transportadas al laboratorio en hielo seco, se agitaron durante 10 s, se congelaron a -70 °C, y se conservaron a -70 °C, previa agitación por 10 segundos.
El aislamiento de S. pneumoniae y la serotipificación fue realizada en el Laboratorio Nacional de Referencia de Neumococo del Instituto de Medicina Tropical "Pedro Kourí" (LNRN-IPK). La identificación de S. pneumoniae se basó en la presencia de α-hemólisis y la inhibición por optoquina.16 Las muestras de exudados NF se descongelaron a temperatura ambiente (25 °C), se agitaron, y utilizando el hisopo contenido en el tubo, se inocularon placas de agar sangre con 5 % de sangre de carnero y 5 mg/L de gentamicina. Estas se incubaron durante 18-24 h a 37 °C en atmósfera de CO2.
De los cultivos sugerentes de neumococo, en función de la presencia de α-hemólisis, se seleccionaron al menos dos colonias. Estas se cultivaron en placas de agar sangre en las que se incluyó un disco de optoquina. Los aislamientos susceptibles a optoquina se informaron como S. pneumoniae, y ante resultados dudosos se corroboró la identificación empleando la prueba de la solubilidad en bilis. Cada cultivo recuperado de una misma muestra de exudado NF identificado como neumococo se conservó independientemente. Los aislamientos confirmados como S. pneumoniae se almacenaron a -70 °C en 1,0 mL del medio LTGG hasta el momento de la serotipificación.
El tipo capsular o serotipo se determinó empleando la reacción de Neufeld-Quellung o reacción de hinchamiento capsular, utilizando el juego de reactivos Pneumotest (Statens Serum Institute, Copenhagen, Dinamarca).16 Los serotipos se clasificaron en: a) serotipos vacunales incluidos en el candidato vacunal cubano contra neumococo (1, 5, 6B, 14, 18C, 19F y 23F); b) relacionados con la vacuna por posible reacción cruzada (6A y 19A); c) serotipos no vacunales, referido a los no incluidos en la formulación de dicho candidato vacunal; y d) aislamientos para los que no se podría asignar una cápsula se informaron como "sin serotipar" en el laboratorio de referencia.
A través de una entrevista individual, y utilizando un modelo de recolección de información previamente establecido, fueron registrados los datos de identificación del niño y de la muestra de exudado NF tomadas. Los registros se incluyeron en una base de datos utilizando Microsoft Access versión 2007.
Se estimó la prevalencia de la colonización NF global y por serotipos. Se describieron las proporciones de serotipos vacunales, los relacionados con la vacuna y los serotipos no vacunales, por edad específica y por estratos de edad. El análisis estadístico se realizó utilizando el software R,17 a través del cual se estimaron las diferencias de significación estadística mediante la prueba de chi cuadrado con un nivel de significación de 0,05.
Los Comités de Ética de la Investigación de la Universidad de Ciencias Médicas de Cienfuegos y del IPK revisaron y aprobaron el protocolo de estudio. Se obtuvo el consentimiento de los padres o tutores de todos los niños antes de la evaluación clínica, e inclusión en el estudio.
RESULTADOS
En la etapa I del estudio fueron enrolados 1 050 niños entre 2-18 meses de edad, de los cuales, 984 (93,71 %) quedaron incluidos para participar. Se obtuvieron un total de 980 muestras de exudado NF (99,59 %). El 21,63 % (212/980) se encontraron positivas para S. pneumoniae (tabla 1). La prevalencia por estratos de edad no varió significativamente (24,62 % en los menores de 6 meses; 20,55 % entre 6 y 12 meses y 21,19 % entre 13 y 18 meses).
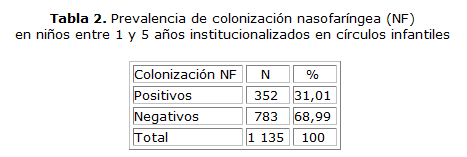
En la etapa II, de los 2 617 niños de 1-5 años de edad institucionalizados en círculos infantiles del municipio Cienfuegos, quedaron incluidos 1 140 (43 %). Se obtuvieron 1 135 muestras de exudados NF (99,56 %) y el 31,01 % (352/1135) resultaron positivas para Streptococcus pneumoniae (tabla 2).
En la primera etapa fueron identificados 30 serotipos de S. pneumoniae de los más de 90 reportados. La distribución de serotipos en portadores nasofaríngeos de 2-18 meses (tabla 3) mostró como más frecuentes los serotipos vacunales 6B (10,4 %) y 23F (8,5 %). Entre los considerados relacionados con la vacuna el 6A se encontró en el 23,1 % de los encuestados, mientras que los serotipos no vacunales alcanzaron el 37,7 % y los serotipos no serotipados fueron el 11,8 % del total de aislamientos. Entre los menores de 6 años de edad, los serotipos 19F, 6B y 14 (6,3 % respectivamente) fueron los más frecuentemente reportados. En este grupo de edad el 43,8 % fueron serotipos no vacunales y 14,6 % los que no fue posible serotipar en el laboratorio. No se detectaron portadores NF de los serotipos 1 y 5.
En niños entre 1 y 5 años (etapa II), la prevalencia global (31,01 %) se incrementó significativamente (p< 0,05). El predominio fue de los serotipos vacunales, que representaron más del 46,88 % (tabla 4). Entre los serotipos relacionados con la vacuna, el 6A (16,76 %) también fue el más frecuente. Los serotipos 19F (18,47 %), 6B (12,22 %) y 23F (8,52 %) prevalecieron como los más frecuentes en este grupo de edad. Los serotipos no vacunales representaron solamente el 21,31 % y los sin serotipar el 3,13 %.
DISCUSIÓN
En el artículo se reportan los resultados de los primeros estudios poblacionales de la colonización neumocócica NF en población menor de 5 años realizado en Cuba. Ellos forman parte de las investigaciones de línea de base previa a la introducción de la vacunación antineumocócica con la PCV7-TT, que permitirán monitorear los cambios atribuibles y el impacto de la vacunación en este grupo de edad.
Las encuestas transversales fueron diseñadas para garantizar representatividad de la población meta en el municipio de Cienfuegos, donde son conducidos los ensayos clínicos para la evaluación del candidato PCV7-TT, y donde se prevé la introducción de la vacunación en niños entre 1 y 5 años a través de una campaña masiva en corto plazo -con elevada cobertura- para probar su efectividad. Constituye una limitación de este estudio la capacidad de detección del método empleado para la detección de los serotipos que colonizan la NF (reacción de Quellung), pero en cualquier caso, la prevalencia sería incluso mayor que la reportada.
La alta frecuencia de portadores NF en niños entre 2 y 18 meses de edad, es una evidencia de que desde los primeros meses de vida estos resultan colonizados como consecuencia de la exposición a la amplia circulación de S. pneumoniae en la comunidad. La convivencia de los lactantes con niños menores de 5 años, y con ancianos, constituyen los factores de riesgo más frecuentemente asociados a este fenómeno en diferentes contextos.2
El incremento significativo de la colonización, asociado a los regímenes de convivencia en círculos infantiles y otras instituciones cuidadoras en niños preescolares menores de 5 años, confirma que el comportamiento epidemiológico en la población cubana no difiere de lo reportado en la literatura internacional.2 Impactar sobre la carga de colonización en esta población meta podría representar una estrategia eficiente para reducir la transmisibilidad y la carga de enfermedad a nivel poblacional.
Téngase en cuenta que la mayor proporción de serotipos aislados corresponden a serotipos vacunales, y que la distribución por frecuencia de ellos no varía de un grupo de edad a otro. La reducción de la circulación de los serotipos vacunales 23F, 19F, 6B, 14 y 18C permitiría reducir más del 40 % de la carga de colonización, y con ello, impactar sobre la enfermedad y la mortalidad asociada a la infección por neumococo.
La distribución de serotipos S. pneumoniae varía según el país, el grupo de edad y el tipo de cohorte de estudio. Estudios realizados con el fin de explorar los principales determinantes de las diferencias en las prevalencias de colonización NF, documentan que en Europa y los EE.UU. las distribuciones de serotipos son similares, con diferencias menores en algunos de ellos.18
En Asia, serotipos y serogrupos similares se informan entre los aislamientos NF en niños sanos. En la India los serogrupos más comunes son 6,14,19 y 15;19,20 y en Vietnam son 19,23,14,6 y 18.21 La distribución del serogrupo en Indonesia es ligeramente diferente, que reporta como los más comunes el 6 (25 %) y 23 (21 %).22 En Kenia serogrupos/serotipos que comúnmente se informan son 13, 15, 14, 6B y 19F, y estuvieron comúnmente presentes.23
La prevalencia global de colonización NF en niños de entre 2 y 18 meses antes de la introducción de vacunas en Cuba, está en el rango de los informes internacionales de Asia, Europa y América del Norte, donde se notifican prevalencias de portadores NF que van desde 11 a 100 %.1,2,11 La literatura científica avala que, aunque la NF de los niños es colonizada en el primer año de vida y la vacunación en los primeros meses resulta muy efectiva, entre los 2 y 5 años la prevalencia de colonización se incrementa significativamente.24,25 En un estudio realizado en Finlandia, la frecuencia de portador NF en niños de 2-24 meses aumenta del 13 % para los menores de 6 meses, a 43 % en niños mayores de 19 meses.26
La vigilancia de la prevalencia serotipo específico de la colonización NF, es útil para monitorear los cambios asociados a la introducción de la vacuna, a pesar que esta no representa con exactitud la contribución de cada serotipo a la carga de la enfermedad neumocócica.27 Por ejemplo, se ha demostrado que el serotipo 1 y 5, que con frecuencia producen ENI, son poco detectados en la colonización NF. Un estudio realizado en Gambia mostró que, a pesar de que los serotipos 1 y 5 son raramente aislados de la NF de los niños, resultan responsables de aproximadamente un tercio de todos los casos de ENI.28 En contraste, los serotipos 6A, 6B, 14, 19A y 19F se aíslan con frecuencia y causan ENI, y también tienen alta prevalencia en la colonización de la NF.29
De los más de 90 serotipos de neumococos existentes, solo entre 6-11 serotipos son responsables del 70 % de ENI en menores de 5 años de edad.30 También la distribución de los serotipos de neumococo causantes de ENI varía según la edad y zonas geográficas. A pesar de ello, la mayor carga de enfermedad se constata en las edades extremas de la vida, y en los niños menores de 5 años asociada a regímenes de institucionalización.2,31,32
En Cuba, a pesar de las limitaciones de los datos sobre los serotipos implicados en la ENI, se ha venido documentando que los serotipos 14, 19A, 19F, 6B, 23F y 6A fueron detectados con frecuencia en niños menores de 5 años de edad.33 Los resultados del presente estudio sobre colonización NF y la información disponible sobre los serotipos prevalentes causantes de ENI,34 sugieren que la introducción de la PCV7-TT, contribuirá a una reducción significativa en la morbilidad y la mortalidad asociadas con el neumococo a corto y largo plazo.
Se concluye que los hallazgos sugieren que la carga de enfermedad neumocócica y la colonización NF en niños menores de 5 años, pudiera ser significativamente impactada por la introducción de la nueva vacuna cubana contra neumococos.
Agradecimientos
Los autores expresan sus agradecimientos al IFV para apoyar este estudio, y a los equipos locales de investigación de las áreas de salud del municipio de Cienfuegos y el Hospital Pediátrico Provincial "Paquito González Cueto"; así como también al personal del LNRN-IPK de La Habana, por su colaboración en el estudio.
Conflicto de intereses
Nivaldo Linares-Pérez es empleado del IFV, centro promotor del candidato vacunal cubano PCV7-TT. Los autores María Eugenia Toledo-Romaní, Dunia Chávez, Gilda Toraño Peraza yMaría Felicia Casanova González, son profesionales que laboran en instituciones del Sistema Nacional de Salud de Cuba, miembros del Grupo de Trabajo del Proyecto Neumococo, y no son financiados por el IFV. Los autores declaran no tener conflicto de intereses en la realización del estudio.
REFERENCIAS BIBLIOGRÁFICAS
1. Publication WHO. Pneumococcal vaccines WHO position paper-2012-recommendations. Vaccine. 2012;30(32):4717-8.
2. Bogaert D, de Groot R, Hermans P. Streptococcus pneumoniae colonisation: the key to pneumococcal disease. The Lancet Infectious Diseases. 2004;4(3):144-54.
3. Croucher NJ, Kagedan L, Thompson CM, Parkhill J, Bentley SD, Finkelstein JA, et al. Selective and genetic constraints on pneumococcal serotype switching. PLoS Genet. 2015;11(3):e1005095.
4. Calix JJ, Nahm MH. A new pneumococcal serotype, 11E, has a variably inactivated wcjE gene. Journal of Infectious Diseases. 2010;202(1):29-38.
5. Ziane H, Manageiro V, Ferreira E, Moura IB, Bektache S, Tazir M, et al. Serotypes and antibiotic susceptibility of Streptococcus pneumoniae isolates from invasive pneumococcal disease and asymptomatic carriage in a pre-vaccination period, in Algeria. Front Microbiol. 2016;7:803-10.
6. Calix JJ, Porambo RJ, Brady AM, Larson TR, Yother J, Abeygunwardana C, et al. Biochemical, genetic, and serological characterization of two capsule subtypes among Streptococcus pneumoniae serotype 20 strains discovery of a new pneumococcal serotype. Journal of Biological Chemistry. 2012;287(33):27885-94.
7. Fitzwater SP, Chandran A, Santosham M, Johnson HL. The worldwide impact of the seven-valent pneumococcal conjugate vaccine. The Pediatric Infectious Disease Journal. 2012;31(5):501-8
8. Afonso ET, Minamisava R, Bierrenbach AL, Escalante JJ, Alencar AP, Domingues CM, et al. Effect of 10-valent pneumococcal vaccine on pneumonia among children, Brazil. Emerging Infectious Diseases. 2013;19(4):589-97.
9. Palmu AA, Jokinen J, Borys D, Nieminen H, Ruokokoski E, Siira L, et al. Effectiveness of the ten-valent pneumococcal Haemophilus influenzae protein D conjugate vaccine (PHiD-CV10) against invasive pneumococcal disease: a cluster randomised trial. The Lancet. 2013;381(9862):214-22.
10. De Wals P, Lefebvre B, Defay F, Deceuninck G, Boulianne N. Invasive pneumococcal diseases in birth cohorts vaccinated with PCV-7 and/or PHiD-CV in the province of Quebec, Canada. Vaccine. 2012;30(45):6416-20.
11. Gonçalves FP, Abreu TC, Alves M, dos Anjos R, de Souza L, Gomes H, et al. Nasopharyngeal carriage, serotype distribution and antimicrobial resistance of Streptococcus pneumoniae among children from Brazil before the introduction of the 10-valent conjugate vaccine. BMC Infectious Diseases. 2013;13:318.
12. González N, Paredes B, Pérez S, Mirabal M, Rivero I, González C, et al. Safety and immunogenicity of Cuban antipneumococcal conjugate vaccine PCV7-TT in healthy adults. MEDICC Review. 2015;17(4):32-7.
13. Dotres CP, Puga R, Ricardo Y, Brono CR, Paredes B, Echemendía V, et al. Safety and preliminary immunogenicity of Cuban pneumococcal conjugate vaccine candidate in healthy children: A randomized phase I clinical trial. Vaccine. 2014;32(41):5266-70.
14. Mokaddas E, Albert MJ. Impact of pneumococcal conjugate vaccines on burden of invasive pneumococcal disease and serotype distribution of Streptococcus pneumoniae isolates: An overview from Kuwait. Vaccine. 2012;30(6):37-40.
15. Farooqui H, Jit M, Heymann DL, Zodpey S. Burden of Severe Pneumonia, Pneumococcal Pneumonia and Pneumonia Deaths in Indian States: Modelling Based Estimates. PLoS ONE. 2015;10(6):e0129191.
16. World Health Organization & Centers for Disease Control and Prevention. Laboratory methods for the diagnosis of meningitis caused by Neisseria meningitidis, Streptococcus pneumoniae, and Haemophilus influenzae [homepage en Internet]; WHO manual, 2011 [citado 12 de Julio de 2016]. Disponible en: http://apps.who.int/iris/handle/10665/70765
17. Team RC. (2014). R: A language and environment for statistical computing. R Foundation for Statistical Computing [homepage en Internet]; Vienna, Austria. 2013 [citado 9 de Mayo de 2016]. Disponible en: http://cran.fiocruz.br/web/packages/dplR/vignettes/timeseries-dplR.pdf
18. Dobay O, Amyes SG, Nagy K. The effect of the 7-valent conjugate vaccine (PCV7) on the incidence of pneumococcal infections world-wide. Reviews in Medical Microbiology. 2008;19(3):79-85.
19. Complete P. Licensure of a 13-valent pneumococcal conjugate vaccine (PCV13) and recommendations for use among children-Advisory Committee on Immunization Practices (ACIP), 2010. MMWR Morb Mortal Wkly Rep. 2010;59:258-61.
20. Weil-Olivier C, van der Linden M, de Schutter I, Dagan R, Mantovani L. Prevention of pneumococcal diseases in the post-seven valent vaccine era: A European perspective. BMC Infectious Diseases. 2012;12:207-11.
21. Dagan R. Impact of pneumococcal conjugate vaccine on infections caused by antibiotic‐resistant Streptococcus pneumoniae. Clinical Microbiology and Infection. 2009;15(3):16-20.
22. Soewignjo S, Gessner BD, Sutanto A, Steinhoff M, Prijanto M, Nelson C, et al. Streptococcus pneumoniae nasopharyngeal carriage prevalence, serotype distribution, and resistance patterns among children on Lombok Island, Indonesia. Clinical Infectious Diseases. 2001;32(7):1039-43.
23. Adegbola RA, De Antonio R, Hill PC, Roca A, Usuf E. Carriage of Streptococcus pneumoniae and Other Respiratory Bacterial Pathogens in Low and Lower-Middle Income Countries: A Systematic Review and Meta-Analysis. PLoS ONE. 2014;9(8):e103293.
24. Hammitt L, Bruden L, Butler JC, Baggett HC, Hurlburt DA, Reasonover A, et al. Indirect effect of conjugate vaccine on adult carriage of Streptococcus pneumoniae: an explanation of trends in invasive pneumococcal disease. Journal of Infectious Diseases. 2006;193(11):1487-94.
25. Cutts F, Zaman S, Enwere Gy, Jaffar S, Levine O, Okoko J, et al. Efficacy of nine-valent pneumococcal conjugate vaccine against pneumonia and invasive pneumococcal disease in The Gambia: randomised, double-blind, placebo-controlled trial. The Lancet. 2005;365(9465):1139-46.
26. Ghaffar F, Barton T, Lozano J, Muniz LS, Hicks P, Gan V, et al. Effect of the 7-valent pneumococcal conjugate vaccine on nasopharyngeal colonization by Streptococcus pneumoniae in the first 2 years of life. Clinical Infectious Diseases. 2004;39(7):930-8.
27. Isaacman DJ, Mc Intosh ED, Reinert R. Burden of invasive pneumococcal disease and serotype distribution among Streptococcus pneumoniae isolates in young children in Europe: impact of the 7-valent pneumococcal conjugate vaccine and considerations for future conjugate vaccines.International Journal of Infectious Diseases. 2010;14(3):197-209.
28. Hill PC, Onyeama CO, Ikumapayi UN, Secka O, Ameyaw S, Simmonds N, et al. Bacteraemia in patients admitted to an urban hospital in West Africa. BMC Infectious Diseases. 2007;7(1):2.
29. García-Vera C. Estado de portador de neumococo en niños y su relación con la enfermedad invasiva. Qué ha cambiado tras la introducción de vacunas conjugadas? Rev Pediatr Aten Primaria. 2010;XII(47):457-82.
30. Johnson HL, Deloria-Knoll M, Levine OS, Stoszek SK, Freimanis Hance L, Reithinger R, et al. Systematic evaluation of serotypes causing invasive pneumococcal disease among children under five: the pneumococcal global serotype project. PLoS Medicine. 2010;7(10):1251.
31. Brink AJ, Cotton MF, Feldman C, Geffen L, Hendson W, Hockman MH, et al; Working Group of the Infectious Diseases Society of South Africa. Guideline for the management of upper respiratory tract infections. S Afr Med J. 2004 Jun;94(6 Pt 2):475-83.
32. Brandileone MCC, Zanella RC, Almeida SCG, Brandao AP, Riveiro AF, Carvalhanas TRMP, et al. Effect of 10-valent pneumococcal conjugate vaccine on nasopharyngeal carriage of Streptococcus pneumoniae and Haemophilus influenzae among children in São Paulo, Brazil. Vaccine [serie en Internet]. 2016 [citado 12 de Octubre de 2016];34(6). Disponible en:http://www.sciencedirect.com/science/article/pii/S0264410X16308404
33. Toraño G, Pérez L, Abreus M, Rodríguez M, Dickinson F, Valcarcel M, et al. Serotipos y resistencia antimicrobiana de aislamientos meníngeos de Streptococcus pneumoniae, Cuba, 2007-2012. VacciMonitor. 2014;23(3):117-23.
34. Agudelo CI, Castañeda E, Corso A, Regueira M, Brandileone M, Brandão AP, et al. Resistencia a antibióticos no betalactámicos de aislamientos invasores de Streptococcus pneumoniae en niños latinoamericanos. SIREVA II, 2000-2005. Rev Panam Salud Pública.
2009;25(4):305-13.
Recibido: 1º de Agosto de 2016.
Aprobado: 6 de Octubre de 2016.