Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Pediatría
versión On-line ISSN 1561-3119
Rev Cubana Pediatr vol.90 no.1 Ciudad de la Habana ene.-mar. 2018
ARTÍCULO ORIGINAL
Marcadores moleculares de la asfixia perinatal
Molecular markers of perinatal asphyxia
Cristóbal González-Losada, Alberto Juan Dorta-Contreras
Laboratorio Central de Líquido Cefalorraquídeo (LABCEL). Facultad de Ciencias Médicas "Miguel Enríquez". La Habana, Cuba.
RESUMEN
Introducción: la asfixia perinatal es un problema de salud que puede acarrear alteraciones del neurodesarrollo en los recién nacidos. Las determinaciones en suero de enolasa específica de neurona, lactato deshidrogenasa y aspartato amino transferasa han sido utilizadas como marcadores de asfixia perinatal.
Objetivos: evaluar el valor de las determinaciones en suero de lactato deshidrogenasa, aspartato amino transferasa y enolasa específica de neurona como marcadores moleculares de la asfixia perinatal.
Métodos: se realizó un estudio observacional descriptivo de corte transversal. Se trabajó con una muestra intencional de 41 recién nacidos asfícticos, clasificados con distintos grados de encefalopatía hipóxico-isquémica según los criterios de Sarnat. Se tomaron muestras de suero al momento del nacimiento y a las 72 horas siguientes. Las determinaciones en suero de enolasa específica de neurona se realizaron por ELISA. Se cuantificó lactato deshidrogenasa y aspartato amino transferasa por espectrofotometría.
Resultados: todos los pacientes presentaron valores elevados en suero, de los tres analitos, a las 24 y 72 horas de nacidos. Los valores enzimáticos no variaron significativamente entre las 24 y 72 horas de nacidos sin tomar en cuenta el grado de encefalopatía hipóxico-isquémica. Existe correlación positiva entre los valores enzimáticos a las 24 y a las 72 horas de enolasa específica de neurona y lactato deshidrogenasa. No fue posible diferenciar el grado de encefalopatía hipóxico-isquémica a través de los niveles en suero de estas enzimas.
Conclusiones: los valores de estas determinaciones enzimáticas contribuyen a describir desde el punto de vista bioquímico el cuadro del neonato con asfixia perinatal.
Palabras clave: asfixia perinatal; encefalopatía hipóxico-isquémica; enolasa específica de neurona; lactato deshidrogenasa; aspartato amino transferasa.
ABSTRACT
Introduction: perinatal asphyxia is a health problem which may cause neurodevelopmental alterations in newborns. Serum determinations of neuron-specific enolase, lactate dehydrogenase, and aspartate aminotransferase have been used as markers of perinatal asphyxia.
Objectives: evaluate the value of serum determinations of lactate dehydrogenase, aspartate aminotransferase and neuron-specific enolase as molecular markers of perinatal asphyxia.
Methods: a cross-sectional observational descriptive study was conducted of 41 asphyxiated newborns classified as different grades of hypoxic-ischemic encephalopathy according to Sarnat's scale. Serum samples were taken at birth and 72 hours later. Serum determinations of neuron-specific enolase were obtained by ELISA. Lactate dehydrogenase and aspartate aminotransferase were quantified by espectrophotometry.
Results: all the patients had high serum values of the three analytes 24 and 72 hours after birth. Enzyme values did not vary significantly from 24 to 72 hours after birth, not considering the grade of hypoxic-ischemic encephalopathy. A positive correlation was found between enzyme values for neuron-specific enolase and lactate dehydrogenase at 24 and 72 hours. It was not possible to differentiate the grade of hypoxic-ischemic encephalopathy via the serum levels of these enzymes.
Conclusions: the values of these enzyme determinations contribute to describe the status of neonates with perinatal asphyxia from a biochemical point of view.
Key words: perinatal asphyxia; hypoxic-ischemic encephalopathy; neuron-specific enolase; lactate dehydrogenase; aspartate aminotransferase.
INTRODUCCIÓN
La asfixia perinatal representa un problema de salud por la morbilidad tan elevada, así como por la ocurrencia de las secuelas neurológicas secundarias a los sucesos perinatales.1
Los eventos privativos de oxígeno son situaciones que pueden tener efectos lesivos sobre el metabolismo y la estructura celular, en las cuales las neuronas son especialmente vulnerables.2
La estimación precoz de la gravedad de una lesión cerebral aguda, secundaria a una hipoxia-isquemia o a otras entidades nosológicas, podría ser de gran utilidad para la toma de decisiones clínicas en neonatos con asfixia. En este sentido, se han estudiado distintos marcadores bioquímicos, en la mayoría de las ocasiones fundamentándose en los mecanismos fisiopatológicos de la lesión hística.
La enolasa gamma enolasa específica de neurona (EEN) es una isoenzima que se encuentra predominantemente en neuronas y tejidos neuroectodérmicos. Representa el 1,5 % de todas las proteínas solubles cerebrales, es estable en los fluidos biológicos, y ha sido estudiada como marcador de lesión neuronal.3
Lackman y otros han valorado el comportamiento sérico de la lactato deshidrogenasa (LDH) y la aspartato amino transferasa (ASAT)4 en eventos privativos de oxígeno. En una primera investigación, refieren aumento en la concentración sérica de las dos enzimas a las 72 horas de vida en recién nacidos a término con depresión; posteriormente, estos autores trabajaron estas enzimas en prematuros y niños nacidos a término.5
Tomando en cuenta la asfixia perinatal como un problema de salud importante relativamente frecuente en nuestro medio6 y su asociación con la ocurrencia de trastornos en el neurodesarrollo del niño, proponemos un estudio de las enzimas EEN, LDH y ASAT en recién nacidos con distintos grados de asfixia.
El objetivo es evaluar el valor de las determinaciones en suero de LDH, ASAT y EEN como marcadores moleculares de la asfixia perinatal.
MÉTODOS
Se estudiaron 41 recién nacidos asfícticos procedentes de la provincia La Habana del Hospital Ginecoobstétrico de Guanabacoa. Estos recién nacidos fueron clasificados con distintos grados de encefalopatía hipóxico-isquémica evaluados por los criterios de Sarnat.1,2,7,8 Esta investigación es observacional descriptiva de corte transversal. Se trabajó con una muestra intencional basada en los criterios de exclusión e inclusión.
Se incluyeron los recién nacidos a término, con peso al nacer de entre 3 000 y 3 900 g, con diagnóstico de asfixia perinatal; y se excluyeron aquellos con pH arterial > 7,15, puntaje de Apgar> 5 a los cinco minutos, los que tuvieron muestras de sueros hemolisados y aquellos con muestras de suero en las que se identificó algún marcador infeccioso viral o bacteriano.
Se tomaron muestras de suero al momento del nacimiento y a las 72 horas siguientes. Las muestras permanecieron congeladas en alícuotas a menos 80 ºC hasta el momento de su uso.
Se determinaron los niveles de EEN por un método inmunoenzimático tipo ELISA (NSE EIA) de la firma Diagnostics GmbH (DRG, Alemania). La placa de microtitulación se lee en un espectrofotómetro SUNRISE con un software Magallanes a 620 nm (Crailsheim, Alemania).
La curva estándar se construye para cada corrida ploteando la absorbancia contra los valores de concentración de cada estándar. Los resultados de los pacientes se obtienen y se leen entonces de la curva.
Se cuantificaron las enzimas LDH y ASAT en un espectrofotómetro Hitachi modelo 717. La operacionalización de las variables se expone en el cuadro siguiente:
Para la concepción de la investigación, el protocolo fue aprobado por el Comité de Ética de Investigación de los hospitales de procedencia de las pacientes. Todas estas variables se vaciaron en un documento y se procesaron en una base de datos en un paquete estadístico MedCalc versión 13.1.
Se obtuvo una matriz de correlación entre las variables hipotéticamente relacionadas y se realizó test t para comparar las medias de las distintas variables. Se trabajó con una confianza del 99 % para estimar la significación estadística. También se realizó test t de series apareadas para la comparación de los niveles enzimáticos al momento del nacimiento y a las 72 horas.
RESULTADOS
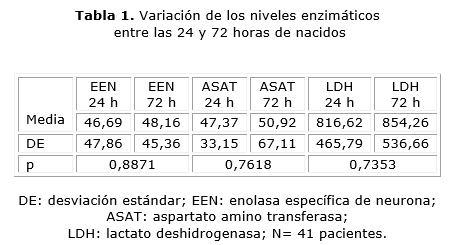
Todos los pacientes presentaron valores elevados de EEN, LDH y ASAT en suero a las 24 y 72 horas de nacidos. En la tabla 1 se observa que los valores enzimáticos no han variado significativamente entre las 24 y 72 horas después de nacidos, sin tomar en cuenta el grado de encefalopatía hipóxico-isquémica.
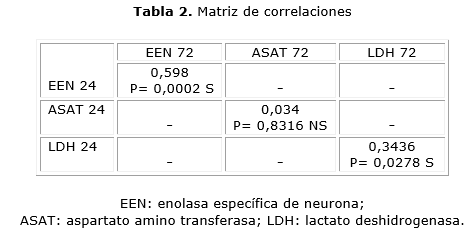
Para la EEN existe correlación positiva entre los valores enzimáticos a las 24 y a las 72 horas. Esto significa que el aumento de la enolasa a las 24 horas se corresponde con un aumento de la enolasa también a las 72 horas, y es significativo desde el punto de vista estadístico para esta enzima. Los valores de ASAT se correlacionaron al evaluar a las 24 y 72 horas. La LDH tuvo una correlación positiva y significativa, lo cual podría interpretarse como un elemento a favor de esta enzima como posible marcador (tabla 2).
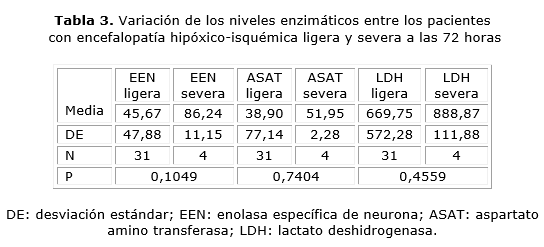
Existen variaciones a las 72 horas en las concentraciones enzimáticas de los pacientes con encefalopatía hipóxico-isquémica ligera y severa, pero esta variación no resulta significativa para la EEN, ASAT y la LDH desde el punto de vista estadístico, por lo que no es posible diferenciarse el grado de encefalopatía hipóxico-isquémica a través de los niveles en suero de estas enzimas (tabla 3).
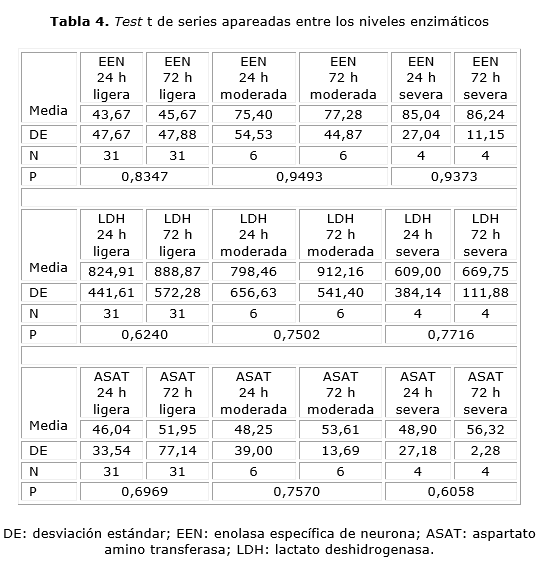
En el test t de series apareadas entre los niveles enzimáticos se compara en cada paciente en los dos momentos de la obtención de la muestra (tabla 4). No es posible diferenciar de forma significativa la existencia de modificaciones en los valores de EEN, para la encefalopatía hipóxico-isquémica ligera, moderada y severa.
Los valores medios de LDH no tienen diferencias significativas entre la toma a la hora del nacimiento y a las 72 horas para las distintas gradaciones de la encefalopatía hipóxico-isquémica, y en todos los casos se mantienen de forma elevada a las 72 horas, lo cual indica, sin lugar a dudas, que existe un daño tisular, como se ha podido apreciar.
En cuanto a los niveles de ASAT, no hay variaciones significativas entre la toma de la muestra a las 24 horas y a las 72 horas para la encefalopatía hipóxico-isquémica ligera, moderada y severa.
DISCUSIÓN
Se han estudiado los niveles de EEN en recién nacido con asfixia, con una elevación de los niveles de concentración de esta enzima en estos pacientes con respecto a controles no asfícticos.9 Los niveles de EEN en suero han sido relacionados con distintos grados de encefalopatía hipóxico-isquémica en recién nacidos asfícticos,10 por lo que se ha propuesto su uso como marcador bioquímico de asfixia perinatal.9
Ha sido posible también señalar una correlación entre altas concentraciones de EEN en suero, y la gravedad de la lesión sobre el SNC en neonatos con asfixia perinatal.11 En nuestro estudio los valores enzimáticos de la EEN se mantuvieron elevados a las 24 y 72 horas, lo cual indica que la situación de daño neuronal y la ausencia de oxígeno ocurrida en el neonato, siguen reflejándose en todo el periodo.6,12
Los niveles de EEN deben normalizarse a las 72 horas después del evento privativo de oxígeno,11 de continuar elevados indicarían, desde el punto de vista bioquímico, que se mantiene el daño tisular.3
Aunque la ASAT y LDH no son específicas del tejido nervioso, las determinaciones en suero de sus niveles en eventos de asfixia han sido utilizadas numerosas veces como indicadores de daño tisular por asfixia, y se han relacionado con la ocurrencia de encefalopatía hipóxico-isquémica con diferentes tipos de desenlaces para los pacientes.13
En nuestro estudio, los valores medios de LDH y ASAT se encontraron elevados, lo cual significa que existe un daño tisular ocasionado por la hipoxia,14 y estos valores no varían de forma significativa en los primeros tres días de nacido el neonato.
Con respecto a la LDH, en los casos de depresión respiratoria, existe falta de oxígeno, por lo cual el proceso de respiración a nivel molecular dado por la cadena respiratoria no pudo llegar a la formación de CO2 y agua. Esto hace que se eleven las concentraciones de lactato y se active la LDH. Un aumento de la actividad de esta enzima, reafirma la situación fisiológica antes expuesta.15
La LDH ha sido utilizada para evaluar la asfixia neonatal, y se ha comprobado que los niveles elevados de esta enzima traducen daño tisular. Estudios de cosos y controles demuestran que, en casos de asfixia, los niveles de LDH se encuentran más elevados que en los controles,16 y se traduce en un pronóstico desfavorable mientras más tiempo se mantengan elevadas sus concentraciones.17
Estudios preliminares, en los cuales se ha evaluado a recién nacidos con asfixia perinatal, han podido constatar que en las primeras 12 horas de vida, la determinación de los niveles de LDH en suero puede ser utilizada como marcador predictor de la ocurrencia de encefalopatía hipóxico-isquémica.18
Los niveles de ASAT se encuentran aumentados en pacientes hipóxicos con daño cardíaco acompañado.12,19 En nuestra muestra no se detectaron aparentemente problemas de este tipo, sin embargo puede apreciarse que los niveles de esta enzima están aumentados, lo que sugiere un grado importante de asfixia y daño a nivel bioquímico del corazón, como otro de los tantos tejidos del neonato que se afectan por la falta de oxígeno.
La ASAT se aumenta en suero en presencia de daño cardíaco fundamentalmente.20 Existen estudios en los que se demuestra que esta enzima se incrementa en los procesos de hipoxia en el recién nacido,12 y que se emplea como predictor menos específico de encefalopatía hipóxico-isquémica.21
Se concluye que los valores de estas tres determinaciones enzimáticas contribuyen a describir, desde el punto de vista bioquímico, el cuadro del niño con asfixia perinatal, y entre ellas, la EEN parece ser la enzima con mayores posibilidades, por su alta especificidad en el tejido nervioso.
Conflicto de intereses
Los autores declaran no tener conflicto de intereses en la realización del estudio.
REFERENCIAS BIBLIOGRÁFICAS
1. De Almeida MF, Moreira LM, Vaz dos Santos RM, Kawakami MD, Anchieta LM, Guinsburg R. Early neonatal deaths with perinatal asphyxia in very low birth weight Brazilian infants. J Perinatol. 2015;35(11):954-7.
2. Fattuoni C, Palmas F, Noto A, Fanos V, Barberini L. Perinatal asphyxia: a review from a metabolomics perspective. Molecules. 2015;20(4):7000-16.
3. Isgrò MA, Bottoni P, Scatena R. Neuron-Specific Enolase as a Biomarker: Biochemical and clinical Aspects. Adv Exp Med Biol. 2015;867:125-43.
4. Lackmann GM, Töllner U, Mader R. Serum enzyme activities in full-term asphyxiated and healthy newborns: enzyme kinetics during the first 144 hours of life. Enzyme Protein. 1993;47:160-72.
5. Lackmann GM, Tóllner U. The predictive value of elevation in specific serum enzymes for subsequent development of hypoxic-ischemic encephalopathy or intraventricular hemorrhage in full-term and premature asphyxiated newborns. Neuropediatrics. 1995;26:192-8.
6. Bu-Coifiu-Fanego R, Dorta-Contreras AJ, Noris-García E, Padilla-Docal B, Pupo-Portal L, González-Hernández A. Neuron-specific enolase in two newborns presenting with moderate depression at birth. Rev Cubana Pediatr [serie en Internet]. 2009 [citado 3 de septiembre de 2016];81(1). Disponible en: http://scielo.sld.cu/scielo.php?script=sci_abstract&pid=S0034-75312009000100003&lng=es&nrm=iso&tlng=es
7. Alaro D, Bashir A, Musoke R, Wanaiana L. Prevalence and outcomes of acute kidney injury in term neonates with perinatal asphyxia. Afr Health Sci. 2014;14(3):682-8.
8. Young L, Berg M, Soll R. Prophylactic barbiturate use for the prevention of morbidity and mortality following perinatal asphyxia. Cochrane Database Syst Rev. 2016;(5):CD001240.
9. Chaparro-Huerta V, Flores-Soto ME, Merin Sigala ME, Barrera de León JC, Lemus-Varela ML, Torres-Mendoza BM, et al. Proinflammatory Cytokines, Enolase and S-100 as Early Biochemical Indicators of Hypoxic-Ischemic Encephalopathy Following Perinatal Asphyxia in Newborns. Pediatr Neonatol. 2017;58(1):70-6.
10. Tekgul H, Yalaz M, Kutukculer N, Ozbek S, Kose T, Akisu M, et al. Value of biochemical markers for outcome in term infants with asphyxia. Pediatr Neurol. 2004;31:326-32.
11. Ramaswamy V, Horton J, Vandermeer B, Buscemi N, Miller S, Yager J. Systematic review of biomarkers of brain injury in term neonatal encephalopathy. Pediatr Neurol. 2009;40:215-26.
12. Peng H, Pu YH. Dynamic changes in serum neuron-specific enolase levels in neonates. Zhongguo Dang Dai Er Ke Za Zhi. 2014 Nov;16(11):1122-4.
13. Beken S, Aydin B, Dilli D, Erol S, Zenciroglu A, Okumus N. Can biochemical markers predict the severity of hypoxic-ischemic encephalopathy? Turk J Pediatr. 2014;56(1):62-8.
14. Róka A, Vásárhelyi B, Bodrogi E, Machay T, Szabó M. Changes in laboratory parameters indicating cell necrosis and organ dysfunction in asphyxiated neonates on moderate systemic hypothermia. Acta Paediatr. 2007;96(8):1118-21.
15. Mehta A, Chawla D, Kaur J, Mahajan V, Guglani V. Salivary lactate dehydrogenase levels can provide early diagnosis of hypoxic-ischaemic encephalopathy in neonates with birth asphyxia. Acta Paediatr. 2015;104(6):e236-40.
16. Chhavi N, Zutshi K, Singh NK, Awasthi A, Goel A. Serum liver enzyme pattern in birth asphyxia associated liver injury. Pediatr Gastroenterol Hepatol Nutr. 2014;17(3):162-9.
17. Thoresen M, Liu X, Jary S, Brown E, Sabir H, Stone J, et al. Lactate dehydrogenase in hypothermia-treated newborn infants with hypoxic-ischaemic encephalopathy. Acta Paediatr. 2012;101(10):1038-44.
18. Karlsson M, Wiberg-Itzel E, Chakkarapani E, Blennow M, Winbladh B, Thoresen M. Lactate dehydrogenase predicts hypoxic ischaemic encephalopathy in newborn infants: a preliminary study. Acta Paediatr. 2010;99(8):1139-44.
19. Lackmann GM. Influence of neonatal idiopathic respiratory distress syndrome on serum enzyme activities in premature healthy and asphyxiated newborns. Am J Perinatol. 1996;13(6):329-34.
20. Berestovskaia VS, Eremina MV, Kozlov AV. Cardiac markers in the pericardial fluid in sudden coronary death. Klin Lab Diagn. 2003;(5):8-10.
21. Castro-Gago M, Rodríguez-Núñez A, Novo-Rodríguez MI, Eirís-Puñal J. Biochemical parameters predictive of neuronal damage in childhood. Rev Neurol. 2001;32(12):1141-50.
Recibido: 24 de julio de 2017.
Aprobado: 4 de septiembre de 2017.
Cristóbal González-Losada. Laboratorio Central de Líquido Cefalorraquídeo (LABCEL). Facultad de Ciencias Médicas "Miguel Enríquez". Ramón Pintó # 202, entre Ensenada y Villanueva, municipio Diez de Octubre. La Habana, Cuba. Correo electrónico: chriss.losada@gmail.com