Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Pediatría
versión On-line ISSN 1561-3119
Rev Cubana Pediatr vol.90 no.1 Ciudad de la Habana ene.-mar. 2018
ARTÍCULO DE REVISIÓN
Ototoxicidad y factores predisponentes
Ototoxicity and predisposing factors
Julianis Quintero Noa,I María del Carmen Hernández Cordero,II Norma Elena de León Ojeda,I Loraine Meléndez QuinteroIII
I Hospital Pediátrico Docente Universitário "William Soler Ledea". La Habana, Cuba.
II Centro de Neurociencias de Cuba. La Habana, Cuba.
III Facultad de Ciencias Médicas "Enrique Cabrera". La Habana, Cuba.
RESUMEN
Introducción: la pérdida auditiva inducida por fármacos ototóxicos se consideró un problema grave, frecuente, con repercusión en el quehacer diario de otorrinolaringólogos y pediatras. Se documentó ototoxicidad relacionada con aminoglucósidos y tratamientos antineoplásicos, salicilatos, quininas y algunos diuréticos.
Objetivo: profundizar en los enfoques actuales más novedosos sobre ototoxicidad, factores de riesgo, predisposición genética y prevención.
Métodos: estudio retrospectivo de la literatura escrita en idiomas español e inglés, de los reportes más interesantes y sugerentes publicados, sin límite de tiempo anterior, hasta Febrero de 2017, a través de búsqueda en línea por Internet, y bases de datos consultadas: Google, Cochrane y PubMed-Medline.
Desarrollo: se obtuvo un total de más de 100 artículos. Los mecanismos exactos de ototoxicidad por aminoglucósidos y cisplatino, constituyeron un área activa de investigación. Se analizó la relación entre ototoxicidad y las caspasas 8,9 y 3, mediadores esenciales en la apoptosis de células ciliadas en la cóclea y la hipoacusia. Se describió la relación entre las mutaciones del gen MTRNR1, que codifica para la subunidad ribosomal 12s, y la pérdida auditiva por ototoxicidad. Se relacionó con hipoacusia y sordera mitocondrial no sindrómica, transmisión exclusivamente materna, e incremento en la susceptibilidad a la ototoxicidad por aminoglucósidos, factor clave predisponente.
Consideraciones finales: los fármacos ototóxicos, inducen toxicidad coclear e hipoacusia bilateralmente simétrica, o asimétrica, en altas frecuencias, secundaria a destrucción irreversible de células ciliadas externas en el órgano de Corti. Nuevas investigaciones sobre cisplatino identifican la población susceptible, y pueden ofrecer alternativas de tratamiento menos agresivas. Se abordan criterios actuales sobre monitoreo audiológico y grados de ototoxicidad. La prevención implica una estricta vigilancia.
Palabras clave: ototoxicidad; fármacos ototóxicos; hipoacusia; herencia mitocondrial y apoptosis; prevención.
ABSTRACT
Introduction: hearing loss induced by ototoxic drugs was approached as a serious, frequent problem with an impact on the daily work of otolaryngologists and pediatricians. A review was conducted about the relationship of ototoxicity to aminoglycosides, antineoplastic treatments, salicylates, quinines and some diuretics.
Objective: analyze the most updated current approaches about ototoxicity, risk factors, genetic predisposition and prevention.
Methods: a retrospective review was conducted of the literature on the topic published in Spanish and English, as well as the most interesting and thought-provoking reports, from an open start date until February 2017, by means of a search on the Internet and in the databases Google, Cochrane and PubMed-MEDLINE.
Results: more than 100 papers were obtained. The exact ototoxicity mechanisms by aminoglycosides and cisplatin were an area of active research. An analysis was made of the relationship between ototoxicity and caspases 8, 9 and 3, essential mediators in the apoptosis of ciliated cells in the cochlea, and hearing loss. A description is provided of the relationship between mutations of the MTRNR1 gene, which codifies for the ribosomal subunit 12s, and hearing loss by ototoxicity. A connection was established with hearing loss and mitochondrial nonsyndromic deafness, exclusively maternal transmission, and increased susceptibility to ototoxicity by aminoglycosides, a key predisposing factor.
Final considerations: ototoxic drugs induce cochlear toxicity and bilaterally symmetric or asymmetric hearing loss at high frequencies, secondary to irreversible destruction of external ciliated cells in the organ of Corti. Recent research about cisplatin has identified the susceptible population, and may offer new, less aggressive treatment alternatives. Current criteria are presented about audiological surveillance and ototoxicity grades. Prevention implies strict surveillance.
Key words: ototoxicity; ototoxic drugs; hearing loss; mitochondrial inheritance and apoptosis; prevention.
INTRODUCCIÓN
La ototoxicidad es el efecto nocivo, iatrogénico, con lesiones reversibles o permanentes, producido en el oído por diversas sustancias denominadas ototóxicos, y que afectan la audición, el equilibrio, o ambos. Se considera ototóxico, cualquier fármaco con potencial de causar reacciones tóxicas a las estructuras del oído interno, incluyendo cóclea, vestíbulo, canales semicirculares, los atolitos, y en algunos casos, nervio auditivo. Clínicamente, se presenta pérdida de audición, sordera, tinnitus y desequilibrio. Los antibióticos aminoglucósidos (AT-AG), se consideran los de uso más habitual, por vía sistémica, o local, en oído medio.1-4 La gentamicina o la estreptomicina tienen una especial selectividad por el oído interno, ya que actúan directamente sobre el laberinto posterior, mientras que kanamicina y neomicina en el laberinto anterior.1,3,4
Actualmente, se señalan entre los factores de riesgo, la enfermedad mitocondrial no sindrómica, que se caracteriza por una pérdida auditiva moderada, severa o profunda, y las variantes patogénicas en MTRNR1 o MTTS1, que se asocian con la predisposición a la ototoxicidad por aminoglucósidos (AG).5-7 Los factores de riesgo genéticos se estiman en aproximadamente 20 % de los casos.5-11
En la mutación A1555G, directamente relacionada con casos familiares de hipoacusia no sindrómica, asociada a AT-AG, los enfermos desarrollan pérdida auditiva si se exponen a tratamientos prolongados, de acuerdo con la edad, e hipoacusia neurosensorial (HNS) previa.2,7,8
Según reporta Hernández,12 a finales de la década de los 40, aparece el término ototoxicidad, con el descubrimiento y empleo masivo de la estreptomicina como tuberculostático, y en las infecciones por gramnegativos, convirtiéndose el uso de AT-AG en la primera causa identificable de vestibulopatía periférica bilateral. Estos fármacos tienen la capacidad de interaccionar con las células auditivas, generan radicales libres que alteran las membranas celulares y lesionan fundamentalmente las células ciliadas externas. No alteran el citoesqueleto, pero sí provocan fenómenos de apoptosis.12,13
Se detecta que un número importante de pacientes con tuberculosis, tratados exitosamente con estreptomicina, desarrollan disfunción coclear y vestibular irreversible. Estos hallazgos, y la asociación con otros AG, conducen a una gran cantidad de investigaciones científicas, sobre la etiología y los mecanismos de la ototoxicidad. Actualmente se ha demostrado que muchos agentes farmacológicos bien conocidos (AG y otros antibióticos, agentes antineoplásicos a base de platino, salicilatos, quinina y diuréticos), tienen efectos tóxicos para el sistema cocleovestibular.1-4
La ototoxicidad se asocia a HNS bilateral de alta frecuencia y acúfenos, puede ser temporal o preferentemente irreversible en la mayoría de los agentes. Generalmente, es bilateralmente simétrica, o asimétrica.13 El tiempo de inicio suele ser impredecible. Una pérdida auditiva marcada aparece inmediatamente posterior al tratamiento, o tardíamente (se manifiesta varias semanas o meses después de la administración de cualquier cantidad, incluso una dosis única del AT-AG o antineoplásico).12-15
Sih y otros1 reportan ototoxicidad cuando se observa una HNS, superior a 25 dB en las frecuencias comprendidas entre 250 y 8 000 Hertzios (Hz) u 8 kilohertzios (KHz). En los niños la gravedad de la afectación se caracteriza por no presentar pérdidas auditivas, tenerlas muy leves acompañadas de acúfenos (síntoma más precoz), o evidenciar una importante HNS bilateral o unilateral y/o graves problemas para mantener el equilibrio.1
Actualmente, se concede gran importancia a la ototoxicidad, y se realizan estudios investigativos encaminados a conocer el efecto de las sustancias ototóxicas a nivel del oído interno, historia familiar, características clínicas, diagnóstico y tratamiento de la enfermedad mitocondrial. El objetivo de esta revisión es profundizar en los enfoques actuales más novedosos sobre la ototoxicidad, factores de riesgo, predisposición genética y la contribución a su prevención.
DESARROLLO
Características clínicas de la ototoxicidad
La pérdida auditiva temprana por daño coclear agudo, puede no ser reconocida por el paciente y manifestarse inicialmente como un aumento en el umbral de las frecuencias agudas (> 4 000 Hz). Si progresa, las frecuencias más bajas del habla, se afectan, y el paciente puede llegar a tener una hipoacusia profunda si se mantiene el medicamento. Si el fármaco se detiene tempranamente, en el transcurso del daño, puede ser posible una recuperación parcial de los umbrales auditivos. Sin embargo, generalmente se produce una pérdida auditiva permanente.1,3,4
Se describe la toxicidad vestibular como un efecto adverso notable de los AT-AG (el nistagmos puede estar presente, como un signo temprano).12 Los síntomas suelen incluir desequilibrio y síntomas visuales. Los niños se caen frecuentemente (sensación de inestabilidad y mareo que dificulta conductas, como ponerse de pie, andar, o subir escaleras). Pueden caminar con las piernas separadas, ser incapaces de trasladarse sin tropezar, signos que se incrementan en la oscuridad. En los casos más graves la visión suele afectarse, observarse imágenes que rebotan, saltan erráticamente, o se ven borrosas cuando mueven la cabeza (oscilopsia). Puede cursar con vómitos, cefalea frecuente, cambios en la frecuencia cardiaca y la tensión arterial.1,12-15
La pérdida auditiva depende del fármaco. Los salicilatos pueden producir una hipoacusia unilateral y permanente, o bilateral y reversible. La administración simultánea de drogas pueden tener un efecto de sinergismo: la toxicidad de la kanamicina se describe más intensa si se asocia con quinina. El uso previamente de un ototóxico puede sensibilizar al órgano de Corti, y los pacientes que padecen insuficiencia renal crónica se consideran más vulnerables.4 La ototoxicidad de una sustancia depende de la concentración que alcance en los líquidos del oído interno, y del tiempo que permanezca en estos; mientras mayor sea, más lesión coclear. Se considera importante la predisposición individual. Los ototóxicos se deben indicar en casos precisos y en dosis adecuadas. Se reporta mayor susceptibilidad, en edades extremas.4
Aminoglucósidos
Desde su introducción a finales de la década del 40 se dispone del tratamiento con AT-AG, que incluye estreptomicina, dihidroestreptomicina, kanamicina, gentamicina, neomicina, tobramicina, netilmicina y amikacina. Se consideran antibióticos bactericidas a la subunidad ribosomal 30s, e inhiben la síntesis de proteínas bacterianas. Se describen activos, contra bacilos gramnegativos, aeróbicos y cóccix.
Se reportan, bien documentados, los efectos ototóxicos, pero se siguen utilizando. Pueden usarse en combinación con penicilina, en endocarditis estafilocócica, estreptocócica y, especialmente, enterocócica. A menudo se añade un AG a un antibiótico beta-lactámico cuando se tratan infecciones graves de Pseudomona aeruginosa. Los AG también pueden ser eficaces en el tratamiento de la tuberculosis. Otros grupos particulares de pacientes, de alto riesgo, incluyen: aquellos con fibrosis quística, disfunción inmune y ciertas enfermedades infecciosas crónicas.
Los AG se reportan más vestibulotóxicos, aunque varían mucho en sus efectos diferenciales, en los sistemas vestibular y coclear. La kanamicina, amikacina, neomicina y dihidroestreptomicina se muestran preferentemente cocleotóxicas. Con la gentamicina se afecta tanto los sistemas cocleares como vestibulares; sin embargo, la mayoría de los autores incluyen la gentamicina como vestibulotóxica, al igual que la estreptomicina, tobramicina y netilmicina.3,12,16-21
Fisiopatología
La toxicidad de los AG se considera la más estudiada. Aunque se dirige principalmente a los sistemas renal y cocleovestibular, no existe una clara correlación entre el grado de nefrotoxicidad, y la ototoxicidad. La toxicidad coclear que produce la pérdida auditiva, generalmente comienza en las altas frecuencias, y se describe secundaria a la destrucción irreversible de células ciliadas externas en el órgano de Corti, generalmente en la espira basal de la cóclea.
Los AG se eliminan más lentamente de los fluidos del oído interno que del suero, y por tanto, existe una latencia en sus efectos ototóxicos. Esta puede resultar en la progresión de la pérdida auditiva, o el inicio del déficit auditivo después del cese del tratamiento. Se recomienda continuar con el seguimiento de los efectos cocleotóxicos y vestibulotóxicos, hasta 6 meses después del cese del tratamiento. Los mecanismos exactos de la ototoxicidad de los AT-AG, permanecen en estudio.1,3-7
Muchos procesos celulares se han implicado, y estos constituyen un área activa de investigación. Wang16 reporta que los AG pueden introducirse en las células ciliadas, para inducir la muerte celular, y posteriormente, muchos mecanismos y procesos celulares deben estar involucrados. Se produce la interrupción de la síntesis de proteínas mitocondriales, la formación de radicales libres de oxígeno, la activación de c-Jun quinasa N-terminal (JNK), de caspasas y nucleasas.
Se ha demostrado que tienen efectos directos sobre los potenciales de la membrana celular, a través de las interacciones con los canales de potasio. Oliveira1 reporta, que en la fase aguda, estos fármacos se combinan con receptores en las membranas de las células ciliadas del órgano de Corti, cóclea o de la mácula (sacular y utricular) y crestas vestibulares. Estos receptores se consideran componentes lipídicos de la membrana celular (los inositol polifosfatos, muy importantes en la actividad bioeléctrica y en la permeabilidad de la membrana, por interacción con el ión calcio). Se reporta la formación de complejos entre los inositol polifosfatos y los AG, como consecuencia del antagonismo entre estos, por bloqueo de los canales de calcio, de potasio y pérdida de iones de magnesio por las mitocondrias en la membrana de las células ciliadas, con lesión de esta. Se afecta el transporte de iones, la permeabilidad, los fenómenos bioelectricos, y los mecanismos reguladoes celulares.1,4,16
Se describen por Huang22 alteraciones del acido ribonucleico (ARN), acido dexosirribonucleico (ADN), síntesis de proteínas y transporte de iones, con lesión de la célula ciliada auditiva. Se reporta la interacción de los AG con metales de transición, como hierro y cobre, que potencian la formación de radicales libres y el daño celular adicional.12 La interacción de estos procesos conduce a la pérdida permanente de las células ciliadas en la cóclea y el aparato vestibular, y como resultado, pérdida irreversible de la audición o disfunción del equilibrio.12
La ototoxicidad de los AG se muestra con herencia multifactorial, por efecto de la interacción de genes de susceptibilidad, con el ambiente, que favorece que esos genes se expresen.12
Factores de riesgo1- Concentración del fármaco en oído interno
Probablemente constituye el factor más importante en el daño ótico. Se observa influido por dosis del fármaco, vía de administración, duración del tratamiento y factores relacionados con la eliminación.
La ototoxicidad de los AG se describe que ocurre con niveles sanguíneos más altos (concentraciones elevadas), o duración más larga de la terapia. Los niveles séricos de creatinina deben ser controlados regularmente para adaptar las dosis terapéuticas de AG o diuréticos, y detectar los primeros signos de neurotoxicidad. Una creatinina de > 0,3 mg/100 mL, debe alertar sobre riesgo de ototoxicidad, principalmente vestibular.4,5
2- Características del paciente
Se puede presentar mayor sensibilidad por susceptibilidad hereditaria, edad (niños o edad avanzada), enfermedad renal o hepática, tratamiento prolongado (más de 10 días), audiograma alterado (problemas auditivos preexistentes, exposición a ruido), deshidratación y septicemia. Se ha identificado mutación en un gen mitocondrial (A155G), que predispone a la ototoxicidad, incluso, a dosis bajas.
3- Uso concomitante de otros fármacos ototóxicos
Se reporta la potenciación de la ototoxicidad cuando se administran dos o más fármacos con este efecto adverso: AG asociados a diuréticos del asa, eritromicina a altas dosis, vancomicina, u otros medicamentos ototóxicos o nefrotóxicos.
4- Tratamiento previo con aminoglucósidos
HNS preexistente. Se sensibiliza el oído interno.4,5,12
Ototoxicidad y genética. Características clínicas5,6
La pérdidas auditivas hereditarias pueden ser conductivas, neurosensoriales o una combinación de ambas; también sindrómica (asociada con malformaciones del oído externo u otros órganos o con problemas médicos que afectan a otros sistemas orgánicos), o no sindrómica (ausencia de anomalías visibles asociadas del oído externo, o problemas médicos relacionados).
Las formas genéticas de la pérdida auditiva deben distinguirse de las causas adquiridas (no genéticas). Las primeras se diagnostican mediante examen otológico, audiológico y físico, antecedentes familiares, pruebas auxiliares (tomografía axial computarizada del hueso temporal [TAC] y pruebas genéticas moleculares). Estas últimas, necesarias para muchos tipos de sordera sindrómica y no sindrómica, desempeñan un papel prominente en el diagnóstico y el asesoramiento genético.
La hipoacusia hereditaria se puede heredar en forma autosómica dominante, autosómica recesiva, o ligada al X, así como por herencia mitocondrial (alteraciones del material genético de las mitocondrias). La pérdida auditiva se describe por tipo y comienzo:
Tipos de pérdida auditiva
• Conductiva: se debe a anomalías en el oído externo y/o en los osículos del oído medio.
• Neurosensorial: se debe al mal funcionamiento de las estructuras del oído interno (la cóclea).
• Mixta: una combinación de pérdida auditiva conductiva y neurosensorial.
• En el paciente con un trastorno de procesamiento auditivo central (CAPD, del inglés Central Auditory Processing Disorder), los sonidos del habla se confunden, porque los centros de procesamiento del habla del cerebro se muestran incapaces de distinguir un sonido de voz de otro, incluso, si su audición se evidencia normal. En las personas con este trastorno se observa dificultad para entender el habla. El problema se evidencia, especialmente pronunciado, en situaciones con ruido de fondo.
Comienzo de la pérdida auditiva
• Prelingual: se presenta antes de que el habla se desarrolle. Toda hipoacusia congénita, presente al nacimiento, se considera prelingual, pero no todas se muestran congénitas.
• Poslingual: ocurre después del desarrollo normal del lenguaje. La prevalencia de la pérdida auditiva puede aumentar con la edad, y en este cambio se refleja el impacto de la genética y el medio ambiente, así como las interacciones entre los desencadenantes ambientales y la predisposición genética de un individuo, como se describe en la ototoxicidad inducida por AG (hipoacusia no sindrómica y sordera mitocondrial, derrame de oído medio y posiblemente la otosclerosis).5,6
Enfermedad mitocondrial y ototoxicidad
Se describe por Fischel-Ghodsian según cita Shearer, (2014),5 que la mayoría de las variantes patogénicas en los genes mitocondriales pueden causar un amplio espectro de trastornos multisistémicos, heredados de la madre; sin embargo, las variantes en un subconjunto de genes, principalmente MTRNR1 y MTTS1, aún en estudio, se relacionan con pérdida auditiva no sindrómica, y MTRNR1 codifica para el ARN ribosomal o ribosómico (ARNr) 12s. El gen MTTS1 codifica para un ARN de transferencia, el ARNt-Ser (UCN). La pérdida auditiva y la sordera mitocondrial no sindrómica, se producen por variantes patógenas en el ADN mitocondrial (ADNmt), y se transmiten por herencia materna.
En 1998 se reporta por primera vez, por Avraham,23 (en familia árabe-israelí), la existencia de una mutación en un gen mitocondrial (A1555G), que predispone a sus miembros a otoxicidad inducida por AG y presencia de hipoacusia, incluso con dosis mínimas. En estudios posteriores se demuestra que esta mutación de ADNmt corresponde al gen MTRNR1.24
Kokotas y otros reportan, según cita Shearer,5 que una variante en este gen, A1555G, se describe como causa frecuente de hipoacusia no sindrómica, heredada de la madre. En algunos individuos la pérdida auditiva se evidencia inducida por administración de dosis apropiadas de AG; sin embargo, se muestra gran variación fenotípica, consistente con el efecto de genes modificadores.
La mutación A7445G del gen ARNt-Ser (UCN), es decir del ARNt de la Serina, puede dar lugar a HNS bilateral, que aparece en la infancia o adolescencia, sobre todo, en altas frecuencias.6 Se reporta que frecuentemente la mutación del gen ARN ribosomal (ARNr) produce hipoacusia mitocondrial.
La mutación A1555G, en el gen ribosómico (ARNr) 12s del genoma mitocondrial, puede causar HNS no sindrómica, sin asociarse a otras enfermedades, así como incremento en la susceptibilidad a la acción ototóxica de los AT-AG e hipoacusia, en dosis bajas, que coincide con lo que se reporta por Avraham.23 Se produce una sustitución de adenina (A) por guanina (G), en los nucleótidos localizados en la posición 1555 del gen MTRNR1, que codifica para la subunidad 12s del ARN ribosomal mitocondrial (A1555G 12Sr ARN). Esta mutación afecta a un dominio del ARN ribosomal, que interviene en la unión con el ARNt. Probablemente la mutación mitocondrial condicione que la unión de los diferentes ARNt, se muestre mucho más débil, y se ocasionen errores en la traducción proteica de las mitocondrias. La prevalencia, se describe muy elevada, y se estima el 17 % la hipoacusia inducida por AT-AG.5-10
Se reporta que estos errores, que se incrementan con los AG, se producen por su acción sobre el ARNr de las bacterias, al unirse los AT a la subunidad 12s de los ribosomas, que aumenta la dificultad en el acoplamiento a los ARNt, la modificación estructural del ARNrmt, y finalmente, más sensibilidad a la acción de los AG.5-9
En relación con la mutación del ADNmt, se han identificado dos familias, con heteroplasmia. Se afecta una determinada proporción de mitocondrias por células, para una transición de A-a-G en nt7445 de este gen; sin embargo, la penetración de la pérdida auditiva se observa baja, y se ha sugerido que las variantes patogénicas de MTTS1, por sí solas, pueden jugar un papel insignificante en la hipoacusia.5,6
En seis individuos con hipoacusia severa a profunda, la mutación mitocondrial se muestra homoplásmica: en todas las mitocondrias de cada uno de los descendientes de una mujer que la tiene, y que corresponde con la variante patogénica A1555G en MTRNR1.5,6,8 En cinco de los seis pacientes, se evidencia herencia materna, y en dos, antecedentes de AG.5,6
Reportes recientes (2014),5,6 describen que la pérdida auditiva mitocondrial no sindrómica y la sordera, se caracterizan por una disminución de la audición de moderada a profunda, y una variante patogénica en MTRNR1 o MTTS1. La primera puede estar asociada con la predisposición a la ototoxicidad por AG y/o a la pérdida auditiva neurosensorial de inicio tardío.9-11
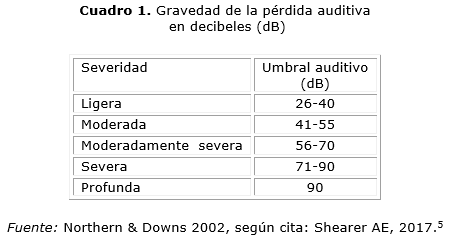
Las variantes patógenas en MTTS1 suelen asociarse con el inicio de la HNS. La pérdida auditiva (cuadro 1) relacionada con la ototoxicidad por AG, incluyen: gentamicina, tobramicina, amikacina, kanamicina o estreptomicina, puede ser bilateral, y de severa a profunda, y ocurrir de forma inmediata o tardía. Aunque se describe asociada con variantes patógenas en MTTS1 no sindrómica, la sustitución m.G7445A también se reporta en algunas familias, con queratodermia palmoplantar (hiperqueratosis y apariencia de nido de abeja de la piel de las palmas, plantas y talones).5-11
El MTRNR1 (que codifica el ARN ribosómico 12s mitocondrial), y MTTS1 (que codifica la transferencia mitocondrial RNA serina1), se consideran los dos genes en los que actualmente se sabe que las variantes patógenas pueden causar pérdida auditiva y sordera mitocondrial no sindrómica.5-11
Se reporta recientemente, que el mecanismo de la ototoxicidad de los AG, sugiere interferencia con la producción de adenosintrifosfato (ATP), en las mitocondrias de las células ciliadas de la cóclea.5 En relación con la genética molecular, el ribosoma mitocondrial en la cóclea constituye el blanco más probable de la ototoxicidad por AG, ya que el ribosoma bacteriano es el "blanco natural" y está evolutivamente relacionado.5
En estudios bacterianos las regiones del ARN ribosómico pequeño parecen importantes, por lo tanto, los genes del ARN ribosomal mitocondrial (ARNr) se describen como los principales candidatos para el sitio de la mutación del ADNmt, en la sordera inducida por AG, heredada maternalmente, especialmente el gen 12s ARNr (MTRNR1).5,6
Se identifica una mutación en el gen del ARNr 12s (A1555G)6,23,24 en los miembros afectados de 3 familias con sordera inducida por AG heredados de la madre. En un amplio pedigrí israelí-árabe, con posible herencia autosómica y mitocondrial combinada, se identifica una mutación en el gen del ARNr 12s (A1555G).23,24
Otros investigadores, apoyan la predisposición genética en la mutación del ARN mitocondrial A1555G, que se ha encontrado asociada con pérdida auditiva no sindrómica y AG, y han sugerido que las poblaciones de alto riesgo, anteriormente señaladas, y con antecedentes familiares, deben ser examinadas para esta mutación.5-8,11,25,26 Los pacientes chinos, con defecto de alteración en la síntesis de proteínas mitocondriales, se describen con signos más rápidos y severos de ototoxicidad por AG. Se considera importante la evaluación cuidadosa de la historia familiar, que puede prevenir muchos casos.5-8,11,25,26
Aminoglucósidos específicos27-33
Estreptomicina: la estreptomicina se reporta como el primer AG aplicado clínicamente. Se utilizó con éxito en el pasado contra bacterias gramnegativas. Afecta, preferentemente, el sistema vestibular y no el auditivo. Se describe el primero por uso prolongado, y en pacientes con insuficiencia renal. Este medicamento aún se documenta en el tratamiento de tuberculosis, a pesar de su toxicidad y la resistencia generalizada.
Gentamicina: igual que la estreptomicina, la gentamicina tiene una predilección por el sistema vestibular. Los niveles séricos máximos terapéuticos de 10-12 mcg/mL, generalmente se consideran seguros, pero pueden ser tóxicos en algunos pacientes. Se recomienda ajustar con cuidado la dosificación en pacientes con enfermedad renal.
Neomicina: se considera uno de los AG más cocleotóxicos cuando se administra por vía oral y en dosis altas; por lo tanto, el uso sistémico generalmente no se recomienda. La neomicina se describe como uno de los AG que más lentos se liberan de la perilinfa; por consiguiente,
puede producirse toxicidad retardada (1-2 semanas) después de suspender el tratamiento. Se utiliza, principalmente, como agente ótico y ototópico eficaz. Aunque la neomicina generalmente se considera segura cuando se usa tópicamente en el conducto auditivo o en pequeñas lesiones cutáneas, existen alternativas igualmente eficaces.
Kanamicina: aunque se evidencia menos tóxica que la neomicina, la kanamicina se describe bastante ototóxica. Se observa una propensión a causar daño profundo en las células ciliadas cocleares, pérdida auditiva marcada de alta frecuencia y sordera completa. El efecto perjudicial se reporta principalmente en la cóclea. Se muestra un uso clínico limitado actualmente. Al igual que con la neomicina, la administración parenteral generalmente no se recomienda.
Amikacina: se describe como derivado de la kanamicina, y tiene muy poca toxicidad vestibular. Sus efectos adversos incluyen principalmente el sistema auditivo, sin embargo, se considera menos ototóxico que la gentamicina. En el tratamiento de infecciones graves, la amikacina se indica principalmente sobre la base de los resultados de las pruebas de susceptibilidad y la respuesta del paciente.
Tobramicina: la ototoxicidad es similar a la de la amikacina, puede producir una pérdida auditiva de alta frecuencia, e igual que la kanamicina, su toxicidad vestibular se considera menos común. Se usa con frecuencia en preparaciones tópicas, uso que generalmente se considera seguro.27-33
Agentes antineoplásicos34-40
Se reportan los compuestos a base de cisplatino y, en menor grado, el carboplatino, como agentes antineoplásicos más comúnmente asociados con ototoxicidad y ampliamente utilizados en afecciones ginecológicas, del pulmón, del sistema nervioso central, de cabeza-cuello y los cánceres testiculares. Los antineoplásicos se describen entre los agentes alquilantes inespecíficos del ciclo celular, que se insertan en la hélice del ADN, e interrumpen la replicación.
El cisplatino se distribuye ampliamente, pero las concentraciones más altas se encuentran en los riñones, el hígado y la próstata. El cisplatino se une irreversiblemente a las proteínas plasmáticas, y puede detectarse hasta 6 meses después de finalizar el tratamiento. El carboplatino no está ligado a proteínas, y puede ser fácilmente eliminado por los riñones. La dosis y la eficacia del cisplatino y del carboplatino se muestran limitadas en gran medida por los efectos adversos.34-40
Fisiopatología
Algunos autores se manifiestan a favor de la hipótesis de la apoptosis, la muerte programada de células. El mecanismo de la ototoxicidad del cisplatino, pudiera estar mediado por la producción de radicales libres y la muerte celular. Los compuestos de platino dañan la vascularización de la estría de la escala media, y causan la muerte de las células ciliadas externas, comenzando en la espira basal de la cóclea.
Se reporta que el cisplatino puede afectar, inicialmente, a las células de sostén, cuya función consiste en mantener la homeostasis metabólica de las células sensoriales especializadas (ciliadas internas y externas). En estas se observan lesiones estructurales y funcionales, cuando se produce un fallo en las células reguladoras de su metabolismo. Estudios in vitro han mostrado que la exposición del neuroepitelio coclear al cisplatino produce oxidantes y depleción del glutatión (tripéptido compuesto por cisteína, ácido glutámico y glicina), indispensable en el metabolismo celular en las células ciliadas, seguido de la muerte de estas.
Las teorías implicadas en la génesis de este estrés oxidativo inducido por cisplatino, incluyen: daño del ADN, interferencia en el sistema de defensa antioxidante del glutatión, o el aumento de la peroxidación de lípidos, lo que produce una elevación de la entrada de calcio y apoptosis de las células ciliadas de la cóclea.
Se produce en el oído interno, únicamente en la cóclea, una forma particular de la enzima nicotinamida adenina dinucleótido fosfato oxidasa (NADPH), y la NOX-3, fuente importante de generación de radicales libres superóxido. El cisplatino activa esta enzima, eleva de forma dramática la producción de superóxidos selectivamente en la cóclea, que por este mecanismo pueden conducir a la muerte mitocondrial mediada por las caspasas. Estas constituyen un grupo de proteínas perteneciente a las cisteín-proteasas mediadores esenciales de los procesos de apoptosis.
Las dos principales vías intracelulares de apoptosis las constituyen: a) Receptor de muerte de superficie celular o vía extrínseca: apoptosis mediada por el ligando Fas (FasL o CD95L), que se muestra como citoquina, la cual se une al receptor Fas, se expresa en linfocitos T activados, en células natural killer (NK), en neuronas y en astrocitos, y por la subunidad 1 de la superfamilia del receptor del factor de necrosis tumoral (TNFR 1), que produce interacciones de la procaspasa-8; y b) la vía mitocondrial o intrínseca, que normalmente inhibe la muerte celular bloqueando la unión de la caspasa-9 al complejo del factor 1 activador de proteasa apoptótica. Una vez activadas la caspasa-8 y la caspasa-9, se observa su participación en una cascada, que culmina en la activación de la caspasa-3, cuyos resultados corresponden con la fragmentación del ADN cromosómico, los cambios morfológicos celulares característicos de la apoptosis, y finalmente, puede contribuir a la pérdida permanente de la audición.38-41
Prevención
Saunders42 (2012) reporta que la ototoxicidad, en países en vías de desarrollo, constituye una de las causas prevenibles de pérdida auditiva, que afecta mayormente a los niños, pero se muestra relativamente poco frecuente en países desarrollados.
Se documentan estudios investigativos sobre quelantes de hierro y antioxidantes, como posibles agentes que previenen la pérdida de audición durante el tratamiento y otras formas de terapia génica, como opciones en el futuro.12 Los AG catalizan la formación de radicales libres, en reacción hierro-dependiente. El 2-hidroxibenzoato (salicilato), suele actuar como quelante del hierro y antioxidante, y puede proteger efectivamente en la sordera inducida por gentamicina. El tratamiento combinado gentamicina-salicilato parece reducir significativamente el umbral auditivo de la pérdida auditiva inducida por AG, desde > 60 dB a < 20 dB.12
Se describen fármacos protectores contra la ototoxicidad de AG o del cisplatino, como la fosfomicina, que compite con los primeros por los sitios reactivos de las membranas de células ciliadas, y disminuye su acúmulo intracelular.2,12,14-16 Se documenta alta ototoxicidad en más a menos en cinco AG: neomicina, gentamicina, tobramicina, amikacina y netilmicina; como también, en cisplatino, y productos químicos industriales.42-44
En la prevención de AT-AG se requiere una cuidadosa vigilancia. Niveles séricos del fármaco (altas concentraciones), función renal o hepática, duración del tratamiento, dosificación (menos tóxico una vez/día), uso simúltaneo de otros ototóxicos, edades extremas, infecciones muy graves, predisposición genética, así como las evaluaciones auditivas antes, durante y después de la terapia.
Reportes actuales describen medir la función audiométrica antes del tratamiento, sin embargo, esto no siempre puede ser posible en situaciones agudas. Los AG permanecen en la cóclea mucho tiempo después de terminada la terapia. Se recomienda evitar ambientes ruidosos durante los 6 meses posteriores a la terminación del tratamiento, porque se mantiene una mayor susceptibilidad al daño coclear inducido por ruido.1,42 Se reporta que varios agentes prometedores, incluyendo vitamina E, ácido alfa lipoico y galangin, se consideran otoprotectores y eficaces en algunos estudios en animales. Se necesitan ensayos clínicos adicionales para determinar si los mecanismos mostrados en estas investigaciones, pueden replicarse en pacientes, mientras se mantienen los efectos terapéuticos de los aminoglucósidos.37,39,43
Un estudio reciente de Kranzer21 (2015) sugiere que el antioxidante N-acetilcisteína (NAC) puede proteger contra la ototoxicidad de la amikacina. La investigación incluye a 46 pacientes que reciben AG por peritonitis relacionada con diálisis, y NAC administrada a la mitad de los casos, y un placebo al grupo restante. Las mediciones de emisiones otoacústicas (EOA) indican que la NAC protege la función coclear, particularmente a frecuencias más altas. Además, las medidas de estrés oxidativo indicaron que el estado antioxidante mejora significativamente en los pacientes con NAC.21 Kranzer y otros21 (2015) también describen el efecto otoprotector cuando se administra NAC con AT-AG, en 146 pacientes con insuficiencia renal terminal, que muestran una reducción de la ototoxicidad.
Un gran avance reciente en la prevención de la ototoxicidad por AG, se evidencia con sustancias protectoras de forma sistémica (los salicilatos), que protegen las células ciliadas de conejillos de Indias expuestos a gentamicina, aunque, paradójicamente, estos pueden ser ototóxicos por vía intratimpánica.42 Otros investigadores, incluyen los antioxidantes como quelantes de hierro, superóxido dismutasa, factor de transformación de crecimiento alfa, inhibidores de la muerte celular como el péptido inhibidor de la quinasa c-Jun, N-terminal y la inhibidora de caspasa.41,43-45
Entre los agentes de quimioterapia, el cisplatino se muestra el medicamento ototóxico prototipo, y la HNS se describe elevada. Recientemente, se reporta por Kim y otros46 (2017), el retardo o inhibición de la inducción de ototoxicidad por gentamicina, explorando el rol de la autofagia in vitro e in vivo. En esta investigación se detecta la autofagia de las células del órgano de Corti por estrés oxidativo, comparando las tratadas y no tratadas con peróxido de hidrógeno (H2O2). El acúmulo del marcador LC3-II, el cual se acompaña por células muertas, se observa mayor en las primeras, como expresión de la elevación de la cathepsin B cistein proteasa ribosomal, lo que muestra que la gentamicina induce ototoxicidad, por este mecanismo de muerte de células auditivas, que puede ser inhibido, por cambios en el fluido autofágico. El mecanismo exacto de la ototoxicidad inducida por la gentamicina, aún no se reporta totalmente aclarado.46 Actualmente, además de la amplificación y la implantación coclear, no hay tratamiento disponible; por lo tanto, la prevención se considera fundamental.12
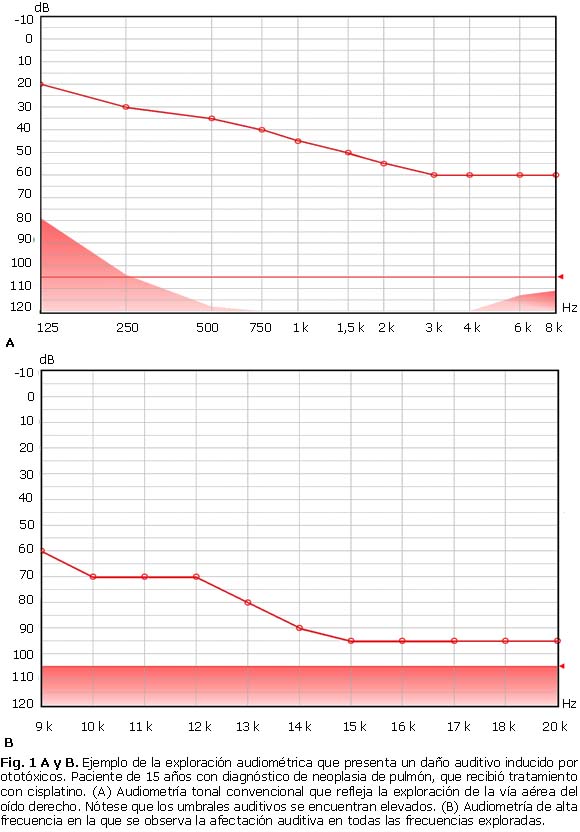
Se recomienda la audiometría de alta frecuencia (AAF),47-49 que puede identificar oportunamente la ototoxicidad y permite la modificación de los protocolos de tratamiento (figura). La AAF constituye una herramienta de investigación que puede estudiar la audición hasta el extremo superior de la banda de frecuencias (los 18-20 kilohertzios), mientras que una audiometría convencional, solamente hasta 8 000 Hertzios. En los AG y el cisplatino, las alteraciones se producen en las zonas de frecuencias agudas, por lo cual esta técnica permite oportunamente detectar la alteración de la cóclea por el ototóxico.49-52
El diagnóstico prenatal, en los embarazos de riesgo puede ser posible, si se conoce la carga de la variante patogénica del ADNmt en la familia. La segregación mitótica, en amniocitos y vellosidades coriónicas, se reporta como poco probable que corresponda a la de otros tejidos fetales o adultos. La presencia de esta variante de ADNmt, no predice la edad de inicio o severidad de la pérdida auditiva.6 Se sospecha hipoacusia mitocondrial no sindrómica de moderada a profunda, cuando uno de los indicadores siguientes está presente: antecedentes familiares de pérdida auditiva sugestiva de herencia materna, o comienzo después de la administración de un antibiótico AG.6,36
Prevención a nivel de atención primaria de salud (APS)5,6
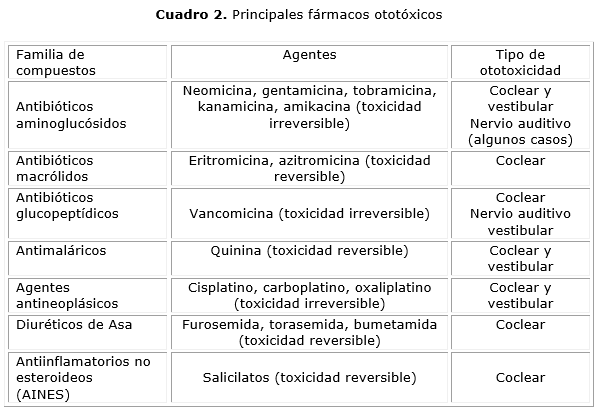
Se recomienda evaluación audiométrica anual para valorar la estabilidad o progresión de la pérdida auditiva, así como evitar AG. Se documentan los principales fármacos ototóxicos,44 según el tipo de agente y la afectación en oído interno (cuadro 2). Se debe evitar la exposición al ruido, especialmente en aquellos con audición normal que tienen la variante patogénica m.A1555G en MTRNR1, evaluar familiares en riesgo, e identificar parientes maternos para la variante antes señalada.5 Acá sería importante la prevención en todos los hijos de madres con la mutación que no deben exponerse al AG, aunque no hayan desarrollado la hipoacusia, y que los hijos-as de los varones afectados no heredan la mutación como factor de susceptibilidad.
Métodos de monitoreo audiológico
Las pruebas de referencia deben obtenerse antes del inicio de los agentes quimioterapéuticos, especialmente cisplatino y carboplatino. En pacientes que reciben AG deben mostrarse dentro de las 72 horas posteriores al inicio del tratamiento. La selección del paciente, el nivel de conciencia y la edad, juegan un papel importante en la selección de métodos para detección temprana.38,39
Las pruebas de referencia deben ser exhaustivas: obtención del umbral de tonos puros de conducción aérea a frecuencias audiométricas estándar, de 0,25 a 8 KHz; y se debe incluir la historia clínica, los antecedentes familiares, el examen otoscópico, la prueba de conducción ósea y la logoaudiometría. Si el equipo permite realizar la AAF, deben ser exploradas.47
En pacientes que no pueden cooperar, se deben obtener pruebas objetivas: EOA y potenciales evocados auditivos de tallo cerebral (PEATC), para el monitoreo. Shearer5 describe la prueba de emisiones otoacústicas como específicamente sensible para el estado de las células ciliadas externas en la cóclea, y muy eficiente para evaluar la cocleotoxicidad.
La monitorización debe continuar durante la terapia a intervalos regulares, y si hay signos de ototoxicidad, tomar medidas para reducirla. Se han sugerido pruebas semanales en tratamiento con AT-AG y medicamentos quimioterapéuticos (se disminuiye el intervalo, con el primer signo de cambio ototóxico). Otros autores reportan la monitorización durante al menos 3-6 meses después del cese de medicación potencialmente ototóxica, o hasta que la audición se estabilice, pero otros recomiendan > 60 meses.5,33,38
Grados de ototoxicidad
Se reporta el uso delos criterios para la ototoxicidad establecidos por la Asociación Americana de Audición, Lenguaje y el Habla (ASHA, del inglés American Speech-Language-Hearing Association) en dB, Hz y KHz, los Criterios de Terminología Comunes del Instituto Nacional del Cáncer para Eventos Adversos (NCI CTCAE, del inglés National Cancer Institute Common Terminology Criteria for Adverse Events) y por Brock.53-57
La ASHA define la ototoxicidad como: una disminución de 20 dB o más en el umbral de tonos puros a una frecuencia; 10 dB o mayor disminución en 2 frecuencias adyacentes; o pérdida de respuesta en 3 frecuencias de prueba consecutivas en las que estas se obtienen previamente, cuando se utiliza EOA o PEATC.
Se han determinado, por el CTCAE y Brock, los grados para definir la ototoxicidad como sigue:
- CTCAE ototoxicidad grados 1-4
- Grado 1. Cambio de umbral o pérdida de 15-25 dB con respecto a la línea de base, promediada en dos o más frecuencias contiguas en al menos un oído.
- Grado 2. Cambio de umbral o pérdida de> 25-90 dB, promediado en dos frecuencias de prueba contiguas en al menos un oído.
- Grado 3. Pérdida auditiva suficiente para indicar la intervención terapéutica, incluyendo prótesis auditivas (por ejemplo > 20 dB bilaterales en las frecuencias del habla > 30 dB unilateral, y que requieren servicios adicionales relacionados con el habla).
- Grado 4. Indicación para el implante coclear y que requiere servicios adicionales relacionados con el habla y lenguaje.
- Los grados de pérdida auditiva de Brock:
- Grado 0. Umbrales auditivos inferiores a 40 dB HL (del inglés hearing level) en todas las frecuencias.
- Grado 1. Umbrales de 40 dB o más a 8 000 Hz.
- Grado 2. Umbrales de 40 dB o más a 4 000-8 000 Hz.
- Grado 3. Umbrales de 40 dB o más a 2 000-8 000 Hz.
- Grado 4. Umbrales a 40 dB o mayor a 1 000-8 000 Hz.
CONSIDERACIONES FINALES
Se concluye, que los fármacos ototóxicos inducen toxicidad coclear e hipoacusia neurosensorial, bilateralmente simétrica, o asimétrica, en altas frecuencias, secundaria a destrucción irreversible de células ciliadas externas en el órgano de Corti. Nuevas investigacionessobre cisplatino identifican la población susceptible, y pueden ofrecer alternativas de tratamiento menos agresivas. Se destacan actualmente los métodos de monitoreo audiológico, realizar sistemáticamente la AAF y los criterios sobre grados de ototoxicidad. La prevención, implica una estricta vigilancia.
Conflicto de intereses
Los autores declaran no tener conflicto de intereses en la realización del estudio.
REFERENCIAS BIBLIOGRÁFICAS
1. Oliveira JA. Ototoxicidad. En: Sih T. Otorrinolaringología Pediátrica. Barcelona: Springer-Verlag; 1999. p. 183-9.
2. Centro de Información y Evaluación de medicamentos y productos Sanitarios de la Región de Murcia. Ototoxicidad por Medicamentos. Boletín Farmacovigilancia Región Murcia [serie en Internet]. 2012 [citado 25 de octubre de 2017];(27). Disponible en: https://www.murciasalud.es/archivo.php?id=253991
3. Hirvonen TP, Minor LB, Hullar TE, Carey JP. Effects of intratympanic gentamicin on vestibular afferents and hair cells in the chinchilla. J Neurophysiol. 2005; 93(2):643-55.
4. Correa O, Gómez C. Ototoxicidad. En: Rivas JA, Ariza HF, editores. Tratado Otología y Audiología. Diagnóstico y tratamiento médico quirúrgico. 2da ed. Bogotá: Arnolca; 2007.p. 507-18.
5. Shearer AE, Hildebrand MS, Smith RJH. Hereditary Hearing Loss and Deafness Overview (Publicación inicial 14 de febrero 1999; actualizado 27 de julio 2017). In: Adam MP, Ardinger HH, Pagon RA, Wallace SE, Bean LJH, Mefford HC, et al. GeneReviews® [libro en Internet]; Seattle: University of Washington, 1993-2017 [citado 25 de octubre de 2017]. Disponible en: https://www.ncbi.nlm.nih.gov/books/NBK1434/
6. Pandya A. Nonsyndromic Hearing Loss and Deafness, Mitochondrial (Publicación inicial 22 octubre 2004; actualizado 3 de Julio de 2014]. In: Adam MP, Ardinger HH, Pagon RA, Wallace SE, Bean LJH, Mefford HC, et al. GeneReviews® [libro en Internet]; Seattle: University of Washington, 1993-2017 [citado 25 de octubre de 2017]. Disponible en: https://www.ncbi.nlm.nih.gov/books/NBK1422/
7. Gallo-Terán J, Morales-Angulo C, del Castillo I, Moreno-Pelayo MA, Mazón A, Moreno F. Predisposición familiar a la ototoxicidad de los aminoglucósidos debido a la mutación A1555G del ADN mitocondrial. Med Clin (Barc). 2003;121(6):216-8.
8. Morales-Peralta E. La mutación A1555G y el uso de aminoglucósidos en la prevención de la sordera [homepage en Internet]; Centro Nacional de Genética Médica [citado 25 de enero de 2017]. Disponible en: http://bvs.sld.cu/revistas/rhab/articulorev10/mutacion.htm
9. Online Mendelian Inheritance in Man, OMIM® [homepage en Internet]; Baltimore: Johns Hopkins University, 1966-2017. OMIM: 56100 [citado 1º de octubre de 2017]. Disponible en: https://www.ncbi.nlm.nih.gov/omim/?term=561000
10. Online Mendelian Inheritance in Man, OMIM® [homepage en Internet]; Baltimore: John Hopkins University; 1966-2017. OMIM: 590080 [citado 1º de octubre de 2016]. Disponible en: https://www.ncbi.nlm.nih.gov/omim/?term=590080
11. Online Mendelian Inheritance in Man, OMIM® [homepage en Internet]; Baltimore: John Hopkins University; 1966-2017. OMIM: 500008 [citado 1º de octubre de 2016]. Disponible en: https://www.ncbi.nlm.nih.gov/omim/?term=500008
12. Hernández-Montero E, Fraile Rodrigo JJ, Marín Garrido C, Carmen Sampériz L, Ortiz García A. Vestibulopatía bilateral por ototoxicidad. ORL ARAGON. 2001;4(1):20-2.
13. Gonzalez-Garrido A, Vega R, Mercado F, Lopez IA, Soto E. Acid-Sensing Ion Channels Expression, Identity and Role in the Excitability of the Cochlear Afferent Neurons. Front Cell Neurosci. 2015 Dec;9:483.
14. Brown AL, Lupo PJ, Okcu MF, Lau CC, Rednam S, Scheurer ME . SOD2 genetic variant associated with treatment-related ototoxicity in cisplatin-treated pediatric medulloblastoma. Cancer Med. 2015 Nov;4(11):1679-86.
15. Olgun Y, Aktas S, Altun Z, Kirkim G, Kizmazoglu DÇ, Erçetin AP, et al. Analysis of genetic and non genetic risk factors for cisplatin ototoxicity in pediatric patients. Int J Pediatr Otorhinolaryngol. 2016 Nov;90:64-9.
16. Wang JA, Van De Water TR, Bonny C, Ribaupierre F, Puel JL, Zine A. A peptide inhibitor of c-Jun N-Terminal Kinase protects against both aminoglycoside and acoustic trauma-induced auditory hair cell death and hearing loss. J Neurosci. 2003 Sep 17;23(24):8596-607.
17. Rybak LP, Whitworth CA. Ototoxicity: therapeutic opportunities. Drug Discov Today. 2005 Oct 1;10(19):1313-21.
18. Selimoglu E. Aminoglycoside-induced ototoxicity. Curr Pharm Des. 2007;13(1):119-26.
19. Matz GJ. Aminoglycoside cochlear ototoxicity. Otolaryngol Clin North Am. 1993 Oct;26(5):705-12.
20. Harris AS, Elhassan HA, Flook EP. Why ototopical aminoglycosides are still first-line therapy for chronic suppurative otitis media? A systematic review and discussion of aminoglycosides versus quinolones. J Laryngol Otol. 2016 Jan;130 (1):2-7.
21. Kranzer K, Elamin WF, Cox H, Seddon JA, Ford N, Drobniewski F. A systematic review and meta-analysis of the efficacy and safety of N-acetylcysteine in preventing aminoglycoside-induced ototoxicity: implications for the treatment of multidrug-resistant TB. Thorax. 2015 Nov;70(11):1070-7.
22. Huang MY, Schacht J. Formation of a cytotoxic metabolite from gentamicin by liver. Biochem Pharmacol. 1990 Dec;40(11):11-4.
23. Avraham KB. Here come more genes. Nat Med. 1998;4(11):1238-9.
24. Avraham KB, Kanaan MJ. Genomic advances for gene discovery in hereditary hearing loss. J Basic Clin Physiol Pharmacol. 2012 Sep;23(3):93-7.
25. Pandya A, Xia XJ, Erdenetungalag R, Amendola M, Landa B, Radnaabazar J, et al. Heterogeneous point mutations in the mitochondrial tRNA Ser (UCN) precursor coexisting with the A1555G mutation in deaf students from Mongolia. Am J Hum Genet. 1999 Dec;65(6):1803-6.
26. Jing W, Zongjie H, Denggang F, Na H, Bin Z, Aifen Z , et al. Mitochondrial mutations associated with aminoglycoside ototoxicity and hearing loss susceptibility identified by meta-analysis. J Med Genet. 2015 Feb;52(2):95-103.
27. Adeyemo AA, Oluwatosin O, Omotade OO. Study of streptomycin-induced ototoxicity: protocol for a longitudinal study. Springerplus. 2016 Jun;5(1):758.
28. Mercado V, Burgos R, Muñoz C. Ototoxicidad por medicamentos. Rev Otorrinolaringol Cir Cabeza Cuello. 2007;67:167-77.
29. Ishiyama G, Ishiyama A, Kerber K, Baloh RW. Gentamicin ototoxicity: clinical features and the effect on the human vestibulo-ocular reflex. Acta Otolaryngol. 2006 Oct;126(10):1057-61.
30. El-Anwar MW, Abdelmonem S, Nada E, Galhoom D, Abdelsameea AA. Cilostazol Effect on Amikacin-Induced Ototoxicity: An Experimental Study. Audiol Neurootol. 2016;21(4):250-3.
31. Mustafa S, Devi VK, Pai RS. Comparative study of kanamycin sulphate microparticles and nanoparticles for intramuscular administration: Preparation in vitro release and preliminary in vivo evaluation. J Microencapsul. 2016 Nov;33(7):679-88.
32. Paludetti G, Conti G, Dinardo G, De Corso E, Rolesi R, Picciotti PM, et al. Infant hearing loss: from diagnosis to therapy. Acta Otorhinolaryngol Ital. 2012 Dec;32(6):347-70.
33. House JR, House LK. Ototoxicity of Polimycin B, Neomycin, and Hidrocortisone suspension in Tympanoplasty Surgery. Otolaryngol Head Neck Surg. 2014 Feb;150(2):282-4.
34. Dogan S, Yazici H, Yalçinkaya E, Erdogdu HI, Tokgöz SA, Sarici F , et al. Protective Effect of Selenium Against Cisplatin-Induced Ototoxicity in an Experimental Design. J Craniofac Surg. 2016 Oct;27(7):e610-4.
35. Noszek L, Budai B, Prekopp P, Széchenyi R, Szonyi M, Talpai S, et al. Early ototoxic changes in patients with germ cell tumor after first cycle of cisplatin-based therapy. Laryngoscope. 2016 Sep 26. doi: 10.1002/lary.26325.
36. Bass JK, Bhagat SP. Challenges in ototoxicity monitoring in the pediatric oncology population. J Am Acad Audiol. 2014 Sep;25(8):760-74.
37. Astolfi L, Simoni E, Valente F, Ghiselli S, Hatzopoulos S, Chicca M, et al. Coenzyme Q10 plus Multivitamin Treatment Prevents Cisplatin Ototoxicity in Rats. PLoS One. 2016 Sep;11(9):e0162106.
38. van As JW, van den Berg H, van Dalen EC. Platinum-induced hearing loss after treatment for childhood cancer. Cochrane Database Syst Rev. 2016 Aug;(8):CD010181.
39. Soyaliç H, Gevrek F, Koç S, Avcu M, Metin M, Aladag I. Intraperitoneal curcumin and vitamin E combination for the treatment of cisplatin-induced ototoxicity in rats. Int J Pediatr Otorhinolaryngol. 2016 Oct;89:173-8.
40. Harrison RT, Seiler BM, Bielefeld EC. Ototoxicity of 12 mg/kg cisplatin in the Fischer 344/NHsd rat using multiple dosing strategies. Anticancer Drugs. 2016 Sep;27(8):780-6.
41. García-Berrocal JR, Nevado J, Ramirez-Camacho R, Sanz R. The anticancer drug cisplatin induces an intrinsic apoptotic pathway inside the inner ear. British J Pharmacol. 2007;152:1012-20.
42. Saunders JE, Danesi A. La prevención de la ototoxicidad en los países en desarrollo. En: Sih T, Chinsky A, Eavey R, Godinho R, editores. X Manual de Otorrinolaringología Pediátrica de la IAPO. Brazil: Vida & Consciencia; 2012. p. 327-39.
43. Kim YR, Kim MA, Cho HJ, Oh SK, Lee IK, Kim UK, et al. Galangin prevents aminoglycoside-induced ototoxicity by decreasing mitochondrial production of reactive oxygen species in mouse cochlear cultures. J Med Genet. 2015;52(2):95-103.
44. Lanvers-Kaminsky C, Zehnhoff-Dinnesen AA, Parfitt R, Ciarimboli G. Drug-induced ototoxicity: Mechanisms, Pharmacogenetics, and protective strategies. Clin Pharmacol Ther. 2017;101(4):491-500.
45. Garcia-Callejo FJ, Pla Gil I, Bécares Martinez C, Calvo Gómez J, Montoro Elena MJ, Marco Algarra J. Uso de agentes antioxidantes en la prevención de la hipoacusia inducida por cisplatino. Estudio en pacientes con carcinoma nasofaríngeo. Anorlmex. 2011;56(4):180-7.
46. Kim YJ, Tian C, Kim J, Shin B, Choo OS, Kim YS, et al. Autophagic flux, a possible mechanism for delayed gentamicin induced ototoxicity. Scientific Reports. 2017;7:41356.
47. Lagos G, López M. Estudio normativo: Umbrales de alta frecuencia (9-20 KHz) en normoyentes entre 8 años y 23 años y 11 meses, pertenecientes a la ciudad de Chillán. Rev Otorrinolaringol Cir Cabeza Cuello. 2016;76:31-42.
48. Rodriguez A, Trinidad A, Garcia JR, Gorriz C, Ramirez R. Extended high-frequency (9-20 kHz) audiometry reference thresholds in 645 healthy subjects. Int J Audiol. 2014;53(8):531-45.
49. Knight KR, Kraemer DF, Winter C, Neuwelt EA. Early changes in auditory function as a result of platinum chemotherapy: use of Extended High-Frequency Audiometry and Evoked Distortion Product Otoacustic Emissions. J Clin Oncol. 2007;25(10):1190-5.
50. Rodríguez-Valiente A, Roldán-Fidalgo A, Villarreal IM, García-Berrocal JR. Audiometría con extensión en altas frecuencias (9,000-20,000 Hz). Utilidad en el diagnóstico audiológico. Acta Otorrinolaringol Esp. 2016;67(1):40-4.
51. Yu KK, Choi CH, An YH, Kwak MY, Barreto S. Comparison of the Effectiveness of Monitoring Cisplatin-Induced Ototoxicity with Extended High-Frequency Pure-Tone Audiometry or Distortion-Product Otoacoustic Emission. Korean J Audiol. 2014;18(2):58-68.
52. Waissbluth S, Peleva E, Daniel SJ. Platinum-induced ototoxicity: a review of prevailing ototoxicity criteria. Eur Arch Otorhinolaryngol. 2017 Mar;274(3):1187-96.
53. Brock PR, Bellman SC, Yeomans EC, Pinkerton CR, Pritchard J. Cisplatin ototoxicity in children: a practical grading system. Med Pediatr Oncol. 1991;19(4):295-300.
54. Brock PR, Knight KR, Freder DR, Campbell KC, Steyger PS, Blakley BW, et al. Platinum-induced ototoxicity in children: a consensus review on mechanisms, predisposition, and protection, including a new International Society of Pediatric Oncology Boston ototoxicity scale. J Clin Oncol. 2012;30(19):2408-17.
55. American Speech-Language-Hearing Association. Guidelines for the audiologic management of individuals receiving cochleotoxic drug therapy. ASHA. 1994;36(sup 12):11-9.
56. National Institutes of Health. National Cancer Institute. Common Terminology Criteria for Adverse Events [homepage en Internet]; CTCAE, version 4.0 [citado 13 de marzo de 2017]. Disponible en: https://evs.nci.nih.gov/ftp1/CTCAE/CTCAE_4.03_2010-06-14_QuickReference_5x7.pdf
57. Knight KR, Kraemer DF, Neuwelt EA. Ototoxicity in children receiving platinum chemotherapy: underestimating a commonly occurring toxicity that may influence academic and social development. J ClinOncol. 2005 Dec 1; 23(34):8588-96.
Recibido: 5 de septiembre de 2017.
Aprobado: 26 de septiembre de 2017.
Julianis Quintero Noa. Hospital Pediátrico Universitario "William Soler". San Francisco # 10 112, Reparto Altahabana, municipio Boyeros. La Habana, Cuba. Correo electrónico: julianis@infomed.sld.cu