Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Pediatría
versión impresa ISSN 0034-7531versión On-line ISSN 1561-3119
Rev Cubana Pediatr vol.90 no.3 Ciudad de la Habana jul.-set. 2018
ARTÍCULO ORIGINAL
La función tiroidea en pacientes con enfermedades autoinmunes
Thyroid function in patients with autoimmune diseases
Marlen Rivero González,I Lisandra Bonilla Machado,II César Emilio Silverio García,II Oramis Sosa PalaciosIII
IServicio de Endocrinología. Hospital "William Soler Ledea". La Habana, Cuba.
IIServicio de Hepatología. Hospital Pediátrico "William Soler Ledea". La Habana, Cuba.
IIIDepartamento de Docencia. Hospital Pediátrico "William Soler Ledea". La Habana, Cuba.
RESUMEN
Introducción: la aparición de enfermedad tiroidea autoinmune presenta una gran prevalencia en pacientes con diagnósticos de enfermedades autoinmunes.
Objetivo: describir las enfermedades tiroideas autoinmunes en pacientes con enfermedades autoinmunes, atendidos en el Hospital Pediátrico "William Soler Ledea", del 1ro. de octubre de 2014 al 31 de enero de 2017.
Métodos: estudio descriptivo, transversal y prospectivo en 42 pacientes con diagnóstico de enfermedad autoinmune. Se midieron variables demográficas, enfermedad autoinmune (lupus eritematoso sistémico, hepatitis autoinmune, artritis idiopática juvenil y esclerodermia), función tiroidea (eutiroidismo, hipotiroidismo e hipertiroidismo) y anticuerpos antitiroideos (antiperoxidasa y antitiroglobulina).
Resultados: las enfermedades autoinmunes, con enfermedad tiroidea, se presentaron en 26,2 % (n= 11): con hipotiroidismo 81,8 % (n= 9) y con hipertiroidismo 18,2 % (n= 2). El hipotiroidismo estuvo presente en adolescentes del sexo femenino (n= 7), el lupus eritematoso sistémico en el 88,9 % (n= 8), seguido de esclerodermia en el 11,1 % (n= 1). El hipertiroidismo solo se diagnosticó en el lupus eritematoso sistémico 100 % (n= 2), ambas en adolescentes del sexo femenino. Solo 3 pacientes tuvieron anticuerpos antitiroideos positivos, solo 2 se correspondieron con enfermedad tiroidea autoinmune: hipotiroidismo con anticuerpos antitiroideos positivos 22,2 % (n= 2, en este caso correspondiente al lupus eritematoso sistémico). Los pacientes sin enfermedad tiroidea (73,8 %; n= 31), a su vez, predominaron en edades de 10-14 años (n= 15; 48,4 %) y en el sexo femenino (n= 22; 71,0 %).
Conclusión: el hipotiroidismo es más frecuente en adolescentes femeninas, con diagnóstico de lupus eritematoso sistémico, y con evidencia de anticuerpos antitiroideos positivos.
Palabras clave: alteraciones tiroideas; enfermedades reumáticas infantiles; enfermedades autoinmunes.
ABSTRACT
Introduction: the appearance of autoimmune thyroid disease has high prevalence in patients diagnosed with autoimmune diseases.
Objective: to describe the autoimmune thyroid diseases in patients with autoimmune diseases attended at "William Soler Ledea" Pediatric Hospital from October 1, 2014 to January 31, 2017.
Methods: descriptive, cross-sectional and prospective study in 42 patients diagnosed with autoimmune disease. Demographic variables, autoimmune disease (systemic lupus erythematosus, autoimmune hepatitis, juvenile idiopathic arthritis and scleroderma), thyroid function (euthyroidism, hypothyroidism and hyperthyroidism) and antithyroid antibodies (antiperoxidase and antithyroglobulin) were measured.
Results: autoimmune diseases with thyroid disease occurred in 26.2 % (n= 11), with hypothyroidism 81.8 % (n= 9), and with hyperthyroidism 18.2 % (n= 2). Hypothyroidism was present in female adolescents (n= 7), systemic erythematosus lupus in 88.9 % (n= 8) followed by scleroderma in 11.1 % (n= 1). Hyperthyroidism was only diagnosed 100 % in systemic erythematosus lupus (n= 2), both in female adolescents. Only 3 patients had positive antithyroid antibodies, only 2 corresponded to autoimmune thyroid disease: hypothyroidism with positive antithyroid antibodies with 22.2 % (n= 2, in this case corresponding to systemic lupus erythematosus). Patients without thyroid disease (73.8 %; n= 31) predominated at ages from 10 to 14 years old (n= 15; 48.4 %) and in females (n= 22; 71.0 %).
Conclusion: hypothyroidism is more frequent in female adolescents, with a diagnosis of systemic erythematosus lupus, and with evidence of positive antithyroid antibodies.
Keywords: thyroid alterations; rheumatic diseases in children; autoimmune diseases.
INTRODUCCIÓN
Las enfermedades autoinmunes afectan entre 5 y 10 % de la población, y en un gran porcentaje está comprometida alguna glándula endocrina. Frecuentemente pueden ser múltiples los órganos comprometidos en un mismo individuo, que pueden conformar síndromes poliglandulares autoinmunes (falla autoinmune al menos de 2 glándulas). Tal es el caso de la aparición de enfermedad tiroidea autoinmune (ETA) en pacientes con enfermedad autoinmune de otro origen.1-3
Se basa en la producción de anticuerpos contra componentes de la glándula tiroides como la antiroglobulina (ATG) y la antiperoxidasa (APO), o contra receptores estimuladores, los cuales están presentes hasta en 80 % de los pacientes con esas enfermedades, y en 5 a 10 % de la población general, proporción que se incrementa con la edad sin que se conozcan los motivos.1,4,5
Las primeras publicaciones datan de la década de 1960. Las evidencias acumuladas indican que existe una comunicación bidireccional entre el sistema nervioso central, el sistema endocrino y el sistema inmune desde el desarrollo embrionario y neonatal hasta las etapas finales de la vida, la cual es constantemente evidenciada bajo situaciones de estrés, desencadenando una serie de reacciones que activan este sistema inmune neuroendocrino, con la consiguiente liberación y síntesis de los llamados mensajeros (hormonas, citoquinas, etc.). Las células tienen receptores para hormonas, citocinas y patrones moleculares asociados con patógenos, y todos ellos se activan para responder de una manera fisiológica a los agentes patógenos.6,7
Así, la alteración de estos procesos de regulación fisiológica, es un factor de riesgo potencial para el desarrollo de las enfermedades autoinmunes, y se ha demostrado de esta forma, una respuesta inmunoneuroendocrina anormal en pacientes con lupus eritematoso sistémico (LES), artritis idiopática juvenil (AIJ) y esclerodermia (ECD), entre otras.7
El objetivo de este trabajo es describir las ETA en pacientes con enfermedades autoinmunes, atendidos en el Hospital Pediátrico "William Soler Ledea".
MÉTODOS
Se realizó un estudio descriptivo, transversal y prospectivo con pacientes atendidos en las consultas de Miscelánea y Hepatología del Hospital Pediátrico "William Soler", desde del 1ro. de octubre de 2014 al 31 de enero de 2017.
La muestra estuvo integrada por 42 pacientes ambulatorios, elegidos no probabilísticamente, con diagnóstico de enfermedad autoinmune, atendidos en la consulta externa de Miscelánea (LES, AIJ y ECD); y en la de Hepatología (hepatitis autoinmune [HAI]).
Como criterios de inclusión se tuvo en cuenta la voluntariedad de participar en el estudio, la edad comprendida entre 1 año y 18 años, 11 meses y 29 días, así como diagnóstico de enfermedad autoinmune; y, como criterios de exclusión, la presencia de enfermedades oncoproliferativas asociadas, haber recibido trasfusión sanguínea o plasmaféresis en los últimos 4 meses, y pacientes tiroidectomizados.
Las variables analizadas fueron:
Variables demográficas
- Sexo: masculino y femenino.
- Grupos de edad: 1-5 años, 6-9 años, 10-14 años, 15-18 años.
Enfermedad autoinmune: pacientes con diagnóstico confirmado de LES, AIJ, ECD y HAI.
Función tiroidea: determinada por el estudio de hormonas tiroideas por el método inmunoradiométrico en fase sólida (método IRMA), estableciéndose 3 perfiles: eutiroideo (T3, T4 normal + hormona estimulante del tiroide [TSH] normal), hipotiroidismo (T3, T4 bajos + TSH alta o TSH alta), e hipertiroidismo.
- (T3, T4 altos + TSH baja o TSH baja). Los valores de referencia fueron aportados por el laboratorio clínico del hospital "William Soler Ledea":
- TSH normal: 0,3-3,5 mUd/dL (baja ≤ 0,29 mUd/dL; alta ≥ 3,6 mUd/dL)
- T3 normal: 1,4-3,5 µmol/L (baja ≤ 1,3 µmol/L; alta ≥ 3,6 µmol/L)
- T4 normal: 50-150 µmol/L (baja ≤ 49 µmol/L; alta ≥ 151 µmol/L)
Anticuerpos antitiroideos (AAT): determinados por el estudio de anticuerpo antiperoxidasa y antitiroglobulina por el método radioinmunoanálisis (método RIA) en el Instituto Nacional de Endocrinología (Laboratorio CENTI), con los valores de referencia siguientes:
- Anticuerpo APO y ATG positivo ≥ 100 mUd/dL
- APO y ATG negativo < 100 mUd/dL
ETA: determinada por la presencia de alteración de la función tiroidea y anticuerpos antitiroideos positivos.
Los datos fueron procesados y resumidos en porcentajes, media y desviación estándar, por medio del programa SPSS 11.5. En el análisis inferencial se emplearon pruebas de hipótesis chi cuadrado de homogeneidad e independencia (se agruparon las enfermedades autoinmunes para el análisis en LES y otras) y análisis de coeficiente de contingencia. Se consideró significativo si p< 0,05, donde p es la probabilidad de error obtenida a partir de los datos, y 0,05 es el nivel de significación prefijado.
El estudio fue avalado en el Comité de Ética para la Investigación en Salud y el Consejo Científico del Hospital Pediátrico Universitario "William Soler", y su aprobación por el Instituto de Endocrinología.
RESULTADOS
En la tabla 1 se aprecia que el LES fue detectado en 52,3 % (n= 22), y las restantes enfermedades autoinmunes, como HAI, AIJ y ECD, se presentaron en cifras inferiores a 25 %.
Del total de pacientes diagnosticados por cada enfermedad autoinmune, entre 15 y 18 años, hubo 54,5 % con LES, entre 10 y 14 años (77,8 y 50 %) con HAI y AIJ, respectivamente, y los 3 pacientes con ECD se distribuyeron en los intervalos de edades de 1 a 5 años, de 6 a 9 y entre 15 y 19.
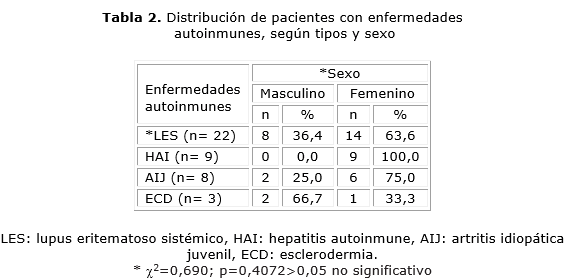
En la tabla 2 del total de pacientes por cada enfermedad autoinmune, en el sexo femenino, el 100 % tuvo HAI, el 75 % AIJ y el 63,6 % LES; mientras que, en la ECD, el 66,7 % correspondió con el sexo masculino. No hubo relación de dependencia entre el sexo y LES (enfermedad autoinmune de mayor frecuencia observada, p= 0,4072).
La tabla 3 muestra que, en los 42 pacientes con enfermedad autoinmune diagnosticada, 26,2 % tuvo alteración de la función tiroidea, distribuidos en hipotiroidismo (n= 9; 81,8 %); y de ellos, hubo 2 pacientes con anticuerpos positivos (22,2 %). Se señala que, aunque en baja frecuencia, hubo hipertiroidismo (18,2 %).
Dentro del grupo sin alteración de la función tiroidea hubo un paciente con anticuerpo antitiroideo positivo, que correspondió a la forma clínica de AIJ, catalogado como riesgo.
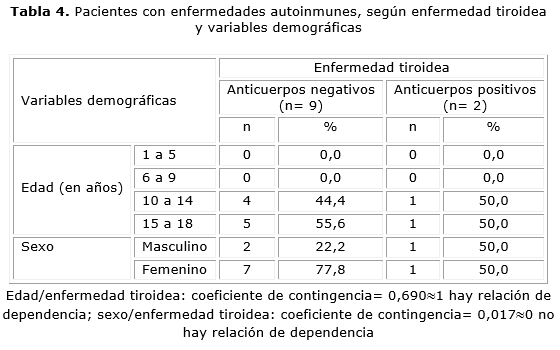
Todos los pacientes con enfermedades autoinmunes y enfermedad tiroidea eran adolescentes (tabla 4). Los anticuerpos positivos (n= 2) se distribuyeron igualmente (50 %) entre adolescentes en etapa temprana y tardía, al igual que entre ambos sexos. Finalmente, en la enfermedad autoinmune, hubo relación de dependencia de la enfermedad tiroidea con la edad (coeficiente= 0,690), pero fue independiente del sexo (coeficiente= 0,017).
En la tabla 5, de los 9 pacientes con hipotiroidismo, 66,7 % tuvo LES (adolescentes y del sexo femenino), y 1 ECD (entre 6 y 9 años); en tanto, los 2 pacientes con hipertiroidismo tuvieron LES (también adolescentes y del sexo femenino).
DISCUSIÓN
Las enfermedades autoinmunes suelen ser más frecuentes en el sexo femenino que en el masculino, llegan a comprometer varios órganos y sistemas, y es cada vez más frecuente la asociación con desórdenes tiroideos.1,4,8-10
Comparten un mismo origen genético, lo que sigue siendo motivo de estudio para muchos autores, los cuales han demostrado la asociación de estas enfermedades en miembros de una misma familia. Tal es el caso de la investigación sobre la frecuencia familiar de autoanticuerpos y enfermedades autoinmunes en una población caucásica de pacientes con LES, en la cual se encontró agregación familiar de LES, AIJ y esclerosis múltiple. En las familias con esta agregación, la prevalencia de anticuerpos antinucleares (ANA) fue 24 % y la de anticuerpos antitiroideos (AAT) 44 %, lo que sugiere la influencia de factores genéticos en la patogenia de la enfermedad.11 En los últimos años se ha visto un incremento importante de estas enfermedades autoinmunes en edades pediátricas, sobre todo, las catalogadas como reumáticas y no reumáticas, y dentro de este último grupo, la HAI.12,13
En esta investigación la muestra de pacientes con diagnóstico de enfermedades autoinmunes se distribuyó con predominio en adolescentes y en el sexo femenino, lo que coincide con la bibliografía consultada, en la cualse describe que el sexo femenino es el más afectado, con mayor representatividad en estadios prepuberales y puberales. Esto está en relación con la producción incrementada de anticuerpos a diferentes estímulos en las hembras, mientras que los varones exhiben mayor tendencia a la inflamación. Se plantea que esta hiperproduccción de anticuerpos frente a infecciones, por ejemplo, incrementa notablemente su producción, pero de manera natural, lo que da lugar a un proceso de aglutinación de antígenos propios, con la consiguiente activación del sistema inmune y aparición de estas enfermedades. Se sabe que los estrógenos y andrógenos tienen influencia directa sobre la respuesta inmune. Simplificando esta paradoja, se plantea que los estrógenos estimulan este tipo de respuesta inmune, mientras que la progesterona y la testosterona la disminuyen.11
Fueron evidentes las enfermedades autoinmunes LES, AIJ y ECD, y dentro de estas, LES alcanzó la mayor frecuencia en adolescentes del sexo femenino; en tanto, la AIJ, aunque menos frecuente, siguió igual distribución (adolescentes del sexo femenino), y la ECD fue más frecuente en el sexo masculino sin distinción por edad. Esto se corresponde con lo documentado en literatura consultada, en la que la mayor incidencia es en mayores de 10 años de edad. En el LES está descrito que la relación sexo femenino/sexo masculino va aumentando con la edad, llegando en la pubertad de 3:1 hasta 5,5:1.14-16
En un estudio cubano de 86 pacientes con LES, 56 (65,5 %) iniciaron después de los 10 años; de ellos, 49 correspondieron con el sexo femenino. En otro estudio, de la serie multinacional de Organización Internacional de Ensayos Clínicos de Reumatología Pediátrica (PRINTO, siglas en inglés), de 554 pacientes de 42 países, la edad de comienzo fue 12 años. En series de pacientes en varios países como Uruguay, Chile, Arabia Saudita y Colombia, predominaron las edades puberales.10,14,17
Caggiani y Gazzara, en 2003, en Uruguay, analizaron las historias clínicas de 18 pacientes con LES, y resultó en el sexo femenino 67 % (12 pacientes) y 33 % en el masculino. La edad de presentación estuvo entre 3 y 14 años, con 67 % de 10 a 15 años.17
La AIJ, aunque menos frecuente que el LES, estuvo representado igualmente por adolescentes del sexo femenino. Se documenta que la relación del sexo femenino/masculino es 7:1, aunque esto varía con la forma clínica.18 En cuanto a la edad, está descrito que sigue un patrón bimodal con dos picos de comienzo: uno entre 1 y 3 años, y otro entre 6 y 12 años.19,20 Es válido señalar, que todos los pacientes no fueron incluidos en el momento del inicio de la enfermedad, sino con años de evolución de este, por lo cual se asume que la edad pudo corresponderse con lo reportado en la literatura.10,13,21-23
En un estudio realizado en Cataluña entre octubre de 2004 y octubre de 2006, se calculó una prevalencia de 40,02 casos por 100 000 niños menores de 16 años, y una incidencia anual en este período de 6,86 casos nuevos por cada 100 000 niños.24 En esta investigación, en las enfermedades autoinmunes reumáticas, la ECD fue la menos frecuente, presente indistintamente por grupos de edad (1 a 5, 6 a 9, 15 a 18 años). Según la literatura médica, su inicio en edad pediátrica es raro, con menos de 5 % en menores de 16 años de edad (media 8,1, etapa escolar) y con un pico entre 10 y 16.25-29
Respecto al sexo, en contraste con el resto de las enfermedades autoinmunes, fue más frecuente en el sexo masculino, y también distinto a lo informado en el estudio realizado en el Hospital Infantil de México "Federico Gómez", en 2009, donde se incluyeron 62 pacientes con diagnóstico de ECD, y 34 % correspondió con el sexo masculino y 66 % con el femenino. En este mismo estudio, pero respecto a la edad, fue más frecuente en el grupo comprendido entre los 5-11 años (n= 39), para 63 %, con una edad media de 7,8 años (rango de 1-14). Esto está acorde con nuestros resultados.25
La HAI ocupó el segundo lugar, solo superada por el LES, presente únicamente en adolescentes del sexo femenino.
En edad pediátrica la HAI aparece en todos los grupos étnicos, pero al tratarse de una enfermedad rara, existen pocos datos epidemiológicos disponibles. Al igual que en otras enfermedades de origen autoinmune, se está observando su incremento en ambos sexos, aunque existe predominio por el sexo femenino. Por ejemplo, en Dinamarca, la prevalencia casi se ha duplicado entre 1994 y 2012, alcanzando 24 casos por 100 000 habitantes.22,30,31
La HAI tiene predilección por el sexo femenino, con una relación de 3:1. Al respecto de este predominio se plantea que existen diferencias en la respuesta inmune básica entre mujeres y varones; por ejemplo, luego de la vacunación, las mujeres presentan niveles más elevados de anticuerpos y mayor activación de células T. Además, se ha demostrado que los estrógenos aumentan in vitro la producción de citoquinas Th1 por los linfocitos T, mientras que los andrógenos la disminuyen.32-35
La edad influye en la incidencia de la HAI, lo que sugiere una relación hormonal en su patogenia. Es una enfermedad pediátrica: 40 % del tipo 1 y 80 % del tipo 2 son diagnosticados antes de los 18 años de edad, con 2 picos de incidencia: entre 6 y 7 años de edad para la tipo 2, y entre 10 y 11 años para la tipo 1.31,32,36
En un estudio mexicano publicado de 20 niños con diagnóstico de HAI (1992 y 2012), pertenecientes a la consulta externa del Departamento de Gastroenterología y Nutrición Pediátrica del Instituto Mexicano del Seguro Social, se obtuvo que la población estuvo formada por 15 mujeres y 5 hombres, proporción 3:1, así como la edad promedio fue 10,07.37
En la literatura médica se describen asociaciones entre estas enfermedades con alteraciones de la función tiroidea.1-3,5
La mayoría de los estudios se limitan a la presencia de AAT y alteraciones subclínicas. Se comunica de la asociación de las enfermedades autoinmunes reumáticas y autoinmunes endocrinas, sobre todo, en pacientes con síndrome de Sjögren, AIJ, LES y ECD; y los trastornos tiroideos que con mayor frecuencia se asocian son: hipotiroidismo autoinmunitario, hipotiroidismo subclínico e hipertiroidismo.38-40
En la serie de pacientes estudiados de esta investigación, aunque predominaron los que no tuvieron alteración de la función tiroidea, y, por ende, hasta el momento, no desarrollaron enfermedad del tiroides, hubo evidencia de alteración de la función tiroidea (hipotiroidismo e hipertiroidismo) en presencia de LES y ECD, representativas en adolescentes del sexo femenino, en correspondencia con reportes de la literatura.38
En los pacientes con AAT que expresaron ETA fueron compatibles exclusivamente con hipotiroidismo y con LES, acorde con lo descrito por otros autores.41,42 En tanto, en la enfermedad autoinmune hubo relación de dependencia de la enfermedad tiroidea con la edad, pero fue independiente del sexo, lo que no se corresponde con la bibliografía consultada,10,42 a pesar del predominio en el sexo femenino.
En el caso específico del LES (asociación con la enfermedad tiroidea descrita desde 1961), algunos autores describen que los cambios tiroideos en pacientes con LES son compatibles con hipotiroidismo subclínico, y son 5 veces más frecuente que en la población general. Sin embargo, cuando se trata de correlacionar ambas entidades, interfieren algunos factores como la edad, el uso de inmunosupresores y la actividad de la enfermedad. En otro estudio, la alteración hormonal y la presencia de AAT es mayor si el lupus está activo.41,42
Investigación realizada en 2008 en 145 pacientes (109 hembras y 36 varones), con diagnóstico de enfermedad autoinmune AIJ (n= 115), LES (n= 17) y otras, se determinaron las concentraciones de T4 y TSH, y si estaban alterados, se determinaron AAT. Se obtuvo que 6 hembras de 2 a 17 años tuvieron alteración tiroidea, 3 AIJ y 3 LES; mientras que, 5 tenían hipotiroidismo autoinmunitario con AAT elevados, y 1 tenía hipertiroidismo. Todos los pacientes con alteración tiroidea tenían ANA positivos, frente a los 37,4 % restantes (p= 0,003), resultando que la prevalencia de alteraciones tiroideas en pacientes pediátricos con enfermedad reumatológica es 4,14 %, y aumentó a 7,9 % en AIJ con ANA positivos, y a 17,6 % en lupus.42
Barcala Salido, Menor Almagro y García-Figueras Mateos en Cádiz, estudiaron 103 pacientes con LES, y obtuvieron que 24 (23,3 %) de los pacientes con LES presentaron alteraciones tiroideas. La prevalencia de hipotiroidismo fue 17,5 % (44,4 % de naturaleza autoinmune), 1,9 % hipertiroidismo y 3,9 % síndrome del eutiroideo enfermo. La presencia de artritis tuvo una prevalencia menor en pacientes con hipotiroidismo, comparados con el grupo eutiroideo (10,3 % vs. 30 %; p= 0,04).43
En un informe de 218 pacientes con ETA, la frecuencia de otras enfermedades autoinmunes fue 13,7 %, especialmente LES.44,45 Otro reporte en 2004, informa alta prevalencia de ETA silente en asociación con esclerosis sistémica progresiva y AIJ, anticuerpos ATG o APO (33 %), hipotiroidismo subclínico (8 %) e hipertiroidismo subclínico (6 %). En un estudio en 1999, en 31 pacientes de un total de 69 con enfermedad de Hashimoto, se demostraron niveles elevados de anticuerpos naturales circulantes, que también se observan en el LES y en la hepatitis crónica activa, y posiblemente resultan de la activación policlonal de las células β. En una revisión se informó que la frecuencia de AAT está aumentada en la AIJ y en la tiroiditis autoinmune.46-50 La enfermedad tiroidea se reporta en pacientes con AIJ.38,51,52
Hubo un paciente con AIJ y ATG, pero sin alteración de la función tiroidea, por tanto, sin ETA, que fue catalogado como de riesgo. Algunos autores han estudiado la presencia de AAT en enfermedades reumatológicas infantiles y han encontrado un aumento en su positividad. Estos anticuerpos no estaban asociados con enfermedad tiroidea clínica ni bioquímica, por lo que el interés de su determinación es escaso si las hormonas tiroideas son normales.51,53
En un estudio de 20 años se detectaron títulos de AAT en pacientes sin alteración de la función tiroidea, con mayor especificidad para la APO. Este estudio plantea que este fenómeno es un factor de riesgo para el desarrollo de hipotiroidismo, y que, en algunos de los pacientes, precedía el desarrollo de un aumento de la TSH. Por tanto, sugiere que títulos detectables de AAT en pacientes asintomáticos y sin alteración de la función tiroidea, constituye un factor de riesgo para la ETA.54
Es evidente que no hubo pacientes con HAI y enfermedad tiroidea; sin embargo, se describe que la T3 y T4 regulan la tasa metabólica de todas las células, incluyendo al hepatocito, y, por tanto, modulan la función hepática. A su vez, el hígado está involucrado en el metabolismo de las hormonas tiroideas, y regula de esta manera sus efectos sistémicos. Esta relación dual explica por qué la disfunción tiroidea puede perturbar la función hepática y, a su vez, la enfermedad hepática puede tener repercusiones sobre el metabolismo tiroideo.46
La prevalencia de los trastornos tiroideos observada en esta investigación, proporcional a la frecuencia de enfermedades autoinmunes, no es despreciable, en contraste con estudios realizados,43-45,55 que incluyen o tras enfermedades autoinmunes.
Se concluye que los pacientes con enfermedad autoinmune predominan en adolescentes del sexo femenino. El LES se encuentra, con mayor frecuencia, en adolescentes del sexo femenino. En la enfermedad tiroidea hay anticuerpos antitiroideos solo en adolescentes con igual distribución por sexo. Hay evidencia de alteración de la función tiroidea, más frecuente hipotiroidismo, en adolescentes del sexo femenino, y principalmente en el LES. Se detectan AAT en el LES y en la ECD.
Se recomienda extender este proyecto de investigación a poblaciones pediátricas con una mayor representatividad de casos, donde se pudiesen incluir otras enfermedades autoinmunes, para determinar la asociación de enfermedad tiroidea con enfermedades autoinmunes mediante la determinación de AAT mayormente y hormonas tiroideas, así como identificar la historia familiar de enfermedades autoinmunes o alteraciones tiroideas.
Conflicto de intereses
Los autores declaran que no existe conflicto de intereses en la realización del presente estudio.
REFERENCIAS BIBLIOGRÁFICAS
1. Letelier MC. Síndromes endocrinos autoinmunes: cuándo sospechar y estudiar un síndrome poliglandular. Rev Med Clin Condes. 2013;24(5):784-9.
2. Roncalés-Samanesa P, de Arriba Muñoza A, Lou Francésa GM, Ferrer Lozanoa M, Justa Roldánb ML, Labarta Aizpuna JI. Síndrome poliglandular autoinmune tipo 1 y mutación C322fsX372. An Pediatr. 2015;82:e60-3.
3. Wémeau JL, Proust-Lemoine E, Ryndak A, Vanhove L. Thyroid autoimmunity and polyglandular endocrine syndromes. Hormones. 2013;12:39-45.
4. Barragán-Garfias JA, Zárate A. Relación entre las enfermedades tiroideas autoinmunes y las del tejido conectivo. Rev Med Inst Mex Seguro Soc. 2013;51(2):e1-5.
5. Bourji K, Gatto M, Cozzi F, Doria A, Punzi L. Rheumatic and autoinmune thyroid disorders: a causal or casual relationship? Autoimmun Rev. 2015 Jan;14(1):57-63.
6. Pita Gutiérrez F, Crespo Marcos D, Iglesias Fernández C, Rodríguez Sánchez, Rodríguez Arnao MD. Enfermedad tiroidea autoinmunitaria: posibilidad de asociación a gastritis autoinmunitaria. An Pediatr (Barc). 2009;71(3):240-3.
7. Jara LJ. La interacción inmuno-neuro-endocrina en enfermedades reumáticas autoinmunes: un nuevo desafío para el reumatólogo. Reumatol Clin. 2011;7(2):85-7.
8. Torres Odio S, Martínez Córdova Z. Factores genéticos, inmunológicos y ambientales asociados a la autoinmunidad. Rev Cubana Invest Bioméd. 2011 Dic;30(4):501-10.
9. Kokuina E. De la autoinmunidad a las enfermedades autoinmunes. Rev Cubana Med. 2001;40(1):36-44.
10. Chiaroni-Clarke RC, Munro JE, Ellis JA. Sex bias in paediatric autoimmune disease-Not just about sex hormones? J Autoimmun. 2016 May;69:12-23.
11. Corporal S, Bijl M, Kallenberg CG. Familial occurrence of autoimmune diseases and autoantibodies in a Caucasian population of patients with systemic lupus erythematosus. Clin Rheumatol. 2002;21(2):108-13.
12. Goldblatt F, O'Neill SG. Clinical aspects of autoimmune rheumatic diseases. Lancet. 2013 Aug 31;382(9894):797-808.
13. González MB. La artritis idiopática juvenil y su relevancia dentro de las enfermedades reumatológicas de la infancia. Rev Med Clin Condes. 2012;23(4):384-9.
14. Coto Hermosilla C, Duarte Pérez MC, Vargas Díaz J. Lupus Eritematoso Sistémico. En: Coto Hermosilla C. Reumatología Pediátrica. La Habana: Editorial Ciencias Médicas; 2012. p. 191-224.
15. Merino Muñoz R, Remesal Camba A, Murias Loza S. Lupus eritematoso sistémico. An Pediatr Contin. 2013;11(2):89-97.
16. Kokuina E. Autoanticuerpos como biomarcadores de actividad de la enfermedad del lupus eritematoso sistémico. Rev Cubana Med. 2014;53(2):201-23.
17. Caggiani M, Gazzara G. Lupus eritematoso sistémico en niños y adolescentes. Características clínicas, inmunológicas y evolutivas. Análisis y consideraciones terapéuticas. Arch Pediatr Urug. 2003;74(4):237-44.
18. Magallares López B, Quesada-Masachs E, Román Pascual AM, Medrano San Ildefonso M. Categorías de artritis idiopática juvenil. DOLOR. 2015;30:116-28.
19. Arreguin-Reyes R, Valle-Leal J, Lozano Renteria L, Medina-Valenton E, Alvarez Bastidas L. Descripción de un cohorte de pacientes de artritis idiopática juvenil en el estado de Sonora, Mexico. Rev Colomb Reumatol. 2016;23(24):236-41.
20. McCurdy KD. Updates in Pediatric Rheumatology. Advances Pediatr. 2016;63:281-332.
21. Gómez Conde SY. Artritis Idiopática Juvenil. En: Coto Hermosilla C. Reumatología Pediátrica. La Habana: Editorial Ciencias Médicas; 2012. p. 125-58.
22. Fábrega E, Arias Loste MT, Llerena S, Iruzubieta P, Crespo García J. Hepatitis autoinmune. Medicine. 2016;12(9):494-504.
23. Borlán S, Giménez C, Iglesias E, Bou R, Antón J. Artritis en el niño. Actualizaciones. FMC. 2016;23(7):389-402.
24. Modesto C, Antón J, Rodriguez B, Bou R, Arnal C, Ros J, et al. Incidence and prevalence of juvenile idiopathic arthritis in Catalonia (Spain). Scand J Rheumatol. 2010;39(6):472-9.
25. Morel Z, Benadón E, Faugier E, Maldonado R. Características clínicas de niños con esclerodermia en un hospital de referencia. Reumatol Clin. 2009 Jul-Aug;5(4):158-62.
26. Laxer RM, Zulian F. Localized sclerederma. Curr Opin Rheumatol. 2006;18(6):606-13.
27. Julian F. Systemic sclerosis and localized scleroderma in childhood. Rheum Dis Clin N Am. 2008;34:239-55.
28. Foeldvari I. Systemic sclerosis in childhood. Rheumatology (Oxford). 2006;45(sup 3):28-9.
29. Zulian F, Cuffaro G, Sperotto F. Scleroderma in children: an update. Curr Opin Rheumatol. 2013;25(5):643-50.
30. Grønbæk L, Vilstrup H, Jepsen P. Autoimmune hepatitis in Denmark: incidence, prevalence, prognosis, and causes of death. A nation wide registry-based cohort study. J Hepatol. 2014;60(3):612-7.
31. Manns MP, Lohse AW, Vergani D. Autoimmune hepatitis-Update 2015. J Hepatol. 2015;62(1 sup):S100-11.
32. Cuarterolo M, Ciocca M, Álvarez F. Hepatitis autoinmune en niños: perspectivas actuales. Arch Argent Pediatr. 2014 Abr;112(2):169-75.
33. Chen J, Eslick GD, Weltman M. Systematic review with meta-analysis: clinical manifestations and management of autoimmune hepatitis in the elderly. Aliment Pharmacol Ther. 2014;39(10):117-24.
34. Liberal R, Grant C, Mieli-Vergani G, Vergani D. Autoimmune hepatitis: A comprehensive review. J Autoimmunity. 2013;41:126e-139.
35. Ciocca M, Bastianelli C, Nacif P, Porta G, Ramírez F, Ríos G, et al. Hepatitis autoinmune en la infancia. Grupo de trabajo de la Sociedad Latinoamericana de Gastroenterología, Hepatología y Nutrición Pediátrica (SLAGHNP). Acta Gastroenterol Latinoam. 2016;46:237-45.
36. Manns MP, Czaja AJ, Gorham JD, Krawitt EL, Mieli-Vergani G, Vergani D, et al. Diagnosis and management of autoimmune hepatitis. Hepatology. 2010;51(6):2193-213.
37. Nares-Cisneros J, Jaramillo-Rodríguez Y. Hepatitis autoinmune en niños: evolución de 20 casos del norte de México. Rev Gastroenterol Mex. 2014 Oct-Dic;79(4):238-43.
38. Fallahi P, Ferrari SM, Ruffilli I, Elia G, Biricotti M, Vita R, et al. The association of other autoinmune diseases in patients with autoinmune thyroiditis: Review of the literature and report of a large series of patients. Autoimmun Rev. 2016 Dec;15(12):1125-8.
39. Roldán Martína MB, Soriano Guillén L, Muñoz Calvo MT. Alteraciones endocrinológicas más frecuentes en la adolescencia. Medicine. 2014;11(61):3588-604.
40. Chueca Guindulain M, Berrade Zubiri S, Dura Travé T, Oyarzábal Irigoyen M. Hipotiroidismo subclínico en la infancia y adolescencia. Rev Esp Endocrinol Pediatr. 2013;5(sup 2):49-57.
41. Magaro M, Zoli A, Altomonte L, Mirone L, La Sala L, Barini A, et al. The association of silent thyroiditis with active systemic lupus erythematosus. Clin Exp Rheumatol. 1992;10(1):67-70.
42. Lvarez Madrida CA, González Fernández A, Lisbona Muñoza M, Molina Rodriguez MA, Merino Muñoza R, García Consuegra J. Alteraciones tiroideas y enfermedades reumáticas infantiles. An Pediatr (Barc). 2009;70(1):53-6.
43. Barcala Salido J, Menor Almagro R, García-Figueras Mateos C. Trastornos tiroideos en lupus eritematoso sistémico: influencia del hipotiroidismo en las manifestaciones clínicas y parámetros analíticos [homepage en Internet]; Congresos "XXXV Congreso Nacional de la Sociedad Española de Medicina Interna (SEMI)". Inflamación/Enfermedades autoinmunes [citado 21 de abril de 2017]. Disponible en: http://www.revclinesp.es/es/congresos/xxxv-congreso-nacional-sociedad-espanola/15/sesion/i nflamacion-enfermedades-autoinmunes/1351/trastornos-tiroideos-en-lupus-eritematoso/14840/
44. Gaches F, Delaire L, Nadalon S, Loustaud-Ratti V, Vidal E. Frequency of autoimmune diseases in 218 patients with autoimmune thyroid pathologies. Rev Med Interne. 1998;19(3):173-9.
45. Tektonidou MG, Anapliotou M, Vlachoyiannopoulos P, Moutsopoulos HM. Presence of systemic autoimmune disorders in patients with autoimmune thyroid diseases. Ann Rheum Dis. 2004;63(9):1159-61.
46. Marsiglia GI. Enfermedad tiroidea asociada a otras enfermedades sistémicas. Gac Méd Caracas [serie en Internet]. 2005 [citado 21 de abril de 2017];113(4). Disponible en: http://www.scielo.org.ve/scielo.php?Script=sciarttext&pid=S0367-47622005000400002
47. Innocencio RM, Romaldini JH, Ward LS. Thyroid autoantibodies in autoimmune diseases. Medicina (B Aires). 2004;64(3):227-30.
48. Tani Y, Morita M, Noguchi S. Prevalence of prolonged APTT and lupus anticoagulant in autoimmune thyroid disease. Rinsho Byori. 1997;45(9):899-902.
49. Jasani B, Ternynck T, Lazarus JH, Phillips DI, Avrameas S, Parkes AB. Natural antibody status in patients with Hashimoto´s thyroiditis. J Clin Lab Inmmunol. 1999;51(1):9-20.
50. Masuko Hongo K, Kato T. The association between autoimmune thyroid diseases and rheumatic diseases: A review. Nippon Rinsho. 1999;57(8):1873-7.
51. Alpigiani MG, Cerboni M, Bertini I, D'Annunzio G, Haupt R, Lester A, et al. Endocrine autoimmunity in young patients with juvenile chronic arthritis. Clin Exp Rheumatol. 2002;20(4):565-8.
52. Stagi S, Giani T, Simonini G, Falcini F. Thyroid function, autoimmune thyroiditis and celiac disease in juvenile idiopathic arthritis. Rheumatology (Oxford). 2005;44(4):517-20.
53. Mihailova D, Grigorova R, Vassileva B, Mladenova G, Ivanova N, Stephanov S, et al. Autoimmune thyroid disorders in juvenile chronic arthritis and systemic lupus erythematosus. Adv Exp Med Biol. 1999;455:55-60.
54. Bergoglio L, Mestman J. Guía de consenso para el diagnóstico y seguimiento de la enfermedad tiroidea. Parte III. Acta Bioquím Clín Latinoam. 2007;41(1):87-119.
55. Liberal R, Vergani D, Mieli-Vergani G. Autoinmune paediatric liver disease. Dig Dis. 2015;33(sup 2):36-46.
Recibido: 26 de diciembre de 2017.
Aprobado: 16 de abril de 2018.
Marlen Rivero González. Hospital "William Soler Ledea". Avenida San Francisco y Perla, reparto Altahabana, municipio Boyeros. La Habana, Cuba. Correos electrónicos:marlenrg@infomed.sld.cu lbonilla@infomed.sld.cu