INTRODUCCIÓN
Los tumores renales tienen una incidencia baja en niños y dentro de este grupo el tipo más frecuente es el tumor de Wilms o nefroblastoma.1) A diferencia de lo que ocurre en adultos, existen pocas investigaciones sobre factores de riesgo de tumores pediátricos. En particular, para los tumores de Wilms se estableció de manera concluyente factores de riesgo genéticos y, de manera no concluyente, factores de riesgo socioambientales.2,3,4,5,6,7,8,9) Si bien no se debe descartar estos últimos factores, los antecedentes bibliográficos apuntan a que los factores de predisposición genética favorecen una mayor frecuencia de esta enfermedad.2,7,9,10
Características de este tipo de tumor pediátrico, como la baja incidencia, su presentación en pequeños agrupamientos y su particular relación con factores de riesgo genéticos, refuerzan la necesidad de realizar análisis espaciales y temporales de la incidencia del cáncer en unidades geográficas de diferente tamaño.11,12) Esto posibilita la identificación de áreas geográficas con un riesgo elevado significativo, que de otra manera difícilmente se podría demostrar. Además, la naturaleza discreta de los tumores renales, hace posible los análisis de este tipo de manera rápida y efectiva y se obtienen buenos resultados exploratorios.11,12,13
Particularmente para la provincia de Córdoba, Argentina, ya se investigaron y encontraron patrones de distribución espaciotemporales de cáncer en grandes áreas geográficas tanto en adultos como en niños.14,15,16,17,18,19) En investigaciones previas determinamos regiones de elevada incidencia de tumores renales que coinciden espacialmente con regiones de mayor incidencia de enfermedades genéticas debido a prácticas endogámicas.
A partir de estos antecedentes, el objetivo de la presente investigación es caracterizar de manera detallada regiones geográficas de alta incidencia de tumores renales pediátricos en el centro de Argentina y su posible vinculación con factores de riesgo genéticos.
MÉTODOS
El área de estudio se circunscribe a la provincia de Córdoba (Fig. 1), que tiene, por su ubicación geográfica dentro de Argentina, una situación mediterránea y céntrica. Según los datos del censo de 2010 la provincia de Córdoba tiene 3 308 876 habitantes. La población infantil menor de 15 años es de 805 512 niños y adolescentes, de los cuales 50,7 % son del sexo masculino y 49,3 % del femenino.20 La provincia está dividida en 26 departamentos (división político-administrativa), donde la población infantil se encuentra distribuida de manera heterogénea.
Se utilizaron datos del Registro de Tumores de la provincia de Córdoba. Este rastrea entre los residentes -toda persona que haya fijado su domicilio en la provincia con al menos un año de anterioridad al diagnóstico- desde 2003, los casos nuevos de cáncer; tumores malignos de cualquier localización, los tumores malignos invasores, las lesiones in situ, papilomas de vejiga, tumores del sistema nervioso central, cualquiera sea su comportamiento y tumores malignos de piel incluyendo carcinoma basocelular.21
La base digital utilizada del Registro de Tumores de la provincia de Córdoba corresponde al periodo 2004-2013. Para su mejor manejo y comparabilidad con otros registros, fue clasificada por la Clasificación Internacional del Cáncer Infantil, tercera edición (ICCC). De los 1 098 datos de casos de tumores totales de niños y adolescentes de 0 a 14 años de edad, 56 casos corresponden a tumores renales (Grupo ICCC VI.). La figura 1 muestra la distribución espacial de los 56 casos de tumores renales, registrados entre 2004 al 2013, en los 26 departamentos de la provincia de Córdoba. Del total de casos 39% se registran en el departamento Capital (22 casos), el resto se distribuye en otros 15 departamentos.
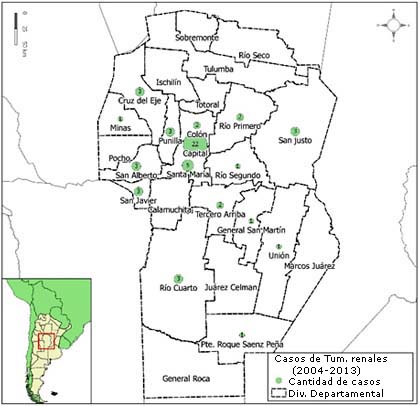 Fuente: Registro de Tumores de la provincia de Córdoba, periodo 2003-2014.
Fuente: Registro de Tumores de la provincia de Córdoba, periodo 2003-2014.Fig. 1 Distribución de los casos de tumores renales pediátricos por departamento en la provincia de Córdoba, Argentina.
Para generar, centralizar y analizar información de mapas de distribución del cáncer pediátrico renal, de factores socioambientales y de otras enfermedades de interés, se empleó la metodología de los sistemas de información geográfica (SIG). Esta permite la extrapolación de los datos en diversas escalas espaciales y temporales. Todos los datos en SIG se georreferenciaron y proyectaron al mismo sistema de coordenadas: Gauss Kruger, faja 4. Para confeccionar esta base de datos se utilizó el software de acceso libre QGIS en su versión 2.14.
Para evaluar la superposición de áreas geográficas de los casos de tumores renales y de otras enfermedades de interés, se aplicó un análisis convexo envolvente que tiene en cuenta la ubicación de las localidades con al menos un caso. A partir de estos datos se genera un polígono que representa el área geográfica abarcada por el conjunto de localidades, de cada una de las enfermedades comparadas, y así de su grado de superposición.
Para realizar los análisis espaciotemporales de conglomerados de la enfermedad, se utilizó el programa SaTScan. Esta metodología es de carácter exploratorio y su objetivo es la detección y ubicación de conglomerados con una frecuencia de ocurrencia de la enfermedad mayor que la esperada para la región puesta a prueba. Al determinar un conglomerado, el programa verifica su significación estadística, y le atribuye un riesgo relativo de la enfermedad con respecto a las zonas no incluidas en el conglomerado. Se puede ampliar sus metodologías y formas de utilización en la guía publicada por Kulldorf.22
Se introdujeron los siguientes datos para realizar los análisis: centroides de los departamentos, casos de cáncer renal en niños de 0 a 14 años por departamento por año y cantidad total de niños de 0 a 14 años por departamento por año (población en riesgo). Para obtener la población en riesgo por año se utilizaron los datos poblacionales provenientes de los Censos Nacionales de Población y Vivienda 2001 y 2010.20,23) Estos fueron extrapolados con la planilla AGEINT perteneciente al Population Analysis Spread sheets (PAS).24
Los análisis de conglomerados se realizaron teniendo en cuenta las covariables de edad y sexo de los pacientes, para evaluar si dichas variables modelan o influyen en la agregación de los datos.
En aquellas zonas de mayor incidencia de cánceres renales (conglomerados espaciotemporales), se llevaron a cabo entrevistas en profundidad a informantes claves: médicos pediatras. Se aplicó un “guion” de entrevista anónima semiestructurada (anexo), que se divide en distintos ejes o bloques: estado de la salud infanto-juvenil (franja etaria 0-14 años), situaciones o problemáticas ambientales o sociales más frecuentes en la región: su incidencia sobre la salud infantil y de los padres. Las entrevistas se grabaron y procesaron siguiendo los criterios detallados a continuación. Se estableció para cada eje o bloque de la entrevista, categorías de respuesta en base a la totalidad de las entrevistas realizadas. Por ejemplo, se categorizaron todos los factores ambientales nombrados y luego se analizó cuántas veces fue nombrado, qué grado de importancia le dio el entrevistado, tiempo, magnitud y perdurabilidad del factor, ubicación geográfica, asociación con enfermedades, asociación con otros factores o ambientales. Además, se extrajeron frases textuales que sirvieran a los fines de graficar o contextualizar factores o problemáticas.
RESULTADOS
Los casos de tumores renales (clasificación ICCC VI.) registrados en el Registro de Tumores de la provincia de Córdoba entre 2004 al 2013, da un promedio anual de 5,6 casos y una tasa de incidencia cruda anual de 6,9 casos por millón de niños de ambos sexos menores de 15 años, para todo el periodo estudiado. De los análisis espaciales, temporales y espaciotemporales realizados con el programa SaTScan, solo se obtuvo un conglomerado espacial significativo (p= 0,01) para siete departamentos (Cruz del Eje, Minas, Pocho, Punilla, San Alberto, San Javier y Santa María) ubicados mayoritariamente al oeste de la provincia de Córdoba (Fig. 2).
 Fuente: Registro de tumores de la provincia de Córdoba, periodo 2003-2014.
Fuente: Registro de tumores de la provincia de Córdoba, periodo 2003-2014.Fig. 2 Conglomerado espacial significativo de tumores renales pediátricos, provincia de Córdoba, Argentina.
El programa tomó como parámetro global una tasa cruda de 6,9 casos por millón en niños menores de 15 años. Dentro del conglomerado se encontraron 18 casos, cuando lo esperado por los cálculos del programa eran 7,6 casos (135 % de diferencia). La tasa cruda calculada del conglomerado es de 16 casos por millón en niños de 0-14 años, con un riesgo relativo de 2,99. El subtipo de tumor renal más frecuente en estos departamentos es el nefroblastoma (83 % de los casos), también llamado tumor de Wilms.
Con el agregado en el programa SaTScan de las covariables edad y sexo, de los casos bajo estudio, se obtuvieron los mismos resultados que sin su inclusión: el conglomerado anteriormente descripto. Esto sugiere que la edad y el sexo no estarían modelando o influyendo en la agregación de los datos en conglomerados de tumores renales pediátricos en nuestro estudio.
Luego de determinar una región de mayor incidencia de tumores renales (conglomerado), se realizaron seis entrevistas en profundidad a informantes claves médicos pediatras. No se pudo recabar información en todos los departamentos pertenecientes al conglomerado ya que no todos poseen nosocomios sanitarios y presencia de profesionales, y por las grandes distancias geográficas implicadas.
En el cuadro se detalla aquellos factores o condiciones que fueron repetidas a lo largo de todas las entrevistas realizadas. Casi en su totalidad se nombró como factor común en la región la alta frecuencia de la enfermedad de Sandhoff (afección genética de carácter autosomal recesiva) relacionada a endogamia o consanguinidad. Algunos de los datos aportados por los entrevistados en este sentido resaltaron que existen bolsones de consanguinidad, característicos de la zona de Traslasierras (zona oeste del conglomerado). Este dato se corrobora en diferentes estudios científicos que determinaron en esta región geográfica mayor incidencia dela enfermedad de Sandhoff, relacionándolo, en su mayoría, con el fenómeno de consanguinidad o endogamia.25,26,27,28,29,30,31,32
Por último, de las entrevistas realizadas se tomaron datos que se sumaron a la caracterización de la región, entre ellos, la presencia de enfermedades parasitarias e infecciosas en ciertas áreas del conglomerado. Además, de la información de censos nacionales y provinciales, surgieron datos de porcentajes medios a altos de necesidades básicas insatisfechas (NBI), alto porcentaje de población sin cobertura de salud, obra social o prepaga; altas tasas de desocupación, con heterogeneidades según el departamento que se analice.20,23
Cuadro Factores reiterados en entrevistas en profundidad realizadas a informantes claves en regiones de mayor incidencia de tumores renales pediátricos (provincia de Córdoba, Argentina)
| Bloque | 1. Salud Infanto-Juvenil (franja de edad 0-14) | 2. Bloque ambiental | 3. Bloque social |
|---|---|---|---|
| Factor o condición más nombrada | Alta o llamativa frecuencia de enfermedades parasitarias como el mal de Chagas y la hidatidosis (pulmonar y hepática). Alta o llamativa frecuencia de mal- formaciones congénitas (mielome- ningocele) y ciertos síndromes genéticos (enfermedad de Sandhoff). Alta frecuencia de lesiones o fallecimiento por accidentes de tránsito. Algunos problemas asociados al embarazo (hipertensión y nacimientos prematuros). Mejoras en los controles y seguimientos de los embarazos y las embarazadas. | Exposición a factores negativos relacionadas con el sector productivo del agropecuario (fumigación, proximidad de cultivos, transporte, procesado y depósito de diversos cultivos, acopio de agroquímicos, entre otros). Contaminación de aguas subterráneas o superficiales. | Endogamia o consanguinidad. Malos hábitos alimenticios. Embarazos juveniles. Separación u otras disfunciones familiares. Alcoholismo y consumo de drogas. Violencia social y/o familiar. Mejoras generales en el poder adquisitivo de las familias. |
En la figura 3 se puede apreciar la superposición de información del conglomerado de tumores renales determinado por SaTScan para el periodo 2004-2013 con la de aquellos departamentos donde se detectaron, en dos investigaciones,29,30) casos de la enfermedad de Sandhoff, así como familiares de estos niños afectados genéticamente (es decir que son portadores del gen mutado).
 Fuente: Kremer,29Lorca30) y Registro de tumores de la provincia de Córdoba, período 2003-2014.
Fuente: Kremer,29Lorca30) y Registro de tumores de la provincia de Córdoba, período 2003-2014.Fig. 3 Departamentos con casos y portadores de la enfermedad de Sandhoff y del conglomerado espacial de tumores renales, provincia de Córdoba, Argentina.
En la figura 4 se detallan los casos por localidad, del conglomerado de tumores renales y de la enfermedad de Sandhoff, publicados por Kremer29) (no se encontraron más datos a nivel local en otras investigaciones o registros). En esta figura, además, se muestra un análisis convexo enfermedad.envolvente que tiene en cuenta la ubicación de las localidades con al menos un
 Fuente: Kremer 29 y Registro de Tumores de la provincia de Córdoba, periodo 2003-2014.
Fuente: Kremer 29 y Registro de Tumores de la provincia de Córdoba, periodo 2003-2014.Fig. 4 Superposición de áreas abarcadas por las localidades con casos de la enfermedad de Sandhoff y de tumores renales pediátricos, provincia de Córdoba, Argentina.
DISCUSIÓN
Es la primera vez que en Argentina se aborda el estudio de los tumores renales infantiles complementado con datos cuantitativos y cualitativos, para determinar un contexto de desarrollo de la enfermedad. Nuestra investigación se circunscribió desde la perspectiva y los alcances de un estudio epidemiológico ecológico de tipo descriptivo. Esto permite, una aproximación epidemiológica que apunta a contribuir en el estudio de la etiología de los referidos tumores.
En investigaciones previas se determinaron conglomerados de distintos grupos de tumores pediátricos.14) Particularmente, el conglomerado espacial de tumores renales expuesto en esta investigación es sumamente llamativo porque tiene indicadores de riesgo elevados, en una región geográfica definida, que posee una población infantil baja comparada con las otras unidades de estudio. Estos resultados adquieren mayor importancia si se tiene en cuenta que este tipo de tumores es poco frecuente en niños.
A nivel internacional existen numerosas investigaciones que determinaron patrones espaciotemporales del cáncer pediátrico. En general, estas investigaciones encuentran conglomerados dentro de los grandes grupos de tumores totales, leucemias, tumores del sistema nervioso central y linfomas, pero ninguna de tumores renales.11,33,34,35,36,37,38,39) La mayoría de estas investigaciones no pudieron, de manera concluyente, relacionar sus resultados con algún factor socioambiental, a pesar de que la presencia de los conglomerados probablemente sea evidencia de que los factores ambientales están relacionados con la presencia y desarrollo de la enfermedad.40,41,42
La implementación de metodologías cualitativas permitió el acceso a información que de otra manera no hubiese sido posible conseguir. Así, el dato de una frecuencia inusitada de enfermedades y malformaciones congénitas, en particular la enfermedad de Sandhoff, permitió enfocarnos en la posible relación entre la alta incidencia de esta enfermedad y la de los tumores renales pediátricos. En este sentido, consideramos relevante los siguientes aspectos que pueden ser profundizados en futuras investigaciones para determinar su posible vinculación con esta enfermedad oncológica. Primero, para el tumor de Wilms existen evidencias concluyentes de numerosos factores de riesgo genéticos. Podemos nombrar, entre otros, síndrome familiar de tumor de Wilms (síndrome hereditario dominante), el síndrome de Beckwith-Wiedemann (síndrome hereditario dominante o recesivo), la trisomía 18 y el síndrome de Turner (síndromes cromosómicos no hereditarios).4,6,8,9,10,11) Si bien estos factores genéticos contribuyen al desarrollo del cáncer renal infantil, representan solo entre 4-10 %,5,10) pero debe tenerse en cuenta que la predisposición hereditaria puede ser un factor decisivo en la susceptibilidad del niño para desarrollar la enfermedad.2,8,43) Específicamente para los tumores renales, diversas investigaciones sobre factores étnicos y geográficos, apuntarían a que los factores genéticos influyen más que los medioambientales en la mayor o menor determinación del riesgo.10 Segundo, en el caso de la enfermedad de Sandhoff, numerosas investigaciones determinaron que esta elevada frecuencia se debe a las prácticas de la consanguinidad o endogamia de poblaciones criollas semiaisladas, radicadas en la zona.25,26,27,28,29,30,31,32) No existen estudios que relacionen la enfermedad de Sandhoff con los tumores de Wilms, pero los mecanismos por los cuales se expresa la mayor frecuencia de la primera puede ser una aproximación al estudio de la alta frecuencia de la segunda.
Asimismo, no debe dejarse de lado la posibilidad de actuación de factores ambientales y la interacción entre ambos. Del tumor de Wilms se han encontrado asociaciones con los factores de riesgo ambientales de exposición parental a pesticidas, agroquímicos, y productos utilizados en los trabajos de mecánica automotriz y soldaduras.3,4,6
Más allá del fuerte indicio del factor de prácticas endogámicas, se debería tener en cuenta en futuras investigaciones otros factores detectados en la zona por cruzamiento de datos o de la información surgida de las entrevistas en profundidad a informantes claves. Así, dentro de los problemas ambientales de la zona se manifestó la preocupación por las fumigaciones en cultivos regionales, como la papa, producción frutihortícola, algodonales y olivares, y más recientemente por los cultivos de soja. Por último, la presencia de enfermedades parasitarias e infecciosas en ciertas áreas del conglomerado y la información de censos nacionales y provinciales, indicarían la existencia de grupos sociales de sectores socioeconómicos bajos, lo cual puede ser un factor de vulnerabilidad para los procesos de salud-enfermedad.
Mediante la aplicación de distintas metodologías, cuantitativas y cualitativas, pudimos caracterizar de manera detallada una región particular de Argentina que manifiesta una incidencia elevada de tumores renales pediátricos. Además, de los resultados expuestos se pudieron identificar posibles factores de riesgo genéticos que deberán ser estudiados en futuras investigaciones. Estos resultados toman mayor relevancia si se tiene en cuenta que otras investigaciones determinaron mayor frecuencia de enfermedades genéticas, en otras regiones del país, con similares características a las de nuestra investigación.43 Por lo tanto, sería interesante indagar qué sucede allí con la incidencia de los tumores renales pediátricos. Tener indicios de posibles factores de riesgo del cáncer renal pediátrico, actuando en poblaciones particulares, no es un hallazgo menor si se tiene en cuenta el poco avance sobre la etiología de esta enfermedad.
A continuación, detallamos algunas limitaciones y recomendaciones de la investigación realizada. Primero, la baja incidencia del cáncer renal pediátrico dificulta su estudio debido a la gran variabilidad de los datos. Sería interesante contar con más años de registro de la enfermedad para corroborar si el patrón espaciotemporal se mantiene o cambia de características. Segundo, los datos de la enfermedad de Sandhoff están desactualizados (no se encontraron registros en las últimas décadas). Este desfasaje temporal entre ambas enfermedades estudiadas debería ser investigado para obtener un panorama más completo del fenómeno que se describe en la investigación.
Finalmente podemos concluir que se detectó una región particular de la provincia con alta frecuencia de tumores renales pediátricos y de la enfermedad de Sandhoff. Numerosos estudios científicos determinan que la endogamia es el factor de riesgo que aumenta la frecuencia de esta enfermedad en esta región. En futuras investigaciones se deberá corroborar si la endogamia también actúa aumentando la incidencia de tumores renales infantiles.














