La exposición fúngica es un hecho diario de la existencia humana, considerado el primer paso de un complejo mecanismo de respuesta que tiene a la sensibilización como fenómeno central en el paciente alérgico, y que puede tener como resultado el inicio de una enfermedad.1
Los hongos ambientales al igual que los ácaros y el polen son considerados como aeroalergenos. Su capacidad para activar el sistema inmune no solo depende de su antigenicidad, sino de factores como el transporte, depósito en las mucosas de la vía aérea superior de un huésped susceptible y el tiempo de exposición a un ambiente predominante de espora.2
La alergia fúngica, con manifestaciones respiratorias, afecta a un gran número de personas que padecen de asma severa y rinitis. Sin embargo, el aislamiento de alguna especie fúngica en la mucosa nasal de un paciente sensibilizado no significa que sea directamente la causa de la alergia respiratoria que padezca.3Existen otras formas clínicas diferentes4 en la presentación de las alergias a los hongos (Fig.1).
Las manifestaciones clínicas, la determinación de un elevado número de eosinófilos en la citología de la mucosa nasal o la determinación de citosinas IL4 e IL5 en lavados nasales, además de la determinación a través de las pruebas cutáneas (PC) de sensibilidad inmediata (Prick Test) para antígenos fúngicos, son los criterios disponibles para establecer la posible relación causal de los hongos ambientales y la alergia respiratoria. (5
En la práctica médica, ante el aislamiento de un hongo en la vía respiratoria, es importante definir cuál es la clasificación clínica del paciente hospedero y precisar que se trata de una alergia fúngica si el paciente presenta evidencia de la reacción inflamatoria inmunológicamente mediada ante un hongo y registrar el daño tisular, aun cuando demostrar y documentar el daño del tejido sea difícil a veces.
El objetivo de la investigación realizada fue determinar si las especies fúngicas aisladas de la mucosa nasal de pacientes alérgicos respiratorios pueden ser definidas como alergenos sensibilizantes a través de las pruebas cutáneas.
MÉTODOS
Se realizó un estudioobservacional, prospectivo, de corte transversal, en las consultas de alergia del Hospital Pediátrico Universitario “William Soler”. Hospital CIMEQy el Área de Salud del Consultorio Médico No. 24 del Policlínico Carlos J. Finlay, todos de la provincia Habana. El universo estuvo constituido por todos los pacientes con diagnóstico de alergia respiratoria o comienzo de asma bronquial variable descompensada que asistieron a las consultas de alergia desde enero 2016 a enero 2017 yque cumplieran los siguientes criterios de inclusión: mayor de 2 años y menor de19 años. Se excluyeron a pacientes que se encontraban febriles o en crisis de agudización de su enfermedad alérgica, con antecedentes conocidos de comorbilidades crónicas cardiovasculares, neoplásicas, pulmonares no alérgicas, con dermografismos o eccema, tratamientos con antihistamínicos, esteroides e inmunosupresores sistémicos por lo menos tres días antes de las pruebas cutáneas, así como quienes se habían aplicado esteroides locales en los sitios de posibles punturas, al igual, los que tuviesen diámetros del habón > de 3mm en el test control negativo y quienes presentaron pruebas de alergia positivas a uno o más aeroalergenos perennes de pólenes o ácaros. Quedó una muestra de 80 pacientes.
Las variables estudiadas fueron: edad, sexo, hábitos tóxicos, antecedentes personales, Prick test (sensibilidad cutánea), colonización de la mucosa nasal, conteo global de eosinófilos en sangre, dosificación de IGE sérica total y pruebas funcionales respiratorias. La fuente de información fue a través dela entrevista que se realizó con cada paciente para recoger los datos necesarios los cuales se obtuvieron a través de un formulario elaborado en base a los objetivos quese persiguieron, todas de tipo cerrada.
Se realizaron determinaciones in vivo: reactividad cutánea. La prueba se realizó utilizando lancetas hematológicas de acero inoxidable. Se aplicó una gota de cada extracto del alérgeno sobre la superficie de la piel del antebrazo derecho (cara anterior), presionando la lanceta perpendicularmente y con presión constante durante aproximadamente 1 seg a través de la gota. A continuación, se limpió la gota suavemente.
La lectura se realizó a los 15 min y se marcó con una pluma el contorno del habón. Con el objetivo de registrar el resultado de la prueba, los habones dibujados se cubrieron con una cinta adhesiva transparente, que se transfirió a una hoja en blanco con el nombre del paciente y la fecha de realización de la prueba. Dicho registro se archivó en el CRD del paciente. Otras de las pruebas fue el exudado de la mucosa nasal, que para obtenerlase mantuvola cabeza del sujeto inclinada hacia atrás y se introdujoun escobillón estéril en ambascoanas con penetración de hasta un mínimo de 15 min y rotar consuavidad para conseguir una muestra representativa. Las muestras se sembraron por agotamiento en placas con medio de agar de Sabouraud con cloranfenicol (bioMérieuxSA, Francia) e incubaron a 25 ± 2 °C durante dos semanas. Se observarondiariamente. Para la identificación de los hongos filamentosos serealizaron, en primer lugar, resiembras en medio de agar dextrosa patata (Merck, Alemania), en microscopio siguiendo las claves e identificándose posteriormente mediante examen descritos en textos especializados. Las levaduras aisladas se sembraron en medio Cromocen CNDF (BIOCEN; La Habana Cuba). La identificación final se obtuvo mediantela prueba de asimilación de azúcares API 20 Caux (Auxacolor, Francia).
Se realizaron otros complementarios de laboratorio como conteo global de eosinófilos e IgE sérica, con el personal preparado y con todas las medidas necesarias.
Para el procesamiento estadísticose utilizó medidas de resumen descriptivas: media, desviación estándar para variables cuantitativas, frecuencia absoluta y porcentaje para las variables cualitativas. Los resultados se procesaron en Windows XP. Se utilizó la prueba estadística de significación chi cuadrada ((2) para determinar la diferencia entre los grupos estudiados (reactividad cutánea y exudado de la mucosa nasal), con una confiabilidad de 95 % para un error de muestreo de 5 %.
Se contó con el aval de consentimiento informado que se le presentó a cada paciente para contar con su aprobación por participar en la investigación, se le explicó, además, de modo general a cada uno en qué consistía el estudio.
La metodología a utilizar para la recogida de los datos no produjo ningún riesgo para los pacientes estudiados. Se contó con la aprobación del Consejo Científico del Hospital Pediátrico Docente “William Soler” y se mantuvo en todo momento la confidencialidad de la información recogida.
RESULTADOS
De los 80 pacientes con clínica de asma, rinitis o ambas, se obtuvieron pruebas cutáneas de Prick test positivas a hongos en 52 de ellos para 65,0 %. Se obtuvo el aislamiento del hongo en el cultivo nasal en 54 de los pacientes para 67,0 %, (p≤ 0,05%). La diferencia fue significativa (tabla).
Tabla Correlación de los síntomas clínicos con las pruebas cutáneas y el crecimiento de los hongos en el cultivo nasal
| Método diagnostico | No. | % |
|---|---|---|
| Pacientes con síntomas clínicos (+) | 80 | 100,0 |
| Pruebas cutáneas (+) hongos Polisensibilizados Monosensibilizados | 52 24 28 | 65,0 46,1 53,9 |
| Crecimiento de hongos (+) exudado | 54 | 67,0 |
Polisensibilizados: más de un hongo; monosensibilizados: solo un hongo específico.
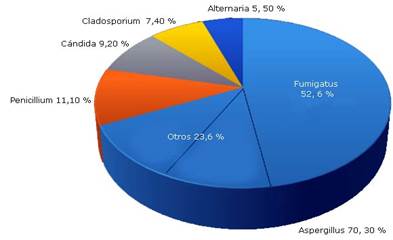
Se identificaron 18 especies diferentes, pertenecientes a 15 géneros. El hongo más frecuente en pacientes alérgicos fue Aspergillus con 70,30 % y dentro de este el Aspergillus fumigatus (52,6 %) (Fig. 2).
DISCUSIÓN
Los hongos más frecuentemente involucrados en la rhinosinusitis y asma son Alternaria, Aspergillus, Cándida, Mucor, Penicillium y Cladosporium, particularmente A. Alternata y C. herbarum constituyen factores de riesgo para el asma severa. Existen estudios que demuestran la asociación entre el aumento de los niveles atmosféricos de esporas fúngicas y el incremento de asistencia de niños con asma a servicios de urgencias. Estas esporas son, en parte, responsables de las exacerbaciones del asma infantil. También se ha demostrado que durante los meses en los que el número de hongos ambientales es más alto se incrementan los ingresos por asma.6
Los hongos que se encuentran en la mucosa liberan productos antigénicos que en sujetos atópicos pueden causar sensibilización y determinar el desarrollo de rinitis e, incluso, asma alérgica. De ahí el interés por conocer la flora fúngica nasal en sujetos alérgicos y normales.
Los hongos ambientales poseen una importante capacidad alergénica y en sujetos atópicos pueden provocar asma y rinitis Se plantea que aproximadamente el 5% de la población puede presentar síntomas de alergia a hongos a lo largo de su vida, de ahí la importancia de conocer cuáles son los alérgenos sensibilizantes, establecer la relación entre la exposición y la posibilidad de desarrollar un proceso alérgico.7,8,9
En un estudio realizado en Cuba en ambiente atmosférico de La Habana se encontró que el género viable más abundante y frecuente fue Cladosporium, seguido de Aspergillus, Penicillium, Curvularia, Fusarium y Alternaria. Mientras que en ambientes interiores los géneros Aspergillus, Cladosporium y Penicillium fueron los más abundantes en cuanto a unidades formadoras de colonias. Estos estudios que se realizan en nuestro país revisten especial importancia para la interpretación de los resultados obtenidos, permiten comparar con la realidad obtenida. Encontramos coincidencia en cuanto al género encontrado Aspergillus, esto demuestra la posible exposición de los pacientes a ambientes con altas concentraciones de esporas fúngicas o por tiempo prolongado que culmina con la colonización de la nariz.10
Un estudio cubano de evaluación de la sensibilización a hongos en escolares
con enfermedades atópicas, encontró Penicillium como el hongo que mostró más sensibilizaciones, lo que se comportó de una manera desigual con respecto a los estudios antes presentados por otros autores que realizaron estudios similares en México, lo cual explicaría las diferencias en cuanto a la variabilidad de hongos que puede existir en ambos países. En el trabajo se encontró sensibilización a Aspergillus, Penicilliumy Alternaria, en ese orden que fue más frecuente que el resto de los alérgenos empleados y que al comparar con este trabajo, difiere en los resultados.11
Estudios similares fueron realizados por Fukutomi y Taniguchi12) para comparar la presencia de hongos ambientales y la sensibilización en niños alérgicos mediante la determinación de IgE específica.
La puerta de entrada nasal para las esporas fúngicas debería reflejar la flora atmosférica dominante. Si se inhalan los hongos, quedan atrapados en las fimbrias de la nariz yse ponen así en contacto directo con la mucosa nasal. En pacientes alérgicos el factor mecánico del uso de pañuelos para la rinitis puede influir en el arrastre de las partículas de hongos inhalados. En el presente estudio los hongos aislados coincidieron con los géneros encontrados en mayor proporción por Rojas y otros,13en estudios en ambientes externos e internos, lo cual refleja la micobiota ambiental existente en los sitios de mayor exposición.
A pesar de que en este estudio se identificaron un total de 15 géneros diferentes, los hongos aislados con más frecuencia en orden decreciente fueron Aspergillus, Penicillium, Cladosporiumy Cándida, que se encuentran entre los que más frecuentemente producen alergias respiratorias.
Los datos comunicados por la Nova Acta Científica Compostela,14señala que las esporas predominantes en exteriores de la ciudad de La Habana durante 2010 a octubre 2012, correspondieron en género más abundante y frecuente a Cladosporium, seguido de Aspergillus, Penicillium, Curvularia, Fusarium y Alternaria; Aspergillus y Penicillium predominaron durante la estación lluviosa (mayo-octubre) de 2010 y 2011, respectivamente.
Las concentraciones de Alternaria y Fusarium, fueron superiores, con máximos mensuales en abril y febrero, hechos que demuestran que las condiciones climáticas determinan la variabilidad y concentración atmosférica de hongos anemófilos, que pueden determinar la aparición temporal de alergia en pacientes atópicos, aunque no se tomaron estas variables para el estudio.15
Contrasta el hecho de que la mayoría de las alergias respiratorias registradas son por Alternaria y que esta solo se aisló en este estudio en tres muestras de sujetos alérgicos (1%). La mayoría de los pacientes alérgicos a hongos no eran portadores de esta en su micobiota nasal, incluso, en algunos casos, se cultivó una especie fúngica distinta a aquella a la que los pacientes estaban sensibilizados.
Este hecho sugiere que no existe una relación directa entre los hongos de la mucosa nasal y la sensibilización a una determinada especie. Situación que podría ser variable según el momento en que se toma la muestra; el arrastre provocado por el uso de pañuelos para la rinitis y el fenómeno de la reactividad cruzada, Por lo tanto, el seguimiento con cultivos seriados en un mismo sujeto a lo largo del año podría proporcionar una información valiosa sobre estas variaciones.
A partir de este análisis se define que es necesario para establecer un diagnóstico de certeza, contar con una adecuada historia clínica del paciente a quien se le practique las pruebas actuales (in vivo e in vitro) para determinar sensibilización fúngica aun cuando no están exentas de limitaciones.
Las discordancias entre los resultados hallados de pruebas practicadas deben ser llevadas a la consideración clínica.
En Cuba donde el asma afecta el 9,8 %16 de la población general, no se cuenta con estudios de identificación de especies fúngicas de micobiota nasal de pacientes alérgicos respiratorios, y su relación con las pruebas cutáneas.
No contar con extractos estandarizados para las pruebas de sensibilización cutánea, ni determinaciones de Inmunoglobulina E específica en la práctica habitual de los laboratorios de los centros asistenciales, forman parte importante de las limitaciones antes señaladas.
Se concluye que el estudio de la micobiota nasal es una prueba que debe interpretarse, junto con las pruebas cutáneas, para el diagnóstico de enfermedades alérgicas por hongo ambiental dado su importancia para el control epidemiológico de la exposición frecuente a hongos, en espacios interiores y exteriores, en los pacientes. Recomendamos hacer extensivo este estudio a otras provincias del país para un mejor diagnóstico y tratamiento.
Agradecimientos
A: Dra. Nirtza E Suarez Navarro. Especialista de I Grado en Microbiología. Máster en Microbiología. Hospital Pediátrico Universitario “William Soler”.
Lic. Yolanda Martínez Ayala. Licenciada en Microbiología. Hospital Pediátrico Universitario “William Soler”.
Tec. Lisandra Linares Luna.Tec, en Inmunoalergia. Hospital Pediátrico Universitario “William Soler”.