Introducción
En Cuba, las aneuploidías de los cromosomas 21,18,13 y X constituyeron el 77 % de todas las aberraciones cromosómicas detectadas en el diagnóstico prenatal de más de 75 000 casos durante el periodo 1984-2012 según Méndez-Rosado y otros.1
Estas anomalías cromosómicas constituyen una carga para la sociedad y la familia desde los puntos de vista económicos, psicológicos y educacionales. La técnica de hibridación in situ por fluorescencia (FISH, por sus siglas en inglés) introducida internacionalmente desde hace años en el diagnóstico prenatal citogenético constituye una poderosa herramienta para la citogenética clínica al proveer un diagnóstico muy rápido y seguro de las aneuploidías anteriormente mencionadas.2,3,4
No obstante, esta técnica tiene sus limitaciones,5 que hay que considerar y que están expresadas en su lugar específico, antes de las conclusiones de este trabajo.
Existen muchos datos en la literatura de la implementación de este método diagnóstico en los países desarrollados.3,6,7 pero pocas publicaciones de estudios extensos en países de bajos ingresos donde no toda la tecnología y screenings prenatales están disponibles.8,9
En Cuba, país donde no están implementados los métodos bioquímicos de screening prenatal, ni las tecnologías de punta usadas en países desarrollados, microarreglos, secuenciación, entre otros, nos proponemos, a pesar de esas limitaciones, describir las características y experiencias del diagnóstico prenatal por FISH, objetivo de este trabajo.
Métodos
Se realizó un estudio descriptivo-retrospectivo que incluyó los casos diagnosticados por el método FISH en células en interfase durante el periodo 2009-2018 en el Centro Nacional de Genética Médica de La Habana. El universo de estudio lo constituyeron 629 embarazadas remitidas desde toda Cuba, a quienes se les realizó esta prueba. Los datos seleccionados comprendieron aquellos donde se pudo obtener un diagnóstico mediante este método. Las variables utilizadas en este estudio fueron: número de procederes invasivos practicados (amniocentesis), número de diagnósticos realizados, motivos de indicación para hacer el estudio prenatal y número y tipo de aberración cromosómica detectada.
Para cada variable, se obtuvieron sus valores absolutos y se calcularon los porcentajes para comparar los resultados.
Para el diagnóstico nos apoyamos en el software Citovision versión 3.9, section Genus (Applied Imagen, EE. UU.) con el que capturábamos y procesábamos las imágenes tomadas desde microscopios Olympus (BX-51, Japón).
Hibridación in situ con fluorescencia para detección de aneuploidías
Esta prueba se estandarizó en Cuba en el 2009. Se realizó desde las 14 semanas de embarazo hasta pasadas las 32 semanas. Se realizó la amniocentesis mediante la extracción de 20 mL del líquido amniótico (LA), 10 mL se utilizaron para la prueba FISH y 10 para el cultivo convencional. La muestra para FISH no se cultiva; se procesa directamente aplicando a los amniocitos dos tratamientos enzimáticos, el primero con tripsina (1:250) y el segundo con pepsina (10 mg/mL). La preparación se extiende sobre láminas portaobjetos y se hibrida con sondas que identifican los cromosomas 21,18,13, X y Y. Para la identificación de los cromosomas 18, X y Y, se usaron juegos de sondas Aneuvision (VYSIS, EE. UU.) para sondas α-satélite CEP 18 (p11.1-q11.1) marcada con fluorocromo Spectrum Aqua, X (p11.1-q11.1) marcada con fluorocromo Spectrum Green y Y (p11.1-q11.1) marcada con fluorocromo Spectrum Orange. Para la identificación de los cromosomas 13 y 21, se utilizaron juegos de sondas Aneuvision (VYSIS, EE. UU.) para sondas LSI 13 (13q14) marcada con fluorocromo Spectrum Green y 21 (q22.13-q22.2) marcada con fluorocromo Spectrum Orange. Al siguiente día se hicieron lavados para eliminar el exceso de marcaje de las sondas, se aplicó el colorante diamidinofenilindol (DAPI) y se analizó con el microscopio de fluorescencia. El resultado estuvo listo en dos días.
El criterio para la definición del mosaicismo cromosómico por FISH aún no está bien definido internacionalmente, pero consideramos que con 20 % o más de células con un patrón de signos diferentes, existe un alto riesgo de mosaicismo cromosómico. Este criterio fue asumido de acuerdo a lo descrito en el prospecto del juego de sondas Aneuvision y la experiencia de otros autores.10
Cuando existió un caso en que el conteo de señales anómalas del FISH oscilaba entre 10-19 % se dio como resultado dudoso y debía ser confirmado por citogenética convencional.
Síndromes de microdeleciones-microduplicaciones
En los casos de las sondas empleadas para la detección de aberraciones que impliquen las regiones dianas asociadas a estos síndromes, se utilizaron las sondas LSI TUPLE1 Spectrum Orange/LSI ARSA Spectrum Green y LSI NP-25 Spectrum Orange/LSI ARSA Spectrum Green para la región 22q11.2 (Síndrome Velocardiofacial) y LSI SRNPN Spectrum Orange/CEP 15(D15Z1) Spectrum Green/ LSI PML Spectrum Orange y LSI D15S10 Spectrum Orange/CEP 15 (D15Z1) Spectrum Green/ LSI PML Spectrum Orange para la detección de la región crítica de los síndromes Prader-Willi y Angelman. Para la detección de la deleción asociada al síndrome de Williams-Beuren se utilizó la sonda LSI ELN Spectrum Orange/LSI D7S485, D7S522 Spectrum Green.
El resultado del FISH se le comunicó al especialista en genética en cuanto estuvo listo, mucho antes que el resultado de la citogenética convencional.
Diagnóstico prenatal cromosómico
Este diagnóstico se realizó por el método estandarizado en nuestro laboratorio basándonos en los protocolos de las guías internacionales del ACT Cytogenetics Laboratory Manual.11) Este método se aplicó siempre que la edad gestacional en que se realizó el proceder invasivo permitiese el posterior cultivo del líquido amniótico. En pacientes con edad gestacional de más de 22 semanas no se realiza el cultivo de amniocitos. En Cuba, el aborto terapéutico es legal hasta las 26 semanas de gestación y se hacía necesario asegurar el resultado citogenético convencional antes de este límite.
Prueba FISH para la corroboración de un resultado dudoso durante el diagnóstico prenatal por análisis cromosómico
En la amniocentesis se extraen 20 mL de líquido amniótico a la embarazada de riesgo genético. Se utilizan 10 mL para realizar el cultivo celular y posterior obtención de cromosomas y los restantes 10 mL son refrigerados a 4 ℃. En el caso que resulte necesario. este líquido amniótico almacenado se puede reutilizar para un nuevo cultivo o realizar la prueba FISH. Este método es empleado cuando obtenemos en primera instancia un resultado dudoso o incompleto, por ejemplo, para descartar el mosaicismo cromosómico.12
Aspectos éticos
En todos los casos se brindó a la pareja el asesoramiento genético y se pidió consentimiento informado para realizar el procedimiento invasivo para la toma de muestras. Una vez obtenido el diagnóstico prenatal todas las muestras no utilizadas se desecharon. En las bases de datos del laboratorio cada paciente tiene asignado un código, con el cual se realizó este trabajo y se mantuvo el anonimato durante el procesamiento de la información. El Comité de Ética de la Investigación Científica del Centro Nacional de Genética Médica aprobó la realización de este estudio.
Resultados
Muestras colectadas
Durante el periodo 2009-2018 se realizaron 629 casos de diagnóstico prenatal utilizando el proceder invasivo por amniocentesis y posterior cultivo de líquido amniótico, que por diversas indicaciones se sometieron a esta prueba. En 612 casos se logró un resultado exitoso (tabla 1).
Tabla 1 Resultados por años del os casos diagnosticados y los casos positivos detectados
| Año | Muestras de FISH | FISH exitoso (%) | Casos positivos (%) |
|---|---|---|---|
| 2009* | 40 | 34 (85,00) | 3 (8,8) |
| 2010 | 4 | 4 (100,00) | - |
| 2011 | 45 | 43 (9,05) | 6 (13,30) |
| 2012 | 94 | 92 (97,80) | 6 (6,50) |
| 2013 | 64 | 64 (100,00) | 6 (9,30) |
| 2014 | 76 | 75 (98,60) | 5 (6,50) |
| 2015 | 37 | 35 (94,50) | 3 (7,60) |
| 2016 | 45 | 44 (97,70) | 9 (15,90) |
| 2017 | 110 | 109 (99,00) | 6 (5,50) |
| 2018 | 114 | 112 (98,00) | 6 (5,30) |
| Total | 629 | 612 (97,00) | 50 (8,10) |
*Se realizaron 26 casos de FISH que previamente se conocia el resultado del cariotipo.
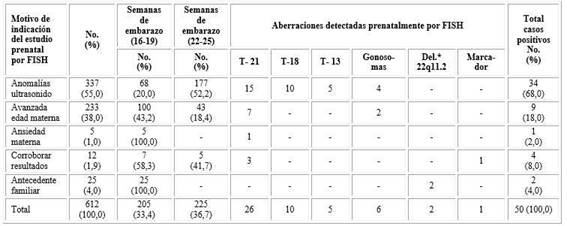
Los motivos de indicación también variaron, los más frecuentes fueron aquellos asociados a alteraciones fetales detectadas por ultrasonido que hacían sospechar una anomalía cromosómica (tabla 2).
La técnica de hibridación in situ por fluorescencia
La prueba FISH fue proporcionada en el 97 % de los casos. Se detectaron 50 anomalías cromosómicas (8,1 %). En la tabla 1 se muestra el desempeño por años de nuestro laboratorio.
El insuficiente número de células presentes en el líquido amniótico constituyó la principal causa de fallo en el diagnóstico (11 casos, generalmente pacientes antes de las 16 semanas de embarazo). En 6 casos el fallo se debió a errores técnicos al no producirse la hibridación de una sonda específica. De los 17 casos sin resultados (629 admitidos y 612 exitosos) 13 se diagnosticaron por citogenética convencional y se detectaron 2 casos con trisomía 18. En 4 casos las pacientes no tuvieron diagnóstico. En los líquidos amnióticos sanguinolentos la contaminación con células maternas no fue lo suficientemente significativa como para evitar un diagnóstico certero.
Casos positivos detectados
La aberración cromosómica más frecuentemente detectada fue la trisomía 21 (26 casos) seguida de la trisomía 18 (10 casos), las aberraciones que involucran los gonosomas (6 casos), la trisomía 13 (5 casos), la deleción 22q11.2 (2 casos) y un caso de un cromosoma marcador proveniente del 15 (inv dup 15). Dentro de las aberraciones de los gonosomas tenemos un mosaico 48,XXXY/49,XXXXY, dos casos de 47,XXY, un 45,X, una 47,XXX y un pseudo isodicéntrico del cromosoma Y. Todos estos casos se diagnosticaron en amniocitos en interfase. El caso del 46,X, idicY se corroboró en cromosomas fetales (tabla 2).
El mayor porcentaje de casos positivos estuvo asociado a las malformaciones detectadas por ultrasonido, el 68,0 % de los casos positivos, principalmente entre las 22-25 semanas de gestación, periodo en que en Cuba se realiza un ultrasonido de rutina a las gestantes. Aquellos casos con avanzada edad materna constituyeron la segunda fuente de casos positivos en nuestro estudio y fueron menos frecuentes en el periodo de las 22-25 semanas de gestación (tabla 2).
Las sondas para detectar deleciones en los síndromes de microdeleciones se aplicaron en familias con antecedentes del síndrome velocardiofacial, síndrome de Prader-Willi o síndrome Williams-Beuren. Se detectaron dos casos de deleción 22q11.2 en madres portadoras de dicha aberración.
Análisis de los resultados de la hibridación in situ por fluorescencia y la corroboración por citogenética cromosómica convencional
Se realizaron 312 casos de citogenética convencional que fueron útiles para corroborar los resultados del FISH. Existió 98 % de concordancia entre las aberraciones detectadas por FISH y las aberraciones cromosómicas detectadas por citogenética convencional. En 7 casos no existió coincidencia: un presumible mosaico 45,X/46,XX en FISH y 46,XX en cultivo de sangre fetal, un síndrome Down detectado por FISH y normal en cultivo de líquido amniótico y 5 casos de aberraciones cromosómicas estructurales (tabla 3).
Tabla 3 Casos positivos no detectados por FISH y su seguimiento
| Cariotipo | indicación | Resultado del embarazo | Estudios de seguimiento |
|---|---|---|---|
| 46,XY,inv (9)(q22q32) | AEM | Nacido vivo | Niño normal |
| 46,XY,inv(2)(p11q14)mat | AEM | Nacido vivo | Niño normal |
| 46,X,del Y(q12)pat | Antecedente familiar | Nacido vivo | Niño normal |
| 46,XX,del(4)(p15.3)de novo | CIUR simétrico, pielectasia renal izquierda, fisura palatina (ultrasonido) | Nacido vivo | Niña afectada (estudio posnatal) |
| 46,XYinv(5)(p15.2q31.1)mat | Malformación cardiovascular troncoconal y CIUR (ultrasonido) | Embarazo interrumpido | Se corroboran los hallazgos prenatales en anatomía patológica. |
El mosaico 45,X/46,XX del FISH presentó 38 % de células con la línea monosómica y el resultado cromosómico en sangre obtenido por cordocentesis fue 46,XX en las 30 células analizadas. En la ecografía fetal se detectó un retardo del crecimiento intrauterino y un oligoamnios sin otras malformaciones visibles. La madre desarrolló una hipertensión severa y se realizó una cesárea de urgencia a las 32 semanas de gestación, el producto, una niña, presentó un bajo peso al nacer y falleció a las 72 horas después del parto. Se confirmó en anatomía patológica el retardo del crecimiento fetal. No se pudieron realizar estudios de corroboración citogenética en los tejidos de la niña fallecida.
Se detectó un falso positivo para la trisomía 21, es un caso que durante el análisis con FISH el 65 % de las células presentaba 3 señales para la región crítica de este cromosoma. La ecografía fetal fue normal y el análisis citogenético de los cromosomas presentó un resultado 46,XY en 20 metafases analizadas de 2 frascos de cultivo. La gestante decidió continuar la gestación, nació un niño normal que actualmente tiene 3 años de edad, su desarrollo es normal y la madre ha rechazado cualquier estudio en la sangre del niño.
Los casos que mayor incertidumbre provocaron fueron aquellos en que por la técnica FISH se detecta un porcentaje de células con un código de señales diferente al set diploide, pero que estas aparecen en una proporción entre el 11-20 % de células afectadas. Esto podría constituir un mosaicismo en baja proporción. En nuestro muestreo registramos 8 casos con este resultado, todos pudieron ser corroborados por diagnóstico prenatal cromosómico, todos fueron normales excepto uno en que se encontraron en cien metafases analizadas 3 células que presentaron la trisomía 21 en 2 frascos de cultivo.
Existieron 5 casos con rearreglos cromosómicos estructurales detectados por citogenética convencional e imposibles de detectar por FISH (tabla 3).
De estos casos existieron 3 que presentaban reordenamientos cromosómicos aparentemente balanceados (inversiones) y 2 con reordenamientos desbalanceados (deleciones). En el caso que se presentó la deleción 4p (detectada en el estadio posnatal) a pesar de presentar múltiples malformaciones fetales no se le realizó cultivo del líquido amniótico por la avanzada edad gestacional de la paciente (24 semanas). El resultado del FISH para la detección de aneuploidías de los cromosomas 21, 18, 13, X y Y fue normal y la pareja decidió continuar la gestación. La niña nació con múltiples malformaciones.
El caso de la inversión del cromosoma 5, el feto tenía una severa cardiopatía detectada por ecografía a las 21 semanas de gestación y retardo del crecimiento. El resultado del FISH para detección de aneuploidías del 21,18,13, X y Y fue normal. El cariotipo fetal presentó una gran inversión pericéntrica del 5, heredada de la madre como pudo corroborarse posteriormente. La pareja decidió la interrupción del embarazo y no se pudo obtener tejido abortivo fetal para realizar otros estudios.
En los restantes 3 casos, la anomalía estructural fue heredada en 2 de ellos y en 1 caso no se pudo corroborar su origen porque no se pudo estudiar al padre. Los tres niños nacieron normales y actualmente son normales.
Resultados prenatales dudosos (citogenética convencional) corroborados por hibridación in situ por fluorescencia
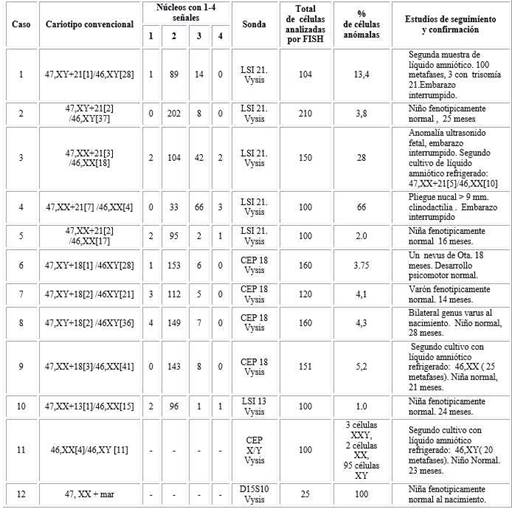
Existieron 12 casos de resultado incierto por la citogenética convencional. En 10 casos existían dudas acerca de un posible mosaicismo fetal de bajo nivel y 2 casos que presentaron dudas con el sexo fetal (tabla 4).
En estos 12 casos los estudios de corroboración del resultado se realizaron con muestras de líquido amniótico refrigerado. En 8 casos aparecieron 2 líneas celulares (tabla 4), la línea aberrada solo en un frasco de cultivo, que hicieron sospechar un mosaicismo cromosómico pero el número de metafases analizadas fue insuficiente para descartar este evento. En estos casos se analizaron al menos 100 células en interfase por FISH. Se detectaron 3 casos con mosaicismo cromosómico (casos 1,3 y 4) y 2 de ellos se verificaron a través del FISH y la citogenética convencional (caso 1 y 3). El tercer caso no pudo ser verificado a través de la citogenética convencional o mediante el estudio del material abortivo, sin embargo, existió una asociación entre el resultado del FISH y los hallazgos del ultrasonido fetal (caso 4).
Se identificaron 7 casos de pseudomosaicismo. El porcentaje de células anómalas nunca excedió el 6 % de los núcleos analizados. Seis muestras refrigeradas se recultivaron y el resultado del FISH corroborado a través del análisis del cariotipo (tabla 4).
Existió un caso con células 46,XX y 46,XY (caso 11) en un único frasco de cultivo. De las cien células en interfase analizadas el 95 % tuvo un marcaje para el cromosoma X y un marcaje para el cromosoma Y, además en el frasco de cultivo resembrado utilizando el líquido amniótico refrigerado solo se obtuvieron células 46,XY. El niño a los dos años es normal y los padres han desestimado hacerle estudios de corroboración. El caso 12 de la tabla 4 fue un 47,XX +mar, no diagnosticable por citogenética convencional. En un principio el marcador fue confundido con un cromosoma Y, pero el ultrasonido correspondía a un feto hembra. En el análisis por FISH en células en interfase se utilizó la sonda para el gen SRY, y no obtuvo marcaje. Se realizó el marcaje con la sonda D15S10 del cromosoma 15 y se obtuvieron 4 marcajes para la región 15q12, 3 marcajes centroméricos y 2 marcajes de la región control 15q22. El diagnóstico quedó definido como una tetrasomía parcial de la región q11-13 del cromosoma 15. La madre decidió la continuación del embarazo y nació una niña aparentemente normal.
Discusión
La prueba FISH prenatal tiene en nuestro laboratorio un porcentaje de éxito de 97 % y como se puede observar este se va incrementando en la medida que mejora la experticia técnica del equipo dedicado a este diagnóstico. tabla 2 Otros autores publican porcentajes de éxitos más elevados.3,4) Sin embargo, Bryndorf y otros, notifican 93 % de muestras con FISH exitoso.7 El mayor número de casos fallidos de nuestro muestreo correspondieron al momento de estandarización de la técnica en el año 2009. Consideramos que una de las causas de casos fallidos durante este diagnóstico se debe a la insuficiencia en el número de células amnióticas presente en algunas muestras.
El motivo de indicación de hallazgo de alguna alteración fetal por ecografía prenatal fue el que predominó en nuestro estudio lo cual explica el alto índice de positividad detectado. Es conocida la relación existente entre determinadas alteraciones fetales, como el aumento del grosor de la translucencia o pliegue nucal, las cardiopatías, el retardo del crecimiento fetal o la holoprosencefalia con las principales aneuploidías presentes durante el embarazo.13,14,15,16
Los estudios citogenéticos convencionales (312 casos) que se utilizaron para analizar los resultados del FISH, detectaron 7 casos que no coincidieron con los resultados del FISH. De estos casos existieron 5 que constituyeron aberraciones estructurales y las sondas utilizadas no están diseñadas para su detección. En un estudio internacional realizado por Evans y otros, con 146 000 cariotipos prenatales, encuentran con la prueba FISH es capaz de detectar 69,4 % de las anomalías fetales.17
Existió un caso falso positivo para la trisomía del cromosoma 21. Durante la ecografía fetal no se detectaron alteraciones. Casos similares se publican en la literatura.18,19,20.21
sin que hasta el momento exista una explicación plausible para este resultado. Se ha sugerido como posible causa, células presentes en el líquido amniótico de un gemelo fallecido en etapas tempranas de la gestación, un reordenamiento críptico o un mosaicismo de bajo nivel. El hecho de que la ecografía fetal fuese normal no necesariamente indica que el feto lo sea. Es conocido que fetos con síndrome Down no siempre presentan un ultrasonido alterado.21 Con este caso se fue muy cauteloso y se esperó el resultado de la citogenética convencional, normal en 20 metafases analizadas. En las condiciones de Cuba, que no posemos las técnicas de QF-PCR o aCGHs, debemos tener mucha precaución para dar un resultado del FISH alterado si el análisis ultrasonográfico es normal. Es imprescindible esperar por el resultado cromosómico para brindar un diagnóstico seguro a la paciente.
Respecto al caso del mosaico 45,X/46,XX detectado por FISH y no corroborado en la sangre obtenida mediante la cordocentesis (46,XX), este feto sí presentaba características que podrían ser compatibles con una línea 45,X como es el retardo del crecimiento intrauterino y el bajo peso al nacer.22,23,24) Debemos tener en consideración que en el líquido amniótico están presentes células de las tres capas germinales que componen al feto (ectodermo, mesodermo y endodermo) no así en la sangre fetal que solo están presentes células del mesodermo.
El FISH en amniocitos en interfase no solo fue utilizado para el diagnóstico de aneuploidías cromosómicas, también se utilizó con buenos resultados para la detección de deleciones en casos de síndromes de microdeleciones. Resultados exitosos en la detección de estas aberraciones cromosómicas también han sido registrados en la literatura internacional.24,25,26,27
En nuestro estudio la contaminación con células maternas no constituyó un problema realmente. Los casos muy contaminados con sangre no se realizaron por FISH y se prefirió el cultivo de amniocitos convencional. En general, estos casos deben ser evaluados muy cuidadosamente, se debe aumentar el conteo celular de acuerdo al grado de contaminación con células de la madre; en los casos que se detecten dos líneas celulares, una aberrada y una normal, se debe esperar por el resultado de la citogenética convencional. Se ha tenido en cuenta para nuestro trabajo que aun en aquellos casos que el LA sea claro, se puede presentar contaminación con células maternas.
En Cuba, una peculiaridad del diagnóstico prenatal por FISH, en células amnióticas en interfase, es la corroboración mediante esta prueba de los resultados dudosos obtenidos por citogenética convencional de bandas GTG con la utilizando líquido amniótico refrigerado.12 Varias artículos en la literatura internacional utilizan la técnica FISH para corroborar resultados citogenéticos convencionales,28,29,30,31) sobre todo en lo referente al mosaicismo cromosómico en baja proporción. En todos estos artículos se repite la amniocentesis para obtener una nueva muestra. La estrategia del uso del líquido amniótico refrigerado (guardado hasta 18 días a 4 ℃) evitó una segunda amniocentesis a las embarazadas, el estrés que implica el proceder invasivo y la ansiedad que provoca el conocer que se repite la prueba debido a un resultado dudoso.
El reporte mundial de defectos congénitos de March of Dimes32) ubica a Cuba como uno de los países de más baja prevalencia del síndrome Down (7 en 1000 nacidos vivos). El programa de diagnóstico prenatal citogenético, la posibilidad del acceso a los programas de salud de nuestra población y la Red Nacional de Genética Médica, han sido determinantes para alcanzar estos logros.
Entre las limitaciones del estudio y a pesar de los resultados aquí mostrados, debemos decir que la técnica FISH tiene sus condiciones, en el hecho que no todas las anomalías cromosómicas pueden ser detectadas, especialmente aquellas que involucran la estructura de los cromosomas y entonces el diagnóstico debe ser complementado con el cultivo de los amniocitos y la obtención de cromosomas.Internacionalmente, en países desarrollados, existen otros métodos más sofisticados y de mayor precisión que se utilizan como herramienta de primera línea para el diagnóstico prenatal,33,34) y es la prueba FISH cada vez menos utilizada.
No obstante, podemos concluir que la tecnología FISH aplicada al diagnóstico prenatal aun constituye una certera y rápida opción de diagnóstico en aquellos casos de embarazos de alto riesgo genético, en un país de bajos ingresos económicos. La prueba FISH en células amnióticas en interfase ha tenido que ser adaptado a nuestras condiciones para buscar siempre un diagnóstico seguro con el menor perjuicio posible a la embarazada, el feto y su familia.