Introducción
La tuberculosis es una enfermedad tan antigua como la humanidad y a pesar de conocerse su etiología desde hace más de un siglo y existir los medios para su tratamiento y prevención, continúa siendo un problema de salud a nivel global. La Organización Mundial de la Salud (OMS) estima que en 2018 afectó a un promedio de 10 millones de personas, el 11 % de las cuales fueron menores de 15 años.1
Los programas de control de la tuberculosis (PNCT) en el mundo han tenido siempre como estrategia fundamental la pesquisa, el diagnóstico, el tratamiento y la curación de los enfermos, lo que elimina la transmisión de esta enfermedad infecciosa en la comunidad.2) En fecha más reciente se plantea que la segunda estrategia es el tratamiento de la infección tuberculosa latente (ITBL) para evitar futuras reactivaciones que perpetúen la enfermedad.3,4,5
La infección tuberculosa latente se define como un estado de persistente respuesta inmune a antígenos del Mycobacterium tuberculosis (MTB) sin evidencia clínica de enfermedad tuberculosa activa.3
Desde tan temprana fecha como 1927, aparecen artículos acerca de MTB en 10 % de lesiones antiguas, de los cuales 50 % eran bacilos vivos en estado latente.6,7) Se describen posteriormente determinantes antigénicos que posibilitan al bacilo, en condiciones de estrés, adoptar esta forma de evadir los mecanismos defensivos del huésped, a través de diversos componentes: interferencia con el procesamiento y presentación de antígenos, evasión de mecanismos efectores antimicobacterianos del macrófago alveolar (la generación de óxido nítrico y especies relacionadas, además de la fusión de fagosomas y lisosomas) y la presencia del bacilo en células no fagocíticas como los neumocitos.7,8) Es importante además la expresión de genes que contrarrestan los efectos bactericidas del óxido nítrico, como los factores sigma (sigB, sigE y sigH) que modifican la expresión de un subgrupo de genes necesarios para la adaptación al estrés in vivo.9
Estos bacilos permanecen quiescentes o “dormidos” dentro del macrófago, el cual, al no detectar crecimiento bacteriano, deja de enviar estímulos a los linfocitos CD8 y CD4 y hace que el bacilo se haga invisible para el sistema inmune y pueda reactivarse después; en este estado de latencia, aunque no es inerte, es imposible verlo o cultivarlo, pero su ADN si es detectable.10
No existe una prueba universalmente aceptada para diagnosticar ITBL, pero la prueba de tuberculina (Mantoux) continúa siendo la más utilizada por su bajo costo y accesibilidad.11,12,13,14,15,16) Existen además nuevas tuberculinas que contienen dos antígenos específicos para MTB: ESAT-6 y CFP-10 (early secreted antigenic target-6 y culture filtrate protein-10 por sus nombres en inglés, respectivamente) desarrolladas en Dinamarca (Statens Serum Institute, Copenhagen) y Rusia (Diaskintest, Generium Pharmaceutical, Moscú), que son más específicas, ya que evitan las reacciones cruzadas con el bacilo vacunal BCG y con las micobacterias ambientales, las que carecen de estos antígenos. También se recomiendan los test que miden la liberación de interferón gamma (IGRAS, por sus siglas en inglés), que también utilizan estos antígenos específicos.3,12,15,17) Todas estas pruebas son aceptables pero imperfectas para el diagnóstico de ITBL.11
Esta infección por bacilos en estado no replicativo puede permanecer inactiva por muchos años y reactivarse en 5-10 % de los individuos, cuando existan condiciones que depriman la respuesta inmune (infección por el virus de la inmunodeficiencia humana [VIH], desnutrición, diabetes, alcoholismo, enfermos sometidos a diálisis, trasplantes o medicamentos inmunosupresores, entre otros).3,12,16,18,19 Se plantea que alrededor de la cuarta parte de la población mundial ha adquirido una infección latente.4
La ITBL puede ser atendida con varios regímenes de tratamiento y la efectividad oscila entre 60-90 %.3,20,21) Es una estrategia costo efectiva y además segura,22,23) aunque su efectividad puede estar limitada por barreras que afectan la adherencia al tratamiento.18,20,22,24,25
Poner fin a la epidemia de tuberculosis (TB) en el 2030, proclamada en la Asamblea Mundial de la OMS 2014,1 requiere fortalecer todas las acciones del PNCT, entre ellas la detección y tratamiento de la ITBL, lo cual debe hacerse en el grupo de mayor riesgo que lo constituyen los individuos en contacto con un enfermo y en otros grupos muy vulnerables por su condición clínica.3,12
El objetivo de este trabajo es examinar la incidencia de infección tuberculosa latente en niños pertenecientes a grupos vulnerables a la tuberculosis.
Métodos
Se realizó un estudio descriptivo, transversal y prospectivo en el periodo abril-junio 2016, en el Hospital Pediátrico Centro Habana (HPCH). El universo de estudio estuvo constituido por todos los pacientes portadores de enfermedades crónicas vulnerables a la TB: diabetes mellitus, enfermedades reales crónicas y colagenosis, que asistieron a consulta de seguimiento durante el mes de abril, así como a los pacientes con afecciones oncológicas del Instituto de Oncología y Radiobiología, ingresados también durante el mes de abril y que reunieran los criterios de inclusión. Otro grupo vulnerable incluyó niños evaluados en el periodo abril-junio, en la consulta del Centro Nacional de Referencia de TB infantil que radica en el HPCH, por referir contacto estrecho y frecuente con enfermo de tuberculosis. En total, en el grupo de estudio se incluyeron 68 niños.
El grupo control estuvo constituido por 17 adolescentes sanos estudiantes de la Escuela de Enfermería de la Facultad General Calixto García.
Todos los niños reunieron los siguientes criterios de inclusión: no tener síntomas ni signos relacionados con la TB, radiología de tórax normal y más de un año de evolución en los que presentaban enfermedades crónicas. Se obtuvo el consentimiento informado de sus padres a participar en el estudio. Se excluyeron los pacientes que no asistieran a la lectura del mantoux y que no estuvieron estables en su enfermedad de base.
Se les realizó un examen clínico buscando síntomas y signos sugestivos de tuberculosis, antecedentes de vacunación BCG, se tomó peso en kg y talla en cm, de acuerdo a lo recomendado por el Programa Biológico Internacional. Se realizó evaluación nutricional de acuerdo a la relación P/T en lactantes y al Índice de masa corporal (P/T2 expresado en kg/m2) en el resto, según las tablas de referencia para la población cubana para cada sexo y edad. Se clasificaron como desnutridos (< 3er percentil), eutróficos (entre 3 y 90 percentil) y sobrepeso/obeso (> 90 percentil). Se obtuvieron datos respecto al tipo de enfermedad de base y tratamiento recibido. Se realizó prueba de mantoux, con Derivado Proteico Purificado (PPD), por la enfermera del PNCT y se leyó a las 72 horas. La prueba de mantoux se consideró reactora para todos los casos cuando se obtuvieron valores ≥ 10 mm. En niños con contacto TB el rango dudoso de 5-9 mm también se consideró reactor, de acuerdo al PNCT de Cuba.
El Comité de Ética de la Investigación del HPCH aprobó el estudio.
Los resultados (grupos de edad, sexo, estado nutricional, resultados del mantoux) se agruparon fundamentalmente según tipo de vulnerabilidad, y se expresaron mediante estadística descriptiva en porcentajes.
Resultados
En el periodo estudiado predominaron los contactos de enfermos con tuberculosis, la mayoría de ellos adolescentes con contactos en la escuela. El sexo femenino predominó ligeramente en general, fue más evidente en los diabéticos y en los controles sanos que provienen de una escuela de enfermería. Dentro de los menores de cinco años solo se estudiaron dos lactantes en investigación de contactos, el resto eran preescolares. Todos estaban vacunados con BCG (tabla 1).
Más de la mitad de los casos eran niños eutróficos, con pocos niños desnutridos. Llama la atención que poco más de la tercera parte tiene valores por encima del peso corporal ideal para su edad, con una distribución similar en los diferentes grupos de estudio (tabla 2).
Tabla 2 Distribución de niños de los grupos de estudio según estado nutricional y características clínica
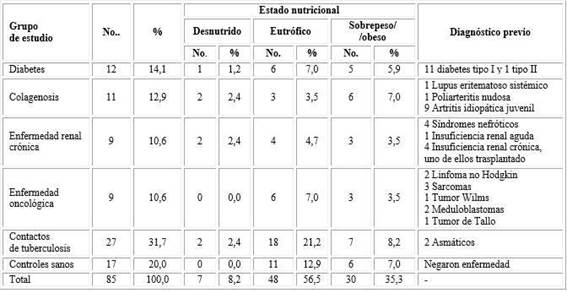
Los pacientes con enfermedades renales crónicas recibían esteroides en altas dosis y en algunos el tratamiento incluía además drogas inmunosupresoras. De forma similar, los pacientes con colagenosis recibían de forma permanente o frecuente ciclos de tratamiento con esteroides además de otros medicamentos inmunosupresores. Ninguno utilizaba productos biológicos que antagonizaran con el factor de necrosis tumoral alfa u otras citocinas. Los pacientes oncológicos se trataban con quimioterapia o radioterapia según protocolo para cada entidad.
La prueba de mantoux solo se consideró reactora en una pequeña proporción de los niños que referían contacto estrecho con un enfermo de tuberculosis, el resto de los estudiados tuvo una respuesta anérgica (tabla 3).
Discusión
La prevalencia de ITBL varía mucho en las diferentes poblaciones estudiadas.17) Es más alta cuando se estudia a los contactos de un enfermo, sobre todo en países de alta carga de TB.26 Un estimado de 354 millones de personas presentan ITBL en la India y forman la próxima generación de futuros casos de TB.20
Sudáfrica es un país de alta prevalencia, en 4880 adolescentes sudafricanos, se describe una prevalencia de ITBL entre 43,8 y 48,5 % en una década, aunque se incrementó en 13 % en adolescentes entre 12-18 años, en estratos socioeconómicos más desfavorecidos.27
En una municipalidad de Brasil, se estudian 99 menores de 15 años en contacto con un adulto con baciloscopia positiva; el 21,2 % presenta ITBL (28
En Guadalajara, México, población de incidencia media de TB, en menores de 19 años, se realiza prueba de tuberculina (PT) y prueba de liberación de interferón γ (IGRA) y se encuentra 23 % de ITBL,15) aunque incluye otros grupos vulnerables como niños que viven con VIH y aquellos albergados en casa hogar; la incidencia es menor cuando solo se considera la PT (12 %) y mayor en los albergados en casa hogar, que son niños que vienen de vivir en la calle y en los afectados por enfermedades reumatológicas.
Otros grupos vulnerables reconocidos son las minorías étnicas,19 los adictos a las drogas, los trabajadores de la salud, los privados de libertad y los que migran de países de alta prevalencia.4
En 74 países de baja morbilidad de TB (tasa TB < 100 × 100 mil habitantes) en una encuesta sobre ITBL, la mayoría, 67 (90,5 %) suministraba pruebas diagnósticas y tratamiento a los niños que eran contactos de casos de TB, pero solo dos tercios informaron suministrarlos a las personas aquejadas de infección por el VIH, considerado un grupo muy vulnerable a la TB.29
Las Guías de la OMS para el diagnóstico y tratamiento de la TB latente 2015-2018,3,12) recomiendan tanto a la PT como el IGRA, aunque su uso combinado puede añadir mayor especificidad. En los estudios que utilizan la PT se plantea que debe tenerse además en cuenta el punto de corte que se utilice.30) En general, se considera una PT positiva cuando la induración es mayor de 15 mm, también las lecturas mayores de 10 mm en niños o adultos pertenecientes a grupos vulnerables y mayor de 5 mm en niños y adultos con estados de inmunosupresión grave.30,31
Cuba es un país de baja incidencia de TB (menos de 10 × 100 mil habitantes desde el año 2002) y con una cobertura de BCG de 99,7 %.32) El PNCT cubano considera reactor positivo a los resultados entre 5-9 mm, en individuos en contacto con un enfermo y en los pertenecientes a otros grupos muy vulnerables, de forma similar al consenso argentino.2,14
En Ciudad de La Habana, Cuba, se realizaron 1 936 PT a estudiantes de noveno grado curso escolar 1999-2000, todos vacunados con BCG. El 96 % de los test fueron < 5 mm; dudosos el 2,5 % (5-9 mm) y 1,5 % resultó >10 mm. El porcentaje de reactividad disminuyó a 0,1 % cuando se utilizó un valor de corte de 15 mm.33
El uso de esteroides y la diabetes mellitus incrementa el riesgo de progresión de ITBL a TB activa de dos a cinco veces.16) En países de bajos y medianos ingresos la prevalencia de diabetes mellitus entre los nuevos casos de TB puede llegar al 40 %.26) En una revisión sistemática y metanálisis,34) se plantea que la diabetes mellitus conlleva un peor pronóstico para la curación y predispone particularmente para la mortalidad en los enfermos de TB, además puede incrementar el riesgo de desarrollar resistencia primaria a isoniacida y rifampicina (TB MDR).
El riesgo de contraer TB en pacientes con trasplantes de órgano sólidos es muy superior a la población general, se asocia a mortalidad y pérdida del injerto.35
Los pacientes con colagenosis tienen riesgo de infecciones oportunistas por los trastornos de la inmunidad humoral o celular que presentan y los tratamientos inmunosupresores, con afectación variable según el tipo de afección del colágeno y tratamientos recibidos.36) Los fármacos antagonistas del factor de necrosis tumoral-α incrementan de 4 a 8 veces la incidencia de TB, por lo que se recomienda la pesquisa y tratamiento de ITBL antes de iniciar el tratamiento.17,36
El diagnóstico de ITBL conlleva tratamiento para evitar la reactivación, aunque se reconoce en la reunión de análisis del manejo programático de la ITBL, OMS, desarrollada en el 2016, en Seúl, Corea, que existen muchos países en los cuales la ITBL no es una condición notificable, hay dificultades con el suministro del reactivo de tuberculina, no se involucra al sector privado y en general hay dificultades en la implementación de esta estrategia preventiva.18 Existen además barreras para el tratamiento de la ITBL debido a su larga duración, el rechazo de los padres a administrar medicamentos en un niño asintomático, el riesgo percibido por el personal de salud de posible aparición de resistencia a la isoniacida por la monoterapia y no considerar la posibilidad real de reactivación de la enfermedad en 10 % de los infectados. A estas dificultades pueden añadirse los costos en que tiene que incurrir la familia, entre otros factores.20,21,24,25
Este estudio tiene la limitante de examinar un pequeño número de enfermos crónicos y no incluir pacientes afectados por VIH-sida. Hacer más eficiente la pesquisa de ITBL y garantizar la oportunidad de tratar a todos los infectados, eliminar las barreras que impiden la adecuada adherencia para un tratamiento efectivo de la TB, es una meta importante para lograr la eliminación de la TB en Cuba y en el mundo.
Se concluye que existe una baja incidencia de infección tuberculosa latente en los grupos vulnerables estudiados; los niños en contacto con enfermos son los únicos afectados, lo que puede estar relacionado con la baja tasa de tuberculosis en Cuba y las rápidas acciones de control.

















