Introducción
El 31 de diciembre de 2019 el Centro Chino para el Control y Prevención de Enfermedades (CDC) notifica por primera vez a la Oficina de la Organización Mundial de la Salud (OMS) radicada en dicho país, una epidemia de casos con infecciones respiratorias bajas inexplicables, que surgen desde principio de ese mes en la provincia de Wuhan. Dicha afección es clasificada al inicio como "neumonía de etiología desconocida" al no poderse identificar el agente causal. Posteriormente, el 7 de enero 2020, se reconoce un nuevo virus denominado Coronavirus (nCoV-19) 1,2) el cual posee más de 95 % de similitud de homología con el coronavirus del murciélago y el 70 % con el coronavirus SARCoV asociado al síndrome respiratorio agudo severo descrito en China en el año 2003.3
La OMS declara el 30 de enero del 2020, a la infección por nCoV-2019 como “una emergencia internacional de salud pública”4) y el 11 de febrero es oficializada la enfermedad con el acrónimo COVID-19 (coronavirus disease), y el virus como SARS-CoV-2.3,5,6
El 11 de marzo la OMS realiza la declaratoria dela COVID-19 como “una pandemia” debido a que en las dos semanas anteriores el número de casos fuera de China se había multiplicado por 13 y triplicado el número de países afectados además de esperarse un incremento mayor de enfermos y fallecidos en fechas próximas en los países afectados.7
En la literatura revisada es notable la baja incidencia en los pacientes pediátricos que se informan, así diferentes investigadores comentan que en una cohorte de 44 672 enfermos confirmados, solo encuentran 2,1 % de positividad en pacientes pediátricos.8 Resultados similares se presentan en otra investigación donde de 75 465 casos, solo 2,4 % positivos pertenecen a este grupo etario.9
En Cuba, el primer reporte de la COVID-19 se realiza el 11 de marzo por la confirmación de tres pacientes extranjeros y desde entonces el número de enfermos ha aumentado, con la particularidad de observarse, al igual que en otros países, poca frecuencia en la población infantil. Disponemos aún de limitada literatura publicada específica para la población pediátrica, de ahí, que este artículo busca revisar factores epidemiológicos, sintomatología, diagnóstico y tratamiento de la enfermedad en la edad pediátrica.
Métodos
Se realizó una revisión de la literatura utilizando la base de datos PubMed y en forma complementaria mediante la plataforma Google, para identificar artículos relevantes en idioma inglés, publicados hasta el 30 de abril del año 2020, para informes de casos o informes de series de casos, datos de laboratorio en niños sintomáticos o asintomáticos y adolescentes (0-≤19 años de edad). Se utilizaron las palabras claves "coronavirus, COVID-19, SARS-CoV-2, pediatría, recién nacidos, lactantes, niños, y adolescentes". Los artículos se seleccionaron por título, resumen y texto completo, todos ellos de procedencia asiática. Si un artículo informaba datos de laboratorio en niños y adultos, se incluyeron solo si las fichas del caso pediátrico podían ser recuperados. Los autores revisaron de forma independiente los títulos y resúmenes para inclusión. Se identificaron artículos notables adicionales de la revisión de las citas bibliográficas.
Para este estudio se utilizó información de pacientes no identificados en bases de datos disponibles en publicaciones, por ello no se obtuvo el consentimiento informado ni se requirió su aprobación ética, por el contrario, se indica la autoría original de los artículos incluidos para acceder a la confirmación de los datos.
Resultados
Coronavirus
Los coronavirus (CoV) se encuentran muy distribuidos en la naturaleza, tienen la propiedad de infectar a los seres humanos, mamíferos y aves, situación que les permite desarrollar enfermedades que afectan a los distintos órganos y sistemas,5) en forma individual o brotes, entre ellas se destacan las pandemias anteriores que ocasionaron el síndrome respiratorio agudo (SARS-CoV) en 2003, y síndrome del virus respiratorio del Oriente Medio (MERS-CoV) en el año 2012.10
La subfamilia de CoV se divide según su genotipo y serología en cuatro géneros: α, β, ɣ y δ CoV. El β-coronavirus se puede clasificar además en cuatro linajes virales (A‐D). Hay casi 30 CoV reconocidos que infectan a humanos, mamíferos, aves y otros animales; su nombre es derivado de la característica apariencia de corona que muestra al observarse bajo microscopia electrónica.3
Los CoV son genomas de virus de ARN monocatenarios con sentido positivo, no segmentados y envueltos en un tamaño que varía de 26 a 32 kilobases, el mayor genoma de ARN viral conocido. El virión tiene una núcleo-cápsula compuesta de ARN genómico y proteína de nucleocápsula (N) fosforilada, que está encerrada dentro de las bicapas de fosfolípidos y cubierta por dos tipos diferentes de proteínas de espiga: glucoproteína (S) que se puede encontrar en todos los CoV y la hemaglutinina-esterasa (HE) que existe en algunos CoV (Fig.). La proteína de membrana (M) (una glicoproteína transmembrana de tipo III) y la proteína de la envoltura (E) se encuentra entre las proteínas S del virus.11)
 Fuente: Li G y otros.2
Fuente: Li G y otros.2
Fig Partícula de coronavirus. Los coronavirus son virus envueltos que contienen una cadena de ARN de polaridad positiva de entre 26 a 32 kilobases de longitud. El virion está cubierto por una nucleocápsida de proteínas fosforiladas (N), una bicapa fosfolipídica y por estructuras que sobresalen de glicoproteínas (S). La glicoproteína de membrana (M) y la proteína de envoltura (E) están localizadas entre las proteínas (S) en la envoltura del virus.
El virus comienza su replicación mediante el acoplamiento de su proteína S en los receptores AC2 situados en la superficie celular, este consiste en una enzima convertidora de la angiotensina e ingresan a la célula a través de una vía endosómica o no endosómica, más tarde, se libera la núcleo-cápsula y el ARN en el citoplasma. En fase posterior se sintetizan las enzimas que participan en la transcripción y replicación del virus, se producen copias ARN de sentido negativo, por medio de ARN subgenómicos lo cual genera proteínas estructurales que en época posterior serán ensambladas. Una vez realizada estas acciones se liberan al espacio extracelular entre 10 000 y 100 000 viriones a través de exocitosis.5
La proteína E es responsable del ensamblaje de los nuevos viriones en el retículo endoplásmico rugo-complejo de Golgi, los que unidos a otras proteínas accesorias, conducen a la aparición de canales llamados virioporos. Estos orificios contribuyen al desequilibrio de iones entre ambos lados de la membrana del retículo endoplasmático, que origina un proceso de apoptosis, autofagia y muerte celular .12
Epidemiología
Todas las edades son susceptibles. El virus se transmite mediante la inhalación de las denominadas gotas de Flügger, producidas por la tos y el estornudo y que pueden depositarse en alguna superficie, luego, cualquier persona puede tocar dicha superficie y tocar su boca, nariz u ojos. La mayor carga viral de los portadores se sitúa en la cavidad nasal en comparación con la faringe, independiente de poseer o no sintomatología.13) Existe un grupo de personas en la población que son asintomáticas, (hasta 80 %), también portan y diseminan el microorganismo, de esa forma intervienen en la propagación del agente patógeno.
La gotas infectadas se extienden a 1-2 metros, el virus permanece en superficies viables hasta 9 días en condiciones atmosféricas favorables,14) pero se destruye en menos de un minuto con desinfectantes comunes como el hipoclorito de sodio, solución alcohólica o peróxido de hidrógeno.3
Otra posibilidad de contaminación es la ruta fecal oral, aunque se necesitan más estudios para su comprobación.3) Las investigaciones realizadas en las heces fecales de los niños enfermos, muestran que permanecen positivas por más tiempo que la correspondiente a los adultos.15)
Es importante tener en cuenta que la transmisión hospitalaria en el personal de la salud puede ocurrir cerca de 29 % y en los pacientes hospitalizados alcanza 12,3 %. El período de incubación se calcula entre 2 y 14 días con un promedio de 7 días.5
La vía transplacentaria al feto en mujeres gestantes, que en el último trimestre han adquirido la infección, hasta el presente no ha sido descrita y es negativa la presencia del virus en muestras analizadas procedentes del líquido amniótico, sangre del cordón umbilical o leche materna, no obstante, se notifica r la enfermedad en recién nacidos, debido a la transmisión posnatal.16,17,18
El curso de una epidemia se define por una serie de factores clave, algunos de los cuales son poco conocidos para la COVID-19, entre ellos, el número de reproducción básico (R0), que define la cantidad media de contagios secundarios generados por un caso primario confirmado y estima la velocidad de expansión de cualquier enfermedad infecciosa. De acuerdo con la Organización Panamericana de la Salud (OPS), el R0 por sí solo no resulta una medida suficiente de la dinámica de las epidemias en grupos de población, pero si se analiza de manera cruzada con otros parámetros epidemiológicos, permite conocer las características de los brotes y preparar respuestas eficaces.7
En China el R0 se reportó en 2,5 personas en las primeras etapas de la epidemia mientras que los datos sobre la transmisión en niños son inciertos. El distanciamiento social tiende a reducir la transmisión en forma aproximada en 60 % y constituye la medida más eficaz para contener la transmisión. (19
Inmunopatogenia
Los mecanismos de defensa inespecíficos y específicos incluyen las barreras físicas; como la piel, las mucosas, la capa de moco, las células epiteliales ciliadas, los linfocitos asesinos naturales (NK del inglés natural killer), las células dendríticas y fagocíticas, el sistema de complemento así como los diferentes componentes del sistema inmunitario específico, representado por los linfocitos T y B.20
Estas últimas células son las únicas que tienen la capacidad de reconocer antígenos específicos y de expresar complejas moléculas en su superficie, denominadas grupos de diferenciación (CD, del inglés clusters of differentiation), proteínas que son sintetizadas por dichas estructuras e interactúan con las denominadas citosinas. Estas citosinas son sustancias secretadas por las propias células del sistema inmune, a las que se les ha dado una nomenclatura oficial como interleucinas, (IL) y se han clasificado en: citocinas implicadas en las respuestas inmunitarias naturales, citocinas reguladoras de linfocitos, citocinas hematopoyéticas, citocinas antiinflamatorias y proinflamatorias.20
En las etapas iniciales de cualquier infección, las estructuras virales son reconocidas por los receptores de reconocimiento de patrones (RRP). En el caso específico del COVID-19, este reconocimiento ocurre esencialmente mediante los receptores tipo toll 3 y 4 (TLR3 y TLR4) cuyo trabajo sinérgico parecen jugar un papel importante en la inmunopatogenia de la enfermedad.( )
Se ha descrito que el TLR3 se encuentra en el compartimiento endosomal de la célula y reconoce dobles cadenas de ARN; mientras que el TLR4 se encuentra en la membrana citoplasmática y reconoce lipopolisacáridos.21
La mayor parte de los receptores tipo toll desencadena una cascada de señales, la cual comúnmente depende de la proteína adaptadora MyD88 que termina en la formación del inflamosoma y producción de citocinas proinflamatorias. Sin embargo, el TLR3 utiliza una vía diferente mediada por la proteína adaptadora TIRF que termina en la producción de interferones y en la respuesta antiviral.22
En el COVID-19 ocurre algo interesante, es que presumiblemente el TLR3 tiene la capacidad de detectar la cadena simple de ARN viral, mientras que el TLR4 reconoce la proteína S, lo que desencadena una activación simultánea de las cascadas de señalización mediadas por MyD88 y TIRF, que concluye en la producción de citocinas proinflamatorias e interferones tipos I por las células infectadas.2
Esta activación sinérgica pudiera justificar la elevación de citocinas proinflamatorias, (tormenta de citocinas) que terminan dañando el tejido circulante por sobreactivación del sistema inmune. Por otro lado, el gen asociado a 3b parece estar asociado a la desregulación de la producción de interferones y la sobreproducción de citocinas proinflamatorias asociadas a las formas graves descritas.23
Diagnóstico
El diagnóstico de esta entidad descansa en tres pilares fundamentales: los hallazgos clínicos, los exámenes complementarios de laboratorios, tanto clínicos como microbiológicos, unidos a los antecedentes epidemiológicos explicados con anterioridad.
Características clínicas en niños
El comportamiento de los síntomas y signos clínicos de los pacientes pediátricos señalan que pueden mostrar una infección asintomática o presentar fiebre, tos seca, con síntomas localizados en las vías respiratorias superiores, dados por congestión y secreción nasal o disnea en caso de invasión al tracto respiratorio inferior, situación infrecuente. Otros enfermos exponen manifestaciones digestivas, que incluyen molestias abdominales, náuseas, vómitos, dolor y diarrea. La mayoría de los niños infectados tienen expresiones sintomáticas leves, y el pronóstico es bueno. La recuperación ocurren en una o dos semanas.11
En la tabla 1 se aborda una revisión de seis series de casos pediátricos con COVID-19 que suman un total de 99 pacientes, en ella se observa que la mayoría muestran una edad superior a los 5 años, salvo el reporte de Xia W y otros,24 donde el 85 % tiene una edad inferior. Hubo un predominio de los varones menos en los hallazgos de Cai y otros,25que describe mayor frecuencia en las hembras con 60 %.
Tabla 1 Características clínicas y exámenes complementarios de pacientes pediátricos según diferentes autores
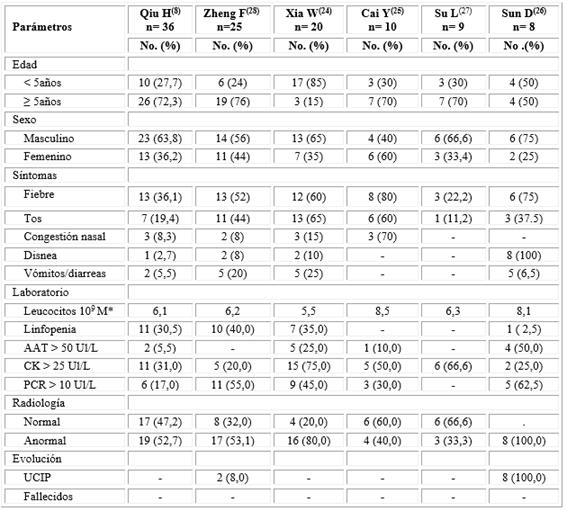
*M: mediana; AAT: alaninatransferasa; CK: creatininfosfoquinasa; PCR: proteina C reactiva; UCIP: unidad cuidados intensivos pediátricos; No.: número.
Los pacientes presentaron fiebre entre el 22 y 80 %, congestión nasal entre 8 y 70 % aunque hubo dos publicaciones en que este signo estuvo ausente. La tos varió desde el 11,2 hasta 60 % y la disnea fue descrita con menos frecuencia variando, desde 2,7 a 10 %. En el trabajo de Sun y otros,26 este signo alcanzó 100 % de los enfermos, pero dicho estudio abarcó a niños tratados enfermos todos en la UCIP, es decir, se realizó en pacientes con pronóstico grave, lo que debe de haber influido en la presencia de este signo.
Los síntomas digestivos representados por vómitos, diarreas o algias ocurrieron en un rango entre 5,5 y 25 % de los pacientes. No se registraron en estas series signos que traducen toma del sistema nervioso central, del aparato cardiovascular, manifestaciones dermatológicas o trastornos del olfato o gusto, lo cual puede deberse a no haber indagado con profundidad en estos aspectos.
De los 25 casos explicados por Zheng, solo 2 ingresaron en la UCIP, dato que no es comparable con la investigación de Sun,26) pues este autor en su casuística solo reportó pacientes graves, el resto de las series no informaron casos con este pronóstico. La evolución de los enfermos con COVID-19 es más benigna que los enfermos adultos, así en China según un informe publicado, con situación grave solo se observó en 2,5 % de la población infantil y fueron los menores de 3 años el grupo más vulnerable.29
La causa por lo cual la mayoría de los casos con la COVID-19 en pediatría tienen síntomas menos graves que los adultos, es sorprendente, pero puede estar relacionado tanto con la exposición como con los factores del huésped, entre los que se destacan:8,27,28,29,30
Los niños generalmente se encuentran bien atendidos en casa y pueden tener relativamente menos oportunidades de exponerse a patógenos o pacientes enfermos.
El número de receptores de ACE2 es inferior al número apreciado en adultos.
El sistema inmunitario en la edad infantil todavía se está desarrollando y puede responder a los patógenos de manera diferente.
Los menores rara vez tienen comorbilidades tales como hipertensión, enfermedad cardiovascular y diabetes.
Exámenes complementarios
Laboratorio clínico y radiológico
En los exámenes de laboratorio se observa en la tabla 1, con relación al aspecto hematológico que la media del conteo leucocitario varió de 5,5 ×109a 8,5 ×109, mientras que la linfopenia alcanzó cifras entre 2,5 y 40 %. Una revisión de 12 artículos que comprendieron 66 pacientes pediátricos expone recuento normal de leucocitos en 69,6 % de los pacientes mientras que e15,2 % presenta conteo aumentado, además plantea el artículo, que en los pacientes adultos, la leucocitosis y neutrofilia son comunes en enfermos con evolución desfavorable.31
El estudio enzimático es variable pues el aumento de la alaninatransferasa (AAT) transcurrió de 5,5 %8) a 50 %,26) además, otros autores, no describen alteraciones de este indicador parámetro.27,28) La creatininfosfoquinasa (CK) tiene presencia en todas las serie mencionadas con incrementos que oscilan entre entre 20 y 75 % de los pacientes examinados.
La AAT es expresión de daño hepático y la CK de injuria muscular,32) que puede comprender al miocardio sin ser tan específica como la troponina, no obstante, en las series analizadas, no hubo reportes de síntomas de miocarditis y los autores no mencionan haber realizado electrocardiogramas o ecocardiografias en las series estudiadas.
La determinación de la proteína C reactiva (PCR), marcador de proceso inflamatorio, arrojó valores entre el 17 y el 62,5 %, y para algunos autores en los niños pudiera ser un indicador de coinfección bacteriana.31
Qiu y otros,8describen que las variables que se asociaron significativamente con la gravedad de COVID-19 en niños, estuvieron representadas por la disminución de los linfocitos, temperatura corporal elevada y altos niveles de procalcitonina, dímero D y CK, aunque no existe claridad sobre la presencia de un biomarcador común en niños, para predecir el pronóstico de gravedad.33
La radiografía de tórax simple ofrece pocos signos anormales en las estructuras que conforman el aparato respiratorio, no así en la tomografía axial computarizada, la cual muestra con mayor frecuencia infiltrados irregulares en forma de cristal esmerilado sin que en algún caso aparezca de derrame pleural, linfoadenopatias, colapso lobular, neumotórax o derrame en niños con COVID-19.33
Exámenes microbiológicos
El diagnóstico microbiológico rápido es decisivo en las enfermedades infecciosas que producen brotes, epidemias o pandemias, su precisión permite a las autoridades políticas y de salud realizar una adecuada vigilancia para determinar el agente etiológico circulante, y tomar medidas encaminadas al control de la transmisión mediante el aislamiento de casos confirmados por laboratorio y sus contactos cercanos en cuarentena para influir con carácter positivo en la situación epidemiológica de una región o país.
Por las características del presente trabajo solo nos limitaremos a señalar cuales son los tipos de diagnóstico de laboratorio microbiológico que se pueden hacer sin entrar en detalles. Estos son:
Detectar el material genético del virus.
Revelar los anticuerpos que neutralizan las partículas virales de interés.
Mostrar los epítopos virales de interés con anticuerpos (pruebas serológicas).
Cultivar y aislar partículas virales viables.34
Ahora bien, es conveniente tener presente que, si las pruebas positivas para la COVID19 son útiles, las pruebas negativas deben interpretarse con precaución, y se ha de tener en cuenta los antecedentes epidemiológicos, las enfermedades previas y el cuadro clínico mostrado por cada paciente en particular, que permita tomar una conducta con menor riesgo para el enfermo y su comunidad.35
Tratamiento
No existe un tratamiento antiviral específico recomendado para COVID-19, actualmente no hay vacuna disponible. La terapéutica es sintomática, el paracetamol debe tomarse como antipirético de primera línea y el ibuprofeno solo debe ser prescripto con precaución.33
La oxigenoterapia representa la principal intervención de tratamiento para pacientes con infección grave. La ventilación mecánica puede ser necesaria en casos de insuficiencia respiratoria refractaria a la administración de oxígeno, mientras que el soporte hemodinámico es esencial para controlar la presencia del shock.6
Antivirales
Lopinavir-Ritonavir
En la tabla 2 se aprecian los distintos fármacos utilizados en los variados ensayos clínicos.
La combinación de retrovirales en la serie descrita por Qiu y otros,8 fue utilizada al ingreso, además de emplear interferón alfa (IFNα) por aerosolización dos veces al día; 14 pacientes (39 %) recibieron jarabe de lopinavir-ritonavir en igual frecuencia, y seis (17 %) necesitaron inhalación de oxígeno. La duración media de la fiebre fue de 3 días (DE ±2), con mejoría del proceso neumónico entre 4 a 10 días después del inicio del tratamiento. El resultado de RT-PCR (Retro Transcriptasa Reacción en Cadena de la Polimerasa, o PCR en tiempo real) de SARS-CoV-2 se volvió negativo después de una media de 10 días (DE±2) de iniciada la terapéutica, independiente del cuadro clínico inicial. Los efectos secundarios de la administración de esta combinación de fármacos son nauseas, vómitos y dolor abdominal.36
Remdesivir
El primer uso clínico de remdesivir fue para el tratamiento del ébola y se han publicado informes de casos exitosos que describen su aplicación en la COVID-19, no se encuentra aprobado su uso en pacientes menores de 18 años y enfermas embarazadas, salvo el argumento de “uso compasivo”.37
Rivabirina
Se ha utilizado con anterioridad en pacientes pediátricos con bronquiolitis, causa toxicidad hematológica importante dependiente de su concentración en sangre. Las altas dosis utilizadas en los ensayos de SARS resultaron en anemia hemolítica en más del 60 % de los enfermos. La ribavirina también es un conocido teratógeno y está contraindicado en el embarazo.38
Se discute a cuáles niños debe estar dirigido el empleo de sustancias antivirales en vista de la alta proporción de contactos infectados asintomáticos.( ) No obstante, la experiencia de su uso según los distintos protocolos, aclarará la conveniencia de su empleo.
Interferones
Los interferones (IFN) activan las células epiteliales y reducen la acción proinflamatoria mediada por macrófagos mononucleares, además de inhibir el reclutamiento de neutrófilos a los sitios de inflamación. La administración temprana de IFN, (IFNα solo o asociado a IFNλ) tiene ciertos beneficios en la reducción de la carga viral y mejora los síntomas clínicos de los pacientes, aunque se discute su acción en reducir las tasas de mortalidad. Se ha utilizado en los protocolos aprobados en China 39) y en Cuba,40) mientras que en España41señalan que no está disponible en el momento actual y se ha eliminado la posibilidad de administración con esta indicación.
Cloroquina/hidroxicloroquina
La indicación de este fármaco antipalúdico se basa en que inhibe la producción y liberación del factor de necrosis tumoral e interleucina 6 (TNF e IL-6). Se ha empleado en adultos en China con efectos beneficiosos porque inhibe el desarrollo de la tormenta de citocinas.42) Otros autores informan que la adición de azitromicina posibilita un aclaramiento viral numéricamente superior en comparación con la monoterapia con hidroxicloroquina, sin embargo se describe que esta combinación puede potenciar el efecto de prolongar el intervalo QT por la interacción farmacológica, lo que está considerado de alto riesgo.43) En los niños, es poco probable que tenga un beneficio clínico significativo cuando se administra de forma rutinaria, pero puede considerarse en el raro caso de ingreso en la UCIP.33
Tocilizumab
Este medicamento es un antagonista de IL-6 que suprime la función del sistema inmune y se indica en enfermedades clasificadas con este rubro, semejante al interferón incide en truncar la tormenta de citocinas inducida por la infección.44
Inmunoglobulinas
La utilización de plasma de convalecientes se ha indicado con la justificación de que los anticuerpos de pacientes recuperados pueden ayudar tanto al aclaramiento de los virus libres como el de las células inmunitarias infectadas. En teoría, los beneficios de esta terapia, sería más provechosa en los primeros 7 a 10 días de infección, cuando la viremia está en su punto máximo y la respuesta de la inmunidad primaria aún no ha ocurrido. Shen C45relata en su investigación sobre 5 pacientes adultos críticos, en los que la temperatura corporal se normalizó al tercer día, en 4 enfermos la carga viral despareció a los 12 días de tratamiento al igual que la insuficiencia respiratoria presentada. También se ha reportado el uso de inmunoglobulina intravenosa.
Esteroides
La justificación del uso de esteroides en los pacientes con COVID-19 es disminuir la respuesta inflamatoria en los pulmones del huésped, lo cual previene el síndrome de distrés respiratorio agudo (SDRA), pero debe tenerse en cuenta sus efectos adversos, pues la disminución de la respuesta inmunológica pudiera implicar una mayor predisposición a las infecciones bacterianas así como una disminución en el aclaramiento de la carga viral. En un estudio se encontró que entre los pacientes con SDRA, el tratamiento con metilprednisolona disminuyó el riesgo de muerte (OR 0,38; IC 95%, 0,20-0,72).46
Ivermectina
La ivermectina es un antiparasitario de amplio espectro. Estudios de laboratorio han confirmado que es capaz de inhibir el crecimiento del virus SARS-CoV-2 en cultivos celulares Vero-hSLAM infectados en el orden de 5000 veces el ARN viral a las 48 horas de aplicado.47 Esta sustancia constituyó el centro de un ensayo clínico de fase III en Tailandia en realizado entre 2014-2017, contra la infección por virus del dengue. Se apreció que una sola dosis oral diaria era segura, y dio como resultado una reducción significativa en las concentraciones séricas de proteína viral NS1, pero no hubo cambios de la viremia o se obtuvo algún beneficio clínico.47
Otros medicamentos
Existen varios productos biológicos propuestos para su empleo: células madre de sangre uterina, células mononucleares o madres del cordón umbilical, y proteína recombinante derivada del gen de citosina.48
La terapéutica con medicina natural y tradicional se encuentra entra las modalidades aparecidas en algunos ensayos clínicos, así en China existen 22 protocolos de registro clínico bajo este rubro, consistentes en compuestos a base de hierbas entre los que se incluyen Feiyanyihao, Qingfeijiedutang, y Xinguanyihao, cuyos ingredientes poseen propiedades antivirales.48
En Cuba, desde una fase temprana se ha preconizado para la prevención de esta afección, el empleo de medicamentos homeopáticos, modalidad autorizada por la OMS y regida su implementación bajo protocolo de la Autoridad Reguladora cubana, Centro para el Control Estatal de Medicamentos y Dispositivos Médicos (CECMED), con un remedio denominado PrevengHo®Vir49) así como otras sustancias utilizadas en fitoterapia y como apifármacos.
Tabla 2 Relación de algunos medicamentos empleados o propuestos para el tratamiento farmacológico de la enfermedad por coronavirus
| Medicamento | Mecanismo acción | Estudio |
|---|---|---|
| Lopinavir/ ritonavir (kaletra®) | Inhibición de 3-quimiotripsina proteasa | Qiu H, Wu J, Hong L, Luo Y, Song Q, Chen D.8 |
| Randesivir | Inhibe la enzima polimerasa RNA | Holshue ML, De Bolt C, Lindquist S, Lofy KH, Wiesman J, |
| Ribavirina | Idem | Kelvin AA, Halperin S.36 |
| Interferones | Activa células epiteliales y reduce la actividad proinflamatoria | National Health Commission and State Administration of Traditional Chinese Medicine.39 |
| Cloroquima | Inhibe la producción y liberación de TNF e IL-6 | Gao J, Tian Z, Yang X.42 |
| Sarilumab/eculizumab Tocilizumab | Antagonista IL-6 suprime la función del sistema inmune | Fu B, Xu X, Wei H.44 |
| Inmunoglobulinas Plasma convaleciente | Ayuda al aclaramiento viral y a las células inmunitarias infectadas | Shen C y otros.45 |
| Esteroides | Disminuye la respuesta inflamatorio, en especial en los pulmones | Wu C, Chen X, Cai Y, Zhou X, Xu S, Huang H, |
| Ivermectina | Inhibidor de la replicación viral |
Caly L y otros.25 |
Consideraciones finales
Los datos actuales indican que los niños son tan susceptibles a la COVID-19 como los adultos, se desconoce la frecuencia de transmisión por mostrar la mayoría de ellos la forma asintomática, mientras que las presentaciones clínicas se acompañan de síntomas respiratorios y digestivos con una evolución más favorable en este grupo de edad. Los estudios presentes indican que las citocinas poseen un papel importante en la fisiopatología de las lesiones en órganos y sistemas, estando dirigido el tratamiento curativo al empleo de fármacos con acción antiviral y aquellos que intervienen en la modulación de la respuesta inmune, según los estudios derivados en diversos ensayos clínicos. Las medidas profilácticas encaminadas a controlar la infección, se enmarcan en la detección precoz de casos infectados mediante el empleo de análisis de laboratorio microbiológicos que demuestran la presencia del virus SARS-CoV-2, retraimiento de los casos positivos y sus contactos, así como el aislamiento social de la población.
El presente estudio, por consideración de sus autores, posee limitaciones dadas en que las series de pacientes analizadas son relativamente pequeñas, por lo cual los resultados deben ser contrastados, con estudios prospectivos controlados, con mayor número de enfermos, no obstante, trabajamos en el intento de proporcionar una actualización dirigida al profesional que labora en pediatría.














