Introducción
La función tubular reúne varias actividades imprescindibles para el organismo, entre ellas, la homeostasis del agua, los electrolitos y el equilibro ácido-básico.1,2) El sistema tubular renal complementa las funciones del aparato glomerular y asegura la constancia del medio interno mediante la producción de una orina con propiedades físicas y químicas adecuadas.3) Por consiguiente, el examen de la función tubular es indispensable ante cualquier sospecha de trastornos hidroelectrolíticos y ácido-básicos, daño renal agudo, expulsión de cálculos, e infecciones recurrentes, entre otras entidades.4,5,6) Sin embargo, y antes de considerar como anómalas las cantidades que se pierden en la orina de una sustancia, es necesario conocer la situación de su balance corporal. Una eliminación aumentada de la sustancia en cuestión puede corresponder a una respuesta renal ante una sobrecarga o a una diuresis de solutos o a la acción de un fármaco o, por el contrario, ser secundaria a alteraciones intrínsecas del propio sistema tubular.
El estudio del aparato renal ha descansado históricamente sobre la colección de 24 horas de orina.7) Las insuficiencias de los métodos de estudio de la función renal basados en la colección de 24 horas han sido documentadas extensamente.8,9 Como alternativa, los autores de la presente comunicación han elaborado modelos estadístico-matemáticos para el estudio de la excreción urinaria de sustancias de interés diagnóstico que se basan en el examen de una muestra matutina de orina.10) Estos modelos se han extendido al estudio de sustancias de interés clínico como las proteínas, los minerales, y los cuerpos azoados.11,12,13,14) Es posible lograr una exactitud analítica y una concordancia diagnóstica mayor que 80,0 % con el uso de estos modelos: suficiente para un estudio integral de la función renal.
Los métodos de estudio de la función renal mediante el ensayo de muestras matutinas de orina así establecidos y validados se emplearon entonces para estimar la frecuencia de ocurrencia de diferentes síndromes tubulares entre los niños y adolescentes, de ahí que el objetivo del estudio es describir las tubulopatías diagnosticadas en niños y adolescentes después del ensayo de muestras matutinas de orina.
Métodos
Locación del estudio
Laboratorio de Estudios de la Función Renal (LEFR), Servicio de Laboratorio Clínico, Hospital Pediátrico Docente “Juan Manuel Márquez”. La Habana, Cuba.
Diseño del estudio
Retrospectivo, analítico. De los registros del LEFR se obtuvieron los datos sociodemográficos (sexo y edad), clínicos (diagnóstico presuntivo), antropométricos (talla en centímetro y peso corporal en kilogramo) y bioquímicos (analitos de interés diagnóstico presente en sangre y orina) de niños y adolescentes atendidos consecutivamente en LEFR en respuesta a pedidos de estudio de la función tubular de los equipos básicos de trabajo del Hospital Pediátrico Docente. El perfil bioquímico completado en cada niño/ adolescente comprendió las determinaciones hechas tanto en muestras de sangre venosa obtenidas después de una noche de ayuno, como en muestras matutinas de orina. Los registros del LEFR almacenan los datos de niños y adolescentes atendidos entre los años 2008-2019.15
En consecuencia, se incluyeron en la serie de estudio los niños y adolescentes en los que se completó un estudio de la función tubular, y en los que se recuperaron los datos requeridos para el diagnóstico del estado del aparato tubular. Por complementariedad, se excluyeron los niños y adolescentes en los que no se recuperaron los datos requeridos para el estudio de una presunta tubulopatía. También se excluyeron de la presente serie de estudio los niños y adolescentes que fueron atendidos en el LEFR por diagnósticos diferentes de las tubulopatías.
Las ecuaciones empleadas en los cálculos están incluidas dentro de la aplicación NEFROCALC construida sobre ACCESS para OFFICE de WINDOWS (Redmon, Virginia, EE. UU.).15 El filtrado glomerular se estimó indistintamente de las ecuaciones de Schwartz,16Hoste17 y otros, basadas en la creatinina sérica, o de las de Zapitelli,18Pottel19 y otros, para la cistatina.
El aclaramiento osmolar (ml. minuto-1) y el aclaramiento de agua libre se estimaron según lo descrito previamente. (20) Para los minerales se calcularon los correspondientes índices de excreción.10) Los índices de excreción se convirtieron, a su vez, en estimados de la excreción diaria del mineral.10) En el caso de los electrolitos, se calculó la excreción fraccionada (EF) corregida para el índice de creatinina. Donde fuera meritorio para el ejercicio diagnóstico se calculó, además, la reabsorción tubular como la diferencia entre la EF de la sustancia y una excreción de 100 %. El gradiente transtubular de potasio (GTTK) se calculó siempre y cuando la osmolaridadorina> 300 mOsmol.L-1.
La extensión “Análisis de datos” de la aplicación EXCEL para OFFICE de WINDOWS (Redmon, Virginia, EE. UU.) se empleó en el procesamiento de los datos y el análisis estadístico-matemático de los resultados.A Los valores obtenidos de los diferentes indicadores empleados como descriptores de la función tubular se redujeron hasta estadígrafos de locación (media), dispersión (desviación estándar), y agregación (frecuencias absolutas o relativas, porcentajes) según fuera el tipo de la variable. Los valores estimados para cada indicador se contrastaron univariadamente con los correspondientes intervalos de referencia. Asimismo, los valores estimados de los indicadores de la función tubular se integraron dentro de las respectivas construcciones de caso de las tubulopatías de interés mediante sistemas de expertos que combinan criterios clínicos y bioquímicos.
Construcción de caso de los síndromes tubulares
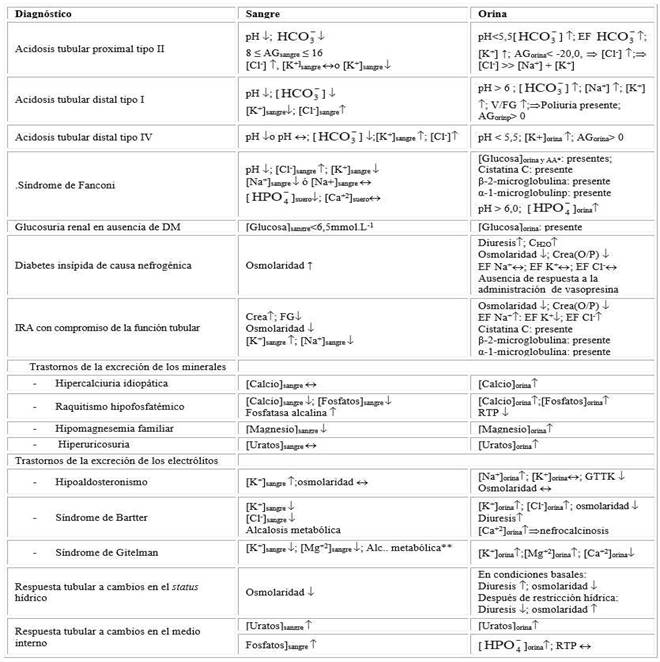
Los indicadores colectados en los niños y adolescentes examinados en el LEFR se emplearon en la construcción de caso de los diferentes síndromes tubulares. La tabla 1 muestra las reglas seguidas en la construcción de los casos.
Consideraciones éticas
La naturaleza de las acciones y servicios diagnósticos del LEFR implica el consentimiento de los padres/guardianes/custodios de los niños y adolescentes en la conducción de los procederes requeridos para el diagnóstico de la condición de salud del probando. El consentimiento se extiende hacia las garantías de confidencialidad, discreción y aseguramiento del anonimato en el tratamiento de los datos de todo tipo obtenido de los probandos.
El estudio completado y reseñado en esta publicación se corresponde con los objetivos de desarrollo e innovación del LEFR. Tales objetivos son del dominio público de la institución de pertenencia de los autores. Las propuestas de investigación e innovación del LEFR ha sido expuestas ante el Comité hospitalario de Investigaciones, y los resultados presentados en las correspondientes jornadas de temas terminados.
Resultados
La tabla 2 muestra las características demográficas, clínicas y antropométricas de los pacientes atendidos en el LEFR entre 2014-2019 por distintas causas de presunto daño tubular.
Se recuperaron los registros analíticos de 56 pacientes, los que representaron 0,5 % de los casos atendidos durante la misma ventana temporal. La serie de estudio se distribuyó uniformemente según el sexo. La edad promedio fue de 4,3 ( 5,5 años. Predominaron los niños con menos de 12 meses de vida extrauterina. Los niños con edades entre 1-5 años constituyeron el segundo grupo de edad más representado en la serie de estudio.
Tabla 2 Características demográficas y clínicas de los pacientes atendidos por distintas causas de presunto daño tubular. Se presentan el número y [entre corchetes] el porcentaje de niños incluidos en cada estrato de la característica correspondiente. En instancias selectas se colocan la media ( desviación estándar de la característica

Número de casos: 56.
De los 56 pacientes estudiados se obtuvieron 70 estudios de la función tubular. Se hace notar que algunos de los pacientes fueron estudiados en el LEFR en momentos separados en años diferentes.
La poliuria (16,1 %) de los casos, la afectación del desarrollo pondo-estatural (14,3 %), la acidosis metabólica de causa diversa (10,7 %) y la infección urinaria recurrente (7,1 %) fueron las causas más frecuentes de estudio de la función tubular.
Otros 13 pacientes fueron atendidos en el LEFR por causas diversas que recorrieron desde la acidosis tubular y la aminoaciduria hasta la hematuria persistente y la hiperfosfatemia. En la quinta parte de los niños estudiados no se dispuso de un diagnóstico presuntivo en el momento del examen de la función tubular. Las edades extremas de los niños atendidos se tradujeron en valores también extremos de las características antropométricas: talla: 46,0 - 76.0 cm; peso corporal: 2,3 - 82,0 kg; índice de masa corporal: 9,3 - 28,3 kg.m-2 y superficie corporal: 0,2 - 2,0 m2; respectivamente (rango de las observaciones). La serie de estudio fue afectada por la doble carga de morbilidad nutricional: desnutrición: 26,8 % vs. exceso de peso: 10,7 %.
La tabla 3 muestra el estado de las variables indicadoras de la función renal que fueron determinadas en la sangre del sujeto. En el 47,1 % de las instancias se observó un pH < 7,4. Los valores promedio de pCO2 reflejaron la fuente venosa de la muestra de sangre obtenida para las determinaciones. Ello explicaría (en parte) que la mitad más uno de las determinaciones de pCO2 fueran (35 mm Hg. Sin embargo, en poco más de la tercera parte de las instancias concurrieron un pH < 7,4 junto con una PCO2(35 mm Hg.
La osmolaridad sanguínea promedio fue de 287,7 ( 13,6 mOsm.L-1, con valores extremos entre 258,0 - 333,4 mOsm.L-1. El AG (del inglés anion gap = brecha aniónica) sanguíneo promedio fue de 17,6 ( 7,6, con valores extremos entre 2,5 y 61,7. La cuarta parte de los valores calculados del AG sanguíneo quedó incluida dentro del rango de la normalidad biológica.
Los valores promedio de Na+ sérico fueron de 140,8 ( 5,9 mmol.L-1. El 11,4 % de los valores determinados de Na+ fueron menores de 135 mmol.L-1. Por su parte, los valores promedio del K+ sérico fueron de 4,5 ( 0,9 mmol.L-1. El 10,0 % de las determinaciones de K+ fueron menores de 3,5 mmol.L-1, mientras que otra cantidad similar fue mayor que los 5,5 mmol.L-1. Los valores promedio de calcio sérico fueron de 2,3 ( 0,5 mmol.L-1. La tercera parte de las determinaciones de calcio sérico fueron mayores de 2,5 mmol.L-1.
Los valores promedio de creatinina sérica fueron de 50,9 ( 31,7 (mol.L-1, mientras que los de la cistatina C sérica fueron de 1,1 ( 0,7 mg.L-1. Los estimados del filtrado glomerular fueron independientes del analito de referencia: FG estimado a partir de la creatinina sérica: 88,3 ( 30,5 mL.minuto-1 vs. FG estimado a partir de la cistatina C sérica: 82,0 ( 32,4 30,5 mL.minuto-1 (p > 0,05; test t-Student para muestras independientes). Asimismo, el número de sujetos con un eFG< 60 mL.minuto-1 fue independiente del analito de referencia: FG estimado a partir de la creatinina sérica: 14,3 % vs. FG estimado a partir de la cistatina C sérica: 11,4 % (( = + 2,9 %; p > 0,05; test de comparación de proporciones independientes).
Tabla 3 Indicadores hematológicos de la función renal de los pacientes atendidos por distintas causas de presunto daño tubular. Se presentan la media ( desviación estándar del indicador hematológico. En instancias selectas se colocan el número y [entre corchetes] el porcentaje de las determinaciones que quedaron incluidas en cada estrato del indicador en cuestión.

AG: Anion-gap; número de registros: 70.
La tabla 4 muestra el estado de las variables indicadoras determinadas en la orina del sujeto. El pH urinario promedio fue de 6,2 ( 0,7, con valores extremos entre 4,9-7,8.
Tabla 4 Indicadores urinarios de la función renal de los pacientes atendidos por distintas causas de presunto daño tubular. Se presentan la media ( desviación estándar del indicador urinario. En instancias selectas se colocan el número y [entre corchetes] el porcentaje de las determinaciones que quedaron incluidas en cada estrato del indicador en cuestión.

AG: Anion-gap; Número de registros: 70.
*Solo calculado para valores de osmolaridad> 300 mOsm.L-1.
La tercera parte de los valores del pH fueron < 6,0. La densidad urinaria promedio fue de 1,013 ( 0,008.
La tercera parte de las muestras ensayadas de orina tuvo una densidad< 1,010. Por su parte, la osmolaridad urinaria promedio fue de 495,8 ( 288,4 mOsm.L-1.
Las tres cuartas partes de las muestras ensayadas de orina tuvieron una Osm> 300 mOsm.L-1. El GTTK en estas muestras fue de 4,6 ( 3,2. Casi la mitad de estas muestras tuvo un GTTK< 4.
El AG urinario promedio fue de +2,5 ( 33,4; como corresponde a la esperanza biológica. Los valores extremos del AG urinario fueron como sigue: AG< -20: 15,7 % vs. AG> 0: 55,7 %. La acidez titulable promedio de las muestras de orina fue de 21,7 ( 17,4, con valores extremos entre 0,0 - 72,1.
La excreción fraccional de los electrólitos y minerales fue como sigue: Magnesio: 5,8 ( 6,8 %; Sodio: 1,3 ( 2,4 %; Cloro: 2,1 ( 3,1 %; Potasio: 13,8 ( 12,4 %; y Fosfatos: 16,4 ( 17,4 %; respectivamente. Los estados de excreción fraccionada aumentada de los electrólitos y minerales se comportaron como sigue: Magnesio: EF> 2,0 %: 44,3 %; Sodio: EF> 1,0 %: 34,3 %; Cloro: EF> 1,1 %: 50,0 %; Potasio: EF> 11,7 %: 42,9 %; y Fosfatos: EF> 12,2 %: 74,3 %: respectivamente. La RTP promedio fue de 83,8 ( 17,2 %. La tercera parte de los valores de la RTP fue menor de 87,8 %.
Por su parte, la excreción urinaria de los minerales fue como sigue: calciuria 24 horas: 4,5 ( 6,6 mg.kg-1.24 horas-1; fosfaturia de 24 horas: 21,9 ( 16,4 mg.kg-1.24 horas-1; uricosuria de 24 horas: 17,5 ( 11,2 mg.kg-1.24 horas-1 y magnesuria de 24 horas: 2,9 ( 3,4 mg.kg-1.24 horas-1; respectivamente. Los estados alterados de la excreción urinaria de los minerales anteriormente expuestos se comportaron como sigue: calciuria 24 horas> 4,0 mg.kg-1.24 horas-1: 32,9 %; fosfaturia 24 horas> 17,0 mg.kg-1.24 horas-1: 47,1 %; uricosuria 24 horas> 15,5 mg.kg-1.24 horas-1: 70,0 %; y magnesuria 24 horas> 2,0 mg.kg-1.24 horas-1: 34,3 %; respectivamente.
Finalmente, la tabla 5 muestra los diagnósticos hechos a la conclusión de los estudios mostrados en este trabajo. La función tubular estaba conservada en 41,1 % de los niños y adolescentes estudiados. Los hallazgos encontrados en otros dos niños se explicaron por la inmadurez presente del sistema tubular.
La hipercalciuria idiopática fue el diagnóstico más frecuente en la serie de estudio, y se presentó en e16,0 % de los niños y adolescentes examinados.
En uno de estos casos la hipercalciuria idiopática había progresado hasta la nefrocalcinosis y la enfermedad renal crónica (ERC).
La diabetes insípida de causa nefrogénica (8,9 % de los casos) y la IRA (5,3 %) fueron los otros dos diagnósticos más frecuentes en la serie de estudio.
Finalmente, en 14 de los niños y adolescentes examinados en este trabajo se diagnosticaron 10 causas de daño tubular que recorrieron desde el raquitismo carencial, la hipofosfatasia, la enfermedad de Leigh, el síndrome de Bartter y la enfermedad de Dent hasta los cuadros I, II y IV de la acidosis tubular.
Tabla 5 Diagnósticos hechos en los niños y adolescentes atendidos a la conclusión de los estudios de la función tubular.

IRA: insuficiencia renal aguda; ERC: enfermedad renal crónica; §raquitismo no carencial ligado al cromosoma X; **secundaria a la presencia
de una valva uretral posterior;1) ***secundaria a diarreas agudas,1 concurrente con hiperamonemia de causa no esclarecida; β progresión hacia
la nefrocalcinosis;1¥ nefritis túbulo-intersticial secundaria a la enfermedad de Sjögren,1) hipoplasia renal bilateral,1) ERC descompensada.1
Número de casos: 56.
Discusión
El sistema tubular renal es esencial en la preservación de la constancia del medio interno y la regulación de la excreción urinaria de electrolitos y minerales. En cumplimiento de tal objetivo, este trabajo ha presentado un sistema procedural para el estudio de la función tubular en niños y adolescentes. El sistema procedural expuesto en este artículo combina la determinación de diferentes analitos en sangre y orina, el ensayo de muestras matutinas de orina, y un sistema informático para la captación y el tratamiento matemático de los resultados, a fin de identificar las situaciones de disfunción tubular que se puedan presentar en estas subpoblaciones. El sistema procedural descrito permite, al final de un día de trabajo, la realización de una evaluación exhaustiva, integral y sistemática de la función tubular renal, y con ello, la asignación del paciente a cualquiera de los diferentes síndromes tubulares preexistentes; lo que ciertamente haría más expedito el diagnóstico médico y la intervención terapéutica.
Las edades pediátricas constituyen una población demandante de estudios de la función tubular debido a sus posibles afectaciones a causa de la inmadurez o la presencia de daños congénitos/adquiridos. Como prueba de ello, se identificaron 33 casos de disfunción tubular entre los 56 pacientes estudiados que recorrieron desde la acidosis tubular en sus distintas formas hasta la insuficiencia renal aguda.
Las consideraciones hechas en este trabajo en torno al estudio de la función renal en recién nacidos, lactantes niños y adolescentes refuerzan lo necesario que es disponer de la mayor suma posible de información preanalítica, así como de asegurar la calidad de los procedimientos analíticos empleados en las determinaciones de las sustancias de interés, a fin de emitir conclusiones diagnósticas que sean congruentes con la sintomatología encontrada en el niño a estudiar.
La hipercalciuria idiopática constituyó el diagnóstico prevalente en la presente serie de estudio, corroborando los hallazgos de una publicación previa.12) La hipercalciuria idiopática denota la excreción urinaria aumentada del mineral concurrente con cifras séricas preservadas.21) La hipercalciuria idiopática podría explicarse por el aumento de la eliminación urinaria del mineral ante una mayor actividad ósea resortiva o una absorción intestinal incrementada.21) Se ha descrito una forma renal de la hipercalciuria idiopática dada por defectos de la reabsorción del mineral en toda la extensión del túbulo renal, junto con invarianza del pH urinario tras estímulo con furosemida.22) Se ha de notar que la hipercalciuria idiopática había progresado hasta la nefrocalcinosis en uno de los niños afectados por esta condición.
La diabetes insípida de causa nefrogénica fue el segundo diagnóstico en orden de frecuencia en la presente serie de estudio.23La poliuria es el signo distintivo de la diabetes insípida, pero a diferencia de la forma central, en la de causa nefrogénica no se observa respuesta a la vasopresina exógena debido a la ausencia de los canales de acuoporinas en la porción distal del túbulo colector.24
El raquitismo fue otro de los diagnósticos prevalentes en la serie de estudio. El raquitismo sobreviene de defectos de la deposición ósea de calcio y fósforo secundarios a ingresos insuficientes o absorción intestinal disminuida de los minerales en cuestión.25,26) En tales condiciones, se estimula la actividad resortiva ósea, y las cantidades liberadas de calcio y fósforo se excretan en la orina. El fenotipo bioquímico se distingue entonces por las cifras séricas disminuidas de calcio y fósforo que concurren con excreción urinaria aumentada en niños atendidos por retraso pondo-estatural.
En este punto se debe hacer notar la identificación en la serie de estudio de un caso de la enfermedad de Dent. La enfermedad de Dent ha sido reconocida como causa de un raquitismo no carencial asociado a hipofosfatemia familiar ligada al cromosoma X.27) La enfermedad de Dent es causada por mutaciones genéticas de las proteínas que constituyen los canales de cloro activados por cambios en el voltaje a nivel del túbulo renal proximal. La enfermedad de Dent debería incluirse en el diagnóstico diferencial de la hipercalciuria idiopática, y tenida en cuenta como causa del síndrome de Fanconi.28,29
Seis niños se diagnosticaron en la presente serie de estudio con IRA de diversa topografía. Tres de ellos mostraron una IRA de causa renal secundaria a una enfermedad renal crónica preexistente (y ahora descompensada), una hipoplasia renal bilateral (que fue diagnosticada en la institución de pertenencia de los autores a la par que se conducían los estudios de la función tubular), y una nefritis túbulo-intersticial aguda que se manifestó durante el curso de un síndrome de Sjögren; respectivamente. El cuarto de los niños desarrolló una IRA posrenal en ocasión de una valva de la uretra posterior que conllevó a la acción quirúrgica. El quinto caso fue diagnosticado con una IRA prerrenal secundaria a un cuadro diarreico agudo. Por último, el sexto de estos casos desarrolló un cuadro agudo de insuficiencia renal en el transcurso de una hiperamonemia de presunta causa metabólica.
Los tipos I, II y IV de la acidosis tubular se presentaron en 5 de los niños estudiados. La acidosis tubular tipo I (también denominada distal) es causada por afectación de la acidificación de la orina a nivel del túbulo distal y se manifiesta por la incapacidad del riñón de disminuir máximamente el pH urinario cuando se presenta una acidosis sistémica mediante la excreción compensatoria de iones H+.30,31
Por el contrario, la acidosis tubular tipo II (proximal) es causada por el daño en la reabsorción de HCO3- en el túbulo proximal, mientras los mecanismos de la acidificación distal están conservados.31,32,33) Se produce entonces la pérdida incontrolada del anión. No obstante, el daño aislado de la reabsorción proximal de HCO3- es de rara ocurrencia, y la acidosis tubular II suele acompañar a un gran número de otros cuadros clínicos (como el síndrome de Fanconi) e intoxicaciones por medicamentos.33) Los niños afectados pueden mostrar retraso pondo-estatural: razón que justifica el pedido de estudio de la función tubular renal.
Por su parte, el defecto de la acidificación de la orina en la acidosis tubular tipo IV (hipercaliémica) radica en la afectación de la amoniogénesis, y con ello, la excreción disminuida de NH4 +.31,33) Los defectos de la producción y excreción renal de NH4 + concurren con aumento de las concentraciones séricas de potasio, lo que apuntaría hacia la coexistencia de estados alterados de la producción y actividad de la hormona aldosterona.33
El síndrome de Bartter denota varias enfermedades renales que comparten la hipocalemia y la alcalosis metabólica.34) La hipocalemia puede explicar síntomas clínicos asociados como los cólicos abdominales y los calambres musculares.34,35) Los niños afectados suelen mostrar retraso pondo-estatural notable. La pérdida urinaria de potasio suele deberse a múltiples mutaciones genéticas de proteínas indispensables para el intercambio de electrólitos en la rama gruesa ascendente del asa de Henle.35,36) El síndrome de Bartter suele presentar desafíos diagnósticos respecto del síndrome de Gittelman.34,35,36
La enfermedad de Leigh ha sido descrita como una causa de encefalitis necrotizante en recién nacidos.37) El defecto molecular primario de la enfermedad de Leigh parece radicar en el complejo mitocondrial de la deshidrogenasa del ácido pirúvico.38) Como se ha descrito en otras enfermedades mitocondriales, la enfermedad de Leigh puede manifestarse a través de acidosis láctica, acidosis tubular renal, nefrocalcinosis, aminoaciduria e hiperuricemia;39,40) eventos estos que pueden culminar en una insuficiencia renal aguda cuya aparición puede hacer aún más compleja el tratamiento médico de tales pacientes.
El diagnóstico de hipofosfatasia fue hecho en un lactante que fallaba en prosperar y mostraba una nefrocalcinosis. La hipofosfatasia es una enfermedad causada por una actividad defectuosa/disminuida de la enzima fosfatasa alcalina (FAL), y que suele trazarse hasta mutaciones del gen ALPL.41,42
En dos de los casos estudiados el cuadro clínico-metabólico encontrado fue calificado como propio de la inmadurez del sistema tubular. En tal aspecto, se ha de reconocer que casi la mitad de los pedidos de examen de la función renal se originó de niños con edades entre 1 - 12 meses que se presentaron con falla en prosperar, trastornos del medio interno, acidosis metabólica, e incluso nefrocalcinosis. El riñón no ha culminado el desarrollo y diferenciación orgánicos en el momento del nacimiento, lo que se convierte en un importante factor de riesgo de enfermedad renal en niños prematuros o desnutridos intraútero.43 Las medidas de contención del daño encontrado, la regularización del medio interno, la intervención nutricional, y el reexamen de la función tubular suelen servir para confirmar este diagnóstico.
Es indudable que el estudio de la función tubular constituye un verdadero reto para el laboratorio clínico dadas las múltiples funciones del sistema tubular en el mantenimiento de la homeostasis del medio interno y la elaboración de una orina adecuada, entre otras funciones. Se ha de tener también en cuenta que las complejas funciones del sistema tubular se realizan sobre el producto de la filtración glomerular, por lo que se impone valorar, al mismo tiempo, la función glomerular junto con las concentraciones en sangre de los diferentes analitos que se excretan por la orina. En esta tarea son de una ayuda inestimable el estudio de los índices de excreción urinaria de estos analitos, así como el cálculo de la fracción de su excreción. El presente trabajo ha demostrado que el estudio integral de la función renal puede realizarse mediante el ensayo de muestras matutinas (o, por la misma razón, únicas) de orina, combinado con el ensayo al unísono en una muestra de sangre de la mayor parte de las sustancias reguladas homeostáticamente por el riñón. De esta manera, se soslaya el requerimiento de la colección de 24 horas de orina, y todos los inconvenientes que ello comporta, los que se acrecientan notablemente en las edades pediátricas y que, a pesar de las mejores intenciones, pueden resultar en errores diagnósticos apreciables.
El estudio integral de la función tubular renal implica el suministro de datos clínicos detallados con la orden de análisis para una mejor interpretación de los resultados. El diagnóstico de las tubulopatías requeriría también de la determinación de proteínas tubulares como la (-2 microglobulina (B2M), igualmente, el protocolo de trabajo puede incorporar pruebas de supresión/estimulación de la excreción urinaria de analitos selectos como parte del diagnóstico diferencial de diversas tubulopatías, por otro lado, este diagnóstico se haría más exacto si se contemplara la posibilidad de un segundo estudio para evaluar los cambios ocurridos en el tiempo y la respuesta terapéutica.
Se concluye que el estudio tubular con muestras matutinas de orina permite el diagnóstico de importantes tubulopatías en las edades pediátricas.
Se recomienda complementar el fenotipo tubular establecido mediante el protocolo discutido en este artículo con estudios genómicos, y así lograr un diagnóstico abarcador del síndrome tubular encontrado en el niño interconsultado.