Introducción
Los tumores del sistema nervioso central en niños y adolescentes constituyen la tercera localización en incidencia en este grupo de edad en Cuba,1) de ellos un grupo está constituido por tumores del tallo cerebral. Los gliomas pontinosdifusos e infiltrativos l (DIPG) son los tumores más comunes del tallo cerebral en las edades pediátricas y representan entre 70 y 80 % de los tumores en esta localización,2) la evolución es de mal pronóstico, la supervivencia media de los pacientes es de apenas 1 año, y muy pocos alcanzan 2 o más años.3,4,5,6 El tallo cerebral contiene núcleos de pares craneales y otros críticos para funciones vitales, por lo que la cirugía es descartable. La radioterapia es la opción de tratamiento; la quimioterapia no ha demostrado ser de utilidad.2,3,5,6,7,8,9,10,11,12,13
El diagnóstico positivo se basa en los signos y síntomas clínicos y en las imágenes obtenidas con tomografía axial computarizada y resonancia magnética: hipertensión endocraneal por hidrocefalia obstructiva debido al crecimiento del tumor, limitación en el movimiento de los ojos, diplopía, desviación de la comisura de la boca, dificultad a la marcha, hemiparesias, clonus, presencia de signo de Babinsky, ataxia, cambios de conducta. La muestra histológica del tumor no se obtiene rutinariamente, ya que la toma de biopsia conlleva la posibilidad de causar daños.2,3,5,6,7,8,9,14
El nimotuzumab es un anticuerpo monoclonal desarrollado en el Centro de Inmunología Molecular de La Habana y fue humanizado a partir de anticuerpos murinos,15) con efectos pro-apoptóticos, antiproliferativos y antiangiogénicos,16) sin los efectos de toxicidades de otros anticuerpos monoclonles antiREGF, como el etuxumab, que produce rash cutáneo, y existe la posibilidad de emplearlo por prolongados periodos.3,17,18
Diversos trabajos acerca del empleo del nimotuzumab asociado a la RT han señalado la utilidad de esta asociación e incrementado la supervivencia en los DIPG.3,5,17,19,20,21,22,23,24) En el presente trabajo el objetivo que nos proponemos es presentar los resultados obtenidos con la combinación de nimotuzumab y radioterapia en tumores del tallo cerebral en niños y adolescentes.
Métodos
Es un estudio clínico, prospectivo, no aleatorizado, constituido por 69 niños y adolescentes con un rango de edad entre 2 y 18 años, incluidos en la investigación desde enero de 2008 a diciembre de 2020, y seguidos hasta agosto de 2021. Todos con un diagnóstico clínico e imagenológico por tomografía axial computarizada o resonancia magnética de tumores difusos e infiltrantes del tallo cerebral (DIPG). La confirmación histológica no fue un requisito en este estudio, aunque en un pequeño grupo se realizó biopsia.
En los criterios de inclusión se encontraban pacientes que presentaban historia de toma de pares de nervio craneales, ataxia, paresia de extremidades y las imágenes características de los tumores infiltrantes y difusos del tallo cerebral, edades entre 2 y 18 años, índice de Karnofsky-Lansky (KL) igual o mayor que 30; posteriormente, al recibir pacientes con KL de 20, se decidió incluirlos valorando la posibilidad de recibir tratamiento aun con intención paliativa.
Criterios de exclusión: pacientes con lesiones focales del tallo, haber recibido quimioterapia o irradiación previa, o pacientes con esperanza de vida de un mes o menos. En todos se obtuvo el consentimiento informado de los padres de los niños o adolescentes.
La irradiación se realizó en el Instituto Nacional de Oncología y Radiobiología (INOR), de la Habana con un acelerador lineal. El volumen tumoral grueso (GTV) se definió por las imágenes, el volumen clínico del tumor(CTV) incluyó enfermedad microscópica subclínica a 1,5 cm del GTV, y el volumen planificado del tratamiento (PTV) entre 3 y 5 cm del CTV, pero estos límites pueden variar según las dosis recibidas en los órganos en riesgo (OR). Las dosis aplicadas estaban en el rango entre 54 y 59,8 Gy, con dosis por fracción de 1,8 Gy, 5 dosis por semana.
Seis pacientes fueron planificados con intensidad modulada (IMRT) y el resto planificación en 3D. En todos los pacientes se utilizaron máscaras termo-deformables con el fin de obtener una correcta inmovilización y localización.
Cincuenta y ocho pacientes (84,1 %) recibieron dexametasona diaria durante la irradiación con el fin de evitar o disminuir el edema intracraneal que puede producir la radioterapia.
El nimotuzumab se administró en dosis de 150 mg/m2 de superficie corporal, por vía endovenosa, una vez por semana mientras dure el tratamiento radiante y comenzar el primer día de irradiación; luego, la misma dosis una vez cada 2 semanas, por 8 dosis, hasta una vez mensual por un año y puede extenderse por 2 o más años, dependiendo de la institución que realizó el seguimiento. Un total de 58 pacientes (84,1 %) recibieron completa la dosis programada Tres pacientes fueron reirradiados debido a recaída del tumor a los 4, 3 y un año, con dosis entre 34,2 y 54,0 Gy concurrente con el nimotuzumab. Uno se encuentra vivo.
Los resultados del sexo, grupo de edad, intervalos del Índice de Karnofsky-Lansky y de la dosis administrada, se expresaron en frecuencia y porcentajes; para variables cuantitativas continuas se usaron las medianas y el IC95%; las funciones de supervivencia se estimaron por el método de Kaplan-Meier y se aplicó el test de log-rank en el análisis univariado.
Para el análisis multivariado se usó la regresión de Cox. Se aplicó el índice de Youden para la determinación del punto de corte de la dosis a la que se alcanza mejoría clínica. Se consideró con significación estadística el valor de p< 0,05. Para el procesamiento de los datos y el análisis estadístico se empleó el programa SPSS versión 22.
Este estudio clínico fue aprobado por el Comité de Ética de las Investigaciones del INOR.
Resultados
La edad al diagnóstico tuvo una mediana de 7 años (IC95%: 5,6-8,0), con un mínimo de 2 años y un máximo de 18 años. El grupo de edad más frecuente correspondió a 5-9 años (N= 35, 50,7 %), y más de las tres cuartas partes fueron pacientes menores de 10 años (N= 53, 76,8 %). El sexo predominante fue el masculino.
El índice de Karnofsky-Lansky en 70 y menos puntos se determinó en la mayoría de ellos (52, 75,4 %). En 40 pacientes se aplicó un intervalo de dosis entre 54,0-57,0 (58,0).
No se encontró asociación entre la dosis administrada y el grupo de edad (Ji-cuadrada= 5,63, p= 0,495) ni con el estado funcional (Ji-cuadrada= 21,1, p= 0,099) (Tabla 1).
La mediana del tiempo de supervivencia global fue de 18,8 meses, [IC95% (10,9-26,6)]; las tasas de supervivencia a 1, 2, 3, 4 y 5 años fueron de 73,5 %, 44,3 %, 38,7 %, 33,1 % y 30,9 %, respectivamente, alcanzándose una meseta a partir de los 55 meses, y hasta el momento de la evaluación existían 14 pacientes vivos con un tiempo de supervivencia mayor de 69 meses (Fig. 1).
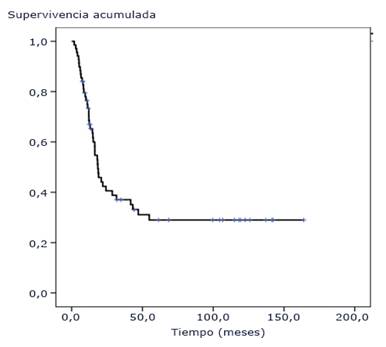
Fig. 1 Función de supervivencia global. Pacientes pediátricos con tumores difusos e infiltrantes del tallo cerebral tratados con radioterapia y nimotuzumab.
El punto de corte para la edad fue de 10 años y más, sin alcanzarse la mediana para este grupo, aunque no se alcanzó diferencia con significación estadística entre ambos grupos (p= 0,067) (Fig. 2).
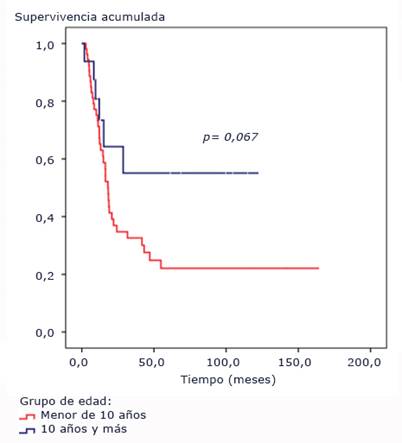
Fig. 2 Funciones de supervivencia según grupo de edad. Pacientes pediátricos con tumores difusos e infiltrantes del tallo cerebral tratados con radioterapia y nimotuzumab.
El índice de Karnofsky-Lansky no fue un factor pronóstico para un punto de corte igual o mayor de 75 % (p= 0,107). No se alcanzó la mediana de supervivencia para los pacientes que presentaban al momento del diagnóstico un índice de 90-75, mientras que para los pacientes con estado funcional menor de 75 fue prácticamente similar a la global (18,4 [IC95% 14,9-21,9] meses) (Fig. 3).
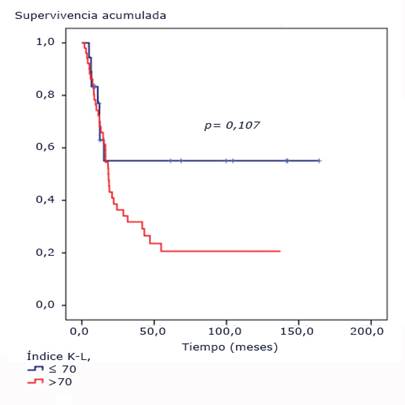
Fig. 3 Funciones de supervivencia según índice de Karnofsky-Lansky. Pacientes pediátricos con tumores difusos e infiltrantes del tallo cerebral tratados con radioterapia y nimotuzumab.
Tres pacientes (4,3 %) recibieron dosis inferiores a 54,0 Gy por interrupción del tratamiento debido a empeoramiento de su enfermedad. El análisis univariado del efecto del intervalo de dosis en los pacientes que cumplieron con la radioterapia planificada mostró diferencias con significación estadística (p= 0,034), con medianas de 28,7 meses, (IC95% [11,5-45,9]) y 24,2 meses, (IC95% [0,0-62,8]) para los intervalos de dosis 54-57, 57-59 y mayor de 59,1 Gy, respectivamente (Fig. 4).
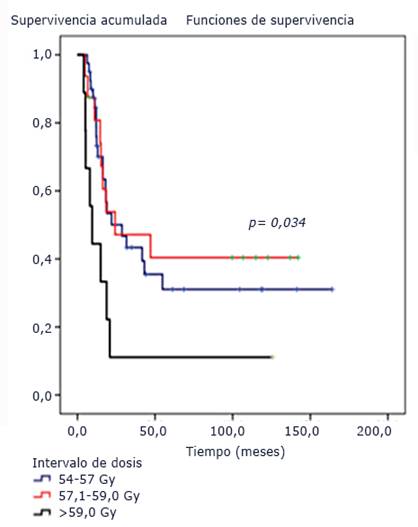
Fig. 4 Funciones de supervivencia según intervalo de dosis. Pacientes pediátricos con tumores difusos e infiltrantes del tallo cerebral tratados con radioterapia y nimotuzumab.
El punto de corte de la dosis a la mejoría clínica resultó en 1790 Gy. Los pacientes que manifestaron mejoría clínica por debajo de esta dosis no alcanzaron la mediana del tiempo de supervivencia (p= 0,038). La mediana del tiempo de supervivencia para los pacientes con dosis mayor de 1790 Gy fue de 16,4 meses, (IC95% [113,6-19,1]); menor que la mediana de supervivencia global (Fig. 5).
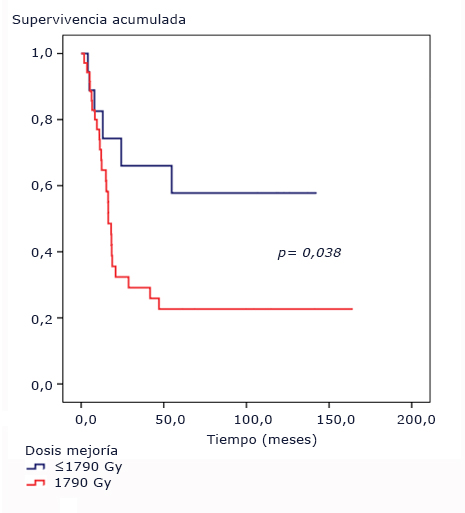
Fig. 5 Funciones de supervivencia según dosis para la mejoría. Pacientes pediátricos con tumores difusos e infiltrantes del tallo cerebral tratados con radioterapia y nimotuzumab.
En el análisis multivariado el intervalo de dosis fue el factor pronóstico independiente con incremento de 3,29 (IC95% 1,344-8,071) del riesgo proporcional de fallecer en los pacientes en que fueron empleadas dosis superiores de 59,0 Gy (Tabla 2).
El tratamiento fue tolerado con toxicidades no mayores de grado 3. El evento adverso más frecuente fue la aparición de alopecia en los campos de irradiación, observada en 59 pacientes. Otros eventos adversos encontrados fueron vómitos, cefaleas, fiebre, náuseas, en menos del 50 % de los pacientes.
De los pacientes re-irradiados, uno sobrevive hasta 9 años después de la re-irradiación, y actualmente estudia una carrera universitaria.
Discusión
Los tumores del tallo cerebral constituyen un grupo predominante en niños, y la mayoría corresponden a gliomas difusos e infiltrantes con una incidencia generalmente entre 6 y 7 años de edad.5,8,25) Signos y síntomas clínicos tales como cefalea, toma de pares craneales, ataxia, paresia de extremidades, e incremento de presión intracraneal, además de las imágenes por tomografía axial o resonancia magnética, son considerados suficientes para el diagnóstico, ya que toma de biopsia puede resultar riesgosa,2,3,4,6,7,8,14 sin embargo, aunque en los últimos años hay tendencia a realizarla, los resultados no cambiarían el tratamiento.4,12,26,27
La irradiación del tumor ha sido el tratamiento de elección, ofrece beneficios de respuesta pero con mal pronóstico a corto tiempo y una mediana de supervivencia de un año o aún menor; pocos pacientes alcanzan los 2 dos años de evolución,2,5,8,25 pese al incremento de la dosis de irradiación o al uso de hipo- o hiperfraccionamiento de la dosis; ni el empleo de nuevos esquemas de quimioterapia han mejorado la supervivencia y son escasos los informes con resultados más allá de los 2 años.2,3,6,8,11,20,22,23,28,29,30
Hemos planteado que el nimotuzumab es un anticuerpo monoclonal desarrollado en el Centro de Inmunología Molecular de La Habana, con efectos antiproliferativos, antiangiogénicos y proapoptóticos,16) lo cual podría explicar los resultados cuando aparece asociado a la radioterapia. Está demostrado que el nimotuzumab no produce toxicidades tal como el rash cutáneo, lo que permite combinaciones con otros medicamentos.3) Los eventos adversos observados, como la alopecia en los campos de entrada de las radiaciones, las náuseas y las cefaleas están asociadas a la radioterapia, más que al nimotuzumab. La asociación de la radioterapia y el nimotuzumab es bien tolerada, así como la aplicación del monoclonal a largo plazo.5,7,22,23) Puede ser administrado a pacientes ambulatorios permitiéndoles continuar estudios o trabajar.5,29 La mayoría de las pacientes muestran mejoría neurológica, con un punto de corte en 1790 Gy. Ha sido señalado que dosis de irradiación acumulativamente bajas pueden resultar en mejoría del estado neurológico.25
Las supervivencias a muy largo tiempo, que son aquellas probabilidades o tasas a 5 o más años de evolución, aparecen en muy pocos informes en el rango de 2,6 a 7,5 años.10,11,12,29,30 En el grupo de 41 pacientes incluidos desde 2008 a 2015, y que tienen un mínimo de 5 años de seguimiento, se alcanzó una muy larga supervivencia a 5 o más años en 34,1 %.29) Es importante señalar que las cifras de supervivencia alcanzadas en nuestros pacientes que tienen un mínimo de 5 años de haber sido incluidos en el tratamiento combinado de radioterapia y nimotuzumab, y el total de los 69 pacientes incluidos, 58 (84,1 %), recibieron el nimotuzumab programado y en los otros hubo interrupciones menores, generalmente por no acudir a tiempo a las consultas programadas o demoras en la obtención del medicamento.
En nuestros pacientes de muy larga evolución (cinco o más años), encontramos que la mayoría se encuentran incorporados a diversos estudios o están trabajando.29) Cuando la enfermedad progresa es posible emplear la re-irradiación en algunos pacientes con el fin de mejorar la calidad de vida y prolongar la sobrevida.3,29,31,32,33
Concluimos que la combinación de radioterapia y nimotuzumab fue bien tolerada y es una opción del tratamiento de estos tumores.