Introducción
La infección por el citomegalovirus (CMV) en el período neonatal puede ser adquirida intraútero (infección congénita) o en el periodo posparto inmediato (infección perinatal).1,2
La infección congénita por CMV (CMVc) es causa de pérdida auditiva neurosensorial, trastornos del neurodesarrollo, complicaciones oftalmológicas, neoplasias cerebrales, autismo infantil, epilepsia y otros trastornos neurológicos. Estas alteraciones se producen por daño directo del virus en el encéfalo y oído e indirectamente por la respuesta inmune inapropiada a nivel cerebral o la disfunción placentaria e hipoxia fetal provocada por la infección y son más frecuentes en los que presentan una infección sintomática.3
La infección perinatal por CMV (CMVp), es el resultado de la exposición a las secreciones genitales maternas durante el parto o a la leche materna infectada por este virus durante los primeros meses de la vida, Se incluye además en esta categoría la infección iatrogénica adquirida por la administración de hemoderivados y por el contacto con fluidos respiratorios infectados del personal de la salud o familiares.1,2,4
La leche materna es la fuente más importante de infección posnatal, por el alto porcentaje de mujeres seropositivas al CMV que excretan el virus en este fluido. El recién nacido pretérmino con muy bajo peso tiene un riesgo mayor de presentar síntomas si la infección ocurre en el periodo posnatal porque la transferencia de anticuerpos maternos es baja. En estos pacientes puede observarse hepatitis, neutropenia, trombocitopenia y un cuadro similar a un síndrome séptico.1,2,4
En contraste con el CMVc, la infección perinatal es generalmente considerada una enfermedad de menor gravedad y no está claro o quedan respuestas inconclusas y contradictorias sobre las secuelas a corto y largo plazo en el neurodesarrollo de este tipo de infección, en neonatos muy bajo peso.5
Se realiza esta investigación con el objetivo de describir la evaluación neurológica en el primer año de vida en niños muy bajo peso al nacer, con infección por citomegalovirus.
Métodos
Estudio observacional, descriptivo y longitudinal donde se incluyeron a 14 neonatos con peso al nacer < 1500 gramos, egresados vivos y nacidos en el Hospital Ginecoobstétrico Docente “Ramón González Coro”, entre el 1ro. de enero del 2015 y el 31 de agosto del 2016; con diagnóstico de infección por CMV congénita o perinatal.
Se consideró con CMVc a todo neonato con detección del virus mediante reacción en cadena de la polimerasa (RCP) de muestra de orina o suero durante la primera semana de vida y con CMVp a los que tuvieron este estudio previamente negativo y a partir de los 15 días de vida se detectó el genoma del virus mediante RCP en muestra de orina o suero.
Se definió a la enfermedad como sintomática en el caso del CMVc a los que presentaron al menos una de las siguientes alteraciones: pequeño para la edad gestacional, petequias, hepatoesplenomegalia, trombocitopenia, hepatitis (ictericia o transaminasas alteradas), alteraciones del SNC, tales como microcefalia y otras anomalías cerebrales, alteraciones citoquímicas del líquido cefalorraquídeo y coriorretinitis.6
En el caso del CMVp se consideró a la enfermedad como sintomática ante la presencia de al menos una de las siguientes condiciones: neumonitis, hepatitis, neutropenia, trombocitopenia y un cuadro similar a un síndrome séptico.1,2,4,7
Seguimiento
A los neonatos que asistieron a las distintas consultas planificadas se les realizó evaluación del neurodesarrollo, ultrasonido craneal (USC), potenciales auditivos evocados de tallo cerebral (PEATC) y potenciales visuales(PV) a las 40 semanas, a los seis meses y al año de edad gestacional corregida (EGC). Se realizó además electroencefalograma (EEG) a las 40 semanas de EGC.
Se les realizó en los períodos señalados, por la sección de neurodesarrollo de la institución, según su protocolo de seguimiento; examen neurológico por el método de Amiel-Tison.8 En la primera evaluación se clasificó dicho examen como normal si la exploración fue completamente normal; sospechoso si presentó hipotonía del eje, disminución de los reflejos primarios y osteotendinosos, así como de su capacidad adaptativa y patológico si presentó hipotonía global (del eje y de miembros), disminución marcada de los reflejos integrados y osteotendinosos y pobre capacidad adaptativa.
A los seis meses y al año de edad corregida se clasificó dicho examen desde el punto de vista evolutivo como normal si la exploración fue completamente normal; con alteraciones ligeras si presentó alguna de las siguientes variaciones: hipotonía muscular leve/transitoria, insuficiencia motora ligera con tono aumentado, alteraciones reflejas, retardo transitorio o leve del desarrollo psicomotor, hipertonía discreta/transitoria, retraso mental ligero, hiperactividad o retraso ligero del lenguaje. Con alteraciones moderadas si presentó alguna de las siguientes variaciones: hipotonía moderada/severa sin trastornos de adaptación o sociales personales, retraso moderado del desarrollo psicomotor, retraso mental moderado, retraso moderado del lenguaje o síndrome hipercinético y con alteraciones severas si presentó alguna de las siguientes variaciones: parálisis cerebral espástica o insuficiencia motora o sensorial de origen cerebral de carácter permanente, microcefalia, epilepsia. El diagnóstico de parálisis cerebral se consideró confirmado si las alteraciones están presentes al final del primer año de edad corregida.
La valoración del índice de desarrollo mental y del índice de desarrollo psicomotor se realizó en la segunda y tercera evaluación por el test de Bayley.9 Según la puntuación obtenida en cada índice se clasificó al niño en cuatro categorías:
Índice de desarrollo mental o desarrollo psicomotor normal: entre 84 y 116.
Disminución ligera del índice de desarrollo mental o desarrollo psicomotor: entre 68 y 84.
Disminución moderada del índice de desarrollo mental o desarrollo psicomotor: entre 50 y 68.
Disminución severa del índice de desarrollo mental o desarrollo psicomotor: menor de 50.
En la primera evaluación se realizó EEG por la sección de neurofisiología; con equipo Medicid-5 de Neuronic SA, Cuba, estando el paciente en sueño espontáneo y en vigilia. El análisis de los montajes monopolares y bipolares de referencia, transversal y longitudinal se realizaron fuera de línea. Este estudio se clasificó como normal si la exploración fue completamente normal; con alteraciones menores si presentó alguna de las siguientes alteraciones: inmadurez, alteraciones del ciclo de sueño, asimetría de voltaje, lento, actividad paroxística focal aislada, actividad paroxística multifocal (con actividad de base normal) o espigas rolándicas positivas (tipo B) y con alteraciones mayores si presentó alguna de las siguientes alteraciones: bajo voltaje (de 5 a 25 mv) y carencia de variabilidad, asimetría de voltaje mayor o igual que 50 %, asincronía interhemisférica, patrón de burst-supression, silencio eléctrico cerebral, descargas focales aisladas., descargas focales rítmicas (pseudo beta-alfa-theta-delta), descargas multifocales (con actividad de base anormal), descargas generalizadas o espigas rolándicas positivas tipo A.
En las tres evaluaciones se realizó por el equipo de neurofisiología exploración auditiva y visual a través de PEATC y PV, respectivamente. El PEATC se realizó por equipo de neurofisiología con el sistema Audix 5 de Neuronic S.A, Cuba; en un local con nivel de ruido ambiental menor de 55 dB SPL, durante el sueño natural de los bebés y explorado cada oído de forma independiente, a las intensidades de estimulación de: 70, 50 y 30 dB nHL, y con 2000 promediaciones.
Se clasificó este examen como normal si la exploración fue completamente normal o anormal si estaban ausentes las ondas I, III y V a los 70 dB nHL, si sus latencias absolutas e intervalos interpicos estaban fuera de los valores normativos del laboratorio para la edad de maduración en la primera evaluación y en la segunda y tercera evaluación si la obtención del pico V como umbral electrofisiológico a los 30 dB nHL se encontraba por encima de los 40 dB nH.
El potencial visual se efectuó, en el sistema Neuronica-5 de Neuronic S.A, Cuba; utilizando goggles: espejuelos para la estimulación monocular mediante el sistema LEDs, con una matriz de diodos de luz roja activados por pulsos eléctricos de 3 ms de duración y frecuencia de 2 Hz. Se realizó el estudio en una habitación en penumbras y bajo condiciones de sueño espontáneo de los bebés, con 100 promediaciones.
Se clasificaron estos registros como normal o anormal teniendo en cuenta la morfología de la respuesta obtenida, la latencia absoluta del componente principal, su amplitud y la diferencia interocular del mismo: estudio normal: presencia del complejo formado por los picos N1P1N2, latencia del componente P1 dentro del rango establecido para la edad de madurez, según las normas del laboratorio; diferencia interocular de la latencia absoluta de P1 menor de 5 ms y amplitud de P1 similar en ambos ojos, estudio anormal: ausencia de respuesta, latencia de P1 prolongada uni- o bilateralmente, diferencia de latencia de P1 interocular mayor de 5 ms, (encontrándose los valores absolutos dentro de límites normales) y amplitud con una disminución significativa de más de 50 % entre las respuestas de ambos ojos.
Para el análisis de los datos se utilizaron medidas descriptivas de resumen.
Aspectos éticos
Se les entregó a las madres de los neonatos un documento con toda la información necesaria sobre la investigación y solo se incluyó en el estudio a su hijo si expresó por escrito su consentimiento de participar en el proyecto.
La información relacionada con la identificación de los pacientes fue tratada confidencialmente. Esta investigación fue revisada y aprobada por el Comité de Ética y por el consejo científico del hospital “Ramón González Coro”.
Resultados
De los 14 pacientes incluidos en esta investigación, seis (43 %) tuvieron infección congénita y ocho (57 %) infección perinatal. Se muestran los datos correspondientes a los 14 neonatos incluidos en la investigación (Tabla 1).
Tabla 1 Antecedentes perinatales y asistencia a las evaluaciones programadas en cada periodo, de los pacientes incluidos
| No. | Peso (g) | EG (semanas) | Apgar | Clasifica- ción de la infección | 40 semanas* (%) | 6 meses** (%) | 1 año** (%) |
|---|---|---|---|---|---|---|---|
| 1 | 1240 | 28 | Normal | Congénita | 100 | 100 | 100 |
| 2 | 950 | 27 | Normal | Congénita | 100 | 100 | 100 |
| 3 | 1400 | 34 | Normal | Congénita | 100 | 100 | 40 |
| 4 | 1280 | 32 | Normal | Congénita | 100 | 60 | 0 |
| 5 | 1250 | 28 | Normal | Congénita | 100 | 100 | 100 |
| 6 | 1400 | 33 | Normal | Congénita | 0 | 0 | 0 |
| 7 | 980 | 28 | Normal | Perinatal | 100 | 100 | 60 |
| 8 | 1480 | 32 | Normal | Perinatal | 100 | 100 | 100 |
| 9 | 1420 | 31 | Normal | Perinatal | 100 | 60 | 0 |
| 10 | 1360 | 30 | Normal | Perinatal | 60 | 0 | 0 |
| 11 | 1260 | 29 | Deprimido ligero | Perinatal | 100 | 100 | 0 |
| 12 | 1460 | 33 | Normal | Perinatal | 100 | 100 | 0 |
| 13 | 1480 | 30 | Normal | Perinatal | 100 | 100 | 100 |
| 14 | 1320 | 30 | Deprimido moderado | Perinatal | 0 | 0 | 0 |
EG: edad gestacional al nacer en semanas entera cumplidas; *corresponde al porcentaje de estudios realizados de los cinco planificados: examen neurológico (ExN), ultrasonido craneal (USC), electroencefalograma (EEG), potenciales visuales (PV), potenciales evocados auditivos de tallo cerebral (PEATC); **corresponde al porcentaje de estudios realizados de los cinco planificados: ExN, Test de Bayley, USC, PV, PEATC.
Dos pacientes no asistieron a ninguna de las evaluaciones programadas y solo 36 % (5/14, 3 con CMVc y 2 con CMVp) realizaron todos los estudios planificados en las tres etapas. A las 40 semanas de EGC se evaluaron completamente 79 % de los casos (11/14, 5 con CMVc y 6 con CMVp) y a los seis meses de EGC se hicieron todas las pruebas 64 % de los niños (9/14, 4 con CMVc y 5 con CMVp).
Se muestran los resultados de los estudios realizados en los tres periodos (Tabla 2).
A las 40 semanas de EGC todas las pruebas realizadas arrojaron resultados normales. A los seis meses de EGC un lactante con CMVc tuvo alterado el PEATC, sin embargo, al repetir el estudio al año de EGC mostró un resultado normal. Al año de EGC dos niños tuvieron disminución en los índices del test de Bayley y en ambos (uno con CMVc y otros con CMVp) el examen neurológico fue considerado con alteraciones ligeras por presentar alteraciones transitorias.
Tabla 2 Resultados de las evaluaciones realizadas a las 40 semanas, 6 meses y 1 año de EGC
| Estudio | 40 semanas (%) | 6 meses (%) | 1 año (%) | |
|---|---|---|---|---|
| ExN | Normal | 12/12 (100) | 11/11 (100) | 4/6 (67) |
| Alterado | 0/12 (0) | 0/11 (0) | 2/6 (33) | |
| USC | Normal | 12/12 (100) | 11/11 (100) | 6/6 (100) |
| Alterado | 0/12 (0) | 0/11 (0) | 0/6 (0) | |
| PEATC | Normal | 12/12 (100) | 8/9 (89) | 6/6 (100) |
| Alterado | 0/12 (0) | 1/9 (11) | 0/6 (0) | |
| PV | Normal | 11/11 (100) | 9/9 (100) | 6/6 (100) |
| Alterado | 0/11 (0) | 0/9 (0) | 0/6 (0) | |
| EEG | Normal | 11/11 (100) | - | - |
| Alterado | 0/11 (0) | - | - | |
| Test Bayley | Normal | - | 11/11 (100) | 4/6 (67) |
| Índice de Dd* | - | 0/11 (0) | 2/6 (33) | |
ExN: examen neurológico; USC ultrasonido de cráneo; PEATC potencial evocado auditivo de tallo cerebral; PV potencial visual; EEG: electroencefalograma; *Desarrollo disminuido.
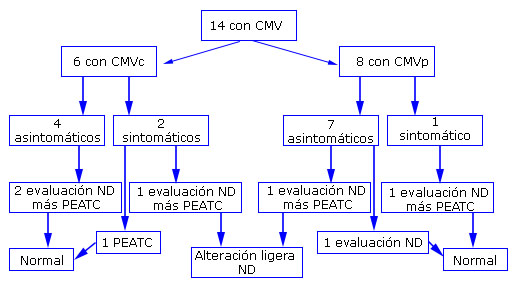
Se muestra el resultado final del neurodesarrollo (examen neurológico y test de Bayley) y el PEATC al año de EGC, según clasificación de la infección por CMV (Fig.).
En los pacientes con CMVc, se evaluaron con los dos ítems, dos de los asintomáticos y uno de los sintomáticos y se detectaron alteraciones ligeras del ND en el último. En los casos con CMVp se evaluaron con las dos categorías un asintomático y un sintomático con alteraciones ligeras del ND en el primero. En total, en seis pacientes se evaluó el ND, que resultó comprometido en 33,3 % de los casos estudiados con infección congénita y con infección posnatal (1/3, respectivamente).
Se realizaron seis PEATC; cuatro en seis de los niños con CMVc y dos en ocho de los infantes con CMVp y todos tuvieron resultados normales.
En los dos neonatos con CMVc sintomático, el único signo relacionado con la infección fue el de tener una evaluación de pequeño para la edad gestacional, simétrico al nacer y en el caso con CMVp sintomático que tuvo como comorbilidad al momento del diagnóstico candidemia, el signo que se encontró fue trastornos de perfusión.
Discusión
Durante el seguimiento ningún paciente tuvo alteraciones del ultrasonido craneal lo cual contrasta con el estudio de Álvarez y otros10 que detectan alteraciones en el USC en neonatos muy bajo peso con infección congénita e infección postnatal por CMV de 62,4 y 31,4 %, respectivamente; aunque los resultados del último caso no difieren de los hallazgos en neonatos de ese grupo de peso sin infección por este virus (21,4 %).
Se evaluó el ND al año de EGC a seis niños, de los cuales 33,3 % de forma general y por tipo de infección (congénita o perinatal) tuvieron retraso del desarrollo psicomotor, con ND normal en las evaluaciones previas.
Estos resultados no concuerdan con un estudio conducido en Suiza11que identifica alteraciones del ND solo en 18,2 % de los pacientes con CMVc a partir de los seis meses de edad y son similares a una investigación realizada en Japón12 donde se encontraron hallazgos desfavorables (en pacientes infectados intraútero) en 28 % de los casos, con la peculiaridad de que las alteraciones fueron gradualmente identificadas después de los seis meses y en la mayoría de los casos al final del tercer año de vida.
Respecto a los niños con CMVp, los estudios en menores de 1500 gramos al nacer muestran resultados contradictorios en cuanto a la posibilidad de que las secuelas en el neurodesarrollo sean similares en niños sin este tipo de infección y relacionadas con otras enfermedades propias de la prematuridad, durante el periodo neonatal. Una investigación13 identifica una diferencia significativa en las funciones motoras y cognitivas, al comparar niños con muy bajo peso al nacer infectados y no infectados por el CMV después del nacimiento mientras otro14 plantea que el CMVp no provoca alteraciones permanentes del ND en los primeros seis años de vida en prematuros.
Al año de EGC no se detectó pérdida auditiva en ninguno de los seis casos con PEATC realizado y en tres pacientes más, la audición fue normal hasta los seis meses de EGC. Estos hallazgos por un lado, son iguales a los resultados de una investigación realizada en Indonesia,15 donde en los niños con antecedentes de CMVc seguidos con PEATC hasta la edad de 14 meses, no se encontraron alteraciones auditivas y por otro, similares al estudio de Nijman16 en cuanto a que en ningún caso con CMVp se detectó hipoacusia neurosensorial en el seguimiento realizado entre los 16 meses y los ocho años a niños con un peso promedio al nacer de 1140±330 gramos.
Estos resultados difieren de otros estudios como el realizado en Polonia17 que documenta 6 % de pérdida auditiva en niños con CMVc; el liderado por McCrary,18 que en niños con una edad promedio de 3,2 años y antecedentes de CMVc sintomáticos y tratados con ganciclovir, encuentra pérdida auditiva en la primera evaluación en 6 7% de los casos y empeoramiento progresivo de la audición en el seguimiento en 87,5 % y el metaanálisis de Liu y otros,19 que indica que el CMVc incrementa el riesgo de pérdida auditiva en escolares (OR= 8,45; IC 95%: 3,95-18,10; p< 001).
Esta investigación tiene como principal limitación que a medida que fue transcurriendo el tiempo de seguimiento, el número de pacientes que acudió a realizarse los estudios programados fue disminuyendo. Una de las razones que puede haber influido en la inasistencia es que los estudios se planificaron en un hospital de atención secundaria, en locales diferentes y en distintos momentos y no en la atención primaria de salud a donde corresponde cada caso y algunos de ellos vivían en municipios distantes. Otro factor relacionado podría ser que la madre o familiares consideren innecesarios repetir pruebas con resultados previos normales.
Se concluye que las alteraciones del neurodesarrollo encontradas al año de edad corregida, pueden estar relacionadas con la prematuridad o la infección por citomegalovirus. El seguimiento a mediano y largo plazo es necesario para detectar otras secuelas neurológicas de debut tardío.