Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Obstetricia y Ginecología
versión impresa ISSN 0138-600X
Rev Cubana Obstet Ginecol v.36 n.2 Ciudad de la Habana abr.-jun. 2010
Mifepristona para tratamiento del fibroma uterino
The use of Mifepristone for treatment of the uterine fibroma
Josep Lluis Carbonell EsteveI; Rita AcostaII; Braulio HerediaIII; Yasmiriam PérezIV; María C. Yero CastañedaV; Isabel SeiglerVI; Juan Carlos Andreu BallesterVII
IDoctor en Medicina y Cirugía. Especialista en Ginecoobstetricia. Clínica Mediterránea Médica. Valencia, España.
IIMáster en Ciencias. Especialista de II Grado en Ginecoobstetricia. Profesora Auxiliar y consultante. Máster en atención integral a la mujer. Hospital Docente Ginecoobstétrico "Eusebio Hernández". La Habana, Cuba.
IIIMáster en Ciencias. Máster en atención integral a la mujer. Especialista de II Grado en Ginecoobstetricia. Profesor Auxiliar. Hospital Docente Ginecoobstétrico "Eusebio Hernández". La Habana, Cuba.
IVEspecialista de I Grado en Ginecoobstetricia. Hospital Docente Ginecoobstétrico "Eusebio Hernández". La Habana, Cuba.
VEspecialista de I Grado en Anatomía Patológica. Instructora. Hospital Docente Ginecoobstétrico "Eusebio Hernández". La Habana, Cuba.
VIEspecialista de I Grado en Ginecoobstetricia. Ultrasonidista. Hospital Docente Ginecoobstétrico "Eusebio Hernández". La Habana, Cuba
VIIUnidad de Investigaciones. Departamento de urgencias. Hospital Arnau de Vilanova. Valencia, España.
RESUMEN
OBJETIVOS: Evaluar la eficacia, seguridad y duración de la mejoría clínica en el tiempo de la administración de 5 vs. 10 mg diarios de mifepristona en el tratamiento del fibroma.
MÉTODOS: Fueron aleatorizadas a recibir 5 ó 10 mg diarios de mifepristona oral durante 3 meses y fueron seguidas durante 6 meses después, 100 mujeres con fibromatosis uterina sintomática. Se calcularon los volúmenes del fibroma y del útero por ultrasonografía abdominal del útero al inicio, al final del tratamiento, 3 y 6 meses después.
RESULTADOS: Al final del tratamiento el fibroma se redujo en 38,3 %, p < 0,001, y 47,5 %, p < 0,001, respecto del valor inicial en los grupos de 5 y 10 mg, respectivamente. El volumen del útero se redujo el 27 % (p = 0,001) y 25,1 % (p = 0,001), con respecto al inicio en los grupos de 5 y 10 mg, respectivamente. La prevalencia de los síntomas fue significativamente menor al final de tratamiento y 6 meses después. Seis meses después del tratamiento el tamaño del fibroma era 21,% y 19,% menor que el valor inicial en los grupos de 5 y 10 mg de mifepristona, respectivamente, y el volumen del útero era 2 % y 0,2,% menor que al inicio en los grupos de 5 y 10 mg, respectivamente. No hubo hiperplasia endometrial en ninguno de los grupos de tratamiento.
CONCLUSIONES: La dosis de 5 mg tuvo similar eficacia que la de 10 mg y 6 meses después de concluido el tratamiento los tamaños del fibroma y del útero estaban cercanos a los valores pretratamiento, pero se mantenía una notable mejoría clínica.
Palabras clave: Mifepristona, leiomioma, fibroma, antiprogestágenos.
ABSTRACT
OBJECTIVES: to evaluate the efficacy, safety and duration improvement obtained over the course of time by administering mifepristone for the treatment of fibroids.
METHODS: One hundred women with symptomatic uterine myomas were randomized to receive oral mifepristone 5 or 10 mg daily for 3 months with 6 month post-treatment monitoring. The fibroid and uterus sizes were calculated by means of abdominal ultrasound examination at the beginning and at the end of treatment as well as 3 and 6 months later.
RESULTS: At the end of treatment the fibroid decreased in size 38.3%, p < 0.001, and 47.5%, p < 0.001, respecting to the initial value in the 5 and 10 mg groups, respectively. The uterine volume decreased 27% (p = 0.001) and 25.1% (p = 0.001), regarding to initial values in the 5 and 10 mg groups, respectively. Symptom prevalence was significantly less at the end of treatment and 6 months later. Six months after treatment fibroid size was 21% and 19% less than the initial value in the 5 and 10 mg mifepristone groups, respectively, and uterine volume was 2 % and 0.2% less than initial values in the 5 and 10 mg groups, respectively. There was no endometrial hyperplasia in any of the treatment groups.
CONCLUSIONS: The 5 mg dose had an efficacy similar to the 10 mg dosage and 6 months after termination of the treatment fibroid and uterine sizes were close to pre-treatment values but a notable clinical improvement was maintained.
Key words: Mifepristone, leimyoma, fibroma, antiprogestagens.
INTRODUCCIÓN
El fibroma uterino es el tumor benigno más frecuente de las mujeres en edad reproductiva.1 Es conocida su mayor incidencia en la raza negra.2 La ausencia de un tratamiento médico con alta eficacia ha hecho que la cirugía sea el procedimiento más común en esta patología. Los análogos de la GnRH han sido ampliamente utilizados pero sus efectos secundarios (hipoestrogenismo) limitan la duración del tratamiento.3,4 La embolización de la arteria uterina es un tratamiento eficaz pero invasivo y no exento de complicaciones.5
Se desconoce el mecanismo exacto de la génesis del fibroma uterino pero se acepta que los esteroides influyen en su evolución, de hecho se ha demostrado la existencia de receptores para estrógenos y progestágenos en el mismo.6-8
El antiprogestágeno conocido como mifepristona ha demostrado tener una eficacia igual o superior a los análogos de la GnRH en el tratamiento del leiomioma.9,10
Álvarez-Murphy y otros, consiguieron regresiones del tamaño de los fibromas del 44 % y 51 % utilizando dosis de 25 y 50 mg de mifepristona diarias durante 3 meses, respectivamente.11,12
Posteriormente Eisinger y otros, obtuvieron resultados similares utilizando dosis de 5 y 10 mg diarios durante 6 meses, pero con una alta tasa de hiperplasias simples endometriales al final del tratamiento.13
Steinauer y otros, realizan una revisión bibliográfica que concluye que sí hay reducción del tamaño de los miomas y mejoría sintomatológica pero advierte de un posible efecto adverso: las hiperplasias endometriales.14
En su segundo estudio, Eisinger y cols, continuación del anterior, administrando las mismas dosis hasta 12 meses no obtuvo beneficios añadidos respecto de los 6 primeros meses de tratamiento, a excepción de una significativa reducción del número de hiperplasias simples derivada de una relectura diagnóstica de las mismas, no hallándose ninguna hiperplasia simple en el grupo de 5 mg.15
Fiscella y otros(2006), demuestran una importante mejoría en la calidad de vida de las pacientes tratadas con 5 mg de mifepristona diarios durante 6 meses, con una tasa nula de hiperplasia simple con esta dosis de 5 mg.16
Este trabajo pretende eliminar el sesgo que se produjo en nuestros 2 primeros estudios, ya que el primero evaluaba la eficacia a los tres meses y el segundo evaluaba su eficacia a los 6 meses postratamiento.17,18 En el primer estudio se consiguieron reducciones del volumen del fibroma del 45 % y 55 % y del 57 % y 40 % del volumen uterino en los grupos de 10 y 5 mg respectivamente, así como una notable mejoría sintomatológica. 17En el segundo estudio, a los 6 meses postratamiento, los valores del útero y del fibroma eran 19 %, 23 % y 8 % y 17 % menores que al inicio del tratamiento en los grupos de 10 y 5 mg, respectivamente.18 En este trabajo se unifican ambos propósitos en otro grupo de 100 mujeres. En un estudio realizado en Nicaragua con similar protocolo se obtuvieron resultados similares a nuestro primer estudio,19 se mantenía aún una muy notable mejoría clínica en más del 90 % de las pacientes.
Los objetivos de este estudio fueron evaluar la eficacia, seguridad y duración de la mejoría clínica obtenida en el tiempo de la administración de 5 vs. 10 mg diarios de mifepristona en el tratamiento del fibroma.
MÉTODOS
Es un ensayo clínico aleatorizado, a doble ciegas, con dos grupos de tratamiento. El estudio fue aprobado por el Comité Científico del Hospital Docente Ginecoobstétrico "Eusebio Hernández" de Ciudad de La Habana, Cuba.
Las mujeres fueron reclutadas a partir de la consulta de clasificación de ginecología del hospital y de las remitidas por las policlínicas de las áreas de salud. Todas las mujeres dieron su consentimiento informado para participar en el estudio. Los criterios de inclusión y exclusión ya fueron descritos así como la procedencia de la mifepristona empleada en el mismo.17
El Grupo I (n = 50) recibió una cápsula diaria de 10 mg de mifepristona oral durante 3 meses. El Grupo II (n=50) recibió una cápsula diaria de 5 mg de mifepristona oral durante 3 meses.
Se realizó ultrasonografía abdominal del útero antes del inicio del tratamiento, a los 3, 6 y 9 meses después de iniciado el mismo. El volumen del fibroma se calculó por la fórmula siguiente: 4p abc/3 donde a, b y c son los radios de la esfera en cada uno de los 3 planos y se expresa en centímetros cúbicos.20 Si la mujer tenía más de un mioma se tomó la medida del mayor de ellos y sus variaciones fueron utilizadas para la evaluación de la eficacia. El volumen total del útero se midió por la fórmula descrita antes. Por ultrasonografía se calculó el grosor endometrial en mm. Las mediciones ultrasonográficas fueron realizadas con un ALOKA Co. Ltd. Ultrasound Diagnostic Equipment SSD-4000, Mitaka-SHI, Tokio, Japón y participaron en las mediciones dos médicos especializados en ultrasonografía. Las mediciones realizadas en los diferentes periodos de seguimiento fueron hechas sin que los ultrasonografistas tuvieran conocimiento del resultado de las mediciones anteriores, solamente conocían la localización del mioma que debían medir en caso de que la mujer tuviera más de un fibroma.
Se tomaron muestras de sangre para determinar los valores de hemoglobina y transaminasas antes del tratamiento, al final y a los 3 y 6 meses después. Se realizó biopsia endometrial antes del inicio y al final del tratamiento. La biopsia se realizó bajo sedación superficial general con curetas metálicas. Las muestras endometriales fueron examinadas e informadas por 3 patólogos del hospital de manera independiente. Las biopsias fueron interpretadas sin previo conocimiento del resultado de la biopsia inicial ni de la dosis de mifepristona recibida por la mujer. La interpretación histológica de las muestras endometriales se hizo teniendo en cuenta las aportaciones realizadas por estudios previos sobre los cambios que ocurren en el endometrio por la acción de la mifepristona.21,22 Las biopsias endometriales se clasificaron como normales si el endometrio estaba en fases secretora o proliferativa normales. La hiperplasia se definió según los criterios de la Organización Mundial de la Salud.23,24 Las biopsias endometriales patológicas fueron evaluadas para la presencia de neoplasia endometrial intraepitelial usando los criterios descritos por Mutter.25
Las variables principales evaluadas fueron los cambios en los volúmenes del fibroma y del útero. Otras variables fueron: los cambios en la prevalencia de los síntomas y signos de la fibromatosis uterina y el grosor endometrial a los 3, 6 y 9 meses. Una vez concluido el tratamiento, las mujeres fueron conscientes de ello y que asistían a consulta para la evaluación de la permanencia de sus efectos en el tiempo y no se les administró ningún tratamiento o placebo. Con ello se eliminó la posibilidad de un efecto placebo como una explicación potencial de la mejoría mantenida en la prevalencia de los síntomas. Los criterios de asignación a uno u otro grupo de tratamiento fueron los mismos que en el primer estudio.17
La reducción esperada del volumen del fibroma fue la variable utilizada para calcular el tamaño de la muestra. Esta se calculó bajo la hipótesis nula de que con 5 mg ó 10 mg de mifepristona el volumen del fibroma se reduciría en un 40 % con respecto a su tamaño original a los 3 meses de tratamiento con cualquiera de las 2 dosis de mifepristona. Un análisis de la potencia indicó que con 40 mujeres en cada grupo de tratamiento era posible detectar ese cambio con un error de Tipo I = 5 % y con una potencia mínima del 80 %.26 El tamaño muestral se incrementó en aproximadamente un 20 %, (50 pacientes en cada grupo, un total de 100 en todo el estudio), para prevenir pérdidas de pacientes durante el curso del tratamiento con mifepristona o por posibles incumplimientos del protocolo.
Los resultados se presentan en frecuencias absolutas, porcentajes, promedios, desviaciones estándar. Para el análisis de los cambios en las medidas de los volúmenes del fibroma y del útero al final del tratamiento, así como a los 3 y 6 meses después de finalizado, se empleó un modelo mixto de efectos fijos con medidas repetidas y sin la inclusión de covariables. Este procedimiento se empleó para el análisis de los cambios del grosor endometrial en cada periodo de evaluación comparando con el valor antes del tratamiento. Se utilizó la prueba de Dunnett para comparar los volúmenes promedio del fibroma y del útero y el grosor endometrial al final del tratamiento, a los 3 y 6 meses después de concluido este, con los respectivos valores antes del tratamiento en cada grupo de mifepristona. La aproximación normal para proporciones se utilizó para la comparación de la prevalencia de síntomas entre los grupos de tratamiento en cada periodo de evaluación. La prueba de Mc Nemar se empleó para el análisis de las ausencia /presencia de síntomas del fibroma dentro de cada grupo de tratamiento. Todas las pruebas fueron de dos colas y p<0,05 fue considerado significativo. El análisis estadístico se realizó por medio del SPSS 11. 5.
RESULTADOS
El estudio comenzó en febrero de 2008 y finalizó en enero de 2009. En ese periodo se incluyeron 100 mujeres en el ensayo clínico. No hubo salidas del estudio ni pérdidas durante el periodo de tratamiento.
Las características generales de las pacientes se muestran en la tabla 1. No hubo diferencias significativas entre los grupos de tratamiento para ninguna de las variables estudiadas.
En total, 8 mujeres tenían diagnóstico de infertilidad asociada al fibroma 6/52 (7,7 %) del grupo de 10 mg y 2/48 (4,2 %) del grupo de g mg, p=0,087.
Había un mioma único en 27/52 (51,9 %) de las mujeres del grupo de 10 mg y en 24/48 (50,0 %) sujetos del de 5 mg de mifepristona, p=0,424. En el total de pacientes estudiadas, el 42 % de los fibromas eran subserosos, el 50 % eran de localización intramural y el 8 % eran submucosos sin diferencias significativas entre los grupos (tabla 1).
Tabla 1. Características de las mujeres según grupos de tratamiento
| Características | 10 mg (n = 52) | IC 95 % del promedio | 5 mg (n = 48) | IC 95 % del promedio | p |
| Edad (años) | 41,2 ± 6,3 | 38,4 – 41,4 | 41,1 ± 5,8 | 38,6 – 41,4 | 0,956* |
| IMC (kg/m2) | 25,0 ± 4,5 | 23,8 – 26,3 | 24,8 ± 4,2 | 23,4 – 25,7 | 0,787* |
| Gravidez | 3,7 ± 3,4 | 2,7 – 3,9 | 2,7 ± 2,2 | 1,9 – 3,1 | 0,070* |
| Paridad | 1,2 ± 1,2 | 0,8 – 1,5 | 1,0 ± 1,0 | 0,7 – 1,3 | 0,345* |
| Abortos | 0,4 ± 0,8 | 0,1 – 0,6 | 0,2 ± 0,5 | 0,0 – 0,6 | 0,284* |
| Volumen fibroma (cc) | 248 ± 325 | 157 – 336 | 177 ± 248 | 104 - 249 | 0,225+ |
| Volumen útero (cc) | 429 ± 303 | 343 – 512 | 413 ± 285 | 329 – 496 | 0,801+ |
| Grosor endometrial (mm) | 6,8 ± 2,9 | 5,9 – 7,6 | 6,5 ± 2,2 | 5,9 – 7,1 | 0,618* |
| Hemoglobina (g/dL) | 11,4 ± 1,5 | 11,0 – 11,8 | 11,5 ± 1,2 | 11,1 – 11,9 | 0,780* |
| ASAT (U/L) | 20,8 ± 8,0 | 18,6 – 23,1 | 18,6 ± 6,0 | 16,7 – 20,2 | 0,124* |
| ALAT (U/L) | 17,9 ± 8,5 | 15,5 – 20,2 | 16,9 ± 8,5 | 14,2 – 19,2 | 0,519* |
| Raza | |||||
| Blanca | 19 [36,5] | 24 – 51 | 19 [39,6] | 26 – 55 | 0,776§ |
| Negra | 19 [36,5] | 24 – 51 | 19 [39,6] | 26 – 55 | |
| Mestiza | 14 [26,9] | 16 – 41 | 10 [20,8] | 10 – 35 |
DE= Desviación estándar ASAT = Aspartato amonitransferrasa
IC = Intervalo de confianza ALAT = Alanino amonitransferrasa
IMC = Índice de masa corporal
* t-test para muestras independientes
+U de Mann-Whitney
§ Chi-cuadrado de Pearson
(Los valores se presentan como promedios ± DE+ o n[%])
En la tabla 2 se presenta la evolución del los tamaños del mioma desde el inicio hasta 6 meses después de concluido el tratamiento. En el grupo de 10 mg de mifepristona se obtuvo una disminución del 38,3 % IC 95 % (29, 46) del volumen del fibroma a los 3 meses de tratamiento, p < 0,001. En el grupo de 5 mg esa reducción fue de 47,5 % IC 95 % (39, 56), p<0,001. No hubo disminución del tamaño del fibroma, cuando se comparó con los valores iniciales, en 7/52 (13,5 %) casos del grupos de 10 mg y en 6/48 (12,5 %) mujeres del grupo de 5 mg, respectivamente, p=0,443.
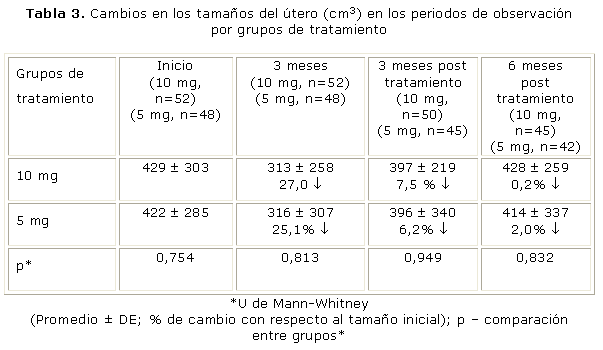
En la tabla 3 se presenta la evolución del los tamaños del útero desde el inicio hasta 6 meses después de concluido el tratamiento. En el grupo de 10 mg las reducción del volumen del útero a los 90 días de tratamiento fue 27,0 % con respecto al valor inicial, IC 95 % (18, 35), p=0,001. En el grupos de 5 mg de mifepristona esa reducción fue 25,1 % IC 95 % (18, 34), p=0,001. No hubo disminución en el volumen del útero en 13/52 (25,0 %) casos del grupo de 10 mg y en 9/48 (18,7 %) mujeres del grupo de 5 mg, respectivamente, p=0,226.
Al final del tratamiento estaban en amenorrea 45/52 (86,5 %) mujeres del grupo de 10 mg y 46/48 (95,8 %) del grupo de 5 mg, p=0,052. Los sofocos estuvieron presentes en 11/52 (21,2 %) y 10/48 (20,8 %) mujeres de los grupos de 10 y 5 mg, respectivamente, p=0,484. Solamente 2 pacientes refirieron náuseas (1 en cada grupo de tratamiento) y 4/52 (7,7 %) y 2/48 (4,2 %) participantes de los grupos de 10 y 5 mg dijeron que habían tenido fatiga/cansancio en ocasiones durante el tratamiento, p=0,229.
La tabla 4 contiene la prevalencia de los síntomas atribuibles al fibroma y la comparación de esta según grupos de tratamiento. En ambos grupos de mifepristona la prevalencia de todos los síntomas al final del tratamiento, 3 y 6 meses después de concluido el mismo fueron mucho menores que al inicio y en todos los casos las diferencias fueron significativas.
Tabla 4. Prevalencia de los síntomas del fibroma antes, al final, 3 y 6 meses después del tratamiento según grupos
| Síntomas / Grupos de tratamiento | Inicio (10 mg, n=52) (5 mg, n=48) | 3 meses (10 mg, n=52) (5 mg, n=48) | 3 meses postratamiento (10 mg, n=48) (5 mg, n=44) | 6 meses postratamiento (10 mg, n=45) (5 mg, n=42) |
| Dolor pélvico, p | 0,020 | 0,109 | 0,182 | 0,170 |
| 10 mg | 43 (82,7) | 7 (13,5) | 10 (20,8) | 10 (22,2) |
| 5 mg | 31 (65,6) | 11 (22,9) | 6 (13,6) | 6 (14,3) |
| Presión pélv, p | 0,411 | 0,308 | 0,086 | 0,083 |
| 10 mg | 25 (48,1) | 3 (5,8) | 2 (4,2) | 2 (4,4) |
| 5 mg | 22 (45,8) | 4 (8,3) | 0 (0,0) | 0 (0,0) |
| Alt. Urinarias, p | 0,333 | 0,477 | 0,475 | 0,485 |
| 10 mg | 15 (28,8) | 1 (1,9) | 1 (2,1) | 1 (2,2) |
| 5 mg | 12 (25,0) | 1 (2,1) | 1 (2,3) | 1 (2,4) |
| Dolor rectal, p | 0,212 | ---- | ---- | ---- |
| 10 mg | 12 (23,1) | 0 (0,0) | 0 (0,0) | 0 (0,0) |
| 5 mg | 8 (16,7) | 0 (0,0) | 0 (0,0) | 0 (0,0) |
| Dolor lumbar, p | 0,291 | 0,291 | 0,465 | 0,299 |
| 10 mg | 31 (59,6) | 2 (3,8) | 2 (4,2) | 2 (4,4) |
| 5 mg | 26 (54,2) | 3 (6,2) | 2 (4,5) | 1 (2,4) |
| Dispareunia, p | 0,296 | ---- | ---- | ---- |
| 10 mg | 20 (38,5) | 0 (0,0) | 0 (0,0) | 0 (0,0) |
| 5 mg | 21 (43,8) | 0 (0,0) | 0 (0,0) | 0 (0,0) |
| Hipermenorrea | 0,288 | 0,291 | 0,180 | 0,261 |
| 10 mg | 33 (63,5) | 3 (5,8) | 6 (12,5) | 5 (11,1) |
| 5 mg | 33 (68,8) | 5 (10,4) | 3 (6,8) | 3 (7,1) |
| Metrorragia | 0,179 | 0,135 | 0,175 | 0,299 |
| 10 mg | 10 (19,2) | 1 (1,9) | 3 (6,2) | 2 (4,4) |
| 5 mg | 6 (12,5) | 3 (6,2) | 1 (2,3) | 1 (2,4) |
Nota: Los valores se presentan como n (%)
Ninguna mujer presentó hiperplasia simple en la biopsia endometrial realizada en el proceso de captación de pacientes. Se tomaron 100 muestras de endometrio para estudio anatomopatológico post tratamiento. Hubo 4 muestras que no fueron útiles para diagnóstico, una en el grupo de 10 mg y tres en el 5 mg. En la biopsia postratamiento se diagnosticaron 80 endometrios secretores, 44/52 (84,6 %) en el grupo de 10 mg (17 de ellos con glándulas quísticas) y 36/48 (75,0 %) en el grupo de 5 mg (19 de ellos con glándulas quísticas). Hubo 10 diagnósticos de endometrio proliferativo, 5 (9,6 %) en el grupo de 10 mg y 5 (10,4 %) en el de 5 mg. Hubo un caso (1,9 %) de maduración irregular del endometrio en el grupo de 10 mg y 4 (8,3 %) en el de 5 mg. En una mujer del grupo de 10 mg se diagnosticó endometrio atrófico. No hubo diagnóstico de hiperplasia simple en ninguno de los dos grupos de tratamiento con mifepristona.
Los valores de las transaminasas hepáticas al final del tratamiento estuvieron dentro de valores normales excepto en una mujer del grupo de 10 mg de mifepristona que tuvo 55 UI de ALAT (valor normal máximo de 49). (Tabla 5).
En el grupo de 10 mg de mifepristona, 10/52 (19,2 %) mujeres tenían hemoglobina por debajo de 10,0 g/dL al inicio del tratamiento y al final 3/52 (2,5 %) estaban por debajo de 10 g/dL, p=0,022. En el grupo de 5 mg, al inicio del tratamiento 5/48 (10,4 %) mujeres tenían hemoglobina menor que 10 g/dL y 3/48 (6,3 %) tenían hemoglobina menor que 10 g/dL, p=0,210, al final del tratamiento.
En la consulta de seguimiento a los 3 meses después de concluido el tratamiento, fueron remitidas a consulta de cirugía 6 mujeres, 2 del grupo de 10 mg de mifepristona y 4 del grupo de 5 mg, todas con hipermenorrea y dolor pélvico, 4 de ellas refirieron "sentirse igual que antes" del tratamiento. Las 6 pacientes estaban completamente asintomáticas a la finalización del tratamiento.
En la consulta de 6 meses después del fin del tratamiento se remitieron a consulta de cirugía a 2 mujeres que habían recibido 10 mg de mifepristona, ambas con hipermenorrea y dolor pélvico, una de ellas refirió que se "sentía igual que antes" del tratamiento. Estas 2 pacientes estaban asintomáticas a la finalización del tratamiento. En total, 8 mujeres del estudio fueron remitidas a consulta de cirugía y se realizó histerectomía en todas.
DISCUSIÓN
Tratamiento
No se consideró la utilización de un grupo placebo en el estudio para no privar a las pacientes de ninguna posibilidad terapéutica, ya que hay evidencia reportada de que la mifepristona en dosis bajas reduce el tamaño del fibroma y produce alivio de la sintomatología asociada y mejoría del estado general de la mujer. Durante los meses de seguimiento programado, de las mujeres que tenían diagnóstico de infertilidad asociada al fibroma ninguna quedó embarazada a diferencia de nuestro primer estudio.17
Hay que señalar que no hubo diferencias significativas entre las dos diferentes dosis de mifepristona utilizadas en ninguna de las siguientes variables: 1) disminución del volumen del fibroma, 2) disminución del volumen uterino, 3) disminución en la prevalencia de los síntomas del fibroma y 4) efectos secundarios atribuibles a la mifepristona.
Las disminuciones de los volúmenes del fibroma son comparables a otros estudios que utilizan dosis similares de mifepristona,9,17,27 y superiores a otros.13 Nuestros porcentajes son similares también a los obtenidos por Fiscella y otros, administrando dosis de 5 mg durante el doble de tiempo que en nuestro estudio.16 Las disminuciones de los volúmenes uterinos obtenidas en este estudio son ligeramente inferiores a las obtenidas por Eisinger y cols, que utiliza las mismas dosis pero en periodos de tratamiento dos y cuatro veces superiores al nuestro: 6 y 12 meses.13,15
La gran mayoría de las pacientes experimentaron mejoría en los síntomas más importantes: dolores pélvico, lumbar, rectal, sangramiento uterino, etc., comparable a la de otros estudios, incluso de aquellos que extienden el tratamiento hasta 6 ó 12 meses.13-15
A juzgar por las disminuciones de volúmenes uterinos y del fibroma y la mejoría sintomática en los estudios publicados hasta la fecha que administran el tratamiento hasta 6-12 meses, no parece ser grande el beneficio añadido de la prolongación del tratamiento más allá de los 3 meses ya que los porcentajes de reducción del volumen uterino y del fibroma son muy similares a los que se obtienen con 3 meses de tratamiento y la mejoría sintomática es prácticamente la misma.13,15
Los efectos secundarios de mayor importancia producidos por la mifepristona fueron los sofocos y la amenorrea. Estos datos concuerdan con los obtenidos en otros estudios que utilizan 5 y 10 mg de mifepristona.13,16,17
Los altos porcentajes de amenorrea obtenidos en ambos grupos son los responsables, clínicamente hablando, del aumento de la hemoglobina y por tanto de la mejoría de la anemia. Estos porcentajes, 86,5 % y 95,8 % en los grupos de 10 y 5 mg, respectivamente, son comparables a los obtenidos en otros estudios que utilizan dosis e intervalos de tratamiento similares a los de nuestro estudio.9,10, 17,27
En el grupo de 5 mg se obtuvo una tasa de sofocos casi el doble, 20,8 %, que la obtenida en nuestro anterior estudio, 10 %.17
El 1% (1 caso) de elevación de las transaminasas obtenido en este estudio es inferior a los reportados en otros estudios.11,13,17,27 En este estudio la elevación de las transaminasas tuvo una significación clínica poco menos que nula, ya que 55 UI sobre un valor de referencia máximo de 49 es un aumento casi despreciable. Fiscella y otros no obtiene ninguna alteración en este parámetro en su estudio.16 Es probable que algunas de estas alteraciones de las transaminasas sean aleatorias o debidas a causas no relacionadas con la mifepristona.
No hubo ninguna hiperplasia simple postratamiento y contrasta con el 13,9 % de hiperplasias simples en el grupo de 10 mg reportadas por Eisinger y cols que administró la mifepristona durante 6 meses.13 En nuestro trabajo anterior se obtuvo una única hiperplasia en una paciente tratada con 10 mg de mifepristona17. En este sentido, el porcentaje nulo de hiperplasias en el grupo de 5 mg de nuestro estudio coincide con los resultados de 0 hiperplasia reportados por otros estudios con 5 mg de mifepristona también.15,16,21
Seguimiento
A los 6 meses después de finalizado el tratamiento no hubo diferencias significativas en la prevalencia de los síntomas con respecto al día 90 del tratamiento. En este estudio la hipermenorrea a los 6 meses postratamiento no había empeorado a diferencia de lo que ocurrió en nuestro anterior estudio en que fue el único signo que mostró diferencias significativas con los valores postratamiento a los 3 meses.18
Uno de los defectos de este estudio es que no se midió la intensidad de los síntomas y signos, pero hay que decir que en opinión unánime de los investigadores, la intensidad de los síntomas a los 6 meses postratamiento fue en general un poco superior a la del final del estudio, donde fue casi nula, pero siguió siendo muy inferior a la de los síntomas pretratamiento.
Respecto al volumen del fibroma no hubo diferencias significativas entre ambos grupos de mifepristona a los 6 meses postratamiento y los fibromas habían vuelto a valores cercanos al tamaño pretratamiento (19 % menor en el grupo de 10 mg y 21 % menor en el grupo de 5 mg). Los volúmenes uterinos, 6 meses después de concluido el tratamiento, fueron casi iguales a los valores antes del inicio del mismo (0,2 % menor en el grupo de 10 mg y 2 % menor en el grupo de 5 mg).
Sin embargo, a pesar de que los volúmenes, tanto del fibroma como del útero, habían regresado a valores muy cercanos a su tamaño original persistía una paradójica mejoría sintomatológica en la inmensa mayoría de los casos, ya que lo lógico sería que si los volúmenes de los fibromas y úteros habían retornado casi a sus tamaños originales también deberían de haber regresado los síntomas iniciales en una cierta proporción y sin embargo, esto no fue así.
Este es el único estudio que hace un seguimiento en el tiempo de la mejoría sintomatológica y de la reducción de los volúmenes de fibroma y útero obtenidos con la mifepristona, a excepción hecha del estudio de Eisinger y cols, que realizó un irregular seguimiento a una reducida parte de la muestra del estudio: 9/26 (35 %) mujeres.15
Hay que resaltar que 6 meses después de ingerida la ultima cápsula de mifepristona ya había hipermenorrea en el 11,1 % de mujeres en el grupo de 10 mg y 7,1 % en el de 5 mg, respectivamente.
Antes del tratamiento había un 15/100 (15 %) mujeres con hemoglobina inferior a 10 mg/dL y después había 8/100 (8 %), es decir un 47 % menos.
Hay que señalar que los significativos aumentos del grosor endometrial que se produjeron en ambos grupos desaparecieron completamente a los 3 meses postratamiento y estaban dentro de límites normales a los 6 meses postratamiento.
En los que respecta a los escasos efectos secundarios de la mifepristona: náuseas, vómitos, sofocos, desparecieron en todos los casos de ambos grupos en la primera semana postratamiento. La ligerísima elevación de transaminasas que se produjo en un caso (55 UI, valor normal 49 UI) había desaparecido a los 15 días postratamiento.
Los 8 casos que acabaron en histerectomía se podrían considerar como los fallos de este nuevo tratamiento del fibroma uterino, es decir, 8/100 (8 %). De estos 8 casos, en 2 no había disminuido nada el tamaño del fibroma y en otros 4 no se había observado disminución en el tamaño del útero. En todos ellos había una florida sintomatología pretratamiento y en el 5/8 (62,5 %) de ellos el volumen del fibroma era notablemente superior al promedio, independientemente del grupo de tratamiento.
A modo de conclusión se puede decir que a los 6 meses postratamiento los volúmenes del fibroma y del útero presentaban valores cercanos a los pretratamiento en ambos grupos de mifepristona, y a pesar de ello en la mayoría de los casos persistía una notable mejoría clínica. Por tanto, sería preferible utilizar la dosis de 5 mg dada su similar eficacia a la de 10 mg. No parece que disminuir esta dosis de 5 mg, como por ejemplo hacen Eisinger y otros, a 2,5 mg vaya a mejorar nada, a juzgar por los resultados obtenidos en su estudio.28
A modo de recomendaciones se puede decir que:
1) Debería de haberse continuado el seguimiento de la nuestra hasta 9-12 meses postratamiento.
2) El grupo de pacientes que 6 meses después del tratamiento presentan ya dolor son posiblemente candidatas a recibir un segundo ciclo de tratamiento en función de la intensidad de los síntomas.
3) Los futuros estudios deberían de medir la intensidad de los síntomas al inicio y en las posteriores evaluaciones.
4) Hay que realizar estudios con ciclos de tratamiento y seguimiento más largos a fin de determinar la duración idónea del tratamiento y la periodicidad del mismo. Aunque en este sentido los futuros estudios deberían ampliar el periodo de seguimiento a 9-12 meses o más, a fin de poder determinar de forma genérica cuando sería necesaria la administración de un segundo ciclo de tratamiento. Independientemente de la norma general que se implante, es obvio que siempre habrá casos individuales que en función de su evolución personal necesitarán antes o después otro ciclo de tratamiento.
Este nuevo método de tratamiento del fibroma aporta un nuevo enfoque terapéutico y de confirmarse definitivamente su eficacia y seguridad se estaría ante una alternativa que disminuiría o incluso eliminaría la necesidad de la cirugía al poder manejar una paciente con repetidos ciclos de tratamientos periódicos de 3 a 6 meses de duración cada 6, 9 ó 12 meses.
También la utilización de la mifepristona prequirúrgica al igual que acontece con los análogos de la GnRH, mejora notablemente a la paciente desde el punto de vista hemático principalmente mejorando las condiciones quirúrgicas tal y como demuestran Engman y cols.29
Agradecimientos
Queremos agradecer la valiosa cooperación de Miguel Errasti e Iris Villa.
REFERENCIAS BILBIOGRÁFICAS
1. Vollenhoven B. Introduction: The epidemiology of uterine leiomyoma. Baillieres Clin Obstet Gynecol. 1998;12:169-76.
2. Marshall LM, Spiegelman D, Barbieri RL. Variation in the incidence uterine leiomyoma among premenopausal women by age and race. Obstet Gynecol. 1997;90:967-73.
3. Lethaby A, Vollenhoven B, Sowter M. Pre-operative GnRH analogue therapy before hysterectomy or myomectomy for uterine fibroids. Cochrane Database Syst Rev. 2001;2:CD000547.
4. Matta WH, Shaw RW, Nye M. Long-term follow-up of patients with uterine fibroids after treatment with the LHRH agonist buserelin. BJOC. 1989;96:200-6.
5. Hurst BS, Stackhouse DJ, Matthews ML, Marshburn PB. Uterine artery embolization for symptomatic uterine myomas. Fertil Steril. 2000;74:855-69.
6..Wilson EA, Yang F, Reese E. Estradiol and progesterone binding in uterine leiomyomata and in normal uterine tissues. Obstet Gynecol. 1980;55:20-4.
7. Andersen J. Factors in fibroid growth. Baillieres Clin Obstet Gynecol. 1998;12:225-43.
8. Reim MS, Barbier RL, Friedman AJ. Progesterone: a critical role in the pathogenesis of uterine myoma. Am J Obstet Gynecol. 1995;172:14-8.
9. Reinsch RC, Murphy AA, Morales AJ, Yen SSC. The effects of RU 486 and leuprolide acetate on uterine artery blood flow in the fibroid uterus: A prospective, randomized study. Am J Obstet Gynecol. 1994;170:1623-8.
10. Zeng C, Gu M, Huang H. A clinical control study on the treatment of uterine leiomyomata with gonadotropin releasing hormone agonist or mifepristone. Chin Obstet Gynecol. 1998;33:490-2.
11. Alvarez-Murphy A, Kettel LM, Morales AJ, Roberts V, Yen S. Regression of uterine leiomyomata in response to the antiprogesterone RU 486. J Clin Endocrinol Metabol. 1993;76:513-7.
12. Alvarez-Murphy A, Kettel LM, Morales AJ, Roberts V, Yen S. Regression of uterine leiomyomata in response to the antiprogesterone RU 486: dose-response effect. Fertil Steril. 1995:64:187-90.
13. Eisinger SH, Meldrum S, Fiscella K, Le Roux H, Guzick D. Low-dose mifepristone for uterine leiomyomata. Obstet Gynecol. 2003;101:243-50.
14. Steinauer J, Pritts EA, Jackson R, Jacoby A. Systematic review of mifepristone for the treatment of uterine leiomyomata. Obstet Gynecol. 2004;103:1331-6.
15. Eisinger SH, Bonfiglio T, Fiscella K, Meldrum S, Guzick D. Twelve-month safety and efficacy of low-dose mifepristone for uterine myomas. J Min Invasiv Gynecol. 2005;12:227-33.
16. Fiscella K, Eisinger SH, Meldrum S. Effect of mifepristone for symptomatic leiomyomata on quality of life and uterine size. A randomized controlled trial. Obstet Gynecol. 2006;108:1381-7.
17. Carbonell JL, Acosta R, Heredia B, Pérez Y, Yero MC, Valle A. Mifepristone for the treatment of uterine leiomyomas. Obstet Gynecol. 2008;112:1029-36.
18. Carbonell JLL, Acosta R, Pérez Y, Yero MC, Seigler I, Braulio Heredia B. Evolución del leiomioma uterino después del tratamiento con mifepristona. Ensayo clínico aleatorizado. POG. En prensa 2010.
19. Carbonell JLL, Quiróz Rámirez GM, Borge A, Castellón Zapata LE, Cuadra Aragón W, Tomasi G. Mifepristona 5 mg versus 10 mg diarios en el tratamiento del leiomioma. Ensayo clínico aleatorizado. Prog Obstet Ginecol. 2009;10:1-8.
20. Friedman AJ, Barbieri R, Doubilet PM, Fine C, Schiff I. A randomized, double-blind trial of a gonadotropin releasing-hormone agonist (leuprolide) with or without medroxyprogesterone acetate in the treatment of leiomyomata uteri. Fertil Steril. 1988;49:404-9.
21. Brown A, Cheng L, Lin S, Baird DT. Daily low-dose mifepristone has contraceptive potential by suppressing ovulation and menstruation: a doubled blind randomized control trial of 2 and 5 mg per day for 120 days. L Clin Endocrinol Metab. 2002;87:63-70.
22. Baird DT, Brown A, Critchley HOD, Williams AR, Ling S, Cheng L. Effect of long-term treatment with low-dose mifepristone on the endometrium. Hum Reprod. 2003;18:61-8.
23. Silverberg S, Kurman R. Endometrial Carcinoma: Tumors of the uterine corpus and gestational trophoblastic disease. Washington, DC: Armed Forces Institutes of Pathology; 1991:47-89.
24.Scully RE, Bonfiglio TA, Kurman RJ, Silverberg SG, Wilkinson EJ. Uterine corpus. In: Histological typing of female genital tract tumors. New York, NY: Springer-Verlag; 1994:13-31.
25. Mutter GL. EIN Overview: 05/0103, Harvard medical School. [cited 2006 Jan 20] Available from: http://www.endometrium.org/EIN%20Central/EINCentral.htm
26. Lemeshov S, Hosmer D, Flar J, Lwanga S. Adequacy of sample size in health studies. John Wiley and Sons, Chichester, England for World Health Organization; 1990.
27. Yang Y, Zheng S, Li K. Treatment of uterine leiomyomata by two different doses of mifepristone. [In Chinese] Chin Obstet Gynecol. 1996;31:624-6.
28. Eisinger SH, Fiscella J, Bonfiglio T, Meldrum S, Fiscella K. Open-label study of ultra-low dose mifepristone for the treatment of uterine leiomyomata. Eur L Obstet Gynecol. 2009 doi:10.1016/j.ejogrb.2009.06.004.
29. Engman M, Granberg S, Williams AR, Meng CX, Lalitkumar PG, Gemzell-Danielsson K. Mifepristone for treatment of uterine leiomyoma. A prospective randomized placebo controlled trial. Hum Reprod. 2009;1:1-10.
Recibido: 3 de enero de 2010.
Aprobado: 18 de enero de 2010.
Dr. Josep Lluis Carbonell Esteve. Clínica Mediterránea Médica. C/ Salvador Guinot, 14. Valencia 46017, España. Teléf: 34 96 358-6020. Fax: 34 96-3785485. Correo electrónico: schja@infomed.sld.cu; josepcarbon@yahoo.es