Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Obstetricia y Ginecología
versión On-line ISSN 1561-3062
Rev Cubana Obstet Ginecol v.36 n.4 Ciudad de la Habana oct.-dic. 2010
OBSTETRICIA
Evidencias de la regulación del estado redox materno entre las 30 y 36 semanas de gestación
Evidences of the maternal redox state regulation among the 30 and the 36 weeks of pregnancy
Elio Cruz ManzanoI; Jesús Corría OsorioII; María Milanés OjeaIII; Yaila Ramírez SuárezIV; Mercedes Sierra NuñezV; Margarita Cruz JorgeVI
IMáster en Bioquímica Clínica. Profesor Auxiliar. Universidad de Ciencias Médicas de Granma. Filial de Ciencias Médicas. Bayamo, Cuba.
IIEspecialista en Medicina General Integral. Instructor. Centro Nacional de Genética e Inmunología Médicas. La Habana, Cuba
IIIEspecialista en Bioquímica Clínica. Profesora Asistente. Universidad de Ciencias Médicas de Granma. Filial de Ciencias Médicas. Bayamo, Cuba.
IVEspecialista en Laboratorio clínico. Instructora. Hospital Universitario "Carlos Manuel de Céspedes". Bayamo, Cuba.
VLicenciada en Tecnología de la salud: Laboratorio Clínico. Instructora. Universidad de Ciencias Médicas de Granma. Filial de Ciencias Médicas. Bayamo, Cuba.
VILicenciada en Tecnología de la salud: Nutrición. Instructora. Centro Provincial de Higiene y Epidemiología. Bayamo, Cuba.
RESUMEN
El embarazo es un estado fisiológico caracterizado por un incremento regulado estrictamente de los procesos oxidativos. El riesgo de estrés oxidativo puede depender del estado antioxidante materno, el cual protege potencialmente a la unidad materno-fetal incrementando el crecimiento intrauterino y el peso del neonato.
OBJETIVO: Mostrar evidencias de la regulación del estado redox materno entre las 30 y 36 sem de gestación fisiológica.
MÉTODOS: Se realizó un estudio observacional, analítico y transversal que incluyó a 36 gestantes saludables con feto único, similar edad, peso y edades gestacionales entre 30 y 36 sem. Como indicadores de defensa antioxidante se determinaron el potencial reductor férrico del suero, la actividad de la superóxido dismutasa extracelular y la concentración de glutatión reducido en eritrocitos. Como indicador de lipoperoxidación se determinó la concentración de malondialdehído. Se determinó además la concentración de hemoglobina, hierro sérico y la glicemia, así como, el índice de masa corporal (IMC) y su variación. Basados en la metodología de análisis de senderos, se contrastaron modelos de ecuaciones estructurales con las variables estudiadas.
RESULTADOS: El potencial reductor férrico y la concentración sérica de malondialdehído correlacionaron positivamente con la actividad sérica de la superóxido dismutasa y con la concentración de glutatión reducido, contribuyendo más el malondialdehído que el potencial reductor férrico a su variación. La glicemia también se relacionó directamente con la peroxidación lipídica y con los indicadores del estado antioxidante.
CONCLUSIONES: Las gestantes incluidas en el estudio tuvieron un adecuado balance redox y el malondialdehído o algún otro producto de la peroxidación lipídica pueden estar relacionados con la estimulación de respuestas protectoras para mantener el mismo.
Palabras clave: Gestación, balance redox, peroxidación lipídica, estado antioxidante.
ABSTRACT
Pregnancy is a physiological status characterized by a strictly controlled increase of oxidative processes. The risk of this oxidative process may to depend on the mother antioxidant status, which to potentially protect the mother-fetus unit increasing the intrauterine growth and the neonate weight.
OBJECTIVE: To show evidences of mother redox satus regulation among the 30 and the 36 weeks of physiological pregnancy.
METHODS: A cross-sectional, analytical and observational study was conducted including 36 healthy pregnants wit a single-fetus, and similar weight and gestational age between 30 and 36 weeks. As antioxidant defense indicators were determined the potential serum-ferric reduction agent, the extracellular superoxide dismutase and malondialdehyde concentration. It was also determined the hemoglobin ,serum ferric and glycemia, as well as the body mass index (BMI) and its variation. Based on the methodology of routes analysis there were structural equations forms with study variable.
RESULTS: The ferric redactor potential and the serum concentration of malondialdehye were positively correlated to serum activity of superoxide dismutase and to the reduced glutathione concentration were the malondialdehyde contributes more than the ferric redactor potential and its variation. Glycemia also was directly related to lipid peroxidation and to antioxidant status indicators.
CONCLUSIONS: Pregnants included in present study had a suitable redox balance, and the malondialdehyde or some other product of lipid peroxidation may be related to stimulation of protective responses for its maintenance.
Key words: Pregnancy, balance, redox, peroxidation, lipid, antioxidant status.
INTRODUCCIÓN
El embarazo es un estado fisiológico caracterizado por un incremento regulado estrictamente de los requerimientos tisulares de procesos oxidativos, determinado por el aumento en el consumo de oxígeno y porque los cambios vasculares, del músculo liso y del tejido conectivo que en él ocurren, implican una gran dependencia del balance prooxidantes-antioxidantes.1,2 Es por ello que constituye una condición que incrementa la susceptibilidad al estrés oxidativo. Las evidencias de tal afirmación, la han aportado estudios en que se ha informado un aumento en la producción de O2- (radical anión superóxido) y productos de la peroxidación lipídica tales como: hidroperóxidos, malondialdehído (MDA) y otras sustancias reactivas al ácido tiobarbitúrico, que alcanzan sus concentraciones máximas durante el segundo trimestre, y entonces declinan hasta el término.3-5 Paralelamente se ha comprobado un aumento progresivo en la actividad de varios sistemas antioxidantes, principalmente hacia el 3er trimestre, tales como la glutatión peroxidasa en eritrocitos y la superóxido dismutasa extracelular (SODec),3,4 presumiblemente como respuesta homeostática al incremento de los intermediarios reactivos que pudiera explicar el descenso de estos últimos en el 3er trimestre. En una gestación normal la proporción prostaciclinas/tromboxanos es mayor que la unidad, sugiriendo la efectividad de los sistemas antioxidantes sobre el estrés oxidativo.6 Datos recientes muestran que niveles fisiológicos de especies reactivas del oxígeno (ERO) en determinadas etapas de la gestación, pueden regular la función celular, a través del control de la producción y activación de sustancias con gran actividad biológica, capaces de activar muchas vías de señalización intracelular.7 Las bajas concentraciones de ERO estimulan la proliferación celular, así como, la expresión de diversos genes relacionados con la morfogénesis, entre ellos los que codifican para muchos factores de transcripción.8 Por otra parte para muchos investigadores no hay duda que la influencia de las ERO y las especies reactivas del nitrógeno (ERN) sobre la circulación útero-placentaria es esencial para garantizar una morfogénesis adecuada, un buen crecimiento fetal y por ende un buen peso al nacer.1,9
En los últimos años, bajo el amparo de las teorías que tratan de explicar el origen fetal de muchas enfermedades crónicas de la adultez, se ha asociado un mayor riesgo de padecer hipertensión arterial, diabetes mellitus, hipercolesterolemia y otras enfermedades cardiovasculares con el antecedente de bajo peso al nacer.10
El período perinatal y el parto en particular son críticos en el mantenimiento del balance entre la producción de especies reactivas y el desarrollo incompleto de la protección antioxidante del feto y neonato. El parto representa un estrés oxidativo para el feto, el cual pasa de un espacio intrauterino hipóxico a un ambiente oxigenado.11
El estrés oxidativo del neonato puede estar relacionado con el parto o con la existencia del mismo en el feto.12 El riesgo puede depender del estado antioxidante materno, el cual protege potencialmente a la unidad materno-fetal incrementando el crecimiento intrauterino y el peso del neonato.13
Es importante comprender cómo el organismo materno regula el balance redox durante el 3er trimestre de la gestación, específicamente entre las 30 y 36 sem, período crítico en la ganancia de peso por el feto. El presente estudio tuvo como objetivo mostrar evidencias de la regulación del
balance redox materno entre las 30 y 36 sem de la gestación fisiológica.
MÉTODOS
Se diseñó un estudio observacional, analítico y transversal. La muestra incluyó a 36 gestantes saludables, que recibían atención prenatal en el Policlínico "Jimmy Hirzel" de la ciudad de Bayamo, Granma, Cuba. Cada paciente dio por escrito su consentimiento, y el estudio fue aprobado por el Comité de Ética del Policlínico "Jimmy Hirzel". Las gestantes seleccionadas tenían edades y pesos similares, con feto único y edad gestacional entre 30 y 36 sem. Las muestras de sangre fueron recolectadas entre las sem 30 y 36 de la gestación (210 y 252 días después de la fecha de la última menstruación). La concentración de MDA se cuantificó a través de la técnica descrita por Yagi K14 (valor de referencia 0,69 ± 0,47)15. La actividad de la SODec se determinó utilizando el método que emplea pirogalol según el PNO/TEC/0326 del Centro de Estudios para las Investigaciones y las Evaluaciones Biológicas del Instituto de Farmacia y Alimentos de la Universidad de la Habana, (valor de referencia 1,45± 0,15).16 El poder reductor férrico (FRP) del plasma, se determinó según el ensayo de Bahr y Basalto, (valor de referencia 600-1200 ìmol/L).17 La concentración de glutatión reducido (GSH) eritrocitario se determinó según el método colorimétrico de Beutler, (valor de referencia 6,57± 1,04).18 Se consultó la historia clínica obstétrica para calcular los valores de las variables: índice de masa corporal (IMC) en el 1er y 3er trimestre y su variación, obtener los de las variables edad materna, edad gestacional, glucemia del 1er y 3er trimestre, concentración de hemoglobina en el 1er y 3er trimestre. La concentración de hierro sérico en el 3er trimestre se determinó según el método enzimático implementado para usar el Kit HELFA DIAGNÓSTICO cubano.
Se empleó el análisis de sendero para valorar la relación entre los indicadores del estado redox, así como los demás indicadores maternos en un modelo de efectos directo en indirecto. Se empleó el método de mínimos cuadrados generalizados para determinar los parámetros del modelo y la prueba chi2 (x2) (p ‹ 0,05) para valorar la bondad del ajuste del modelo propuesto. Los modelos se analizaron con el paquete estadístico Statitisca for Windows, versión 6.3 (StaSoft, Tulsa, OK).
RESULTADOS
Como muestra la tabla 1, las medias de los descriptores maternos evaluados en nuestro estudio se encuentran dentro del rango de valores considerados normales para la gestación. Estos resultados confirman el estado saludable de las pacientes incluidas en la muestra para poder estudiar el comportamiento de algunos indicadores del balance redox durante la gestación fisiológica y sus posibles implicaciones en su regulación.
En cuanto a los indicadores del estado redox materno entre las 30 y 36 sem de gestación, tabla 2, nuestros resultados arrojaron un incremento significativo (p< 0,001) de la concentración de glutatión eritrocitario y de la actividad sérica de la superóxido dismutasa extracelular de 1,68 y 6,35 veces respectivamente, en comparación con los valores de referencias poblacionales de las técnicas empleadas. Entre tanto no existieron diferencias significativas entre la concentración plasmática de malondialdehído y el poder reductor férrico con respecto a sus valores de referencia.
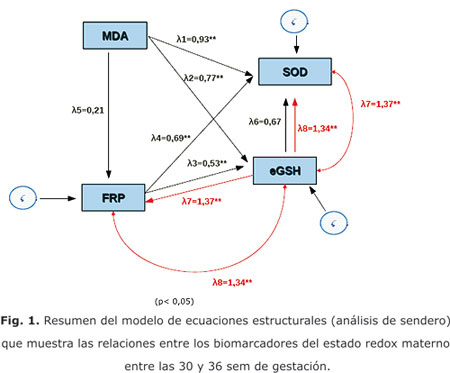
La figura 1 muestra las relaciones entre los indicadores del estado redox materno resultantes del modelo de ecuaciones estructurales, el cual fue estadísticamente significativo (p < 0,05) con un buen ajuste de los datos, según indicó el valor cercano a cero de la función de discrepancia.
Una correlación directa y significativa (p<0,01) fue encontrada entre el poder reductor férrico y la concentración sérica de malondialdehído, con la actividad sérica de la superóxido dismutasa extracelular, y la concentración de glutatión eritrocitario. El malondialdehído contribuyó más que el poder reductor férrico a la variabilidad de estos indicadores, según los valores de los coeficientes del modelo, lo que sugiere que la peroxidación lipídica desempeña un papel importante en la regulación del sistema antioxidante. La correlación directa entre la concentración de glutatión eritrocitario y el poder reductor férrico, correlacionó directa y significativamente (p < 0,01) con la actividad de la superóxido dismutasa extracelular y es la que más contribuyó a su variación; mientras que la correlación directa entre la concentración de glutatión eritrocitario y la actividad sérica de la superóxido dismutasa, correlacionó directa y significativamente con el poder reductor férrico (p < 0,01) y de forma similar a la correlación anterior, contribuyó valiosamente a su variación.
La figura 2 muestra las relaciones entre los indicadores del estado redox materno y los niveles en el 3er trimestre de hierro total, hemoglobina y glucemia, además de la variación del IMC entre el 1er y 3er trimestre, resultantes de cuatro modelos de ecuaciones estructurales, los cuales fueron estadísticamente significativos (p < 0,01) con un buen ajuste de los datos, según indicó el valor cercano a cero de sus funciones de discrepancia.
Como se muestra en la figura 2, solamente los niveles de hemoglobina y glucemia correlacionaron directa y significativamente (p < 0,05) con los de glutatión eritrocitario, sus contribuciones a la variación de los niveles de este indicador son muy similares. Entre tanto solo la glucemia correlacionó directa y significativamente (p < 0,00001) con el poder reductor férrico y el malondialdehído, mientras que la glucemia y la variación del IMC correlacionaron de forma directa y significativa (p < 0,0001) con la actividad de la superóxido dismutasa, la glucemia contribuyó más a la actividad de la enzima que la variación del IMC (V-IMC). Es muy llamativa la correlación directa de la glucemia con todos los indicadores, lo que sugiere que el metabolismo de la glucosa desempeña un rol regulador del estado redox.
DISCUSIÓN
El término regulación redox es usado para describir un proceso en el cual las señales son originadas a partir de la química redox.19-22 Normalmente las especies reactivas existen en las células y tejidos en bajas concentraciones, pero son medibles, las que están determinadas por el balance entre su velocidad de producción y la de eliminación por varios sistemas antioxidantes.19,20 La regulación redox se manifiesta cuando este estado de equilibrio es desestabilizado por un incremento temporal en la formación de especies reactivas o una disminución en la actividad de los sistemas antioxidantes. En organismos superiores, estos eventos oxidativos pueden ser inducidos de forma muy regulada a través de la activación de los sistemas generadores endógenos de ERO y ERN. Si el incremento inicial de las especies reactivas (ER) es relativamente pequeño, la respuesta antioxidante puede ser suficiente para compensar tal incremento y restaurar el balance inicial del estado redox. Con el paso del tiempo estos mecanismos tienden a mantener un estado de equilibrio estable llamado homeostasis redox. 19,20
En nuestro estudio encontramos un incremento significativo de la actividad sérica de la SODec y de la concentración de GSH eritrocitario en el periodo gestacional evaluado, con respecto a los valores de referencias poblacionales de la técnicas utilizadas. Por su parte en la muestra estudiada, la peroxidación lipídica, medida a través de los niveles de MDA sérico, no está aumentada de forma significativa con respecto a los valores de referencia, lo que puede deberse en parte al efecto regulador de estos componentes sobre el estado redox. Las ventajas para la gestación de un incremento en la actividad de la SODec y los niveles de GSH, están ampliamente descritas.1,19,23,24
Nuestros resultados indican que un incremento de la peroxidación lipídica (malondialdehído) se asocia con incremento de los niveles de GSH eritrocitario y de la actividad sérica de la SODec. Esto lo consideramos como una expresión de un mecanismo de regulación redox en la gestación normal.
Existen evidencias que muestran un rol específico de la peroxidación lipídica en la regulación redox. El 4-hidroxi-2-nonenal (4HNE), un producto de este proceso, puede activar la expresión de la hemo-oxigenasa -1 (HO-1) y de la ferritina, lo cual se considera una estrategia defensiva contra la peroxidación lipídica mediada por el hierro.24 Además existen evidencias de que el 4HNE puede aumentar la síntesis de GSH a través de la inducción de la síntesis de la enzima reguladora del proceso, la glutamato-cisteína ligasa.25-27 Se ha comprobado también que varios intermediarios y productos de la peroxidación lipídica inducen la expresión de enzimas de fase II, que emplean al GSH como cofactor.19,25 Con respecto a la relación peroxidación/SODec, no hay evidencias experimentales de que intermediarios y/o productos de este proceso se relacionen directamente con su expresión, sin embargo, no es desacertado conjeturar un mecanismo que implique al 4-hidroxi-2-nonenal en la expresión de esta enzima, ya que este producto de la peroxidación lipídica ha mostrado ser un potente inductor de varias vías de señalización relacionadas con la protección del estrés oxidativo.28-31
El 4HNE en el rango subtóxico de concentración induce marcadamente la formación y activación del factor de transcripción AP-1 en varios tipos celulares, entre los que se incluyen las células del músculo liso vascular, a través de la activación de la vía JNK o p38/c-Jun/AP-1.28-31 Por su parte se ha informado que este factor de transcripción puede inducir la expresión de las tres isoformas de la SOD.32 El tipo celular mencionado es la principal fuente de la SODec vascular.23 Esta estrategia defensiva podría ser muy ventajosa, toda vez que estimula positivamente a una enzima fase I, la superóxido dismutasa (SOD), del sistema implicado en el control de la peroxidación lipídica. Esto es solo un modelo, el mecanismo propuesto debe ser confirmado experimentalmente.
Otro hallazgo de la investigación lo constituye la correlación directa del FRP con la actividad sérica de la SODec y la concentración de GSH eritrocitario. Sin embargo, el hecho de que el MDA contribuya más que el FRP a la variabilidad de la SODec y del GSH, es reflejo de que estos sistemas antioxidantes han evolucionado para ser muy sensibles a los productos de los procesos oxidativos que ellos controlan. Además, estos resultados confirman que la peroxidación lipídica desempeña un papel importante en la regulación del sistema antioxidante de la SODec y el GSH.
Nuestros resultados sugieren que la interacción entre la concentración de GSH eritrocitario y el FRP, rinde un efecto positivo sobre la actividad de la SODec. Se ha reportado que altos niveles de radicales libres y peróxidos lipídicos pueden inactivar esta enzima.11 En este sentido, altos niveles del FRP indican una buena capacidad antioxidante del suero lo que contribuye a un buen estado reductor extracelular, entre tanto altos niveles de GSH eritrocitario indican un buen estado reductor intracelular, lo cual implica menor flujo de radicales libres y especies reactivas hacia el compartimiento extracelular, contribuyendo también a un buen estado reductor en este y por consiguiente a una buena actividad de la SODec.
Por otro lado, la interacción entre la concentración de GSH y la actividad de la SODec rinde un efecto positivo sobre el FRP. Un incremento en la actividad de la SODec implica una mayor velocidad de extracción de radical anión superóxido y por tanto disminuye el consumo de moléculas antioxidantes que contribuyen al FRP. Entre tanto altos niveles de GSH eritrocitario provocan un menor flujo de radicales libres y especies reactivas hacia el compartimiento extracelular, produciendo un efecto sobre el FRP del suero, similar al del incremento de la actividad de la SODec.
Nótese que los efectos de las interacciones son los que más contribuyen a la variación de la actividad sérica de la SODec y el FRP. Este sinergismo e interrelación denota integridad del sistema antioxidante, y es muestra de su eficiencia y operatividad para mantener un buen estado reductor.
Nuestros resultados muestran que un incremento en los niveles de glucosa sanguínea se correlaciona con un incremento de la peroxidación lipídica, la actividad de la SODec, la concentración de GSH eritrocitario y del FRP. Varios estudios han demostrado que la hiperglucemia induce un incremento de la peroxidación lipídica,33-37 lo que se corresponde con nuestros resultados. Bajo estas circunstancias, y en la ausencia de una respuesta antioxidante compensadora adecuada, el sistema se deteriora, resultando en desequilibrio del estado redox. Las especies reactivas que se producen en este contexto, producen daño celular a través de la activación persistente de varias vías de señalización intracelular sensibles al estrés tales como NF-êB, p38 MAPK, JNK, PKC, AGE/RAGE, sorbitol entre otras,34-38 lo que incrementa la expresión de numerosos productos génicos que causan daño celular y participan de forma relevante en la etiología de la insulino-resistencia.33-37 Precisamente durante la gestación existe una disminución fisiológica de la sensibilidad a la insulina. Por tal motivo el embarazo es considerado un factor de riesgo de la insulino resistencia.37,38
Como la hiperglucemia se asocia con estrés oxidativo, es plausible plantear que dentro de estos mecanismos reguladores se activen también los de regulación redox. De modo que las correlaciones directas entre la glucemia y los indicadores de defensa reportadas en nuestro estudio, las consideramos reflejo de mecanismos de regulación redox encaminados a participar en el control del metabolismo de la glucosa en la gestación fisiológica.
El mecanismo que proponemos es el siguiente: bajo condiciones fisiológicas, nótese que las pacientes de nuestro estudio presentan valores de glucemia en el rango de la normalidad, un incremento temporal y ligero o moderado de la glucosa sanguínea, produce un incremento de la generación de especies reactivas, y por consiguiente estrés oxidativo transitorio. Bajo estas circunstancias, se pueden activar temporalmente y sin alcanzar la barrera de toxicidad celular, las vías de señalización sensibles al estrés, que pueden inducir la expresión y la síntesis de varias enzimas y compuestos antioxidantes, entre los que se encuentran la SODec y GSH, los que se encargarían de retornar el sistema al estado de equilibrio redox, controlando también los efectos negativos de la activación prolongada de las vías de señalización sensibles al estrés, ya que se ha demostrado que estas se inhiben cuando aumenta el potencial reductor.20
El vínculo glucemia-FRP lo explicamos como consecuencia del aumento de la actividad de la SODec y los niveles de GSH inducido por la glucemia, a través del efecto de la interacción de estos sobre el FRP.
Otro resultado obtenido fue la correlación directa entre los niveles de hemoglobina en el 3er trimestre y la concentración de GSH. La interrelación entre las propiedades antioxidantes del eritrocito y su metabolismo es un factor crucial para su supervivencia. La habilidad de estas células para persistir en la circulación y mantener a la hemoglobina en un estado soluble y no oxidada depende principalmente del estado redox. Por tanto, mientras mayor sea la concentración del GSH mayor será la protección de la estructura de la hemoglobina y por consiguiente de su función.
En conclusión, los resultados del estudio sugieren que el aumento de la actividad de sistemas antioxidantes endógenos como el glutatión reducido y la superóxido dismutasa extracelular constituye una respuesta protectora de la gestante en el período analizado ante el incremento de los procesos relacionados con el aumento de la lipoperoxidación.
REFERENCIAS BIBLIOGRÁFICAS
1. Biondi C, Pavan B, Lunghi L, Fiorini S, Vesce F. The role and modulation of the oxidative balance in pregnancy. Curr Pharm Des. 2005;11:2075-89.
2. Agarwal A, Gupta S, Sikka S. The role of free radicals and antioxidants in reproduction. Curr Opin Obstet Gynecol. 2006;18:325-32.
3. Qanungo S, Mukherjea M. Ontogenic profile of some antioxidants and lipid peroxidation in human placental and fetal tissues. Mol Cell Biochem. 2000;215:11-9.
4. Uotila, J, Tuimala, R, Aarnio T, Pyykko K, Ahotupa M. Lipid peroxidation products, selenium-dependent glutathione peroxidase and vitamin E in normal pregnancy. Eur J Obstet Gynecol. Reprod Biol. 1991;42:95-100.
5. Tamura T, Olin KL, Goldenberg RL, Johnson KE, DuBard MB, Keen CL. Plasma extracellular superoxide dysmutase activity in healthy pregnant women is not influenced by zinc supplementation. Biol Trace Elem Res. 2001;80:107-14.
6. Dale A, Dickinson H, Forman J. Cellular glutathione and thiols metabolism. Biochemical Pharmacology. 2002;64:1019-26.
7. Sugino N, Takiguchi S, Umekawa T, Heazell A, Caniggia I. Oxidative Stress and Pregnancy Outcome: A Workshop Report. Placenta 28, Supplement A, Trophoblast Research. 2007;21:S48eS50.
8. Lunghi L, Ferretti M, Medici S, Biondi C, Vesce F. Control of human trophoblast function. Reproductive Biology and Endocrinology. 2007;5:6.
9. Carrascosa A. Crecimiento intrauterino: factores reguladores. Retraso de crecimiento intrauterino. An Pediatr. 2003;58(Supl 2):55-73.
10. Luo ZC, Fraser WD, Julien P, Deal CL, Audibert F, Smith GN, et al. Tracing the origins of " fetal origins'' of adult diseases: Programming by oxidative stress? Medical Hypotheses. 2006;66:38-44.
11. Meriem Saker, Nassima Soulimane Mokhtari, Sid Ahmed Merzouk, Hafida Merzouk, Boumediene Belarbi, Michel Narce. Oxidant and antioxidant status in mothers and their newborns according to birthweight. European Journal of Obstetrics & Gynecology and Reproductive Biology. 2008; 141:95-9.
12. Lurie S, Matas Z, Boaz M, Fux A, Golan A, Sadan O. Different degrees of fetal oxidative stress in elective and emergent cesarean section. Neonatology. 2007;92:111-5.
13. Buonocore G, Perrone S. Biomarkers of oxidative stress in the fetus and newborn. Hematology. 2006;2:103-7.
14. Yagi K. Assay for blood plasma or serum. Methods Enzymol, 1984;105:328-31.
15. Ilhan N, Ilhan N, Simsek M. The changes of trace elements, malondialdehyde levels and superoxide dismutase activities in pregnancy with or with or without preeclampsia. Clinical Biochemistry. 2002;35:393-7.
16. Boehringer M. Biochemical Information. A revised biochemical reference sources Enzymes for routine (1th edition). Germany: Boehringer Mannheim; 1987.
17. Bahr P. El Potencial Reductor Férrico (FRAP). Un ensayo para evaluar la capacidad antioxidante en suero. Revista Correo Científico Médico de Holguín. 2004;4(8).
18. Beutler E. Improved methods for determination of blood glutathione. J Lab Clin Med. 1963;61:882-90.
19. Valko M, Leibfritz D, Moncol J, Cronin MTD, Mazur M, Telser J. Free radicals and antioxidants in normal physiological functions and human disease. The International Journal of Biochemistry & Cell Biology. 2007;39:44-84.
20. Dröge W. Free Radicals in the Physiological Control of Cell Function. Physiol Rev. 2002;82:47-95.
21. Frein D, Schildknecht S, Bachschmid M, Ullrich V. Redox regulation: A new challenge for pharmacology Biochemical Pharmacology. 2005;70:811-23.
22. Schafer FQ, Buettner GR. Redox environment of the cell as viewed through the redox state of the glutathione disulfide/glutathione couple. Free Radic Biol Med. 2001;30:1191-1212.
23. Filomena G, Ottaviano BS, Handy DE, PhD, Loscalzo J, MD, PhD. Redox Regulation in the Extracellular Environment. Circulation Journal. 2008;72, January:1-16.
24. Girotti AW. Lipid hydroperoxide generation, turnover, and effector action in biological systems. Journal of Lipid Research.1998;39.
25. Franco R, Schoneveld OJ, Pappa A, Panayiotidis MI. The central role of glutathione in the pathophysiology of human diseases. Archives of Physiology and Biochemistry. 2007;113(4-5):234 -58.
26. Yadav S, Zajac E, Singhal SS, Awasthi S. Linking stress signaling, glutathione metabolism, signaling pathways and xenobiotic transporters. Cancer Metastasis Rev. 2007;26:59-69.
27. Rahman I, Adcock IM. Oxidative stress and redox regulation of lung inflammation in COPD. Eur Respir J. 2006;28:219-42.
28. Uchida K ‡, Shiraishi M, Naito Y, Torii Y, Nakamura§ Y, Osawa T. Activation of Stress Signaling Pathways by the End Product of Lipid Peroxidation. The Journal of Biological Chemistry.1999;274(4):2234-42.
29. Lee SJ, Seo KW, Yun MR, Bae SS, Lee WS, Hong KW, et al. 4-Hydroxynonenal enhances MMP-2 production in vascular smooth muscle cells via mitochondrial ROS-mediated activation of the Akt/NF-êB signaling pathways. Free Radical Biology & Medicine. 2008; 45:1487-92.
30. Awasthi YC, Sharma R, Sharma A, Yadav S, Singhal SS, Chaudhary P, et al. Self-regulatory role of 4-hydroxynonenal in signaling for stress-induced programmed cell death. Free Radical Biology & Medicine. 2008;45:111-8.
31. Forman HJ, Dickinson DA. Introduction to serial reviews on 4-hydroxy-2-nonenal as a signaling molecule. Free radical biology & medicine. 2004;37(5):594-96.
32. Miao L, St. Clair DK. Regulation of superoxide dismutase genes: Implications in disease, Free Radic Biol Med. 2009;10:1016.
33. Kaneto H, Katakami N, Kawamori D, Miyatsuka T, Sakamoto K, Matsuoka T, et al. Involvement of oxidative stress in the pathogenesis of diabetes. Antioxidants & Redox signaling. 2007;9(3):355-66.
34. Maiese K, Morhan SD, Chong ZZ. Oxidative Stress Biology and Cell Injury During Type 1 and Type 2 Diabetes Mellitus. Curr Neurovasc Res. 2007;4(1):63-71.
35. Bonnefont-Rousselot D. Glucose and reactive oxygen species. Curr Opin Clin Nutr Metab Care. 2002;5:561-8.
36. Ceriello A. Oxidative stress and glycemic regulation. Metabolism. 2000;49(2):27-9.
37. Chen X, Md, Scholl TO. Oxidative Stress: Changes in pregnancy and with gestational diabetes mellitus. Current diabetes reports. 2005;5:282-8.
38. Evans JL, Goldfine ID, Maddux BA, Grodsky GM. Are Oxidative Stress-Activated Signaling Pathways Mediators of Insulin Resistance and B-Cell Dysfunction? Diabetes. 2003;52:1-8.
Recibido: 15 de septiembre de 2010.
Aprobado: 3 de octubre de 2010.
MsC. Elio Cruz Manzano. Universidad de Ciencias Médicas de Granma. Filial de Ciencias Médicas de Bayamo. Carretera a Santiago de Cuba Km 3 ½ : Bayamo. CP. 85100. Granma, Cuba. Correo electrónico: ecruz@fcmb.grm.sld.cu