Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Obstetricia y Ginecología
versión impresa ISSN 0138-600X
Rev Cubana Obstet Ginecol vol.39 no.3 Ciudad de la Habana jul.-sep. 2013
GINECOLOGÍA Y SALUD REPRODUCTIVA
Implicaciones de la trasmisión del VIH a partir de espermatozoides humanos durante la fecundación
Implications of HIV transmission from human sperm during fertilization
Jurany Andrea Sánchez,MD,I Walter Cardona-Maya,PhD,II María Teresa Rugeles PhDI
I Grupo Inmunovirología. Facultad de Medicina, Universidad de Antioquia. Medellín, Colombia.
II Grupo Reproducción. Facultad de Medicina, Universidad de Antioquia. Medellín, Colombia.
RESUMEN
Introducción: leucocitos seminales son considerados la fuente de infección del VIH durante la transmisión sexual, a pesar de haberse descrito interacción entre espermatozoides y virus.
Objetivo: determinar la capacidad de espermatozoides de individuos VIH-positivos, de transmitir el virus a macrófagos.
Métodos: espermatozoides puros, tratados o no con tripsina, de 14 pacientes VIH-1 positivos fueron cocultivados con macrófagos. La interacción celular fue evaluada por microscopía de luz. A partir del ADN de espermatozoides y de los cocultivos se realizó una PCR-anidada para el gen env.
Resultados: se comprobó interacción de espermatozoides con macrófagos mediante cabeza, cuello y cola. En el ADN de espermatozoides no se detectó ADN proviral. Sin embargo, se detectó el gen env en el ADN de los cocultivos a las 4 y 24 horas en 50 % y 87,5 % de las tratadas con tripsina y en un 43 % y 28,6 % de las no tratadas, respectivamente.
Conclusión: el virus entra al espermatozoide siendo capaz de trasmitirlo a macrófagos. Así, durante la fecundación, natural o asistida, este podría entrar al oocito y establecer una infección productiva en el embrión, transmitiendo la infección a la madre. La tripsina podría potenciar la trasmisión viral, al facilitar la entrada de viriones a macrófagos.
Palabras clave: espermatozoide, transmisión vertical, VIH, infección.
ABSTRACT
Introduction: seminal leukocytes are considered the source of HIV infection during sexual transmission, although the interaction between sperm and virus has been described.
Objective: the aim of this study was to determine the ability of sperm from HIV-positive individuals to transfer the virus to macrophages.
Methods: pure sperm from 14 HIV-1 infected patients treated or not with trypsin were cocultured with macrophages. Cell interaction was evaluated by light microscopy. Nested-PCR for the env gene from sperm and cocultures DNA was performed.
Results: macrophages sperm interaction through head, neck and tail was found. Proviral DNA was not detected within sperm DNA. However, the env gene was detected in DNA from the cocultures at 4 and 24 hours in 50% and 87.5% of those treated with trypsin and in 43% and 28.6% of the non treated cultures, respectively.
Conclusion: the virus enters the sperm, and this cell is capable of transferring the virus to macrophages. Thus, during natural or assisted fertilization, viral particles might enter into the oocyte, establishing a productive infection in the embryo, and transmitting the infection to the mother. Trypsin could enhance viral transmission by facilitating entry of virions into macrophages.
Key words: spermatozoa, vertical transmission, HIV, infection.
INTRODUCCIÓN
En la actualidad más de 33,3 millones de personas están infectadas con el virus de la inmunodeficiencia humana 1 (VIH-1) alrededor del mundo, y anualmente ocurren 2,6 millones de nuevas infecciones.1 En Colombia, se estima que el número de individuos infectados con el VIH es de 160 000,1 para una prevalencia de la infección del 0,4 % - 0,7 %,2 la mayoría de infectados son hombres entre 25 y 35 años , con una razón de 3:1 con respecto a las mujeres infectadas.2
Aunque la probabilidad de contagio del VIH por relaciones sexuales es baja, estas continúan siendo la principal fuente de transmisión en el mundo.1 De ahí que la principal medida de prevención sea el uso del preservativo, que a su vez impide la concepción natural. Sin embargo, el aumento de la supervivencia y la mejor calidad de vida de los pacientes seropositivos, debido a los tratamientos antirretrovirales, han motivado el interés de las parejas serodiscordantes de tener hijos, buscando métodos de reproducción asistida, tratando de minimizar el riesgo de transmisión.3
En las parejas serodiscordantes en las cuales el seropositivo es el hombre, es importante tener en cuenta la disminución de la fertilidad, por los cambios de los parámetros seminales,4 los cuales se han relacionado con el recuento de linfocitos T CD4+.5 Así mismo, es importante tener en cuenta el riesgo de trasmisión.
Hasta hace unos años se había atribuido la transmisión del virus a las partículas virales que se encuentran en forma libre en el líquido seminal o asociadas a linfocitos y macrófagos, presentes en el eyaculado.6 El espermatozoide no se había considerado como posible fuente de infección, por no expresar sobre su membrana la molécula CD4, que actúa como receptor viral7 y porque varios reportes previos indicaron que estas células no albergaban ADN proviral.8,9 Sin embargo, se ha reportado la interacción del virus con el espermatozoide a través de otras moléculas como el receptor de manosa,10,11 el galactosil alkil acilglicerol12 y más recientemente el heparán sulfato.13
De otro lado, recientemente este grupo4 y otros,7,14,15 han logrado detectar ADN proviral en espermatozoides puros provenientes de individuos VIH positivos por medio de PCR anidada. Sin embargo, según los estudios observacionales, el lavado en los programas de reproducción asistida en parejas serodiscordantes, disminuye el riesgo de trasmisión,16 debido a que no se puede decir que es 100 % seguro, al no haber ensayos clínicos controlados que lo confirmen, además de encontrar reportes de casos de seroconversión del hijo o la madre, que fueron sometidos a este procedimiento.17-21 Más aún, una revisión de la literatura reciente indica que el lavado de semen no permite tener certeza absoluta de que no habrá trasmisión de la infección,22 situación que es imposible verificar experimentalmente, por consideraciones éticas.
El objetivo del presente trabajo fue determinar la capacidad de los espermatozoides humanos provenientes de individuos VIH-1 positivos para transmitir el virus a células susceptibles, teniendo en cuenta la importancia que los resultados tendrían en el entendimiento de la fisiopatología y trasmisión de la infección por el VIH, así como el impacto que podría tener para el manejo de la concepción en parejas serodiscordantes.
MÉTODOS
Las muestras de semen fueron donadas por 14 individuos VIH-1 positivos quienes estaban recibiendo terapia antirretroviral. Todos los participantes firmaron el consentimiento informado; este estudio fue aprobado por el comité de ética del Instituto de Investigaciones Médicas de la Universidad de Antioquia.
Purificación de la fracción de espermatozoides
Las muestras de semen se obtuvieron por masturbación después de 3 a 5 días de abstinencia sexual. Luego de la licuefacción, se realizó la evaluación de los parámetros seminales convencionales y se procedió con la separación de la fracción de espermatozoides puros. Brevemente, 0,5 mL de semen fueron separados usando dos gradientes diferenciales (ALLgrad® 90 % y 45 %, Life Global, Turkey), mediante centrifugación a 560 x g por 22 min. El botón de células fue resuspendido en 2 mL de medio RPMI-1640 (Gibco®, Grand Island, NY, USA) y centrifugado a 300 x g por 7 minutos; la fracción de espermatozoides móviles fue resuspendida en 1 mL de medio RPMI-1640 (Gibco®, Grand Island, NY, USA). Finalmente, se evaluó la pureza de las células espermáticas, por microscopía de luz, verificando la ausencia de células redondas.
Tratamiento de los espermatozoides con tripsina
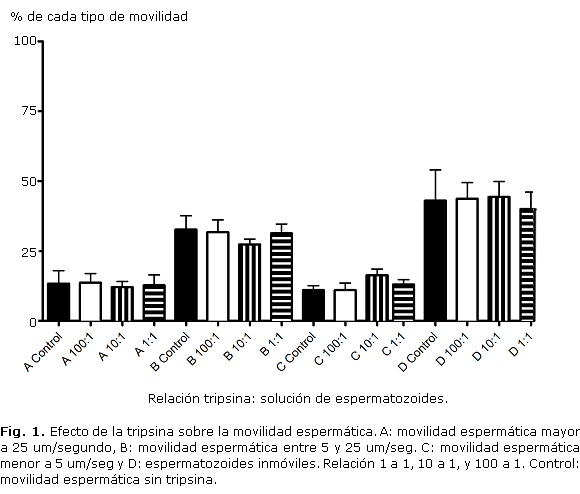
Con el objetivo de eliminar partículas virales que pudieran encontrarse adheridas a la superficie de los espermatozoides purificados, estas células se incubaron con tripsina a 37°C en 5 % CO2 por 15 min en 3 proporciones diferentes (1 a 1, 10 a 1 y 100 a 1, volumen a volumen); posteriormente, se centrifugaron a 300 x g por 8 min y fueron resuspendidas en 300 uL de medio. Con el fin de evaluar el efecto de la tripsina sobre la calidad espermática se evaluó la movilidad espermática por microscopía de luz.
Cultivo primario de macrófagos
Se realizó la separación de mononucleares mediante un gradiente de densidad usando Ficoll (HISTOPAQUE®-1077, Sigma Chemical Co., St Louis, MO, USA). Brevemente se diluyeron 50 mL de sangre desfibrinada en buffer fosfato salino (PBS, Sigma Chemical Co., St Louis, MO, USA) en una relación 1:1. Posteriormente, se recuperó la capa de células mononucleares y se lavaron mediante centrifugación a 550 x g por 10 minutos; el botón obtenido se resuspendió en 20 mL de PBS (Sigma Chemical Co., St Louis, MO, USA), y se centrifugó nuevamente. Las células fueron resuspendidas en 15 mL de medio RPMI-1640 (Gibco®, Grand Island, NY, USA) suplementado con 0,5 % suero autólogo y sembradas 12´000,000 ± 6´000,000 células mononucleares por pozo en platos de 6 pozos. Se eliminaron 24 h después las células no adheridas mediante tres lavados con PBS (Sigma Chemical Co., St Louis, MO, USA), suplementado con suero bovino fetal al 0,5 %. Finalmente, se dejó el cultivo entre 5 a 6 días para la diferenciación de los monocitos a macrófagos.
Cocultivo macrófagos-espermatozoides
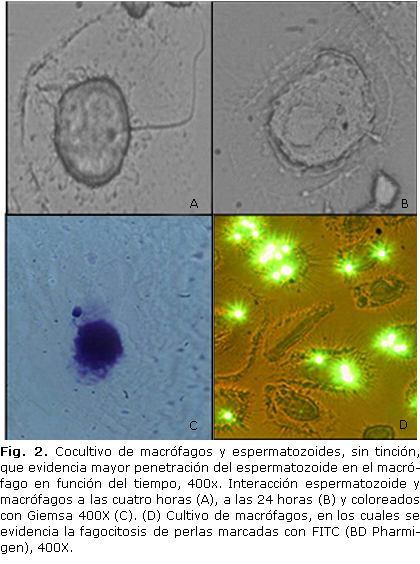
Lograda la diferenciación in vitro de macrófagos, se lavó el plato dos veces con PBS (Sigma Chemical Co., St Louis, MO, USA), se agregaron 0,5 mL de medio RPMI y 0,1 mL de la solución de espermatozoides puros con y sin tratamiento con tripsina, además, no se agregaron espermatozoides a un pozo como control negativo; se incubó a 37°C en 5 % CO2 durante 4 y 24 h. Posteriormente, se lavaron los cocultivos de 3 a 4 veces con 1 mL de PBS (Sigma Chemical Co., St Louis, MO, USA), con el objetivo de eliminar todos los espermatozoides que no estuvieran "fagocitados" o "adheridos" a los macrófagos. Finalmente, las células fueron fijadas con metanol y coloreadas con Giemsa (Novalab®, Medellín, Colombia). Como control positivo se realizaron ensayos en los cuales perlas marcadas con isotiocianato de fluoresceína (FITC) fueron incubadas con los macrófagos, en las mismas condiciones, para observar la capacidad fagocítica de estas células mediante microscopia de fluorescencia. Otros cocultivos se dejaron 7 días en incubación, para luego desprender los macrófagos mecánicamente del plato y extraer el ADN.
Extracción de ácidos nucleicos y PCR para detectar el gen env
Las células de los cocultivos desprendidas de cada pozo fueron centrifugadas a 12 000 x g durante 10 min. Al botón obtenido se le agregó 1 mL de solución de lisis de blancos y 5 uL de proteinasa K; se incubó durante 3 horas a 56°C. Luego se le adicionó a la mezcla 1 mL de fenol cloroformo y se centrifugó a 12 000 x g por 10 min a 4°C. La fase acuosa se transfirió a otro tubo de 2 mL, al cual se le adicionó 1 mL de etanol absoluto y 50 uL de acetato de sodio; posteriomente, se centrifugó a 7 500 x g por 10 min. Se descartó el sobrenadante, se agregó 1 mL de etanol 70 % y se centrifugó a 7 500 x g por 10 min. Finalmente, se descartó el sobrenadante, se dejó secar y el ácido nucleico se resuspendió en 50 uL de agua destilada, libre de ADNasa y ARNasa (Gibco®, Grand Island, NY, USA) y se dejó 1 hora a 56°C.
Posteriormente, se realizó una PCR anidada para la amplificación del gen env al ADN extraído tanto de los espermatozoides puros como de los cocultivos, usando 4,5 ul de ADN y los siguientes primers para la primera ronda: ED3 (5'-TTA GGC ATC TCC TAT GGC AGG AAG AAG CGG-3') y ED14 (5'CTT GCC TGG AGCTGT TTG ATG CCC CAG AC-3'). Para la segunda ronda, se usó 3 ul del producto de la primera ronda y los primers: ED31 (5-CCT CAG CCA TTA CAC AGGCCT GTC CAA AG-3) y ED33 (5-TTA CAG TAG AAA AAT TCC CCT C-3). La PCR fue llevada a cabo usando el termociclador PTC-100 (MJ Research, USA). EL protocolo seguido para las dos rondas de la PCR fue una temperatura inicial de desnaturalización de 94°C por 3 min; 4 ciclos a 94°C por 1 min, 55°C por 1 min y 72°C por 1 min; luego 32 ciclos a 94°C por 15 seg, 55°C por 45 seg y 72°C por 1 min, para una temperatura final de extensión de 72°C por 7 min, como previamente se había reportado.4 El producto final fue detectado bajo luz U.V con SYBR Green®.
Para corroborar la presencia de ADN y la ausencia de inhibidores de la PCR, se realizó una PCR estándar para detectar una secuencia del exón 4 del gen CCR5.
Análisis estadístico
Se realizó un análisis descriptivo de los datos obtenidos en los 14 cocultivos de espermatozoides y macrófagos, dependiendo de si se obtenía un producto de amplificación en la PCR para el gen env. Para analizar el efecto de las diferentes relaciones de tripsina sobre la movilidad espermática se uso una prueba de Friedman test, en el que se definió una p menor de 0,05 para considerar las diferencias estadísticamente significativas entre células control y tratadas, usando el software GraphPad Prism 5.0.
RESULTADOS
Pureza
Mediante el procedimiento de separación utilizado se logró obtener una muestra de espermatozoides puros siguiendo el protocolo previamente establecido en nuestro laboratorio4 y con el cual se obtiene una pureza del 99,9 %, eliminando todas las células redondas, como fue evidenciado por microscopía de luz.
Efecto del tratamiento con tripsina sobre la movilidad espermática
Al evaluar la movilidad espermática de los espermatozoides tratados con tripsina, se encontró que el tratamiento no afectaba este parámetro, como había sido reportado previamente23 (Fig. 1).
Interacción espermatozoides-macrófagos
Al microscopio de luz, se hizo evidente el contacto de los espermatozoides con el macrófago a través de la cabeza, cuello y la cola, sin ninguna preferencia por alguna de las estructuras (Fig. 2A, 2B, 2C). Además, se observó una mayor penetración del espermatozoide en el macrófago con el paso del tiempo, al observarlos a las 4 y 24 h (Fig. 2A y 2B). La coloración con Giemsa también fue usada para evaluar la interacción (Fig. 2C). De igual forma, mediante microscopía de fluorescencia se observó la interacción de los macrófagos con las perlas marcadas con FITC (Fig. 2D).
Detección del gen env del VIH en espermatozoides puros y en macrófagos expuestos a espermatozoides puros de pacientes VIH-1 positivos
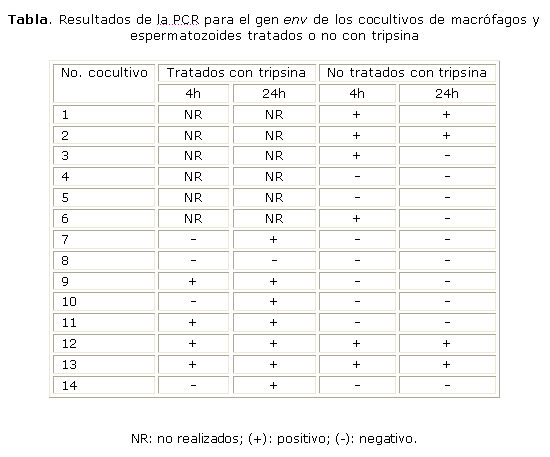
No se logró detectar el gen env por PCR anidada en las muestras de ADN de los espermatozoides puros de los pacientes seropositivos, al igual que en el control negativo.
En el ADN proveniente de los cocultivos, se logró detectar el gen env por PCR anidada en las muestras de espermatozoides provenientes de pacientes VIH-1 positivos a las 4 y 24 h en un 50 % y 87,5 % de las muestras no tratadas con tripsina y en un 43 % y 28,6 % de las tratadas, respectivamente (Tabla).
DISCUSIÓN
Por mucho tiempo se consideró que el espermatozoide no era fuente de infección del VIH al no detectarse ADN proviral en estas células.9,24 De hecho, en este estudio tampoco fue posible detectar el gen env en el ADN de los espermatozoides puros de los 14 pacientes seropositivos. Sin embargo, en estudios previos realizados por estos autores y otros reportes de literatura sí se ha reportado la presencia del ADN viral en células espermáticas puras;4,25,26 estas discrepancias pueden deberse a la sensibilidad de las técnicas usadas en las diferentes investigaciones15 o a que algunas de las muestras provenían de pacientes recibiendo tratamiento antirretroviral, con cargas virales bajas o indetectables, disminuyendo la posibilidad de detección, como en el presente estudio. El hallazgo del ADN proviral en espermatozoides puros,27 sugiere que hay virus dentro del espermatozoide.28 Sin embargo, no se ha logrado detectar replicación viral dentro de esta célula, a pesar de que recientemente se informó la capacidad de la célula espermática y de las células embrionarias de trascribir el ADN proviral del gen gag.29 De hecho en procesos de traducción, detectando la proteína gag p24, solo se ha hecho evidente en células embrionarias.29
Una vez se detectó el gen env en muestras de ADN proveniente del cocultivo entre macrófagos y espermatozoides de individuos VIH positivos, se decidió repetir el experimento utilizando los espermatozoides previamente tratados con tripsina, para evitar que viriones unidos a la superficie de estas células fueran responsables de la infección de macrófagos, dejando esta posibilidad a la trasferencia del virus que esté dentro del espermatozoide, bien sea el genoma viral integrado al genoma humano, en forma episomal o el virión completo. A pesar de este tratamiento se siguió detectando el gen env en muestras de ADN proveniente del cocultivo. Sobre la base de estos resultados y teniendo en cuenta que los espermatozoides puros, utilizados en los cocultivos fueron negativos para el ADN proviral, el ácido nucleico viral que se está detectando en los cocultivos debe ser producto de la replicación viral que se está dando en el macrófago, al aprovechar su maquinaria para transcripción y traducción, la cual está ausente en el espermatozoide.
A pesar de que la tripsina puede inhibir la interacción entre el espermatozoide y el macrófago mediada por los receptores típicos al alterar su conformación habitual, el hecho de que se detectó el gen env en una proporción mayor de las muestras tratadas con tripsina en comparación con las no tratadas, sugiere un efecto potenciador de esta enzima en la trasmisión. Esta potenciación puede tener una de las siguientes explicaciones: 1) la tripsina vuelve más frágil la membrana espermática facilitando la salida del virus alrededor o dentro del macrófago, favoreciendo la fusión de las membrana del fagosoma con la del virión, y por ende la liberación del genoma viral al citoplasma, y 2) la tripsina debilita la membrana espermática, por una digestión generalizada,30 favoreciendo la fagocitosis del espermatozoide por el macrófago, aumentando las posibilidades de fagocitar un espermatozoide "infectado", en comparación con los espermatozoides no tratados.
Basados en los resultados presentados en este artículo y en previos trabajos de este grupo,4,10 se puede concluir que partículas virales del VIH logran entrar al espermatozoide y este es capaz de trasmitirlo a células susceptibles como los macrófagos. Así, en el caso de una fecundación, bien sea natural o asistida, el virus podría entrar al oocito, y una vez dentro de esta célula podría realizar su ciclo de replicación completo. En este caso se daría la infección productiva en el embrión, que puede terminar en un individuo no viable, al darse la integración del genoma viral, o en un individuo infectado, que eventualmente conllevaría a la infección de la madre.
Agradecimientos
Este estudio fue financiado por el Instituto de Investigaciones Médicas (IIM) de la Facultad de Medicina de la Universidad de Antioquia y el Programa de Sostenibilidad 2013-2014 del Grupo de Inmunovirología y del Grupo Reproducción. Este trabajo recibio el Premio al Grupo Investigador del Año en Medicina ASCOFAME- Fundación Medina. Walter Cardona Maya fue becario de Colciencias.
REFERENCIAS BIBLIOGRÁFICAS
1. UNAIDS. Report on the global AIDS epidemic. Geneva: WHO; 2010.
2. Chave TM. Comportamiento del VIH/SIDA durante el 2010 en Colombia. Colombia: Ministerio de la Protección Social; 2011.
3. Royce RA, Seña A, Cates W, Cohen MS. Sexual Transmission of HIV. N Engl J Med. 1997;336(15):1072-8.
4. Cardona-Maya W, Velilla P, Montoya CJ, Cadavid A, Rugeles MT. Presence of HIV-1 DNA in spermatozoa from HIV-positive patients: changes in the semen parameters. Curr HIV Res. 2009;7(4):418-24.
5. Nicopoullos JD, Almeida PA, Ramsay JW, Gilling-Smith C. The effect of human immunodeficiency virus on sperm parameters and the outcome of intrauterine insemination following sperm washing. Hum Reprod. 2004;19(10):2289-97.
6. Haase AT. Perils at mucosal front lines for HIV and SIV and their hosts. Nat Rev Immunol. 2005;5(10):783-92.
7. Kim LU, Johnson MR, Barton S, Nelson MR, Sontag G, Smith JR, et al. Evaluation of sperm washing as a potential method of reducing HIV transmission in HIV-discordant couples wishing to have children. Aids. 1999;13(6):645-51.
8. Mermin JH, Holodniy M, Katzenstein DA, Merigan TC. Detection of human immunodeficiency virus DNA and RNA in semen by the polymerase chain reaction. J Infect Dis. 199;164(4):769-72.
9. Quayle AJ, Xu C, Mayer KH, Anderson DJ. T lymphocytes and macrophages, but not motile spermatozoa, are a significant source of human immunodeficiency virus in semen. J Infect Dis. 1997;176(4):960-8.
10. Cardona-Maya W, Lopez-Herrera A, Velilla-Hernandez P, Rugeles MT, Cadavid AP. The role of mannose receptor on HIV-1 entry into human spermatozoa. Am J Reprod Immunol. 2006;55(4):241-5.
11. Fanibunda SE, Velhal SM, Raghavan VP, Bandivdekar AH. CD4 independent binding of HIV gp120 to mannose receptor on human spermatozoa. J Acquir Immune Defic Syndr. 2008;48(4):389-97.
12. Brogi A, Presentini R, Solazzo D, Piomboni P, Costantino-Ceccarini E. Interaction of human immunodeficiency virus type 1 envelope glycoprotein gp120 with a galactoglycerolipid associated with human sperm. AIDS Res Hum Retroviruses. 1996;12(6):483-9.
13. Ceballos A, Remes Lenicov F, Sabatte J, Rodriguez Rodrigues C, Cabrini M, Jancic C, et al. Spermatozoa capture HIV-1 through heparan sulfate and efficiently transmit the virus to dendritic cells. J Exp Med. 2009;206(12):2717-33.
14. Hanabusa H, Kuji N, Kato S, Tagami H, Kaneko S, Tanaka H, et al. An evaluation of semen processing methods for eliminating HIV-1. Aids. 2000;14(11):1611-6.
15. Meseguer M, Garrido N, Gimeno C, Remohi J, Simon C, Pellicer A. Comparison of polymerase chain reaction-dependent methods for determining the presence of human immunodeficiency virus and hepatitis C virus in washed sperm. Fertil Steril. 2002;78(6):1199-202.
16. Bujan L, Hollander L, Coudert M, Gilling-Smith C, Vucetich A, Guibert J, et al. Safety and efficacy of sperm washing in HIV-1-serodiscordant couples where the male is infected: results from the European CREAThE network. Aids. 2007;21(14):1909-14.
17. Matz B, Kupfer B, Ko Y, Walger P, Vetter H, Eberle J, et al. HIV-1 infection by artificial insemination. Lancet. 1998;351(9104):728.
18. Ross RS, Elgas M, Roggendorf M. HIV-1 transmission through artificial insemination. Lancet. 1998;351(9118):1812-3.
19. Ceballos A, Andreani G, Ayala SE, Romer Y, Rimoldi I, Agosti MR, et al. Epidemiological and molecular evidence of two events of father-to-child HIV type 1 horizontal transmission. AIDS Res Hum Retroviruses. 2004;20(8):789-93.
20. CDC. Epidemiologic Notes and Reports HIV-1 Infection and Artificial Insemination with Processed Semen. Morbidity and Mortality Weekly Report; 1990.
21. Mitha M, Parboosing R, Nzimela A. HIV-negative mother with an HIV-infected child: a diagnostic dilemma. SAMJ: South African Medical Journal. 2009;99:513-4.
22. Eke AC, Oragwu C. Sperm washing to prevent HIV transmission from HIV-infected men but allowing conception in sero-discordant couples. Cochrane Database Syst Rev. (1):CD008498.
23. Tesarik J, Mendoza C. Insights into the function of a sperm-surface progesterone receptor: evidence of ligand-induced receptor aggregation and the implication of proteolysis. Exp Cell Res. 1993;205(1):111-7.
24. Quayle AJ, Xu C, Tucker L, Anderson DJ. The case against an association between HIV-1 and sperm: molecular evidence. J Reprod Immunol. 1998;41(1-2):127-36.
25. Bagasra O, Farzadegan H, Seshamma T, Oakes JW, Saah A, Pomerantz RJ. Detection of HIV-1 proviral DNA in sperm from HIV-1-infected men. AIDS. 1994;8(12):1669-74.
26. Lasheeb AS, King J, Ball JK, Curran R, Barratt CL, Afnan M, et al. Semen characteristics in HIV-1 positive men and the effect of semen washing. Genitourin Med. 1997;73(4):303-5.
27. Alexander NJ. HIV and germinal cells: how close an association? J Reprod Immunol. 1998;41(1-2):17-26.
28. Baccetti B, Benedetto A, Burrini AG, Collodel G, Ceccarini EC, Crisa N, et al. HIV-particles in spermatozoa of patients with AIDS and their transfer into the oocyte. J Cell Biol. 1994;127(4):903-14.
29. Wang D, Kang XJ, Li LB, Xie QD, Gao YS, Huang TH. In vitro study on vertical transmission of the HIV-1 gag gene by human sperm. J Med Virol. 2011;83(1):16-23.
30. Edelman GM, Millette CF. Molecular probes of spermatozoan structures. Proc Natl Acad Sci U S A. 1971;68(10):2436-40.
Recibido: 15 de junio de 2013.
Aprobado: 30 de junio de 2013.
Jurany Andrea Sánchez. Grupo Inmunovirología. Facultad de Medicina, Universidad de Antioquia. Calle 62 Nº. 52-59, laboratorio 532. Medellín, Colombia.Autor para la correspondencia: María Teresa Rugeles. Teléfono: (574) 219 6551; fax: (574) 219 6482. Correo electrónico: mtrugel@udea.edu.co