Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Obstetricia y Ginecología
versión impresa ISSN 0138-600X
Rev Cubana Obstet Ginecol vol.40 no.1 Ciudad de la Habana ene.-mar. 2014
GINECOLOGÍA Y SALUD REPRODUCTIVA
Detección de Chlamydia trachomatis en muestras de exudado endocervical mediante una prueba de diagnóstico rápido y dos técnicas de reacción en cadena de la polimerasa
Detection of Chlamydia trachomatis in endocervical swab using rapid test and two reaction techniques polymerase chain
MSc. Dianelys Rivero Figueroa,I Dra. C. Vivian Kourí Cardellá,II MSc. Consuelo Correa Sierra,II Dra. C. Isabel Martínez Motas,III MSc. Rafael Llanes Caballero,II MSc. Rosa Teresita Barreal González,I MSc. Edel García VegaIV
I Centro Municipal de Higiene y Epidemiología de 10 de Octubre. La Habana, Cuba.
II Instituto de Medicina Tropical "Pedro Kourí". La Habana, Cuba.
III Instituto "Finlay". Centro de Investigación y Producción de Vacunas. La Habana, Cuba.
IV Hospital Militar Central "Dr. Luis Díaz Soto". La Habana, Cuba.
RESUMEN
Introducción: Chlamydia trachomatis es el principal agente bacteriano que produce infecciones de transmisión sexual.
Objetivo: detectar la presencia de C. trachomatis utilizando una prueba de diagnóstico rápido y compararla con la reacción en cadena de la polimerasa (RCP).
Métodos: se procesaron 50 muestras de exudado endocervical, de mujeres sintomáticas del municipio 10 de Octubre. A las muestras se les aplicó la prueba Chlamy-check-1, un ensayo de RCP del gen del plásmido críptico y una RCP en tiempo real (RCP-TR) de la proteína mayor de la membrana externa (MOMP) de C. trachomatis, que fue utilizada como referencia. Se calculó, sensibilidad, especificidad, valor predictivo positivo (VPP) y negativo (VPN).
Resultados: de las muestras estudiadas, 44 resultaron positivas por la prueba rápida, mientras que por la RCP del plásmido críptico solo 3 muestras (6 %) amplificaron. Al aplicar la RCP-TR, 4 muestras (8 %) se confirmaron como positivas, coincidiendo 3 por los tres métodos de diagnóstico. Al evaluar la prueba Chlamy-check-1 frente a la prueba de referencia se observó una sensibilidad de 100 %, mientras que la especificidad fue de 13 %, así como un VPP de 9,1 % y VPN de 100 %. Por el contrario, la RCP del plásmido críptico mostró una sensibilidad y especificidad de 75 y 100 %, respectivamente; un VPP de 100 % y VPN de 97,9 %.
Conclusiones: se obtuvo diferencia entre los porcentajes de positividad detectados con la prueba rápida, y las técnicas de RCP. La baja especificidad de la prueba rápida indica la necesidad de realizar estudios de evaluación de este estuche diagnóstico.
Palabras clave: Chlamydia trachomatis, Chlamy-check-1, reacción en cadena de la polimerasa, plásmido críptico, proteína mayor de la membrana externa (MOMP).
ABSTRACT
Introduction: Chlamydia trachomatis is the leading bacterial agent that causes sexually transmitted infections.
Objective: to detect the presence of C. trachomatis using a rapid test and compare it with the chain reaction (PCR).
Methods: 50 endocervical exudates taken from symptomatic women were processed in Diez de October municipality. The samples were applied the Chlamy-check-1 test, a PCR assay of the cryptic plasmid gene and a real-time PCR (RT-PCR) of major outer membrane protein (MOMP) of C. trachomatis which was used as reference. Sensitivity, specificity, positive (PPV) and negative (NPV) predictive value were calculated.
Results: 44 samples were positive by the rapid test, whereas only three samples (6%) amplified by cryptic plasmid PCR. Applying RT-PCR, 4 samples (8%) were confirmed as positive, 3 samples matched with three diagnostic methods. In assessing the Chlamy-check-1 versus the reference test, 100% of sensitivity was observed, while the specificity was 13%> Also PPV was 9.1% and NPV was 100%. On the contrary, the cryptic plasmid PCR had 75 and 100% of sensitivity and specificity respectively, 100% PPV and 97.9% NPV.
Conclusions: the difference was obtained between the percentages of positivity detected with both the rapid test, and CPR techniques. The low specificity of the rapid test indicates the need for further studies to evaluate this diagnostic kit.
Keywords: Chlamydia trachomatis, Chlamydia check-1, chain reaction polymerase, cryptic plasmid, major outer membrane protein (MOMP).
INTRODUCCIÓN
La infección por Chlamydia trachomatis se considera la más común de las infecciones de transmisión sexual (ITS) de origen bacteriano. La frecuencia de la infección varía entre 2 y 25 %, en dependencia de la población investigada y las técnicas de detección utilizadas.1
En la mujer, esta infección ocasiona uretritis e infección cervical. No obstante, entre 70 y 90 % de los casos tiene un curso asintomático,2 por lo que el diagnóstico tardío favorece el desarrollo de la enfermedad inflamatoria pélvica (EIP) y desencadena complicaciones como el embarazo ectópico, el dolor pélvico crónico y la infertilidad. De ahí, la importancia de un diagnóstico preciso y rápido para evitar la transmisión de la infección y la aparición de posibles secuelas.1,3
Las técnicas de amplificación de ácidos nucleicos (NAAT, del inglés Nucleic Acid Amplification Tests) logran este propósito y constituyen el patrón de referencia para el diagnóstico de C. trachomatis a partir de muestras uretrales, del cérvix y la orina, en virtud de su elevada sensibilidad y especificidad; entre ellas cobra mayor importancia la reacción en cadena de la polimerasa (RCP).4-6 Sin embargo, el elevado costo de estas técnicas dificultan su implementación para un uso masivo en los países con escasos recursos, y conduce al empleo de técnicas de detección de antígenos, que a pesar de su baja sensibilidad en comparación con las pruebas moleculares, agilizan el diagnóstico,7 en particular las pruebas de diagnóstico rápido, diseñadas para utilizar en las consultas médicas como un apoyo al diagnóstico clínico, pues brindan un resultado en alrededor de 20 a 30 min, a través de la interpretación cualitativa del mismo.5,8
En Cuba existen limitados reportes de estudios sobre la frecuencia de infección genital por C. trachomatis. Los primeros trabajos publicados refieren el empleo de técnicas de RCP para estudiar mujeres con antecedentes de infertilidad,9 así como seropositivas al VIH.10 En estos momentos, el país cuenta con una técnica de diagnóstico rápido, Chlamy-check-1 (Vedalab, Francia), que se distribuye y aplica en diferentes centros de salud. Sin embargo, se conoce que estos métodos rápidos pueden generar resultados falsos positivos, por lo que deben complementarse con métodos moleculares de referencia.11-13 El presente estudio se realizó con el objetivo de detectar la presencia de C. trachomatis en muestras de exudado endocervical, utilizando esta prueba rápida, así como comparar esta técnica con técnicas de RCP.
MÉTODOS
Selección de las muestras clínicas
Se procesaron 50 muestras de exudado endocervical, de mujeres en edad reproductiva (15 a 49 años) con dolor abdominal bajo, del municipio 10 de Octubre, en el período comprendido entre los meses de abril y septiembre de 2010.
Se utilizaron 2 hisopos plásticos estériles para la toma de la muestra en el canal endocervical. El primer hisopo se utilizó para la detección de C. trachomatis, mediante la prueba de diagnóstico rápido Chlamy-check-1 (Vedalab, Francia). Mientras que, el segundo se suspendió en el medio de transporte (UTM-RT, del inglés Universal Transport Medium-Room Temperature) (Copan Diagnostics Inc) y se conservó a -70 ºC en el laboratorio de ITS del Instituto de Medicina Tropical "Pedro Kourí" (IPK), hasta la realización de los ensayos de RCP.
Prueba de diagnóstico rápido Chlamy-check-1
Una vez obtenidas las muestras clínicas, se les aplicó el test de diagnóstico rápido Chlamy-check-1 para la detección de C. trachomatis, siguiendo las indicaciones recomendadas por el fabricante (Vedalab, Francia). Esta prueba constituye un ensayo inmunocromatográfico que identifica el antígeno de lipopolisacárido (LPS) específico del género Chlamydia, presente en las muestras de exudados endocervicales y uretrales, en aproximadamente 20 min, utilizando una combinación única de conjugado anticuerpo monoclonal-colorante y anticuerpo en fase sólida.
TÉCNICAS DE RCP PARA EL DIAGNÓSTICO DE C. TRACHOMATIS
Extracción de ADN de las muestras clínicas
Se realizó la extracción de ADN de las 50 muestras clínicas mediante el estuche comercial QIAamp DNA Mini Kit (Qiagen, Alemania), a partir de un volumen de 200 µL del medio de transporte UTM-RT, previa centrifugación a 14 000 x g, a 4 ºC durante 1 h, luego se suspendió el pellet y se procedió a la extracción del ADN, siguiendo las indicaciones del fabricante. El ADN obtenido se almacenó a -20 ºC hasta la realización de las RCP.
RCP en tiempo real (TR) del gen de la b globina humana
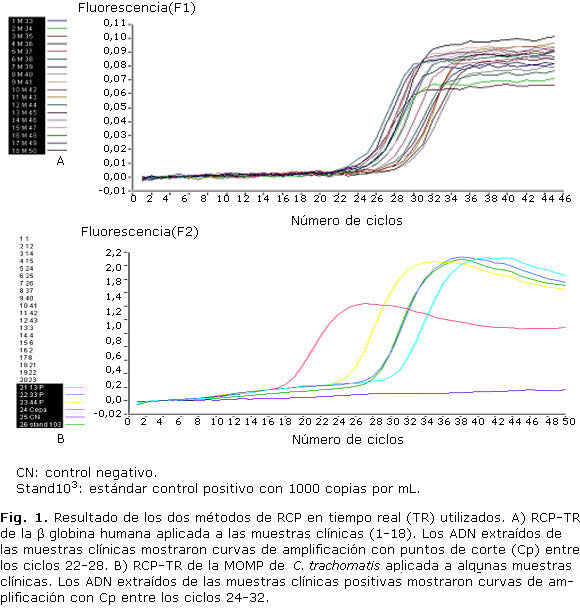
Como control interno de la extracción de ADN de las muestras clínicas se realizó una RCP-TR (metodología TaqMan), empleando un juego de cebadores complementarios a un fragmento del gen que codifica para la proteína b globina humana, según el protocolo descrito por Schmitz y otros.14 Este protocolo de RCP se manejó desde el punto de vista cualitativo, considerando que la muestra era positiva (ausencia de inhibición) si se observaba la aparición de una curva de fluorescencia con un punto de corte (Cp) inferior al ciclo 40. El proceso se llevó a cabo en un equipo LightCycler 1.5 (Roche Diagnostics, Alemania).
RCP del gen del plásmido críptico de C. trachomatis
Se empleó una RCP cualitativa, complementaria a una región del plásmido críptico presente en C. trachomatis, que amplifica un fragmento de 517 pares de base (pb). La reacción de amplificación se realizó en un volumen total de 50 µL, con una mezcla constituida por: 5 µL de tampón de la enzima (Tris-HCL 10 mM pH=9), 8 µL de MgCl2 (25 mM), 0,8 µL dNTPs (25 mM), 1 µL (10 pmoles) de cada cebador, 0,5 µL de enzima Taq ADN polimerasa (5U/µL) (Roche, Alemania) y agua libre de ARNasas y ADNasas para completar el volumen final. La amplificación se realizó en un termociclador (VWR, Doppio, Bélgica), siguiendo los ciclos previamente publicados.15 Como sustrato de la reacción se empleó 5 µL de ADN correspondiente a cada muestra clínica. Se incluyó además, un control negativo que contenía agua libre de ARNasas y ADNasas.
Una vez obtenido el producto de la RCP se observó en un gel de agarosa al 2 %. Las bandas de ADN amplificadas se visualizaron mediante un transiluminador de luz ultravioleta (Uvitec, Francia) y se definieron sus tamaños, empleando un marcador de peso molecular (MPM) de 100 pb (ADN Ladder, Promega, EUA).
RCP-TR cuantitativa del gen de la MOMP de C. trachomatis
Se utilizó como prueba confirmatoria, una RCP-TR comercial que amplifica, detecta y cuantifica un fragmento de 136 pb del gen que codifica para la MOMP (del inglés Major Outer Membrane Protein) de C. trachomatis, empleando el estuche comercial LightMix Kit Chlamydia trachomatis (TIB MOLBIOL, Alemania), que contiene una mezcla de cebadores y probe de hibridación (Light Mix), un control interno (IC Mix) y un estándar de C. trachomatis constituido por un fragmento de ADN del gen que codifica para la MOMP, clonado y purificado, con una concentración en el rango de 106 copias/µL-10 copias/µL. Este ensayo tiene un límite de detección de 10 copias/µL de C. trachomatis.
La mezcla de reacción se realizó en un volumen de 20 µL, compuestos por: 2 µL de Master Mix (FastStar DNA Master HybProbe, Roche, Alemania), 2,4 µL de MgCl2 (25 mM), 2 µL de Light Mix, 2 µL de IC Mix, 6,6 µL de agua y 5 µL de ADN extraído de cada muestra clínica, siguiendo las indicaciones de la casa comercial TIB MOLBIOL. La amplificación se realizó en un equipo LightCycler 1.5 (Roche Diagnostics, Alemania), siguiendo los parámetros de ciclaje recomendados por la casa comercial. El análisis y la cuantificación de las muestras se realizaron de manera automática, empleando el método de la derivación secundaria máxima, versión 3.3 del programa del LightCycler 1.5.
Análisis estadístico
Se calculó sensibilidad, especificidad, valor predictivo positivo (VPP) y valor predictivo negativo (VPN) de la prueba rápida (Chlamy-check-1) y de la RCP de plásmido críptico, para ello se utilizó el programa estadístico Epidat versión 4.0 para Windows. También se realizó cálculo de frecuencia expresada en porcentaje para la presentación de los resultados.
RESULTADOS
Se obtuvieron 44 (88 %) muestras positivas y 6 (12 %) negativas a C. trachomatis mediante la prueba rápida Chlamy-check-1, fueron válidos todos los resultados.
Al determinar la calidad del ADN extraído de las muestras clínicas, se comprobó que todos los ADN generaron curvas de amplificación (indicador de la producción de amplicones), con Cp entre los ciclos 22-28, lo que indicó que no existía ninguna muestra inhibida y que tenían cantidades suficientes de ADN por lo que eran útiles para aplicar los ensayos de RCP (Fig. 1).
Al aplicar el ensayo de RCP del plásmido críptico a los 50 ADN extraídos, solo 3 muestras amplificaron (números 13, 33 y 44, 6 %) (Fig. 2).
De igual manera, mediante la RCP-TR de MOMP (Fig. 1), se confirmaron 4 muestras positivas (números 13, 33, 44 y 34, 8 %), mostrando niveles variables de carga bacteriana: muestra 13: 1,4 x 102 copias/µL, muestra 33: 8,4 x 102 copias/µL, muestra 44: 8,5 x 103 copias/µL y muestra 34: 8,5 x 102 copias/µL, coincidiendo 3 de estas muestras como positivas por las 3 técnicas diagnósticas utilizadas.
Al evaluar el comportamiento de la prueba Chlamy-check-1 frente a la RCP-TR de MOMP (usada como prueba de referencia) se observaron valores de sensibilidad de 100 %, mientras que la especificidad fue de solo de 13 %, así como un VPP de 9,1 % y VPN de 100 %. Por el contrario, la RCP del plásmido críptico mostró valores de sensibilidad y especificidad de 75 y 100 %, respectivamente; así como un VPP de 100 % y VPN de 97,9 %.
DISCUSIÓN
La infección genital por C. trachomatis constituye un importante problema de salud pública mundial.3 En Cuba se desconoce su frecuencia pues debido a las características del microorganismo (intracelular obligado), resulta difícil y costoso contar con métodos de elevada sensibilidad y especificidad. Por esta razón, existe una escasa cobertura diagnóstica en el país y se cuenta con pocos estudios en mujeres con mayor riesgo.9,10,16
Sin embargo, en los últimos años Cuba ha adquirido pruebas rápidas que, si bien constituyen una alternativa diagnóstica para el tamizaje de la infección, requieren de su complementación con pruebas de referencia.11-13
En correspondencia con estos antecedentes, se decidió realizar el presente estudio donde se incluyeron mujeres con síntomas asociados a la infección por C. trachomatis. Al aplicar la prueba rápida Chlamy-check-1 en 50 muestras de exudado endocervical, el porcentaje de positividad obtenido fue superior al reportado por Ortiz y otros (45,2 %), en el año 2010, al emplear el mismo estuche diagnóstico en muestras similares de mujeres infértiles y abortadoras habituales atendidas en el Hospital Ginecobstétrico "Ramón González Coro".17 Sin embargo, en países como el Líbano, al aplicar el mismo test diagnóstico a 557 muestras de mujeres de una comunidad rural, no detectaron casos positivos,18 resultado que difiere con la presente investigación y que pudiera estar justificado por las normas sociales que rigen dicho territorio, pues según expresan los autores, es una comunidad religiosa, donde las relaciones sexuales prematrimoniales y extramatrimoniales resultan en sanciones sociales y persecución. Del mismo modo, un estudio en Alemania señala, en mujeres con inflamación pélvica aguda y crónica, porcentajes de positividad de 7,8 y 10,6 %, respectivamente.19 En estos trabajos, a pesar de que se evalúan un mayor número de muestras, se detectan porcentajes de positividad inferiores al que se identifica en el presente estudio.
La diferencia reportada entre la presente investigación y los reportes anteriores pudiera estar relacionada con la presencia de otros microorganismos, que podrían ocasionar resultados falsos positivos debido a que la mayoría de las pruebas de diagnóstico rápido diseñadas para la detección de C. trachomatis tienen un principio similar al de los ELISA (del inglés Enzyme-Linked Inmunoabsorbent Assay), pues utilizan anticuerpos dirigidos contra el LPS del género Chlamydia, los que son similares a los de otras bacterias gramnegativas.8,20 Vale la pena señalar que, a pesar de haber realizado una minuciosa búsqueda de citas bibliográficas sobre la aplicación de este ensayo (Chlamy-check-1), esta discusión incluyó los únicos 3 trabajos recogidos en la literatura médica consultada.
Como las NAAT constituyen el método de referencia para el diagnóstico de C. trachomatis, en esta investigación se utilizaron 2 de estas técnicas, una RCP de plásmido críptico y una RCP-TR comercial que fue utilizada como prueba de referencia. Con ambas pruebas moleculares se obtuvieron resultados equivalentes y similares a los reportados en estudios previos realizados en Cuba y en el mundo. Kourí y otros, en el año 2002, al estudiar por una RCP de MOMP, 60 mujeres seropositivas al VIH y 60 seronegativas, obtienen una positividad de 10 y 6,6 %, respectivamente.10 Así como Frontela y otros (15,3 %), al evaluar 59 mujeres que tenían antecedentes de infertilidad mediante una técnica de RCP de plásmido críptico.16 Posteriormente, estos mismos autores reportan en 224 mujeres, en edad reproductiva, 6,9 % de positividad.21 Por otro lado, en la India, varios autores refieren porcentajes de positividad similares: Sood y otros, utilizando una RCP de plásmido críptico (9,3 %), así como Dwibedi y otros, y Pramanik y otros, empleando una RCP de MOMP (7 y 12,3 %), respectivamente.22-24 A su vez, la aplicación previa de un sistema de control interno del material genético permitió determinar la integridad de las muestras clínicas procesadas y por tanto brindó una mayor confiabilidad de los resultados, como fue referido previamente.25
Aún más, la baja especificidad observada con la prueba rápida (13 %), al compararla con la prueba de referencia, reafirma lo planteado anteriormente en relación con que el ensayo Chlamy-check-1 está diseñado para la detección del LPS de la pared bacteriana de C. trachomatis, lo que constituye una de sus principales desventajas, pues podría estar sujeto a reacciones cruzadas con los LPS presentes en otros microorganismos, fundamentalmente en las bacterias gramnegativas e incluso, en otras especies dentro del propio género [8, 20]. La ocurrencia de resultados falsos positivos en el diagnóstico de esta infección, como en toda ITS, causa incertidumbre y discrepancia entre los miembros de la pareja, así como, se hace un uso indiscriminado de los antibióticos y se contribuye al desarrollo de la resistencia antimicrobiana con una implicación económica por gastos innecesarios en medicamentos.
Resulta de gran importancia contar con métodos diagnósticos que proporcionen resultados confiables, y que a su vez fortalezcan el diagnóstico microbiológico de la infección genital por C. trachomatis en Cuba, ya que esta infección se asocia a complicaciones que afectan la salud reproductiva de la mujer. En el presente estudio se observaron diferencias entre los porcentajes de positividad detectados con la prueba rápida, y las técnicas de detección de ácidos nucleicos. Teniendo en consideración la baja especificidad detectada con la prueba rápida (Chlamy-check-1), al compararla con la prueba de referencia utilizada, sumado al hecho de que existen pocas investigaciones a nivel mundial que emplean esta técnica, recomendamos que se realicen en el país estudios que evalúen la validez de esta prueba para el diagnóstico de C. trachomatis, utilizando un mayor número de muestras, ya que esta es la principal limitación de la presente investigación.
REFERENCIAS BIBLIOGRÁFICAS
1. Gallo L, Entrocassi C, Corominas AI, Rodríguez M. Distribution study of Chlamydia trachomatis genotypes in symptomatic patients in Buenos Aires, Argentina: association between genotype E and neonatal conjunctivitis. BMC Research Notes. 2010;3:34.
2. Arráiz N, Ginestre M, Castellano M, Perozo A, Urdaneta B. Detección de Chlamydia trachomatis en muestras de hisopado endocervical por inmunofluorescencia directa y reacción en cadena de la polimerasa. Rev Soc Ven Microbiol. 2006;26(1):14-8.
3. Corbeto EL, Lugo R, Martró E, Falguera G, Ros R, Avecilla A, et al. Prevalencia de la infección por C. trachomatis y N. gonhorroeae y determinantes para su adquisición en jóvenes y adultos-jóvenes en Cataluña. Enferm Infecc Microbiol Clin. 2011;29(2):96-101.
4. Vázquez F, Lepe JA, Otero L, Blanco MA, Aznar J. Diagnóstico microbiológico de las infecciones de transmisión sexual. Enferm Infecc Microbiol Clin. 2008;26(1):32-7.
5. Martínez MA. Diagnóstico microbiológico de las infecciones de transmisión sexual (ITS). Rev Chil Infect. 2009;26(6):529-39.
6. Sachdeva P, Lal A, Sachdev D, Ali M, Mittal A, Saluja D. Comparison of an in-house PCR assay, direct fluorescence assay and the Roche AMPLICOR Chlamydia trachomatis kit for detection of C. trachomatis. J Med Microbiol. 2009;58:867-73.
7. Martínez MA. Diagnóstico microbiológico de Chlamydia trachomatis: Estado actual de un problema. Rev Chil Infect. 2001;18(4):275-84.
8. Centers for Disease Control and Prevention. Screening Tests to Detect Chlamydia trachomatis and Neisseria gonorrhoeae Infections. Morbidity and Mortality Weekly Report. MMWR. 2002;51(RR-15):1-40.
9. Montenegro AG. Diagnóstico de infecciones genitales por Chlamydia trachomatis: utilidad de la Reacción en Cadena de la Polimerasa (RCP) y el aislamiento en cultivos celulares [tesis para optar por el título de Especialista de Primer Grado en Microbiología]. Ciudad de la Habana: IPK; 1993.
10. Kourí V, Cartaya J, Rodríguez MF, Mune M, Soto Y, Resik S, et al. Prevalence of Chlamydia trachomatis in Human immunodeficiency Virus-infected women in Cuba. Mem Inst Oswaldo Cruz. 2002;13(2):52-5.
11. Van Dommelen L, Van Tiel FH, Ouburg S, Brouwers EEHG, Terporten PHW, Savelkoul PHM, et al. Alarmingly poor performance in Chlamydia trachomatis point-of-care testing. Sex Transm Infect. 2010;86:355-9.
12. Bandea C, Koumans EH, Sawyer MK, Dover J, O'Connor A, Papp JR, et al. Evaluation of the Rapid BioStar Optical Immunoassay for Detection of Chlamydia trachomatis in Adolescent Women. J Clin Microbiol. 2009;47(1):215-6.
13. Yin YP, Peeling RW, Chen XS, Gong KL, Zhou H, Gu WM, et al. Clinic-based evaluation of Clearview Chlamydia MF for detection of Chlamydia trachomatis in vaginal and cervical specimens from women at high risk in China. Sex Transm Infect. 2006;82 Suppl 5:33-7.
14. Schmitz M, Scheungraber C, Herrmanna J, Teller K, Gajdab M, Runnebauma IB, et al. Quantitative multiplex PCR assay for the detection of the seven clinically most relevant high-risk HPV types. J Clin Virol. 2009;44:302-7.
15. Claas HCJ, Wagenvoort JHT, Niesters HGM, Tio TT, Van Rijsoort-Vos JH, Quint WGV. Diagnostic Value of the Polymerase Chain Reaction for Chlamydia Detection as Determined in a Follow-Up Study. J Clin Microbiol. 1991;29(1):42-5.
16. Frontela M, Amores I, Yepe S, Kourí V, Fereira R, Mallea L. Detección de Chlamydia trachomatis en muestras de exudado endocervical por la reacción en cadena de la polimerasa. Rev Cubana Endocrinol. 2002;13(2):135-43.
17. Ortiz CE, Hechavarría CE, Ley M, Álvarez G, Hernández Y. Estudio de Chlamydia trachomatis, Ureaplasma urealyticum y Mycoplasma hominis en pacientes infértiles y abortadoras habituales. Rev Cubana de Obstet Ginecol. 2010;36(4)573-84.
18. Deeb ME, Awwad J, Yeretzian JS, Kaspar HG. Prevalence of reproductive tract infections, genital prolapse, and obesity in a rural community in Lebanon. Bolletin of the World Health Organization. 2003;81(9):639-45.
19. Sönmez AS, Sönmez E, Durmaz B, Köroglu M, Özbilge H. Investigation of Chlamydia trachomatis infection with two different methods and administration of azithromycin in treatment of the women with pelvic inflamatory disease. J Turgut Özal Medical Center. 1997;4(1):10-3.
20. Land JA, Van Bergen JEAM, Morre SA, Postma MJ. Epidemiology of Chlamydia trachomatis infection in women and the costeffectiveness of screening. Human Reproduction Update. 2010;16(2):189-204.
21. Frontela M, Rodríguez Y, Verdejas OL, Valdés FJ. Infección por Chlamydia trachomatis en mujeres cubanas en edad reproductiva. Rev Cubana Endocrinol [serie en Internet]. 2006 [citado 22 May 2009];17(2). Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S1561-29532006000200001&lng=es&nrm=iso
22. Sood S, Mukherjee A, Bala M, Satpathy G, Mahajan N, Sharma A, et al. A pilot study for diagnosis of genital Chlamydia trachomatis infections by polymerase chain reaction among symptomatic Indian women. Indian J Dermatol Venereol Leprol. 2012;78:443-7.
23. Dwibedi B, Pramanik JM, Sahu P, Kar SK, Moharana T. Prevalence of genital Chlamydia infection in females attending an Obstetrics and Gynecology out patient department in Orissa. Indian J Dermatol Venereol Leprol. 2009;75(6):614-6.
24. Pramanik JM, Potdar S, Kerkar S. Diagnosis of Chlamydia trachomatis Infection. J Clin Lab Anal. 2006;20:8-14.
25. Orta N, Guna MR, Cardona CG, Pérez JL. Control de calidad en microbiología molecular. Enferm Infecc Microbiol Clin. 2008;26 Suppl 9:2-7.
Recibido: 16 de octubre de 2013.
Aprobado: 30 de octubre de 2013.
Dianelys Rivero Figueroa. Centro Municipal de Higiene y Epidemiología de 10 de Octubre. Calle Patrocinio y Poey. 10 de Octubre. La Habana, Cuba.
Autora para la correspondencia: Vivian Kourí Cardellá. Instituto de Medicina Tropical "Pedro Kourí", La Lisa. La Habana, Cuba. Correo electrónico: vkouri@ipk.sld.cu