Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Obstetricia y Ginecología
versión impresa ISSN 0138-600X
Rev Cubana Obstet Ginecol vol.40 no.3 Ciudad de la Habana jul.-set. 2014
ARTÍCULO DE INVESTIGACIÓN
Caracterización de la hiperplasia endometrial en el Hospital Ginecobstétrico Docente “Profesor Eusebio Hernández”
Characterization of Endometrial Hyperplasia at Prof. Eusebio Hernández Gynecobstetric Teaching Hospital
Dr. Orlando M. Perera Boza,I Dra. Lisbet Molina Peñate,II Int. Jenny Torres ToledoII
I Hospital Ginecobstétrico “Profesor Eusebio Hernández”. La Habana, Cuba.
II Centro de Investigaciones Médico Quirúrgicas, La Habana, Cuba.
RESUMEN
Introducción: la hiperplasia endometrial es la proliferación de las glándulas endometriales en tamaño y forma irregular, causada por una excesiva exposición a los estrógenos.
Objetivo: caracterizar las hiperplasias endometriales en pacientes del Hospital Eusebio Hernández durante todo el año 2011.
Método: se realizó un estudio observacional descriptivo. Se revisaron 2 842 informes histopatológicos en el Departamento de Patología del Hospital Ginecobstétrico “Profesor Eusebio Hernández” en Marianao, La Habana en el periodo comprendido entre el 1º de enero y el 31 de diciembre de 2011, de los cuales 1 269 correspondieron a biopsias de endometrio obtenidas por legrado.
Resultados: en 154 de las biopsias endometriales (12,1 %) el diagnóstico fue de hiperplasia endometrial. El rango de edades de mayor frecuencia de diagnóstico fue el de las mujeres entre 41 y 50 años y en el mayor porcentaje de pacientes (84,4 %) se diagnosticó hiperplasia simple sin atipias; mientras que, el 7,1 % de los casos presentó atipias. El factor de riesgo más asociado fue la obesidad en 46,1 % de los casos. El ultrasonido tuvo una positividad en los casos con atipia endometrial del 90,9 % y la histeroscopia del 100 %. El tratamiento hormonal fue utilizado en el 67,5 % de las pacientes y el tratamiento quirúrgico se utilizó en la totalidad de las pacientes con atipias celulares.
Conclusiones: hubo predominio de hiperplasia endometrial sin atipia en las mujeres con edades entre 41 y 60 años y con menor paridad y una baja ocurrencia de hiperplasia atípica.
Palabras clave: hiperplasia endometrial, atipia endometrial, biopsia endometrial.
ABSTRACT
Introduction: endometrial hyperplasia is a proliferation of endometrial glands in size and irregular shape, caused by excessive exposure to estrogen.
Objective: to characterize the endometrial hyperplasia in patients at Eusebio Hernández Hospital in 2011.
Method: a descriptive study was conducted. 2842 pathology reports were reviewed in the Department of Pathology, at ''Profesor Eusebio Hernández" Gynecobstetric Hospital in Marianao, Havana from January 1st to December 31st, 2011. 1269 of them were for endometrial biopsies obtained by curettage.
Results: 154 endometrial biopsies (12.1 %) had the diagnosis of endometrial hyperplasia. The age range of diagnosis was more frequent for women between 41 and 50 years and the highest percentage of patients (84.4 %) were diagnosed with simple hyperplasia without atypia; while 7.1 % of the cases showed atypia. The associated risk factor was obesity in 46.1 % of cases. Ultrasound had positivity in patients with atypical endometrial 90.9 % and 100% hysteroscopy. Hormone therapy was used in 67.5 % of patients and surgical treatment was used in all patients with cellular atypia.
Conclusions: there was a predominance of endometrial hyperplasia without atypia in women aged between 41 and 60 and with low parity and a low occurrence of atypical hyperplasia.
Keywords: endometrial hyperplasia, endometrial atypia, endometrial biopsy.
INTRODUCCIÓN
La hiperplasia endometrial constituye un grupo de alteraciones morfobiológicas de las glándulas y estroma endometriales que varía entre un estado fisiológico exagerado hasta el carcinoma in situ. La misma suele originarse en un endometrio proliferativo causado por la estimulación prolongada de estrógenos y en ausencia de la influencia de los progestágenos, lo que puede traducirse clínicamente como un sangrado uterino anormal.1,2
La persistente estimulación estrogénica y/o una mayor sensibilidad del endometrio a dicha hormona pueden provocar cambios desde el punto de vista histopatológico para que la lesión evolucione desde una hiperplasia simple o quística a una hiperplasia compleja o adenomatosa y/o aparecer las atipias celulares,2-4 por tanto la atipia suele acompañar a la hiperplasia simple o la compleja según la estructura glandular correspondiente.
El riesgo de que la hiperplasia endometrial progrese hasta carcinoma se estima en el 1 % de las mujeres con hiperplasia simple, el 3 % en aquellas con hiperplasia compleja sin atipias, el 8 % con hiperplasia simple con atipias y en el 29 % si presenta hiperplasia compleja atípica.4 En consecuencia, la hiperplasia endometrial puede considerarse, un estado precursor del carcinoma, y a la presencia de atipias celulares como el factor pronóstico más importante para la progresión a carcinoma endometrial.5,6
Las características más importantes de los diferentes tipos de hiperplasias son: La simple o quística es una lesión proliferativa que se caracteriza por cambios arquitectónicos en las glándulas de diversos tamaños, con mínimos cambios en la complejidad y densidad glandular y abundante estroma entre las mismas. El epitelio superficial es pseudo-estratificado con figuras mitóticas ocasionales y ausencia de atipia nuclear.
La hiperplasia endometrial compleja es también una lesión proliferativa, en la cual se exhibe un incremento en el número y tamaño de las glándulas endometriales, aglomeradas de forma irregular y con mínimo estroma interpuesto adoptando una morfología característica conocida como patrón de “espalda contra espalda”.
La atipia citológica está caracterizada por un aumento en la estratificación con dispolaridad celular, núcleos hipercromáticos, nucléolo prominente, cromatina de aspecto grumoso e incremento de la razón núcleo/citoplasma.6,7
Algunos autores plantean que el 23 % de las pacientes con hiperplasias atípicas desarrollan adenocarcinoma de endometrio en un promedio de 4 años posterior al diagnóstico de la lesión precursora, mientras que solo 2 % de lesiones sin atipia progresan en un período estimado de 13 años.6-8
Existen diversos factores de riesgo que se asocian a la hiperplasia endometrial. Estos son: Amenorrea o períodos amenorréicos, disfunciones tiroideas, enfermedades hepáticas, obesidad, diabetes mellitus, síndrome de ovario poliquístico, infertilidad, nuliparidad o baja paridad, historia familiar de carcinoma endometrial, hipertensión arterial, historia de cáncer de colon y terapia hormonal de reemplazo estrogénico sin oposición progestacional en pacientes con el útero conservado.12-17
La hiperplasia endometrial se manifiesta de diversas maneras: asintomática, sangrado intermenstrual o manchado (Spotting), sangrado menstrual excesivo, sangrado irregular en pacientes pre menopáusicas y sangrado post menopáusico.
El ultrasonido es el medio diagnóstico más utilizado. Puede realizarse a través de la pared abdominal, aunque la vía transvaginal permite obtener una medida más confiable del grosor endometrial. Puede utilizarse también la hidrosonografía y también realizar una histeroscopia, proceder que permite visualizar y evaluar el epitelio de la cavidad endometrial, tomar muestras de biopsia dirigidas y a la vez solucionar otras afecciones concomitantes.
La biopsia endometrial para el estudio histológico es la que determina el diagnóstico de la hiperplasia, la misma puede ser obtenida mediante el uso de cureta, aspiración o por histeroscopia.
El tratamiento siempre será individualizado, ya que es fundamental diferenciar el tipo de hiperplasia, la edad de la mujer y los deseos de conservar su fertilidad. Por tanto, éste puede oscilar entre la observación activa, el tratamiento médico o el tratamiento definitivo mediante la histerectomía.
Cuando no hay atipias celulares el tratamiento con progestágenos orales o parenterales es el más indicado.9
Si se trata de una hiperplasia atípica que se observa con frecuencia durante la perimenopausia, entonces suele proponerse la histerectomía, que es en nuestro medio la opción más utilizada.
Además existen métodos alternativos para el tratamiento de la hiperplasia endometrial sin atipias, mediante la destrucción o ablación del endometrio.10,11
Al ver la importancia clínica de la hiperplasia endometrial como una afección precursora del cáncer de endometrio, se propone determinar en un grupo de pacientes algunos aspectos clínicos y de riesgo asociados y cuáles son los procedimientos diagnósticos y terapéuticos de mayor utilización en las lesiones hiperplásicas endometriales.11,12 El propósito de la investigación fue caracterizar la hiperplasia endometrial en pacientes del Hospital “Profesor Eusebio Hernández” durante el año 2011.
MÉTODOS
Estudio observacional, descriptivo, longitudinal y retrospectivo realizado en el Servicio de Ginecología del Hospital Docente Ginecobstétrico “Profesor Eusebio Hernández”, desde el 1ro. de enero de 2011 hasta el 30 de diciembre de 2011, en un grupo de pacientes que fueron atendidas por hemorragia uterina anormal.
Se revisaron un total de 4 842 informes histopatológicos, de los cuales 1 269 correspondieron a legrados/biopsias de endometrio.
Se incluyeron 154 pacientes con diagnóstico histopatológico de hiperplasia endometrial, las que fueron divididas en dos grupos: menopáusicas y no menopáusicas.
Se excluyeron las pacientes que recibieron terapia hormonal en el último año, mujeres tratadas con corticoides por tiempo prolongado (más de 3 meses), pacientes con coagulopatías, antecedentes de neoplasias malignas, de inmunosupresión y resultado anatomopatológico de pólipo endometrial o mioma uterino.
No se utilizó el nombre de la paciente ni otra información que permitiera establecer su identidad. Sólo se empleó como indicativo el número de historia clínica para evitar la duplicidad de la información.
En la ficha de recolección de datos de cada historia clínica, se incluyó, la edad, peso corporal, historia obstétrica y ginecológica, antecedentes personales de diabetes mellitus, hipertensión arterial, familiares de cáncer de endometrio o colon, tratamientos hormonales en años previos, los diagnósticos por imágenes realizados ultrasonografía transvaginal y hallazgos histeroscópicos si los hubiera. Finalmente, el resultado histopatológico del legrado diagnóstico, fue la herramienta contra la cual se valoraron los criterios clínicos y terapéuticos.
La información recogida fue almacenada en una base de datos creada con el sistema Visual FoxPro 6.0 sobre Windows XP.
RESULTADOS
El 84,4 % de las pacientes presentó hiperplasia simple sin atipicidad celular (tabla 1).
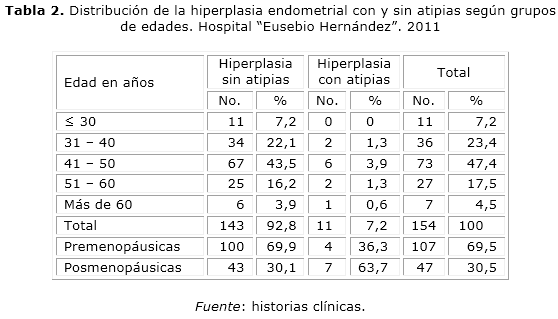
En relación con la edad de aparición de la hiperplasia endometrial según tipo histológico con y sin atipias, esta fue encontrada en pacientes de 41 a 55 años con una frecuencia del 47,4 % y se observó una mayor incidencia de pacientes con atipias en el período pos menopáusico con el 63,7 % (tabla 2).
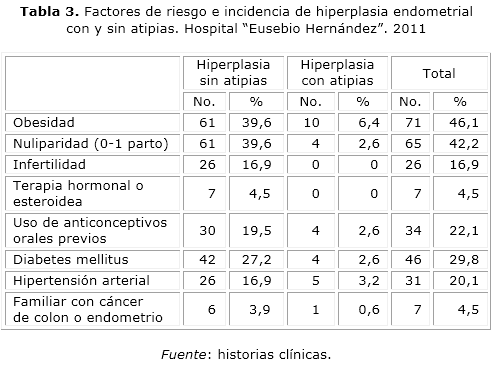
Entre los factores de riesgo que se encontraron asociadas a la hiperplasia endometrial, se observan en una mayor proporción la obesidad, la baja paridad, la diabetes mellitus y el antecedente de haber usado anticonceptivos hormonales orales (tabla 3).
Se realizó ultrasonido e histeroscopia a 78 y 23 pacientes respectivamente, como muestra la tabla 4, con endometrio engrosado el 78,2 % y con histeroscopia positiva el 82,6 % de las mismas.
DISCUSIÓN
En la práctica ginecológica, aproximadamente 15 % de las consultas se deben a hemorragia uterina anormal y es causa del 25 % de las operaciones quirúrgicas.12
Las implicaciones de este cuadro conllevan desde una alteración hormonal (hemorragia uterina disfuncional) hasta una neoplasia maligna,5,6,11,14 por lo que los hallazgos clínicos y los procedimientos diagnósticos con un manejo racional, estarán encaminados al diagnóstico precoz para lograr un exitoso tratamiento.13
Del total de los 1 269 legrados uterinos diagnósticos realizados, 154 casos correspondieron con hallazgos histopatológicos de hiperplasia endometrial, lo que representa 12,1 % de las biopsias endometriales realizadas en el periodo y la hiperplasia endometrial sin atipias fue el hallazgo más frecuente con más del 80 %, cifras similares encuentran Brun,15 Méndez García,16 Barahona17 y García Ayala18 en sus publicaciones.
Se destaca que en todos los subgrupos histológicos de hiperplasia endometrial el mayor número de pacientes se ubicó igualmente en el anterior grupo etario, mencionándose en la literatura a nivel mundial la ocurrencia de esta afección principalmente en mujeres de más de 45 años.19-22
El comportamiento de la proporción de pacientes con hiperplasia endometrial en el grupo de posmenopáusicas y en el de premenopáusicas, no debe desestimar la ocurrencia de esta afección en este último grupo, esta distribución también se presenta en varias publicaciones 18,23,24 (tabla 2).
Los niveles elevados de progesterona secretados por la placenta durante el embarazo pudieran ser los responsables de cierta protección ante la hiperplasia endometrial inducida por los estrógenos. Dado estos elementos, se encontró que en las nulíparas o de un solo parto, la hiperplasia endometrial se diagnosticó con mayor frecuencia que en las mujeres multíparas,25 esto coincide con la teoría de Katsanis26 de que las mujeres nulíparas y los estados de anovulación, confieren un riesgo dos veces mayor de acelerar hiperplasia endometrial y la formación de un cáncer de endometrio;26,27 sin embargo, otros como Barahona17 y Galceran28 no encontraron diferencias en cuanto a la paridad.
La obesidad conlleva a exposición del endometrio a cantidades elevadas de estrógenos provenientes de la trasformación periférica de la androstendiona, los cuales en ausencia del efecto regulador de la progesterona, estimulan la proliferación endometrial que puede progresar a hiperplasia endometrial,25 con un riesgo de incremento de hasta cinco veces, de padecer una neoplasia endometrial.29,30
Se encontró una frecuencia de 46 % de las pacientes con obesidad, autores como Ivanov31 señalan hasta el 90 % de obesas en sus pacientes, otros autores como Meira Epplein,32 Lacey J.V.,33 Ricci E.,34 García Ayala,18 confirman este hallazgo.
En muchas publicaciones aparece el aumento de la incidencia de diabetes mellitus relacionada a la existencia de hiperplasia endometrial,35-37 en este trabajo se encontró que 29,8 % de las pacientes eran diabéticas.
La diabetes mellitus puede aumentar el riesgo hasta cuatro veces más en relación con las mujeres no diabéticas, aunque hay autores que plantean que debido a la asociación con la obesidad, ésta es la responsable del riesgo para desarrollar cáncer endometrial y no la diabetes, hay trabajos como los de Randall36 y Creasman37 que demuestran que las mujeres con sobrepeso y que padecen diabetes mellitus presentan mayor riesgo de este cáncer que las mujeres con sobrepeso que no lo son.36
Se ha señalado a la hipertensión arterial como factor de riesgo, en este estudio apareció en 20,1 % de las pacientes y se ha planteado su asociación con la obesidad al igual que la diabetes, a diferencia de lo que se menciona en la literatura considerándose a la hipertensión arterial como un factor de riesgo de neoplasia endometrial.35,37
Sweet38 evalúa entre otros factores de riesgo, la anovulación que se produce con el uso de anticonceptivos orales, nosotros encontramos una incidencia del 22,1 % de pacientes lo que se corresponde con lo hallado en otros estudios como los de Ricci y cols.39 que además encontraron que no existía una asociación significativa con la historia familiar de cáncer de endometrio, ovario o mama igual a lo hallado en este estudio.
La ultrasonografía transvaginal ha demostrado ser útil en el diagnóstico de la enfermedad endometrial, en este estudio se indicó a 78 pacientes con el 78,2 % de positividad de endometrios engrosados, en la literatura se encontraron valores entre el 90 % y 92 %.40,42
Barahona17 y otros40,42 consideran a la histeroscopia la prueba de mayor sensibilidad diagnóstica (gold standard) para evaluar la superficie endometrial, tiene falsos positivos, por lo que plantean que se debe complementar con biopsias dirigidas, en este trabajo se utilizó solo en 23 pacientes por ser un proceder de reciente disponibilidad en este centro hospitalario. Se encontró una positividad del 82,6 % y hay autores que señalan más del 90 % de la misma, lo que corrobora la utilidad de este proceder.
La histerosonografía es una técnica ecográfica que se señala de utilidad pero no fue empleada en estos estudios, ya que no se dispone de la misma.
En las revisiones de la literatura actual, se ha demostrado que la hiperplasia endometrial tiene una significativa respuesta a la terapia hormonal con progestágenos, con una regresión entre el 70 % y el 90 % a partir de los 6 meses de tratamiento y completa a los 18 meses, con una recurrencia para la hiperplasia entre el 15 % y el 20 % aproximadamente, según los autores citados.43-48
Estos estudios han señalado que la hiperplasia sin atipias con tratamiento hormonal tiene bajo riesgo de progresar a adenocarcinoma endometrial, sin tratamiento alrededor del 12 % aparecerían atipias celulares y existe el riesgo de que entre el 4 % y el 5 % de estas progresen a adenocarcinoma endometrial.
Autores como Brun,30 Ivanov31 han señalado que se está de acuerdo en que la histerectomía es el tratamiento indicado cuando existen atipias celulares o no hay respuesta al tratamiento hormonal.
En las mujeres jóvenes con deseos reproductivos e hiperplasia sin atipias se han ensayado con éxito tratamientos conservadores, además de la terapia hormonal con progesterona, el tratamiento con Anastrazole (inhibidor de la aromatasa),47 los agonistas de GnRH, DIU medicados con levonorgestrel49-51 resección o ablación térmica endometrial por histeroscopia, la embolización u oclusión de las arterias uterinas y otros que no están disponibles en nuestra práctica clínica.30,52
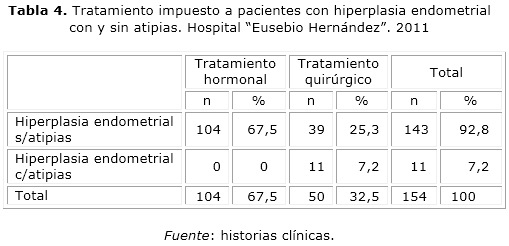
En este estudio, 67,5 % de las pacientes con hiperplasia sin atipias recibieron tratamiento hormonal con progesterona y de señalar que todas las pacientes con hiperplasia con atipias recibieron tratamiento quirúrgico en correspondencia con lo planteado para esta afección en los estudios aquí citados.
Se puede concluir que la hiperplasia endometrial sin atipias fue el hallazgo histopatológico más frecuente y la hiperplasia simple y compleja con atipia representó la minoría del total de casos.
Se encontró que el mayor número de pacientes estuvo en el rango de edad de 41 a 50 años de edad, siendo el mayor por ciento nulíparas o primíparas.
Se encontró asociación de la enfermedad con factores de riesgo como la obesidad en primer lugar además de la hipertensión arterial, la diabetes mellitus y el uso de anticonceptivos hormonales orales.
La mayoría de las pacientes recibieron terapia hormonal con progestágenos y todas las pacientes con atipia celular recibieron tratamiento quirúrgico.
Se recomienda por lo tanto, educar a la población sobre los factores de riesgo modificables de esta enfermedad y promover cambios de estilos de vida que permitan evitar la obesidad, el sedentarismo y el control de las enfermedades crónicas no transmisibles.
Dados los resultados de este estudio, perfeccionar el protocolo de atención a las pacientes con el diagnóstico de hiperplasia endometrial.
REFERENCIAS BIBLIOGRÁFICAS
1. Hiperplasia endometrial. Patología estructural y funcional. En: Robbins.España:Mc Graw-Hill Interamericana;1999:1104-8.
2. Lesiones malignas del útero. En: Rigol O. Obstetricia y ginecología. La Habana: Ciencias Médicas; 2004:307-8.
3. Ronnett BM, Kurman RJ. Precursor lesions of endometrial carcinoma. In: Kurman RJ, ed. Blaustein’s Pathology of the Female Genital Tract, 5th ed. New York: Springer-Verlag, 2002:467-500.
4. Kummar V, Abbas A, Fausto N. Robbins and Cotran Pathologic Basis of Disease, 7ma. ed. Elsevier 2004;22:1088-108.
5. Álvarez de los Heros J, Monte Mercado J, Pérez Ortega A. Lesiones Premalignas de Endometrio. Hiperplasia. Tratado de Ginecología, Obstetricia y Medicina de la Reproducción. Editorial Médica: Panamericana, Tomo 2, S.E.G.O. 2003:1587-93.
6. Martínez PL, Atero MD, Bosch JM. ¿Hiperplasia endometrial atípica o adenocarcinoma de endometrio? Un reto. Prog Obstet Ginecol 2008;51(10):605-9.
7. Montgomery BE, Daum GS, Dunton CJ. Endometrial Hyperplasia: A Review. Obstet Gynecol Survey 2004;59(5):368-75.
8. Kresowik J, Ryan GL, Van Voorhis BJ. Progresión of Atypical Endometrial hyperplasia to Adenocarcinoma Obstetrics and Gynecology. Endoscopía Ginecológica.111(2), Part 2, February 2008:547-9.
9. Lethaby A, Farquhar C, Sarkis A, Roberts H, Jepson R, Barlow D. Terapia de reemplazo hormonal en mujeres postmenopáusicas: hiperplasia endometrial y sangrado irregular. En: La Biblioteca Cochrane Plus, 2008:(4). Disponible en: http://www.update-software.com
10. Flint E. Hiperplasia Endometrial y Técnicas de Ablación de Endometrio.Perú:Sociedad Peruana de Obstetricia y Ginecología;2006-2010. Disponible en: http://www.interactivastudio.com
11. Maillet M. Departamento de Patología Universidad de Valencia, curso de Posgrado en Citopatología clínica. La Habana; Ciencias Médicas; 2000.
12. American College of Obstetricians and Gynecologists (ACOG) practice bulletin, clinical management guidelines for obstetrician-gynecologists, number 65, August 2005: management of endometrial cancer. Obstet Gynecol. 2005;106:413-25.
13. The evaluation of abnormal uterine bleeding. Lippincot Williams and Wilkins. Clin Obstet Gynecol. 2005;48(2):258-73.
14. Cáncer endometrial. Revista de Menopausia (en línea). (Acceso: 13 marzo 2007). Disponible en: http://www.encolombia.com/menovol6200-riesgos2.htm
15. Brun JL, André G, Descat E, Creux H, Vigier J, Dallay DJ. Methods and efficacy of medical and surgical treatment of non functional menorrhagia Gynecol Obstet Biol Reprod. 2008 Dec;37(Suppl 8):368-83.
16. Méndez García M, Torres Hernández R, LLanes Vivó A, Rodríguez Hernández V. Hiperplasia endometrial. Revista de Ciencias Médicas La Habana 2011;17(2).
17. Barahona S, Mere J. Hiperplasia endometrial. Experiencia en el Hospital Nacional Arzobispo Loayza. Rev Per Ginecol Obstet. 2006;52(3):89-99.
18. García Ayala E, Cárdenas Mastrascusa L, Sandoval Martínez D, Mayorga Anaya H. Hiperplasia endometrial. Análisis de serie de casos diagnosticados en biopsia endometrial. Rev Chil Obstet Ginecol 2010;75(3):146-52.
19. Kurman RJ, Kaminski PF, Norris HJ. The behavior of endometrial hyperplasia. A long-term study of ‘untreated’ hyperplasia in 170 patients. Cancer 1985;56:403-12.
20. Horn LC, Schnurrbusch U, Bilek K, Hentschel B, Einenkel J. Risk of progression in complex and atypical endometrial hyperplasia: clinicopathologic analysis in cases with and without progestogen treatment. Int J Gynecol Cancer 2004;14:348-53.
21. Horn LC, Meinel A, Handzel R, Einenkel J. Histopathology of endometrial hyperplasia and endometrial carcinoma: An update. Ann Diagn Pathol 2007;11:297-311.
22. Tratado de Ginecología, Obstetricia y Medicina de la Reproducción. Panamericana, Tomo 2. Sociedad Española de Ginecología y Obstetricia. 2003;1587-93.
23. Hammond R, Johnson J. Endometrial hyperplasia. Current Obstetrics and Gynecology. 2004;14:99-103.
24. Tabata T, Yamawaki T, Yabana T, Ida M, Nishimura K, Nose Y. Natural history of endometrial hyperplasia. Study of 77 patients. Arch Gynecol Obstet. 2001;265:85-8.
25. Katsanis WA, Shields LB. Immune recognition of endometrial tumour antigens induced by multiparity. Gynecol Oncol. 1998;70(1):33-9.
26. Randall TC, Kurman RJ. Progestin treatment of atypical hyperplasia and well-differentiated carcinoma of the endometrium in women under age 40. Obstet Gynecol. 1997;90:434-40.
27. Galcerán J. Carcinoma de endometrio: incidencia y mortalidad. Ginecol Obstet Clin. 2003;4(1):8-10.
28. Petridou E, Belechri M, Dessypris N, Koukoulomatis P, Diakomanolis E, Spanos E, et al. Leptin and body mass Gynecol Obstet Fertil. 2002 Mar;30(3):244-51.
29. Brun JL, Belaisch J, Rivel J, Hocké C. Endometrial hyperplasias resistant to progestins: alternatives to traditional treatments. Ann Nutrit Metabol 2002;46:147-51.
30. Ivanov S, Kovachev E, Tsonev A, Abbud A. Modern tendencies in treatment of atypical glandular hyperplasia our and foreign experience. Akush Ginekol (Sofia). PubMed. 2010;49(2):47-9.
31. Mazur MT. Endometrial hyperplasia/adenocarcinoma: A conventional approach. Ann Diagn Pathol. 2005;9:174-81.
32. Lacey JV Jr, Ioffe OB, Ronnett BM, Rush BB, Richesson DA, et al. Absolute Risk of Endometrial Carcinoma During 20-Year Follow-Up Among Women With. Endometrial Hyperplasia J Clin Oncol. 2010 February 10;28(5):788-92.
33. Epplein M, Reed SD, Voigt LF, Newton KM, Holt VL, Weiss NS. Risk of complex and atypical endometrial hyperplasia in relation to anthropometric measures and reproductive history. Am J Epidemiol. 2008;168:563-70.
34. Lindahl B, Willen R. Spontaneous endometrial hyperplasia. A prospective, 5 year follow-up of 246 patients after abrasio only, including 380 patients followed-up for 2 years. Anticancer Res. 1994;14:2141-6.
35. Randall LM. Management of disfunctional uterine blleding during adelescence I Luisiana. Med Soc. 1988;110:160.
36. Carreras R, Mancebo G. Obesidad y Cáncer de Endometrio. Med Clin (Barc). 2007;128(5):176-7.
37. Sweet MG, Schmidt-Dalton TA, Weiss PM, Madsen KP. Evaluation and management of abnormal uterine bleeding in premenopausal women. American Family Phisician. 2012 Jan 1;85(1):35-43.
38. Ricci E, Moroni S, Parazzini F. Risk factors for endometrial hyperplasia: Results from a case-control study. Int J Gynecol Cancer. 2002;12:257-60.
39. Bergós C. Cáncer de endometrio ¿Qué pruebas diagnósticas hemos de realizar antes de la cirugía? Ginecol Obstet Clín. 2003;4(1):15-22.
40. The evaluation of abnormal uterine bleeding. Lippincot Williams and Wilkins. Clin Obstet Gynecol. 2005;48(2):258-73.
41. Gao WL, Zhang LP, Feng LM. Comparative study of transvaginal ultrasonographic and diagnostic hysteroscopic findings in postmenopausal breast cancer patients treated with tamoxifen. Chin Med J. (Engl). 2011 Aug;124(15):2335-9.
42. Gunderson CC, Fader AN, Carson KA, Bristow RE. Oncologic and Reproductive outcomes with progestin therapy in women with endometrial hyperplasia and grade 1 Adenocarcinoma: A systematic review. Gynecol Oncol. Jan 11 2012;125(2).
43. Penner KR, Dorigo O, Aoyama C, Ostrzega N, Balzer BL, Rao J, et al. Predictors of resolution of complex atypical hyperplasia or grade 1 endometrial adenocarcinoma in premenopausal women treated with progestin therapy. Gynecol Oncol. 2011 Nov(10):27-32.
44. Reed SD, Newton KM, Garcia RL, Allison KH, Voigt LF, et al. Complex Hyperplasia With and Without Atypia: Clinical Outcomes and Implications of Progestin Therapy Obstet Gynecol. 2010 August;116(2 Pt 1):365-73.
45. Kurt Christopher G. Significance of Concurrent Endometrial Cancer in Women With a Preoperative Diagnosis of Atypical Endometrial Hyperplasia. J Obstet Gynaecol Can. 2008 October;30(10):896-901.
46. Koloszar S, Pal Z, Kereszturi A, Vajda G, Pal A, Daru J. Effects of aromatase inhibitor on menopausal hyperplasia in a case of obesity. Climacteric. 2012 Feb;15(1):93-4.
47. Reed SD. Complex hyperplasia with and without atypia: Clinical outcomes and implications of progestin therapy. Annual American Association for Cancer Research, April 18-22, 2009.
48. Furness S, Roberts H, Marjoribanks J, Lethaby A, Hickey M, Farquhar C. Hormone therapy in postmenopausal women and risk of endometrial hyperplasia. PubMed. Cochrane Database Syst Rev. 2009 Apr 15;(2):CD000402.
49. Sitruk-Ware R. The levonorgestrel intrauterine system for use in peri- and postmenopausal women. Contraception. 2007 Jun;75(6 Suppl):155-60.
50. Kresowik J, Ryan GL, Van Voorhis BJ. Progression of atypical endometrial hyperplasia to adenocarcinoma despite intrauterine progesterone treatment with the levonorgestrel-releasing intrauterine system. Obstet Gynecol. 2008 Feb;111(2 Pt 2):547-9.
51. Yu M, Shen K, Yang JX, Huang HF, Wu M, Pan LY, et al. Outcome analysis of conservative treatment of well-differentiated endometrial adenocarcinoma and severe atypical hyperplasia in young women. Zhonghua Fu Chan KeZaZhi. 2006 Apr;41(4):242-5.
Recibido: 23 - 4 -14
Aprobado: 3 - 6 - 14
Jenny Torres Toledo
Centro de Investigaciones Médico Quirúrgicas, La Habana, Cuba.Correo electrónico: jenny.ttoledo@infomed.sld.cu