Meu SciELO
Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista Cubana de Obstetricia y Ginecología
versão impressa ISSN 0138-600Xversão On-line ISSN 1561-3062
Rev Cubana Obstet Ginecol vol.43 no.4 Ciudad de la Habana oct.-dez. 2017
ARTÍCULO DE REVISIÓN
Inmunopatogenia de la enfermedad hipertensiva gravídica
Immune-Pathogenesis of Pregnant Hypertension
Alaín Alonso-Remedios, Maité Pérez-Cutiño, Dania F. de León Delgado
Universidad de Ciencias Médicas de Cienfuegos. Cuba.
RESUMEN
La enfermedad hipertensiva gravídica constituye una patología obstétrica relativamente frecuente. En los últimos años se ha avanzado en la comprensión de la patogenia de la enfermedad, al ser el sistema inmune uno de los actores de vital importancia en la aparición de este trastorno. Las células asesinas naturales de la decidua constituyen un componente fundamental en el remodelado vascular durante la formación de la placenta. Cuando existen alteraciones en esta población celular, se induce una isquemia placentaria que promueve la liberación de factores vasculares y mediadores de la inflamación que promueven el daño sistémico con aparición de los síntomas de la enfermedad.
Palabras clave: preeclampsia; sistema inmune; patogenia.
ABSTRACT
Pregnant hypertension is a frequent pregnancy disorder. Researchers has recentely advanced in understanding this disease pathogenesis. The immune system plays a key role in this disease onset. Decidual natural killer cells are fundamental component in vascular remodeling during placental development. When alterations occurs in this cell population, placental ischemia is induced promoting the release of vascular factors and inflammation mechanisms that cause these disease symptoms.
Keywords: preeclampsia; immune system; pathogenesis.
INTRODUCCIÓN
El embarazo es considerado como un evento fisiológico y es recibido, en la mayoría de los casos, como un regalo concedido al sexo femenino.1 Sin embargo, en esta etapa existen numerosas afecciones que constituyen causa de morbilidad y mortalidad materno-infantil.
La preeclampsia/eclampsia es una enfermedad de etiología desconocida en la que aparece un sustrato fisiopatológico de hipoxia tisular generalizada, particularmente en la microcirculación, con repercusión multisistémica que afecta especialmente, al riñón, el hígado, los vasos sanguíneos y el sistema nervioso central. La hipoxia, por otras razones (hipóxica, anémica), agravará más la situación de la paciente al incrementar el daño a la microcirculación.2
Han transcurrido aproximadamente 2 000 años después de que Paracelso describiera la enfermedad por primera vez; sin embargo, el progreso en la comprensión de la pre-eclampsia ha sido lento y sólo en los últimos 10 o 15 años ha cambiado el conocimiento de este desorden.3
El cuadro clínico se caracteriza por cifra de presión sistólica alcanza 140 mmHg o más y de presión diastólica de 90 mmHg o más, acompañada de proteinuria; es frecuente que además se presente cefalea, acúfenos, fosfenos, edema, dolor abdominal y/o alteraciones de laboratorio. Se le conoce como eclampsia cuando además, las pacientes con enfermedad hipertensiva gravídica presentan convulsiones o estado de coma en ausencia de otras causas.4
Entre los factores de riesgo conocidos que predisponen a la preeclampsia están: la nuliparidad, la adolescencia, mujeres mayores de 35 años, obesidad, hipertensión arterial previa, embarazo múltiple, enfermedades crónicas como la diabetes mellitus, historia de preeclampsia/eclampsia en embarazos previos, historia familiar de preeclampsia y/o de haber padecido eclampsia, entre otros factores.4
Recientemente se ha demostrado que durante el embarazo existe un remodelado de las arterias espirales uterinas con invasión de las células trofoblástica, el cual es indispensable para una correcta irrigación placentaria. Cuando este fenómeno es deficiente, se obtiene como resultado una placenta isquémica, la cual constituye un factor central en la etiopatogenia de la preeclampsia.5,6
Componentes del sistema inmune como Macrófagos y células asesinas naturales uterinas (dNK del inglés decidual Natural killer) están involucradas en el proceso de placentación. Existen evidencias que apuntan a una relación directa entre las poblaciones de células inmunes de la placenta, el ambiente de citoquinas producidas por estas células y la aparición de enfermedades asociadas a la gestación como crecimiento intrauterino retardado, abortos y enfermedad hipertensiva gestacional.5,7
Basados en las sólidas evidencias que apuntan a un papel importante del sistema inmune en la patogenia de la enfermedad hipertensiva gravídica hemos decido realizar la presente revisión con el propósito de describir los principales mecanismos inmunológicos que participan en la patogenia de la pre-eclampsia a través del resumen de los datos aportados por artículos publicados respecto al tema en los últimos 10 años.
MÉTODOS
Se realizó una revisión bibliográfica en la base de datos de Pubmed/Medline, usando los descriptores: pre-eclampsia, pre-eclampsia and inflammation, pre-eclampsia and immune system, pre-eclampsia and citoquinas. Se tomó como criterio de inclusión todos los artículos publicados en revista de acceso abierto cuya fecha de publicación no antecediera al 2005. Aparecieron un total de 225 artículos, de los cuales fueron seleccionados 30 trabajos en cuyos resúmenes encontramos aspectos relacionados con el propósito de nuestra investigación. Adicionalmente se revisó la Revista Cubana de Ginecología y Obstétrica donde se emplearon los descriptores: pre-eclampsia, etiopatogenia de la pre-eclampsia de la cual se seleccionaron 4 artículos publicados del 2005 a la fecha.
INMUNOPATOGENIA
Sistema inmune en la placenta normal
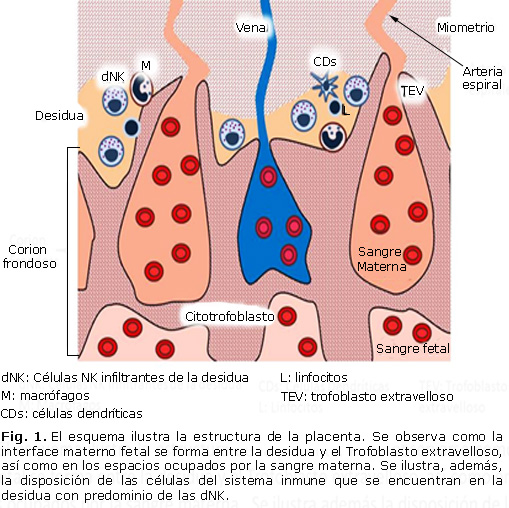
La placenta constituye el órgano de intercambio materno fetal, además de encargarse de la producción de hormonas. Hacia el cuarto mes está formada por dos componentes; uno fetal el corion frondoso y uno materno, la decidua basal. En la zona de unión se mezclan células trofoblásticas y deciduales. Entre la lámina coriónica y decidual se encuentran los espacios intervellosos ocupados por sangre materna.8 La interface materno-fetal se forma en los espacios intervellosos y en la decidua basal (Fig. 1).9
Las células trofoblástica están en contacto directo con la sangre materna. El feto se comporta como un trasplante semi-alogénico por tener la mitad de la información la información genética de la madre.10 Para evitar el rechazo, las células trofoblástica no expresan las moléculas del complejo principal de histocompatibilidad (MHC del inglés: Major Histocompatibility Complex) clase II (DP, DQ y DR). Tampoco presentan las moléculas del MHC clase I A ni B; solo expresan el MHC I C y formas no clásicas del MHC I como el HLA (del inglés: Human Leukocyte Antigens) E, F y G.11 De esta manera las células trofoblástica evitan la eliminación por las células inmunes maternas presentes en la interface materno-fetal.
En la decidua se encuentran células del sistema inmune como linfocitos, células dendríticas, células asesinas naturales y otras las cuales son necesarias para el embarazo normal.12 Las células asesinas naturales (NK del inglés Natural Killer) constituyen la principal población de leucocitos en la interface materno-fetal.13 En humanos esta población representa 70 % de todas las células blancas encontradas en la placenta durante el primer trimestre de embarazo y se denominan NK infiltrante de la decidua (dNK). Esta población se distingue por el fenotipo CD56 bright CD16- a diferencia de las células NK tradicionales encontradas en sangre periférica y otros tejidos, las cuales se caracterizan por expresar los marcadores CD56dim CD16 + (Fig. 1).14
La población de dNK al no expresar del receptor de baja afinidad para IgG (CD16) carece de actividad citotóxica dependiente de anticuerpo (ADCC del inglés antibody-dependent cell-mediated cytotoxicity ).9 Adicionalmente las dNK tienen mayor expresión del receptor KIR (del inglés: killer cell immunoglobulin-like receptors)14 y ILT (del inglés: leukocyte immunoglobulin-like receptor)15 que las células NK de la sangre periférica.
Los KIR son una familia polimórfica de receptores donde algunos tienen acción inhibidora mientras otros transmiten señales activadoras. Los ligandos de estos receptores son las moléculas del MHC clase I, particularmente el HLA-C.16 Adicionalmente los ligando de los receptores ILT son las moléculas del HLA-G y su señalización también inhibe la actividad citotóxica de las células NK.15 En el trofoblasto usualmente se expresa altamente el HLA-C y HLA-G;14 esto juega un papel importante en la tolerancia del feto y la formación de la placenta.
Las dNK secretan citoquinas pro-inflamatorias como TNF-α (Factor de necrosis tumoral alfa, del inglés: Tumoral Necrosis Factor Alpha), IL-8 e IFN-γ (interferón gamma); además de producir factores de crecimiento como el Factor de crecimiento del endotelio vascular (VEGF, del inglés Vascular-endothelium Growth Factor),5 Factor de crecimiento de la placenta (PGF, del inglés:Placental Growth Factor), ANGPT1/2 (del inglés: angiopoietin) y Factor de crecimiento Transformante beta1 (TGF-β1, del inglés: Transforming Growth Factor Beta1).14
Estudios in vitro e in vivo demostraron que las señalizaciones por el receptor activadores en las dNK favorecen la actividad secretora; a diferencia de las NK de sangre periférica, las cuales liberan factores citotóxicos de sus gránulos.17 La IL-8 producida por las dNK interviene en los procesos de migración e invasión del trofoblasto, sin embargo el TNF-α aumenta la actividad citotóxica de las dNK sobre las células del trofoblasto.5 De igual manera el PGF, ANGPT 1/2 y el VEGF intervienen en el proceso de formación de la placenta y el remodelado de los vasos sanguíneos.14
En la interface materno-fetal además de las dNK encontramos otras células inmunes. Los linfocitos T representan menos del 10 % de los leucocitos encontrados en la placenta. En su mayoría son linfocitos TCD4 aunque también podemos encontrar linfocitos T CD8 encargados de la producción de citoquinas y regulación de la invasión trofoblástica.18
Las células dendríticas (CDs) solo representan entre 1 y 2 % de los leucocitos (Fig. 1). En el útero predominan las CDs inmaduras caracterizadas por la expresión del marcador CD1a, a diferencia de las CDs maduras encontradas en el endometrio durante de la fase menstrual, las cuales expresan el CD38. Las CDs interaccionan directamente con el trofoblasto a través del receptor DC-SING (del inglés dendritic cell-specific ICAM grabbing nonintegrin). Dada a su función de presentar antígenos, las CDs tienen la capacidad de regulan el patrón de diferenciación de los linfocitos T.15
La acción de las hormonas durante el embarazo también tiene efecto en los linfocitos. La progesterona induce la producción del Factor de unión inducido por progesterona (PIBF del inglés progesterone-induced binding factor). El PIBF favorece en los linfocitos TCD4 la diferenciación al fenotipo Th2 productor de IL-4, IL-5 e IL-10. Las células Th2 promueven la adquisición del fenotipo M2 en los macrófagos con lo cual contribuye al ambiente tolerogénico de la placenta.19
Los macrófagos representan aproximadamente 20 % de los leucocitos infiltrantes de la decidua durante el embarazo; sin embargo, constituyen una fuente importante de citoquinas para la tolerancia del feto y la defensa frente a infecciones. En el embarazo normal predominan los macrófagos del fenotipo M2 (CD68+) secretores de citoquinas anti-inflamatorias5 y factores vasculares como VEGF, IL-8 y ANGPT ½ (Fig. 1).20
Inmunopatogenia de la preeclampsia
Durante mucho tiempo se consideró la enfermedad hipertensiva gestacional (pre-eclampsia/eclampsia) como la dolencia de las múltiples etiologías; sin embargo, en la década del 70 del pasado siglo se reveló que esta enfermedad se asociaba a la isquemia útero-placentaria. Hoy en día se conoce que esta irrigación insuficiente se debe a la formación inadecuada de los vasos sanguíneos en la placenta.21
Durante el embarazo normal, las células derivadas del cito-trofoblasto fetal migran al endometrio y miometrio remplazando el musculo liso y el endotelio de las arterias espirales uterinas, este remodelado garantiza vasos de mayor calibre y menor resistencia al flujo sanguíneo. Sin embargo, cuando este proceso no ocurre completamente se inician complicaciones asociadas al embarazo.5
Se han realizado intensivos esfuerzos para entender los factores involucrados en el proceso de formación de la placenta. Recientes evidencias indican que la pobre proliferación, migración e invasión de las células trofoblástica son consecuencias de la infiltración aberrante por células inmunes en el útero y la acción de las citoquinas producidas por estas células.5
En la patogenia de la preeclampsia están involucrados las moléculas no clásicas del MHC, las células NK, células dendríticas, receptoras de reconocimiento de patrones, citoquinas y las subpoblaciones de linfocitos TCD4 y TCD8. 22 Es por ello que el sistema inmune juega un papel importante en este trastorno. Experimentos in vitro demostraron que las dNK son importantes para el proceso de remodelado de las arterias espirales y correcta formación de la placenta. Por tanto, alteraciones en esta población celular están vinculadas con la aparición de la enfermedad.23
En un modelo murino de enfermedad hipertensiva gravídica se demostró que hay una reducción de la población de dNK con la consiguiente pérdida de factores derivados de estas células.24 Otros estudios, mediante el modelo murino de pre-eclampsia BPH/5 mostraron elevación de la IL-15 a la vez que disminuyó la población de dNK. En humanos se ha corroborado la existencia de relación entre los niveles de IL-15 y la severidad de la preeclampsia.13
Estudios inmunohistoquímicos en humanos han demostrado un aumento en la población de células NK (CD56) placentarias respecto a las placentas de embarazadas normales. Sin embargo no se han encontrado diferencias significativas entre la infiltración por células NK placentarias entre mujeres con pre-eclampsia y eclampsia.25 Estos resultados aparentemente contradictorios a lo encontrado en modelos animales se deben a que en pacientes con enfermedad hipertensiva gravídica ocurre un proceso inflamatorio asociado a la isquemia placentaria con reclutamiento de células NK periférica con actividad citotóxica16 estos datos nos corroboran la teoría de que existe un vínculo entre inflamación y el desarrollo de la enfermedad. Aunque recientemente se han publicado nuevas evidencias que confirman el papel de la inflamación en la génesis de la pre-eclampsia.26,27
Otras causas de inflamación diferentes de la isquemia han sido relacionadas con la génesis de la enfermedad. Por ejemplo, está descrita la asociación entre las infecciones del tracto genital y múltiples patologías en mujeres embarazadas. Dentro de ellas los fallos de implantación, abortos y partos pre-términos. Sin embargo, el ambiente inflamatorio ocasionado por estos gérmenes alteran el patrón de citoquinas en el útero, lo que pudiera contribuir en la aparición de la enfermedad hipertensiva gestacional como factor desencadenante.28
Estudios en modelos animales mostraron que la inyección de LPS al inicio del embarazo producía síntomas similares a la pre-eclampsia. Estos hallazgos sugieren que la señalización por el receptor de reconocimiento de patrones TLR-4 (del inglés: Toll-like Receptor) es importante en la génesis de esta enfermedad. Existen datos clínicos de incremento de este receptor en placentas humanas de mujeres con pre-eclampsia.29 Además, apuntan a una posible asociación entre las bacterias Gram negativas y el desarrollo de la enfermedad hipertensiva gestacional.30 Es necesario recordar que una parte importante de la microbiota del tracto genital son bacterias Gram negativas.
La respuesta inflamatoria no solo aparece ante infecciones; por ejemplo, la obesidad se asocia a un proceso inflamatorio crónico de bajo grado. 31 Estudios han demostrado que la obesidad y las dietas ricas en azúcares y grasas disminuyen la infiltración de dNK durante el embarazo. Adicionalmente los adipocitos producen leptina, la cual incrementa la actividad citotóxica de las dNK.5 Los resultados son menores niveles de los factores necesarios para estimular la migración del trofoblasto y por el otro, una población de dNK con capacidad de destruir las células trofoblásticas. La combinación de estos fenómenos se traduce en un menor remodelado de las arterias espirales, por tanto, se afecta el flujo sanguíneo útero-placentario y la placenta se torna isquémica.
La placenta isquémica produces factores solubles como el sFLt1 y el VEGF, la elevación de estos factores en la sangre materna se asocia con el inicio de la pre-eclampsia.32-34 El uso de anticuerpos monoclonales (AcM) contra el sFLt1 y el VEGF demostraron disminuir la proteinuria en ratones. Curiosamente en humanos la pre-eclampsia no se desarrolla en todas las mujeres con elevados valores de sFLt1.35 Estos resultados se deben a que los factores producidos por la placenta isquémica inducen un daño endotelial generalizado responsable de la proteinuria y de la elevación de las cifras de tensión arterial. La combinación de estos dos factores y el daño endotelial son responsables de la aparición de edemas en estas pacientes (Fig. 2).26
Las endoglin parecen jugar un papel importante en la lesión endotelial y pudieran servir como marcadores de riesgo para el desarrollo de la enfermedad. El factor inducible de hipoxia alfa (HIF1-α de inglés Hypoxia inducible factors) parece jugar un papel relevante en el inicio de la enfermedad hipertensiva gestacional.36 El HIF1-α se produce en respuesta a la hipoxia y su aumento en la placenta se asocia a la expresión de genes de respuesta a hipoxia dentro de los que se encuentra el VEGF y el sFLt1.37
El factor HIF1-α no solo interviene en la síntesis de factores vasculares derivados de la placenta si no tiene efecto en el sistema inmune, lo que favorece el ambiente inflamatorio en la interface materno-fetal,37 con aumento de las poblaciones Th1, productoras de IFN-γ, IL-2 e IL-12, unido a una disminución de las poblaciones de linfocitos T reguladores.38 Este ambiente inflamatorio, unido al daño endotelial favorece el reclutamiento de NK con actividad citotóxica, las cuales destruyen las células trofoblástica afectando aún más la circulación útero-placentaria y refuerza la isquemia.39 De ahí que el inadecuado aporte oxígeno sea el factor detonante de la enfermedad.
La isquemia placentaria induce además un aumento en la población de macrófagos M1 productores de IFN-γ.5 Aunque el IFN-γ aumenta la producción de CXCL12 por las células endoteliales, principal factor para el reclutamiento de NK CD56 bright CD16,-40 su señalización induce apoptosis en las células trofoblástica.11 Por tanto, esta isquemia inicial empeora la génesis de la enfermedad convirtiéndose en un lazo de amplificación en la inmunopatogenia de la preeclampsia. Por esta razón, podemos afirmar que el efecto del IFN-γ en la inmunopatogenia de la preeclampsia es controversial; no obstante, muchos autores han relacionado asociación entre altos niveles de esta citoquina y el desarrollo de la enfermedad.22
Otras citoquinas producidas por los macrófagos del fenotipo M1, como el TNF-α, favorece la expresión aberrantes de metaloproteinasas y produce apoptosis directa en las células trofoblástica con lo que se enlentece la invasión trofoblástica a las arterias espirales. 40 De forma general las citoquinas proinflamatorias disminuyen la migración trofoblástica y están vinculadas al desarrollo de la enfermedad.22
De igual manera, el patrón de respuesta de linfocitos TCD4 también se relacionan con la aparición de la patología, donde algunas subpoblaciones como los Th1 y Th17 favorecen su aparición; mientras que los Treg y Th2 constituyen factores protectores.41,42 De forma general las citoquinas del patrón Th1 promueven apoptosis de las células trofoblásticas y retardo en la invasión del trofoblasto; mientras que las citoquinas del patrón Th2 favorecen la proliferación e invasión del trofoblasto.11,22 Estudios clínicos han demostrado que las mujeres con preeclampsia tienen cifras de linfocitos Th17 elevados43 y Treg disminuidos respecto a embarazadas normales y estas alteraciones maternas trascienden al feto, lo cual influye en el sistema inmune del recién nacido en las primeras semanas de vida.44
Adicionalmente, el desarrollo de la enfermedad grávida gestacional guarda relación con cambios epigenéticos y genéticos en la paciente. Un estudio bioinformático demostró que en la expresión de genes polimórficos en las vellosidades crónicas influyen en la aparición de la preeclampsia, de ellos la mayor parte están vinculado a genes de expresión diferencial. Mucho de los productos de estos genes se relacionan con la actividad de las dNK.45
Estudios en humanos mostraron que las madres en las que sus dNK solo expresan receptores KIR inhibitorios como el KIR2DL1en combinación con la expresión del alelo de HLA-C2 por el feto incrementa el riesgo de enfermedad hipertensiva gravídica y crecimiento intrauterino retardado respecto a las madres que expresan el alelo KIR2DS1 del receptor activador en las dNK.46 Esto es explicado por el hecho de que la señalización por los receptores activadores induce en las dNK sus funciones secretoras y no las citotóxicas.17
Polimorfismos en el HLA-G también han sido relacionados con un mayor riesgo de preeclampsia, pues los fetos portadores del alelo +14 bp/+14 bp HLA-G tienen una menor expresión de HLA-G en las células trofoblástica lo que favorece la acción citotóxica de las NK. (11) Otros polimorfismos como el TGF-β 1869 T˂C;47 así como en las proteínas C6 MASP1 del complemento también se han asociado al desarrollo de la enfermedad.48
A modo de resumen en la patogenia de la enfermedad se imbrican factores ambientales y genéticos que traen como consecuencia un menor infiltrado de células dNK. Debido a la importancia de las dNK en promover la migración e invasión de las células trofoblásticas, una disminución en esta población trae como consecuencia que no se remplace las células endoteliales ni musculares lisas de las arterias espirales con la consiguiente insuficiencia del aporte de sangre y nutrientes. En respuesta a esta isquemia placentaria se liberan factores y citoquinas que transforman el ambiente de tolerogénico a inflamatorio con lo cual se destruyen aún más las células trofoblásticas. Por otra parte, el exceso de factores vasculares y la transformación del proceso inflamatorio local en sistémico produce daño endotelial, el cual es responsable de la aparición del cuadro clínico en estos pacientes.
Conflictos de intereses
Los autores no declaran tener conflictos de intereses.
REFERENCIAS BIBLIOGRÁFICAS
1. García I, Alemán M. Riesgos del embarazo en la edad avanzada. Rev Cubana Obstet Ginecol. [Internet]. 2013[citado 17 Jul 24];39(2):120-7. Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S0138-600X2013000200007&lng=es
2. Suárez J, Gutierrez M, Cairo V, Marín Y, Rodríguez L, Veitía M. Preeclampsia anterior como factor de riesgo en el embarazo actual. Rev Cubana Obstet Ginecol. [Internet]. 2014 [citado 17 Jul 24];40(4):368-77. Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S0138-600X2014000400003&lng=es
3. Delgado J, Reyes E, Amador A, García M, Cubero O, Quesada F, et al. Malonildialdehido y peso al nacer en la pre-eclampsia. Breve revisión y asociación entre ambos. Rev Cubana Obstet Ginecol. [Internet]. 2008[citado 17 Jul 24];34(3): Disponible en: http://scieloprueba.sld.cu/scielo.php?script=sci_arttext&pid=S0138-600X2008000300003&lng=es
4. Álvarez V, Alonso R, Muñiz M, Martínez J. Caracterización de la hipertensión inducida por el embarazo. Rev Cubana Obstet Ginecol. [Internet]. 2014[citado 17 Jul 24];40(2):165-74. Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S0138-600X2014000200004&lng=es .
5. Spradley F, Palei A, Granger J. Immune Mechanisms Linking Obesity and Preeclampsia. Biomolecules. [Internet]. 2015[citado 17 Jul 24];5:3142-36. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4693273/
6. Abbas Y, Oefner C, Polacheck W, Gardner L, Farrell L, Sharkey A, et al. A microfluidics assay to study invasion of human placental trophoblast cells. J R Soc Interface. [Internet]. 2017[citado 17 Jul 28];14(130). https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5454302/
7. Matson BC, Caron KM. Adrenomedullin and endocrine control of immune cells during pregnancy. Cel & Mol Immunol. [Internet]. 2014[citado 17 Jul 24];11:456-9. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4197213/
8. Salder TW. Langman´s Medical Embriology. 8th ed. Mexico: Ed Médica Panamericana; 2010.
9. Jabrane-Ferrat N, Siewiera J. The up side of decidual natural killer cells: new developments in immunology of pregnancy. Immunology. [Internet]. 2013 [citado 17 Jul 24];141:490-7. Disponible en: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3956423/
10. Göhner C, Plösch T, Faas M. Immune-modulatory effects of syncytiotrophoblast extracellular vesicles in pregnancy and preeclampsia. Placenta. [Internet]. 2017 [citado 17 Jul 28]; pii: S0143-4004(17)30288-6. http://www.sciencedirect.com/science/article/pii/S0143400417302886?via%3Dihub
11. Serrano NC. Immunology and genetic of preeclampsia. Clin Develop Immunol. [Internet]. 2006[citado 17 Jul 24];13(2-4):197-01. Disponible en: https://www.ncbi.nlm.nih.gov/pubmed/17162362
12. LaMarca B, Amaral L, Harmon A, Cornelius D, Faulkner J, Cunningham MJ. Placental Ischemia and Resultant Phenotype in Animal Models of Preeclampsia. Curr Hypertens Rep. [Internet]. 2016[citado 17 Jul 24];18(5):38. Disponible en: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5127437/
13. Sones JL, Lob HE, Isroff CE, Davisson RL. Role of decidual natural killer cells, interleukin-15, and interferon-γ in placental development and preeclampsia. Am J Physiol Regul Integr Comp Physiol. [Internet]. 2014 [citado 17 Jul 24];307(5):490-2. Disponible en: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4214833/
14. DA Lima P, Zhang J, Dunk C, Lye SJ, Croy BA. Leukocyte driven-decidual angiogenesis in early pregnancy. Cel & Mol Immunol. [Internet]. 2014[citado 17 Jul 24];11:522-37. Disponible en: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4220841/
15. Martínez-Varea A, Pellicer B, Perales-Marín A, Pellicer A. Relationship between Maternal Immunological Response during Pregnancy and Onset of Preeclampsia. J of Immunol Res. [Internet]. 2014[citado 17 Jul 24];2014:210241. Disponible en: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4060291/
16. Takeshita LYC, Gonzalez-Galarza FF, dos Santos EJM, Maia MHT, Rahmam MM, Zain SMS, et al. A database for curating the associations between killer cell immunoglobulin-like receptors and diseases in worldwide populations. Database. [Internet]. 2013[citado 17 Jul 24];2013:bat021. Disponible en: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3625957/
17. HannaJ GWY. Decidual NK cells regulate key developmental processes at the human fetal-maternal interface. Nat Med. [Internet]. 2006[citado 17 Jul 24];12:1065-74. Disponible en: http://www.nature.com/nm/journal/v12/n9/full/nm1452.html?foxtrotcallback=true
18. Wallace AE, Fraser R, Cartwright JE. Extravillous trophoblast and decidual natural killer cells: a remodelling partnership. Human Reprod Update. [Internet]. 2012 [citado 17 Jul 24];18(4):458-71. Disponible en: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3373213/
19. Robinson DP, Klein SL. Pregnancy and pregnancy-associated hormones alter immune responses and disease pathogenesis. Horm Behav. [Internet]. 2012;63(3):263-71. Disponible en: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3376705/
20. Smith SD, Dunk ED, Aplin JD, Harris LK, Jones RL. Evidence for Immune Cell Involvement in Decidual Spiral Arteriole Remodeling in Early Human Pregnancy. Am J Pathol. [Internet]. 2009[citado 17 Jul 28];174:1959-71. Disponible en: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2671283/
21. Vázquez Cabrera J. Embarazo, parto y puerperio. Principales complicaciones. La Habana: Editorial Ciencias Médicas; 2009.
22. Ning F, Liu H, Lash G. The Role of Decidual Macrophages During Normal and Pathological Pregnancy. Am J Reprod Immunol. [Internet]. 2016[citado 17 Jul 24]; 75(3):298-309: p. 510-24. https://www.ncbi.nlm.nih.gov/pubmed/26750089
23. Robson A, Harris LK, Innes BA, Lash GE, Aljunaidy MM, Aplin JD, et al. Uterine natural killer cell initiate spiral artery remodeling in human pregnacy. FASEB J. [Internet]. 2012[citado 17 Jul 28];26:4876-85. Disponible en: https://www.ncbi.nlm.nih.gov/pubmed/22919072
24. Linzke N, Schumacher A, Woidacki K, Croy BA, Zenclussen AC. Carbon Monoxide Promotes Proliferation of Uterine Natural Killer Cells and Remodeling of Spiral Arteries in Pregnant Hypertensive Heme Oxygenase-1 Mutant Mice. Hypertension. [Internet]. 2014[citado 17 Jul 28];63:580-8. Disponible en: http://hyper.ahajournals.org/content/63/3/580.long
25. Akhlaq M, Nagi AH, Yousaf AW. Placental morphology in pre-eclampsia and eclampsia and the likely role of NK cells. Indian J Pathol Microbiol. [Internet]. 2012[citado 17 Jul 24];51(1):17-21. Disponible en: http://www.ijpmonline.org/article.asp?issn=0377-4929;year=2012;volume=55;issue=1;spage=17;epage=21;aulast=Akhlaq
26. Borzychowski AM, Sargent IL, Redman CWG. Inflammation and pre-eclampsia. Sem in Fet & Neon Med. 2006[citado 17 Jul 31];11:309-16. Disponible en: http://www.sciencedirect.com/science/article/pii/S1744165X06000436?via%3Dihub
27. Harmon A, Cornelius D, Amaral L, Faulkner J, Cunningham MJ, Wallace K, et al. The role of inflammation in the pathology of preeclampsia. Clin Sci (Lond). [Internet]. 2016 [citado 17 Jul 24];130(6):409-19. Disponible en: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5484393/
28. Weiss G, Goldsmith LT, Taylor RN, Bellet D, Taylor HS. Inflammation in Reproductive Disorders. Reprod Sci. [Internet]. 2009[citado 17 Jul 24];16(2):216-29. Disponible en: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3107847/
29. Koga K, Mor G. Toll-Like Receptors at the Maternal-Fetal Interface in Normal Pregnancy and Pregnancy Disorders. Am J Reprod Immuno. [Internet]. 2010[citado 17 Jul 28];63(6):587-00. Disponible en: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3025804/
30. Rampersaud R, Randis TM, Ratner AJ. Microbiota of the upper and lower genital tract. Semin Fetal Neonatal Med. [Internet]. 2012[citado 17 Jul 28];17(1):51-7. Disponible en: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3242913/
31. Romeo GR, Lee J, Shoelson SE. Metabolic syndrome, insuline resistence, and role of inflammation-Mecanisms and therapeutic targets. Arterioescler. Thromb. Vasc. Biol. [Internet]. 2012[citado 17 Jul 24];32:1771-6. Disponible en: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4784686/
32. Palmer K, Tong S, Kaitu'u-Lino T. Placental-specific sFLT-1: role in pre-eclamptic pathophysiology and its translational possibilities for clinical prediction and diagnosis. Mol Hum Reprod. [Internet]. 2017[citado 17 Jul 31];23(2):69-78. Disponible en: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4925329/
33. Almasry S, Elfayomy A, Hashem H. Ultrastructure and histomorphometric analysis of human umbilical cord vessels in preeclampsia: a potential role of VEGF, VEGFR-1 and VEGFR-2. Rom J Morphol Embryol. [Internet]. 2016[citado 17 Jul 31];57(2 Suppl): 681-9. Disponible en: http://www.rjme.ro/RJME/resources/files/571216681689.pdf
34. Liberis A, Stanulov G, Ali E, Hassan A, Pagalos A, Kontomanolis E. Pre-eclampsia and the vascular endothelial growth factor: a new aspect. Clin Exp Obstet Gynecol. [Internet]. 2016[citado 17 Jul 31];43(1):9-13. Disponible en: https://www.ncbi.nlm.nih.gov/pubmed/27048010
35. Kanasaki K, Kalluri R. The Biology of Preeclampsia. Kidney Int. [Internet]. 2009 [citado 17 Jul 24];76(8):831-7. Disponible en: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4313558/
36. Robb K, Cotechini T, Allaire C, Sperou A, Graham C. Inflammation-induced fetal growth restriction in rats is associated with increased placental HIF-1α accumulation. PLoS One. [Internet]. 2017[citado 17 Jul 31];12(4):e0175805. Disponible en: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5397034/
37. Charnock-Jones D. Placental hypoxia, endoplasmic reticulum stress and maternal endothelial sensitisation by sFLT1 in pre-eclampsia. J Reprod Immunol. [Internet]. 2016 [citado 17 Jul 24];114:81-5:38-42. Disponible en: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4822533/
38. Vianna P, Mondadori A, Bauer M, Dornfeld D, Chies J. HLA-G and CD8+ regulatory T cells in the inflammatory environment of pre-eclampsia. Reproduction. [Internet]. 2016[citado 17 Jul 28];152(6):741-51. Disponible en: http://www.reproduction-online.org/content/152/6/741.long
39. Southcombe J, Redman C, Sargent I. Peripheral blood invariant natural killer T cells throughout pregnancy and in preeclamptic women. J Reprod Immunol. [Internet]. 2010[citado 17 Jul 24];87(1-2):52-9. Disponible en: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2995212/
40. Lockwood CJ, Basar M, Kayisli UA, Guzeloglu-Kayisli O, Murk W, Wang J, et al. Interferon-g Protects First-Trimester Decidual Cells against Aberrant Matrix Metalloproteinases 1, 3, and 9 Expression in Preeclampsia. Am J Pathol. [Internet]. 2014 [citado 17 Jul 28];184:2549-59. Disponible en: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4188280/
41. LaMarca B, Cornelius D, Harmon A, Amaral L, Cunningham M, Faulkner J, et al. Identifying immune mechanisms mediating the hypertension during preeclampsia. Am J Physiol Regul Integr Comp Physiol. [Internet]. 2016[citado 17 Jul 31];311(1):R1-9. Disponible en: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4967235/
42. Figueiredo A, Schumacher A. The T helper type 17/regulatory T cell paradigm in pregnancy. Immunology. [Internet]. 2016[citado 17 Jul 31];148(1):13-21. Disponible en: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4819144/
43. Cornelius D, Amaral L, Wallace K, Campbell N, Thomas A, Scott J, et al. Reduced uterine perfusion pressure T-helper 17 cells cause pathophysiology associated with preeclampsia during pregnancy. Am J Physiol Regul Integr Comp Physiol. [Internet]. 2016[citado 17 Jul 28];311(6):R1192-R1199. Disponible en: http://ajpregu.physiology.org/content/311/6/R1192.long
44. Sava F, Toldi G, Treszl A, Hajdú J, Harmath Á, Rigó JJ, et al. Immune cell subsets, cytokine and cortisol levels during the first week of life in neonates born to pre-eclamptic mothers. Am J Reprod Immunol. [Internet]. 2017[citado 17 Jul 31];77(6). Disponible en: http://onlinelibrary.wiley.com/doi/10.1111/aji.12659/pdf
45. Rabaglino MB, Post-Uiterweer ED, Jeyabalan A, Hogge WA, Conrad KP. A bioinformatics approach reveals evidence for impaired endometrial maturation before and during early pregnancy in women who developed preeclampsia. Hypertension. [Internet]. 2015[citado 17 Jul 31];65(2):421-9. Disponible en: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4290371/
46. Ivarsson MA, Michaëlsson J, Fauriat C. Activating killer cell Ig-like receptors in health and disease. Front Immunol. [Internet]. 2014[citado 17 Jul 28];5(184):1-9. Disponible en: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4001058/
47. Li X, Shen L, Tan H. Polymorphisms and Plasma Level of Transforming Growth Factor-Beta 1 and Risk for Preeclampsia: A Systematic Review. PLoS ONE. [Internet]. 2014[citado 17 Jul 28];9(5):e97230. Disponible en: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4019528/
48. Wu W, Yang H, Feng Y, Zhang P, Li S, Wang X, et al. Polymorphisms in complement genes and risk of preeclampsia in Taiyuan, China. Inflamm Res. [Internet]. 2016[citado 17 Jul 31];65(10):837-45. Disponible en: https://link.springer.com/article/10.1007%2Fs00011-016-0968-4
Recibido: 1 agosto 2017.
Aprobado: 19 de septiembre de 2017.
Alaín Alonso-Remedios. Universidad de Ciencias Médicas de Cienfuegos. Cuba.
Correo electrónico: alain.alonos@gal.sld.cu