Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Obstetricia y Ginecología
versión impresa ISSN 0138-600Xversión On-line ISSN 1561-3062
Rev Cubana Obstet Ginecol vol.44 no.2 Ciudad de la Habana abr.-jun. 2018
GINECOLOGÍA Y RIESGO REPRODUCTIVO
Factores pronósticos para lograr el embarazo con inseminaciones artificiales intrauterinas
Prognostic factors to achieve pregnancy with artificial intrauterine inseminations
José Ignacio Frade Guardado,I Caridad Yánez Vincent,II José Alberto Almaguer Almaguer,I Yudy Cambero MartínezI
I Facultad de Ciencias Médicas Salvador Allende. La Habana, Cuba.
II Hospital Ginecobstétrico Ramón Gonzalez Coro. La Habana, Cuba.
RESUMEN
Introducción: La inseminación artificial consiste en el depósito de espermatozoides en el conducto genital femenino con la finalidad de lograr embarazos.
Objetivo: Evaluar factores pronósticos de éxito para el embarazo y calcular la tasa acumulada por ciclos de inseminación intrauterina.
Método: Estudio descriptivo, prospectivo, analítico y longitudinal. Se analizaron los ciclos realizados entre los años 2014 - 2016. Se incluyeron mujeres infértiles entre 24 y 41 años. Se precisó: tipo y tiempo de infertilidad, causas, densidad y movilidad espermáticas poscapacitación, número de folículos, grosor endometrial y cantidad de ciclos en que se realizó la inseminación. Se realizó una estimulación ovárica controlada según protocolos establecidos y seguimiento folicular ecográfico. Los resultados se analizaron mediante el programa SPSS 15.0. Las categóricas se evaluaron en frecuencias y porcentajes.
Resultados: Se analizaron 290 parejas con 736 ciclos totales. La tasa de embarazo por ciclo y por parejas fue de 8,3 y 21,0 % respectivamente, con edades de 33,3 ± 5,2 años. Las tres variables significativas fueron: tiempo de infertilidad, movilidad espermática y número del ciclo en que se realizó la inseminación.
Conclusiones: El mayor éxito se logra en los dos primeros ciclos de tratamiento, en parejas con menos de cuatro años de infertilidad y con movilidad espermática ≥ 77,6 %.
Palabras clave: inseminación artificial intrauterina; infertilidad de la pareja.
ABSTRACT
Introduction: Artificial insemination consists of depositing sperm in the female genital duct in order to achieve pregnancies.
Objective: To evaluate prognostic factors of success for pregnancy and calculate the rate accumulated by cycles of intrauterine insemination.
Method: A descriptive, prospective, analytical and longitudinal study was carried out in cycles ran between 2014 and 2016. Infertile women aging 24 and 41 years were included. We determined type and time of infertility, causes, sperm density and mobility post-capacitation, number of follicles, endometrial thickness, and number of cycles in which insemination was performed. Ultrasound follicular follow-up and controlled ovarian stimulation, according to established protocols, were performed. The results were analyzed using the SPSS 15.0 program. The categories were evaluated in frequencies and percentages.
Results: Two hundred ninety (290) couples were studied with 736 total cycles. The pregnancy rate per cycle and in pairs was 8.3 and 21.0% respectively, ages ranges 33.3 ± 5.2 years. The three significant variables were time of infertility, sperm motility and number of the cycle in which insemination was performed.
Conclusions: The greatest success is achieved in the first two treatment cycles, in couples with less than four years of infertility and sperm motility ≥ 77.6%.
Keywords: artificial intrauterine insemination; infertility of the couple.
INTRODUCCIÓN
La inseminación artificial (LAC) es una técnica de reproducción asistida que consiste en el depósito de espermatozoides (previa preparación) en el conducto genital femenino, con la finalidad de lograr el embarazo. La inseminación intrauterina (IIU) ha mejorado su tasa de éxitos gracias a los avances tecnológicos y al mejor conocimiento de la fisiología reproductiva.1
Cuando se habla de LAC se debe hacer referencia a las técnicas de capacitación del semen, las cuales permiten obtener mayor número de espermatozoides móviles y de morfología normal, así como a la utilización de tratamientos hormonales que ayuden al desarrollo folicular múltiple.2 La incorporación de la ecografía vaginal hace posible el estricto control del desarrollo folicular y la correcta sincronización entre la ovulación y el momento de la inseminación.3
La IIU se recomienda cuando existen alteraciones como: incapacidad para depositar el semen en la vagina, oligo, asteno, terato o azoospermia no aguda,4 anatomía del cuello uterino no apta para la penetración espermática, endometriosis, disfunción ovulatoria, infertilidad inmunológica o de origen desconocido. 5 La tasa de éxitos varía de un centro de reproducción a otro unos reportan tasas de embarazo muy bajas (5 %) y otros muy altas (70 %); sin embargo, de 10 a 20 % de los embarazos clínicos (por ciclos) demuestran límites aceptables para todas las causas.5,6
El momento de la ovulación es un factor decisivo para determinar el éxito de la IIU; por lo cual se han establecido estrategias, como el monitoreo urinario de la hormona LH, o la inyección de gonadotropina coriónica humana (HCG) para inducir la ovulación; permitiendo la segunda un mejor control del ciclo.3,7
Existen parámetros que pronostican el éxito en la IIU. El factor principal que se vincula con la mujer es la edad, ya que es indicador directo de la calidad de los ovocitos.8 Otros factores importantes son el número de folículos preovulatorios y el grosor endometrial al momento de la ovulación.9,10 Es difícil determinar el efecto de los parámetros masculinos en la tasa de embarazo con la IIU. La falta de unificación de los parámetros normales del espermograma es otra de las causas que dificultan la evaluación de sus ventajas en el éxito de la IIU.10 En la actualidad se considera que la concentración de espermatozoides móviles poscapacitación es el principal factor pronóstico para el éxito.5,8 La infertilidad ocasionada por afectación grave del factor masculino requiere de técnicas de reproducción asistida de alta complejidad.11
Varias publicaciones han intentado identificar el valor pronóstico de los diferentes parámetros reproductivos en las parejas infértiles.12,13 La finalidad de este estudio fue evaluar los factores pronósticos de éxito para el embarazo con la IIU, así como calcular las tasas acumuladas de embarazo por ciclo y por pareja mediante esta técnica; además de la planeación eficaz de los tratamientos para pronosticar la probabilidad de éxito de manera general e individual en las parejas sometidas a este tratamiento.
MÉTODOS
Se realizó estudio descriptivo, prospectivo, analítico y longitudinal. El grupo de estudio lo conformaron 290 parejas que se realizaron 736 ciclos de IIU entre el 1ro de enero del 2014 y el 31 de diciembre de 2016 en el Hospital Ginecobstétrico Docente "Ramón González Coro" en La Habana, Cuba que cumplieron con los criterios de inclusión propuestos.
Criterios de inclusión:
- Pareja en seguimiento por infertilidad.
- Edad de la mujer entre 24 y 41 años.
- Causa de infertilidad: ovulatoria, tubo peritoneal (al menos una trompa permeable), factor masculino alterado, endometriosis, factor uterino, factores mixtos e infertilidad de causa no determinada.
- Qué estuvieran de acuerdo a ser parte de la investigación mediante la firma del consentimiento informado.
- Qué todos los datos estuvieran incluidos en la historia clínica.
A todas las pacientes se les realizaron los estudios relacionados al protocolo de atención a la pareja infértil: espermograma directo, histerosalpingografía y/o histerosonografía y/o laparoscopia contrastada, cultivos de exudado cérvico-vaginal,Chlamydia trachomatis, Mycoplasma hominis y Ureaplasma urealyticum. Las parejas con factor masculino alterado (según los parámetros de la Organización Mundial de la Salud) fueron valoradas por Urología previamente en su inclusión en el protocolo de IIU.
Ninguno de los procederes realizados constituyó una modificación al seguimiento normal de las parejas, ni representaron un retraso para el tratamiento. Todas las parejas mostraron su aceptación para ser parte de la investigación al firmar el consentimiento informado ( Anexo I).
Se analizaron las siguientes variables: edad, tipo de infertilidad (primaria o secundaria), causa de la infertilidad (factor alterado), tiempo de infertilidad, densidad espermática poscapacitación, movilidad espermática poscapacitación, número de folículos totales y maduros, grosor endometrial, día del ciclo en que se realizó la IIU y número del ciclo en el que se efectuó. En cuanto a la edad de las mujeres según años cumplidos, se agruparon en cuatro grupos definidos como menores de 30 años, de 30 a 34 años, 35 a 39 años, 40 años y más.
Para la población de estudio se establecieron las definiciones operativas siguientes:
•Infertilidad primaria o secundaria: se designó así a la pareja que al momento de ingreso al estudio no había logrado el embarazo o lo contrario, respectivamente.
• Causa de la infertilidad: se definió con base en si la pareja demostró uno o más factores alterados. Definimos causa mixta cuando hubo más de un factor alterado en la pareja. La endometriosis se dividió en endometriosis I-II o III-IV.
• Densidad espermática poscapacitación: concentración espermática después de la preparación del semen.
• Movilidad espermática poscapacitación: la suma del porcentaje de la movilidad lineal progresiva rápida o tipo A, más la movilidad lineal no progresiva o tipo B.
• Número de folículos totales y maduros: número de folículos logrados al final de la estimulación ovárica (se consideraron maduros con tamaño ≥ 16 mm).
• Grosor endometrial: es la longitud ántero posterior del endometrio (en mm) medida a 1 cm del fondo de la cavidad endometrial con el útero en corte sagital.
• Día de inseminación: día del ciclo menstrual en que se realizó la IIU.
• Número de ciclo: número de IIU realizadas a la paciente.
Protocolo de estimulación ovárica y seguimiento folicular
La estimulación ovárica se inició en la mayoría de las pacientes con gonadotropina menopáusica humana (hMG), a dosis inicial de 75 a 150 UI/día a partir del tercer día del ciclo y/o Citrato de Clomifeno (50 - 10 mg desde 3 o 5to día del ciclo x 5 días).
El seguimiento folicular se efectuó con ultrasonido Toshiba 1400 y un transductor transvaginal de 6.0, MHz. Se realizó ultrasonido transvaginal basal (entre 2do. y 5to. día del ciclo); en caso de no encontrar afectación uterina, ovárica o de trompas (miomas submucosos o que distorsionen el contorno endometrial, quistes ováricos mayores de 12 mm, endometriomas o hidrosálpinx que contraindiquen la estimulación ovárica) se reinició el seguimiento folicular el día 8 del ciclo y se realizó cada 48 ó 72 horas (dependiendo del tamaño folicular, aumentando o disminuyendo la dosis en protocolos con hMG), hasta encontrar entre 3 y 5 folículos ≥ 16 mm. En ese momento administrar gonadotropina coriónica humana (hGC) a concentraciones de 5 000 a 10,000UI como dosis única. La IIU se realizó 36 horas después de administrar la hGC y en los casos con indicaciones de inseminación en doble día se realizaron a las 12 y 36 horas posteriores a la aplicación de esta hormona. La FSH recombinante (FSH r) se administró en un porcentaje pequeño de los ciclos a dosis similares a la de la hMG, y en combinación con ella.
Capacitación espermática
La muestra de semen se recolectó por masturbación (con abstinencia sexual de dos a cinco días) en un recipiente de plástico estéril y se colocó en baño María a 37 oC durante veinte minutos. Posteriormente se realizó espermograma pre capacitación. La preparación del semen o capacitación espermática se realizó con la técnica de dos gradientes de concentración en gradientes de 40 y 90%, respectivamente. La muestra se mezcló con fluido tubárico humano (HTF) enriquecido con suero sintético sustituto (SSS) al 10% (HTF más SSS 10%); después, se centrifugó durante cinco minutos a 1,600 rpm, eliminando el sobrenadante y re suspendiendo con 2 mL de HTF más SSS 10%.
Técnica de inseminación
Con la paciente en posición de litotomía, se colocó espéculo vaginal limpiando el cuello uterino y la vagina con gasas secas estériles. Se conectó la jeringa de insulina de 1.0 mL al catéter con guía para la inseminación. Se introdujo lentamente hasta cerca de 1 cm del conducto uterino, depositando la muestra durante 30 segundos y extrayendo el catéter lentamente. Se retiró el espéculo y dejando a la paciente en reposo (30 min).
Soporte de fase lútea
A todas las pacientes se les administró progesterona sintética intramuscular a dosis de entre 25 y hasta 100 mg/día, desde el día de la IIU y hasta que hubiera sangrado menstrual o determinación de hGC en sangre negativa, o hasta las 14 semanas de gestación.
Análisis estadístico
Se dividió la población en dos grupos: embarazadas y no embarazadas. Los resultados se analizaron mediante el programa estadístico Statview 9.0 y el SPSS 15.0.
Estadística descriptiva
Las variables continuas (edad, tiempo de infertilidad en años, densidad espermática poscapacitación, movilidad espermática poscapacitación [A+B], folículos totales, folículos maduros, grosor endometrial, día de inseminación y número de ciclos) se describieron con tendencia central de media, Medidas de dispersión (DE) y rangos (mínimo y máximo).
Las variables categóricas (causa de la infertilidad, tipo de infertilidad y tratamiento) se describieron con frecuencias y porcentajes. La variable de embarazo se utilizó como constante de agrupamiento para describir las mediciones de tendencia central, dispersión y frecuencias, divididas en los grupos de embarazadas y no embarazadas. También se muestra la tasa de embarazo para las variables donde se encontraron diferencias estadísticas (análisis estadístico inferencial).
Estadística inferencial
En todos los casos se tomó como variable dependiente al embarazo, con valor 1 para positivo (embarazo) y 2 para negativo (no embarazo). Se consideró significativa la p<0.05. Las variables continuas se evaluaron mediante regresión logística univariada para determinar la significación estadística y se reportó el intervalo de confianza asintótico del coeficiente al 95%.
La variable del tipo de infertilidad se estimó en razón de probabilidades y su significación e intervalo de confianza con el método de Mantel-Haenszel. Las variables de causa de la infertilidad y tratamiento se analizaron con la chi cuadrado independiente. Se calcularon los intervalos relevantes para determinar los puntos de corte óptimos en las variables: tiempo de infertilidad (años), movilidad A + B (poscapacitación), ciclo en el que se realizó la IIU y en las que se identificó significación estadística para embarazo, según regresión logística.
RESULTADOS
Durante el periodo estudiado se analizaron 736 ciclos de IIU realizados en 290 parejas. Las tasas de embarazo por ciclo y por pareja fueron del 8,3 y 21,0 %, respectivamente. La edad promedio de las pacientes fue de 33,2 ± 5,2 años; el tipo de infertilidad predominante fue la primaria (69,3 %) y el tiempo promedio de infertilidad de 6,5 ± 3,3 años. La causa más frecuente fue la mixta (72,1 %) y el esquema de estimulación con hMG (60,1 %) el más utilizado.
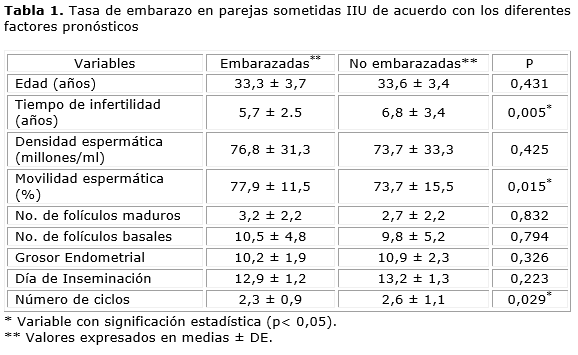
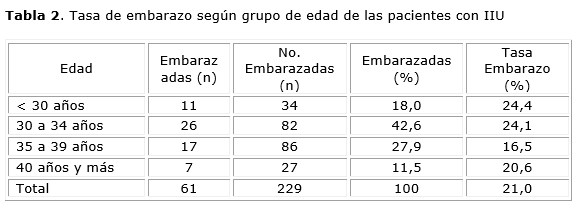
Entre los grupos no se encontraron diferencias significativas en la edad promedio entre pacientes embarazadas (33,3 años ± 3,7 años) y no embarazadas (33,6 ± 3,4 años) p= 0,43 (Anexo, Tabla 1 ). Al momento de clasificar a las pacientes por grupos de edad se obtuvo la tasa de embarazo más alta en las menores de 30 años, disminuyendo de forma progresiva hasta reflejar un pico en el grupo de 39 a 41 años (Anexo, Tabla 2). No se encontraron diferencias significativas en el tipo de infertilidad entre los grupos.
El tiempo de infertilidad fue estadísticamente significativo (p= 0,003), entre los grupos (Anexo, Tabla 1). Se encontró que la tasa de embarazo en parejas con menos de cuatro años fue del 17,6 %, disminuyendo progresivamente hasta hacerse nula en parejas con más de 13 años (Anexo, Tabla 3). La tasa acumulada de embarazo fue del 90,1 % cuando las parejas tuvieron menos de 10 años de infertilidad (Anexo, Tabla 3). Se estableció como punto de corte 4,5 años, con sensibilidad del 47,1 % y especificidad del 60,8 %.
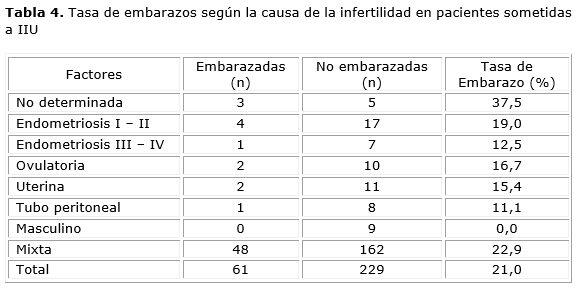
La causa más frecuente de infertilidad fue la mixta 63,2 % de las pacientes embarazadas y en 72,8 % de las no embarazadas (Anexo, Tabla 4). La relación con mayor predominio (dentro de las mixtas) fue el factor masculino y la endometriosis I-II. La segunda causa (única) con mayor frecuencia fue la endometriosis I-II en 11.5% de las pacientes embarazadas y en 6,2 % de las no embarazadas. La distribución de las causas de infertilidad fue homogénea entre los grupos y no mostró diferencias significativas (p= 0,06) en estas variables.
Al analizar el grupo de pacientes embarazadas se encontró que la mejor tasa de embarazo se obtuvo en las parejas con infertilidad de causa no determinada (37,5 %), endometriosis I-II (19,0 %) y factor ovulatorio (16,7 %) (Anexo, Tabla 4). Ninguna de las parejas con factor masculino (4,4 %) como causa única logró embarazo. Debido a este resultado se investigó (dentro del factor mixto) el porcentaje de parejas con factor masculino y se demostró que 29,4 % del total de las parejas lo padecían; el grupo de mujeres embarazadas tuvieron factor masculino alterado en 26,4 % (como causa mixta) frente a 33,6 % de las no embarazadas (p= 0,22).
La densidad espermática poscapacitación en el grupo de pacientes embarazadas fue de 76,8 ± 31,3 millones/mL y en las no embarazadas de 73,7 ± 33,3 millones/mL (p= 0,42). El análisis de la movilidad espermática poscapacitación fue superior significativamente (p= 0,01) en el grupo que logró embarazos (77,9 ± 11,5 %) (Anexo, Tabla 1). Después de calcular la curva se estableció el punto de corte del 77,8 %, con sensibilidad del 61 % y especificidad del 53 %. Las parejas que no lograron el embarazo tuvieron resultados de densidad < 10 millones/mL y movilidad ≤ 22 %.
No existieron diferencias significativas (p> 0,05) en el promedio de folículos maduros, número total de folículos y grosor endometrial (al final de la estimulación ovárica). El esquema de estimulación ovárica más utilizado en ambos grupos fue la hMG, seguido del citrato de clomifeno en 93,1 frente a 89,7 y 2,3 frente 9,3 % de las embarazadas y no embarazadas respectivamente. Al analizar el efecto de los diferentes esquemas de estimulación ovárica se encontraron diferencias significativas entre los grupos (p= 0,0006). La tasa de embarazo más alta se logró con el esquema de FSH recombinante + hMG (28,6 %), seguido de la hMG sola (13,5 %) y de citrato de Clomifeno (3,6 %).
Por la baja tasa de embarazo lograda en el grupo de pacientes que usaron citrato de clomifeno solo, se analizó la significación entre usuarias de estas y los otros esquemas. Los resultados tuvieron diferencias significativas (p= 0,02), a favor de las que no usaron Citrato de Clomifeno. Las parejas que tuvieron éxito realizaron, en promedio, números significativamente menores (p= 0.029) de ciclos, en comparación con las que no lo tuvieron (2,3 ± 0,9 frente 2,6 ± 1,1 ciclos) (Anexo, Tabla 1). El punto de corte óptimo fue de 2.5 ciclos, con sensibilidad del 42,5 % y especificidad del 47,0 %.
Al calcular la tasa acumulada de embarazo por se observó que ésta aumenta del 15,8 % en el primer ciclo, al 28,6 % con dos ciclos y subiendo hasta 38,1 % después del tercero y hasta el sexto ciclo. La tasa de embarazo por ciclo disminuye después del cuarto ciclo (Anexo 1 ).
DISCUSIÓN
Los factores pronósticos de éxito en IIU varían según diferentes reportes, por lo que no se pueden dar con bases más objetivas que las que desearíamos. Esto es el reflejo de tratar pacientes con variabilidad biológica marcada en su reacción al tratamiento. En este estudio pretendimos identificar los factores pronósticos de éxito en la IIU así como calcular la tasa acumulada de embarazos por ciclo.5,14,15
La edad de la mujer se relaciona directamente con la fecundidad, pues disminuye con el paso de los años debido entre otras cosas a una reducción de la receptividad uterina y una disminución en la calidad de los ovocitos.16 En este estudio, la tasa de éxito es nula en las pacientes mayores de 39 años.
No encontramos diferencias significativas entre la edad promedio del grupo que logró embarazos versus el grupo que no los logró (p= 0,43). Estos resultados coinciden con autores que reportan a la edad como factor pronóstico no significativo en la IIU;5,16 sin embargo, otros si describen diferencias significativas de este factor con las tasas de embarazo en menores de 25 años y mayores de 40. 9,15 Nuestra investigación demostró que en el grupo de pacientes embarazadas la tasa disminuye a partir de los 35 años, con un engañoso incremento en aquellas con 39 años, considerando se encuentra en relación con la poca cantidad de pacientes incluidas en este grupo y el predominio en ellas de estimulación con FSH r + hMG.
El análisis reflejó que los tres factores pronósticos de éxito en la IIU: fueron la duración de la infertilidad (p= 0,005), el número de espermatozoides móviles poscapacitación (0,015) y el número del ciclo (0,029) en el que se realizaron. Corroborando que el éxito de la IIU disminuye mientras mayor sea el tiempo de infertilidad de la pareja.5,16 Ninguna pareja logró embarazarse con infertilidad mayor a 13 años.
En esta investigación se evaluaron el valor de la densidad y la movilidad espermática poscapacitación como los principales parámetros seminales pronósticos de éxito. De ellos, la movilidad espermática demostró un valor significativo entre ambos grupos (0,015), lo que contrasta con algunos estudios en los que hubo diferencias significativas importantes en relación con la densidad espermática.5,17 No obstante la mayoría de las investigaciones coincide que la movilidad espermática es más importante como factor pronóstico que la densidad espermática poscapacitación.18
Coincidimos con los resultados mencionados al encontrar que el índice de espermatozoides móviles poscapacitación fue mayor (significativamente p= 0,001) en el grupo que lograron embarazos (77,9 ± 11,5 %) vs el grupo que no los logró (73,7 ± 15,5 %) y sugerimos mediante el punto de corte óptimo que el porcentaje del 77,8 % merece tomarse en consideración como referencia para establecer pronósticos en lo que a esta variable se refiere.
La tasa de embarazo con IIU se ha reportado de manera más o menos constante durante los primeros seis ciclos de tratamiento, pero varios autores reportan disminución de éstas a partir del tercer ciclo realizado.15,16 Nosotros encontramos que el grupo que logró embarazos, lo hizo en menor número de ciclos (2,3 ± 0,9) que el grupo que no los logró (2,6 ± 1,1) (p= 0,04), lo cual asevera lo reportado en otros estudios. El punto de corte óptimo (1.5 ciclos) confirma que después de dos ciclos la tasa de embarazo disminuye. Resultados muy similares a los reportado por otros autores con muestras superiores,16 con base sugerimos realizar como máximo cuatro ciclos de IIU y de no tener resultados acudir a una técnica de alta complejidad.
No se encontró relación significativa según el tipo de infertilidad (primaria o secundaria), similar a lo reportado en otras investigaciones afines.5,16 Es difícil determinar y aislar el efecto negativo de la causa de infertilidad en la tasa de embarazo. Nuestro estudio demostró que la mayor parte de los embarazos se lograron en pacientes con causas mixtas de infertilidad (63,1 %), seguidos por los logrados en pacientes con endometriosis I-II (11,5 %) y con factor endocrino ovárico (8,1 %). Al momento de analizar la tasa de embarazo que se logró en cada una de las causas, se obtuvo que las mejores tasas de embarazo ocurrieron en las pacientes con infertilidad de causa no determinada (30 %), seguido por la causa mixta (23 %),endometriosis I-II (21,7 %) y factor endocrino ovárico(19,4 %).
El número de folículos totales y maduros pueden ser factores pronósticos de éxito en IIU. En nuestro estudio no encontramos relación entre el número total de folículos y el éxito de la inseminación en términos de embarazo (p= 0,9). La estrecha relación entre el número de folículos maduros y el éxito de la inseminación se han confirmado en otras investigaciones,18,19 sin embargo en la presente investigación no encontramos diferencias significativas relacionadas a esta variable. Situación similar a la ocurrida con respecto al grosor endometrial.
Los esquemas de tratamiento estudiados con mayor frecuencia en nuestro estudio fueron la hMG (90,1 %) y el Citrato de Clomifeno (8,4 %) con tasa de éxito del 13,5 y 3,6 %, respectivamente. Estos resultados contrastan con otros que reportan mayor tasa de embarazo con FSH r, 5 o con esquemas que emplean hMG.20 El día del ciclo en que se realiza es otro factor muy importante para el éxito de la IIU. No obstante, nuestros resultados demuestran que no hay diferencias significativas.7
Conclusiones
Finalmente, la tasa acumulada de embarazo por ciclo es un factor importante. Aunque no lo consideramos pronóstico, se calculó y analizó por la importancia que tiene en la planeación que el médico y los pacientes deben hacer del tratamiento a seguir. En este estudio encontramos que la tasa acumulada de embarazo aumenta del 15,8 % en el primer ciclo, al 28,6 % en las parejas que realizaron dos ciclos y hasta 38,1 % a partir del tercero.
El resultado de la IIU no sólo está condicionado por el depósito del semen en el útero, sino por varios factores vinculados con la pareja que se convierten en decisivos para establecer o dar el pronóstico de embarazo. Las parejas que se sometan al protocolo de LAC en nuestro medio tendrá mejor pronóstico cuando tenga menos de cuatro años de infertilidad, movilidad espermática poscapacitación superior al 77,8 %, con mayores probabilidades en los dos primeros ciclos.
REFERENCIAS BIBLIOGRÁFICAS
1. Pérez E. Atención integral de la infertilidad. Endocrinología, cirugía y reproducción asistida. México: McGraw Hill, 2013; pp: 501 - 9.
2. De Jonge C. Biological basis for human capacitation. Hum Reprod Update. 2015;11:205-14.
3. Lewis V, Queenan J, Hoeger K, Stevens J, Guzick D. Clomiphene citrate monitoring for intrauterine insemination timing: a randomized trial. Fertil Steril. 2016;85:401-6.
4. Duran H, Morshedi M, Kruger T, Oehnninger S. Intrauterine insemination: a systematic review on determinants of success. Hum Reprod Update. 2002;8:373-84.
5. Tomlinson MJ, Amissah JB, Thompson KA, Kasrai JL, Bentick B. Prognostic indicators for intrauterine insemination (IUI): statistical model for IUI success. Human Reproduction. 2014;11:1892-6.
6. Ombelet W, Puttemans P, Bosmans E. Intrauterine insemination: a first-step procedure in the algorithm of male subfertility treatment. Hum Reprod. 2015;10(Suppl.1):90-102.
7. Zreik TG, Garcia-Velasco JA, Habboosh MS, Olive DL, Arici A. Prospective, randomized, crossover study to evaluate the benefit of human chorionic gonadotropin-timed versus urinary luteinizing hormone-timed intrauterine inseminations in clomiphene citrate-stimulated treatment cycles. FertilSteril. 2017;71:1070-4.
8. Stone BA, Vargyas JM, Ringler GE, Stein AL, Marrs RP. Determinants of the outcome of intrauterine insemination: analysis of outcomes of 9963 consecutive cycles. Am J Obstet Gynecol. 2016;180:1522-34.
9. Khalil MR, Rasmussen PE, Erb K, Laursen SB. Homologous intrauterine insemination. An evaluation of prognostic factors based on a review of 2473 cycles. Acta Obstet Gynecol Scand. 2015;80:74-81.
10. Montanaro GM, Kruger TF, Coetzee K, Smith K. Stepwise regresion analysis to study male and female factors impacting on pregnancy rate in an intrauterine insemination programme. Andrología. 2016;33:135-41.
11. OMS. Manual de laboratorio para el examen del semen humano y de la interacción entre el semen y el moco cervical. 8ª ed. Buenos Aires: Editora Panamericana, 2013.
12. Goverde AJ, McDonnell J, Vermeiden JP, Schats R. Intrauterine insemination or in vitrofertilization in idiopathic subfertility and male subfertility: a randomized trial and cost effectiveness analysis. Lancet. 2015;355:13-8.
13. Revised American Society for Reproductive Medicine classification of endometriosis 1996; Fertil Steril. 2015;77:817-21.
14. Dickey RP, Taylor SN, Lu PY, Sartor BM. Effect of diagnosis, age, sperm quality, and number of preovulatory follicles on the outcome of multiple cycles of clomiphene citrate-intrauterine insemination. Fertil Steril. 2016;78:1088-95.
15. Nuojua-Huttunen S, Tomas C, Bloigu R, Tuomivaara L, Martikainen H. Intrauterine insemination treatment in subfertility: an analysis of factors affecting outcome. Hum Reprod. 2016;14:698-703.
16. Cano F, Simon C, Remohi J, Pelicer A. Effect of aging on the female reproductive system: evidence for a role of uterine senescence in the decline in female fecundity. Fertil Steril. 2015;64:584-9.
17. Van Waart J, Kruger TF, Lombard CJ, Ombelet W. Predictive value of normal sperm morphology in intrauterine insemination (IUI): a structured literature review. Hum Reprod Update. 2015;7:495-500.
18. Ombelet W, Vandeput H, Van De Putte G, Cox A. Intrauterine insemination after ovarian stimulation with clomiphene citrate: predictive potential of inseminating motile count andsperm morphology. Hum Reprod. 2015;12:1458-63.
19. Hughes EG. The effectiveness of ovulation induction and intrauterine insemination in the treatment of persistent infertility: a meta-analyses. Hum Reprod. 2016;12:1865-72.
20. Daya S, Gumby J, Hughes EG. Randomized controlled trial of follicle stimulating hormone versus human menopausal gonadotropin in in-vitro fertilization. Hum Reprod. 2015;10:1392-6.
Recibido: 4/12/2017.
Aprobado: 4/1/2018.
José Ignacio Frade Guardado. Facultad de Ciencias Médicas Salvador Allende. La Habana, Cuba.
Correo electrónico: joseignacio@infomed.sld.cu
ANEXO. Modelo Consentimiento Informado para Inseminación Artificial.
Paciente:________________________________ CI:___________________
Paciente:________________________________ CI:___________________
La inseminación artificial (LAC) es una técnica de reproducción asistida de baja complejidad. Su objetivo es aumentar la posibilidad de lograr un embarazo durante un ciclo menstrual en parejas en seguimiento por infertilidad (10% ciclo natural a 20% por LAC). Con esto aumentan la cantidad de espermatozoides que llegan al sitio donde normalmente ocurre la fecundación.
Indicaciones:
- Infertilidad cervical.
- Infertilidad masculina (leve o moderada).
- Infertilidad inmunológica.
- Endometriosis (mínima o ligera).
- Infertilidad de causa inexplicable.
- Parejas con otro factor alterado que previo al inicio hayan realizado al menos 3 ciclos fallidos de relaciones sexuales dirigidas (coito dirigido).
Etapas:
1.- Estimulación ovárica controlada: el estímulo a utilizar se definirá en ciclos previos dependiendo de edad, peso, antecedentes de trastornos ovulatorios, respuesta a la estimulación previa y control de esta.
2.- Seguimiento ecográfico (y/o control hormonal con estradiol): primera ecografía entre 2do. - 5to. día, para iniciar estimulación hormonal, y al menos otra en días previos a la LAC para valorar desarrollo folicular y necesidad de usar GCH antes del proceder para propiciar la ovulación (24 - 36 h).
3.- Soporte fase lútea: la implantación embrionaria y el mantenimiento del embarazo se ven favorecidos con la administración de progesterona, la que de ser necesaria se administraría desde el día de la inseminación. Administración diaria hasta la menstruación o el diagnóstico del embarazo.
Seguimiento: 18 días después de la LAC se realizará extracción de sangre para medir la cantidad de gonadotropina coriónica humana (β HCG), hormona específica del embarazo, la que de ser positiva se repetiría a los 7 días (siempre que la paciente no menstrúe). De ser negativa suspender suplementación de la fase lútea. Realizar ecografía transvaginal a los 7 días de atraso menstrual para diagnóstico de certeza de embarazo.
Eficiencia:
Los procedimientos de reproducción asistida están en gran parte determinados por la calidad y capacitación de los profesionales y el equipamiento del centro. Existen otras condiciones que afectan las probabilidades de embarazo, estas son:
- edad de la mujer (probabilidad menor a mayor edad).
- calidad de los gametos.
- calidad de los embriones que se forman.
Riesgos y efectos secundarios:
1.- Aquellas que dependen de la estimulación ovárica controlada (EOC).
2.- Fracaso del proceder: de no producirse el embarazo en un ciclo se realizaran de manera consecutiva entre otros 2 o 3 ciclos. De no obtener el resultado esperado se reevaluaran todos los factores y se reiniciará el protocolo. No se recomiendan realizar más de 6 ciclos.
3.- Abortos Espontáneos: existe la probabilidad de que aunque ocurra la fecundación no se logre la implantación del embrión, o una vez que esto ocurra se desprenda (aborte). La probabilidad se sitúa en alrededor del 15% de los embarazos que se logran con la LAC. En caso de ocurrir se recomienda suplementación de fase lútea al reiniciar el protocolo.
4.- Embarazo múltiple: relacionado con el mayor número de óvulos producidos con la EOC y la edad de la mujer La posibilidad de complicaciones para la madre y los hijos aumenta a mayor número de fetos.
5.- Embarazo ectópico: implantación del embrión fuera del útero. Este diagnóstico se puede hacer alrededor de 21 días después de la LAC.
6.- Malformaciones congénitas: El porcentaje no es mayor que el de la de la población general.
7.- Infecciones.
8.- Riesgos personalizados: Debido a las características médicas, psicológicas y sociales de este caso particular, se podría asociar algún riesgo específico agregado, como puede ser:
_______________________________________________________________
_______________________________________________________________
Posibilidad de retirar el consentimiento:
La firma de este documento no les compromete de forma definitiva, siendo totalmente libres de retirar o modificar el consentimiento antes del procedimiento, por cualquier motivo. Sin embargo, de cambiar de opinión respecto al tratamiento, deben hacerse responsable de informar al centro y firmar el consentimiento donde se indiquen sus nuevas decisiones.
Si desean mayor información de la que está en este formulario, pueden solicitarla en cualquier momento. Siempre será un placer servirles.
En: ________________________, a los ____ días del mes de _____________, del año 20_____.
Firma: ______________________ Firma:_______________________
Paciente Paciente
Médico: _______________________________
Registro Profesional