Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Obstetricia y Ginecología
versión impresa ISSN 0138-600Xversión On-line ISSN 1561-3062
Rev Cubana Obstet Ginecol vol.44 no.3 Ciudad de la Habana jul.-set. 2018
OBSTETRICIA Y MEDICINA PERINATAL
Reacciones adversas por medicamentos en embarazadas cubanas
Adverse Drug Reactions in Cuban Pregnant Women from 2003 to 2013
Juan Antonio Furones-Mourelle,1 María Aida Cruz-Barrios,1 Ángel Francisco López-Aguilera, 2 Druyet Castillo Dalilis,3 Julia Pérez-Piñero1
1 Escuela Nacional de Salud Pública. La Habana. Cuba.
2 Facultad de Ciencias Médicas "Julio Trigo". La Habana, Cuba.
3 Ministerio de Salud Pública de Cuba.
RESUMEN
Introducción: La vigilancia poscomercialización de la seguridad de los medicamentos en las gestantes es esencial para prevenir los efectos perjudiciales de los fármacos.
Objetivos: Caracterizar las reacciones adversas medicamentosas en embarazadas reportadas al Sistema de Farmacovigilancia e identificar nuevos efectos adversos.
Método: La primera etapa del estudio fue descriptiva y transversal y la segunda fue analítica. El estudio se realizó desde 2003 hasta 2013. La fuente de información fue la base de datos nacional de Farmacovigilancia. Para detectar las señales, se calculó el riesgo relativo proporcional (RRP). Los pares medicamento-reacción adversa con RRP> 2 (p ≤ 0,05), se sometieron a evaluación cualitativa por expertos.
Resultados: La tasa de notificación reacciones adversas fue de 1 536,6 / 105 embarazadas. El grupo de 40 y más años (2 357,8 / 10 5) resultó ser el más afectado. Las reacciones adversas medicamentosas predominantes fueron vómito (22,8 %), leves (52,8 %), probables (64,9 %) y frecuentes (65,9 %), producidas más por antivirales (21,1 %) y oseltamivir (21,9 %). Los licenciados en farmacia (37,2 %) reportaron más desde la atención secundaria de salud (60,9 %). Se detectaron 7 avisos y una señal.
Conclusiones: Las reacciones adversas medicamentosas en embarazadas detectadas en una década mostraron características diferentes a lo reportado a nivel internacional y nacional. Se generó la señal de una nueva reacción adversa por un antiviral que estaba en vigilancia intensiva.
Palabras clave: reacción adversa medicamentosa; Farmacovigilancia; farmacoepidemiología; embarazadas.
ABSTRACT
Introduction: There is no knowledge of the characteristics of adverse drug reactions in Cuban pregnant women or the signs of new adverse reactions during a decade of notification.
Objectives: To characterize adverse drug reactions in pregnant women reported to the Pharmacovigilance System from 2003 to 2013. To identify signs of new adverse reactions.
Method: This study had two stages. The first stage was descriptive and transversal, the second was analytical. The source of information was the national pharmacovigilance database. We calculated the relative proportional risk (RRP) to detect signals. Experts subjected the drug-adverse reaction pairs with RRP > 2 (p ? 0, 05) to qualitative evaluation.
Results: The reporting rate of adverse reactions was 1 536, 6 / 105 pregnant. The age group of 40 and older (2 357, 8 / 105) was the most affected. The predominant adverse drug reactions were vomiting (22, 8%), mild (52, 8%), probable (64, 9%) and frequent (65, 9%) produced more by antiviral drugs (21,1%) and oseltamivir (21,9%). Graduates in pharmacy (37, 2%) reported more from secondary health care (60,9%). Seven warnings and a signal were detected.
Conclusions: Adverse drug reactions in pregnant women detected in a decade showed different characteristics than those reported at the international and national levels. The signal of a new adverse reaction was generated by an antiviral that was under intensive surveillance.
Keywords: adverse drug reaction, pharmacovigilance, pharmacoepidemiology, pregnant.
INTRODUCCIÓN
La Organización Mundial de la Salud (OMS) define: reacción adversa a medicamento como la reacción nociva y no deseada que se presenta tras la administración de un fármaco, a dosis utilizadas habitualmente en la especie humana, para prevenir, diagnosticar o tratar una enfermedad, o para modificar cualquier función biológica.1
Las reacciones adversas a medicamentos (RAM) representan un problema de la Salud Pública y en farmacoterapéutica al estar asociadas con elevada morbilidad, mortalidad, bajo cumplimiento y amenazan el éxito del tratamiento. Representan3,6 % de los ingresos y 10,1 % de los pacientes hospitalizados las padecen.2 En atención primaria son motivo de consulta en 2,5 % de los casos.3 En los países desarrollados se ubican entre la tercera y cuarta causa de muerte, por encima de la diabetes y la neumonía.4 Las RAM tienen un notable costo económico en los sistemas sanitarios.5
Muchos de los problemas actuales de seguridad de los medicamentos ocurren porque las agencias reguladoras, responsables de autorizar la comercialización de un nuevo fármaco, basan sus decisiones en los ensayos clínicos precomercialización, válidos para demostrar eficacia, pero con limitaciones para verificar su seguridad.6 Gran número de RAM no se conocen hasta años posteriores a la comercialización.7
La farmacovigilancia (FV) surge como una respuesta al desastre de la talidomida a mediados del siglo XX. Este hecho conmocionó a la sociedad e indicó que los sistemas sanitarios deben contar con medios de detección oportuna de RAM y estrategias para evitarlas.8 El procedimiento de pesquisa más utilizado es la notificación espontánea de sospechas de RAM por los profesionales sanitarios, cuya desventaja principal es la infranotificación.9
La principal función de la FV es la identificación precoz de RAM no descritas, la denominada señal, es la sospecha de un efecto adverso desconocido previamente, la cual se sustenta en información nueva. Esta indica la relación causal entre un acontecimiento adverso determinado y un medicamento específico. Dicha reacción adversa no aparece en la ficha técnica de ese medicamento, documento oficial de la unidad reguladora de registros de medicamentos de un país, el cual describe todas las características farmacológicas y tecnológicas de un medicamento; entre ellas, las RAM que produce. Se requiere más de una notificación para generar una señal.10
La principal fuente de señales es el programa de notificaciones espontáneas de RAM. En ella se realizan búsquedas activas en las grandes bases de datos nacionales y mundiales de reportes de efectos adversos, como la del Centro de Monitoreo de Uppsala en Suecia dela OMS. Para comunicar una nueva señal es necesaria su valoración por métodos cuantitativos y cualitativos.12
Para la detección efectiva de señales, la minería de datos ( Data mining) posee diferentes métodos cuantitativos como el riesgo relativo proporcional (RRP). Estos establecen desproporcionalidad estadística en la base de datos al comparar la proporción de reportes de una reacción adversa a un medicamento específico con la proporción de esa misma reacción para el resto de los medicamentos.13
Las embarazadas son consideradas una población de alto riesgo en FV y farmacoterapéutica por el peligro de efectos teratogénicos.14 Ellas tienen cambios fisiológicos que alteran la respuesta farmacológica al modificarse procesos farmacocinéticos y farmacodinámicos,15 así como por el vacío de información para evaluar la relación beneficio/riesgo de los fármacos al ser excluidas de los estudios precomercialización.16 Sin embargo, la mayoría de ellas usan medicamentos durante el embarazo, con una media de 2,6 a 13,6 fármacos por gestante.17
Los estudios poscomercialización de seguridad de los medicamentos en gestantes están más centrados en los riesgos dismorfogénicos.18 No obstante, se conoce que el uso de medicamentos incrementa en 14,0 % el riesgo de tener problemas en el parto.19 Los fármacos cardiovasculares, antimicrobianos y los antianémicos están entre los más implicados en las RAM.20
El Sistema Cubano de FV, rectorado por la Unidad Coordinadora Nacional de FV (Ucnfv), almacena los reportes de RAM en la base de datos FarmaVigiC, realiza sus actividades por procedimientos normalizados de trabajo (PNO) y labora en busca de señales.21 Las RAM que no aparecen en el Formulario Nacional de Medicamentos (FNM)22 se clasifican como no descritas, fuente para identificar señales.21
La FV cubana cuenta con un prestigio nacional e internacional, avalado por la OMS 23y tiene como área de trabajo priorizada las poblaciones vulnerables. Sin embargo, solo algunas investigaciones en Cuba aportan datos de las RAM en embarazadas24,25 sus resultados tienen un alcance limitado al abarcar un corto periodo de notificación o centrarse en un tipo de RAM.
No se dispone de información de las peculiaridades epidemiológicas y clínicas de las RAM en embarazadas cubanas que abarquen una década de notificación y si existen señales de reacciones adversas desconocidas en esta población. La información constituye una evidencia científica de la práctica real, que permita mejorar el uso de los medicamentos y proteger a la gestante.
El objetivo de la investigación fue caracterizar las reacciones adversas medicamentosas en embarazadas reportadas en una década al Sistema Cubano de Farmacovigilancia e identificar señales en las reacciones adversas no descritas en gestantes.
MÉTODOS
Se realizó una investigación fase IV en dos etapas. La primera fue un estudio descriptivo y transversal de serie de casos en FV. La segunda fue un estudio analítico desarrollado en Cuba con alcance nacional, desde el 1 de enero del 2003 hasta el 31 de diciembre del 2013.
En la primera etapa, el universo estuvo constituido por 1 908 reportes de RAM en embarazadas registrados en la base de datos nacional de FV en el período de estudio. Se excluyeron las RAM por Medicina Natural Tradicional y con imputabilidad no relacionada. En la segunda etapa, estuvo conformado por 177 reportes de RAM no descritas.
Las variables estudiadas fueron: para el objetivo uno la notificación de RAM, tipo de RAM, sistema de órgano afectado, medicamento y su categoría de riesgo en el embarazo, grupo farmacológico, gravedad, imputabilidad y frecuencia de RAM, así como edad de la embarazada, edad gestacional, nivel de atención de salud y notificador. Para el segundo objetivo se estudiaron aviso, alerta y sospecha de señal, tipo de sospecha y señal.
Los tipos de RAM y los sistemas de órganos afectados (SOA) se establecieron por el Diccionario de Términos de Reacciones Adversas de la OMS (WHO-ART).26 Los medicamentos por el nombre genérico según Sistema Anatómico Químico y Terapéutico (ATC ),27 los grupos farmacológicos y la categoría de riesgo del medicamento en el embarazo por el FNM.22 La gravedad, imputabilidad y frecuencia de RAM se midieron como procede la Ucnfv.21
El nivel de atención de salud según el origen del reporte. El notificador se determinó por el perfil profesional.
Se consideró aviso de señal, si al menos existen tres notificaciones de igual par medicamento-reacción adversa no descrita, alerta de señal cuando la RAM no descrita no apareció en el Martindale The Complete Drug Reference,28 ni en el Meyler´s Side Effects of Drugs.29 Sospecha de señal, si la alerta presentó fuerza de asociación entre el fármaco y el efecto adverso. Señal, cuando al menos 75 % de los expertos consideraron que es una RAM desconocida.
La fuente de información se obtuvo de la FarmaVigiC. A partir de ella, se confeccionaron dos bases de datos en aplicación Microsoft Excel, por cada objetivo y etapa de la investigación.
La confiabilidad de la base se sustenta en la calidad de la notificación, con tres filtros de revisión, realizados por farmacoepidemiólogos y profesionales expertos en la actividad, a nivel municipal, provincial y nacional. Los datos de la base fueron validados en la calidad del dato y en las evaluaciones según las Normas y procedimientos de FV de Cuba.21 La duplicidad de registros de RAM se realizó por una validación lógica. Se eliminaron los reportes duplicados.
Para caracterizar las RAM se trabajó con la reacción principal, que define la gravedad. Para identificar las señales se aplicó el algoritmo según PNO30 de la FV en Cuba, el que se adaptó en función de la investigación. Entre las adaptaciones está el establecer cuatro categorías en el proceso de identificación de la señal. La evaluación cualitativa se realizó por la Comisión Nacional de FV según las Normas y procedimientos de trabajo de FV.21
Las medidas de resumen fueron frecuencia absoluta, porcentaje y tasas. Para estimar las tasas, se utilizó la población a mitad del período proporcionada por la Dirección Nacional de Estadística. Se sometieron a prueba de hipótesis la asociación entre el medicamento y la reacción adversa de los avisos de señal. Se consideró fuerza de asociación si RRP fue al menos de 2, con intervalo de confianza al 95 % (IC- 95 %) que excluyó al uno y el estadígrafo chi cuadrado (X2) de independencia presentó nivel de significación estadística del 5 % (p< 0,05). Los datos se procesaron por SPSS 21.0 y EPIDAT 3.0.
La investigación fue aprobada por el comité de ética de la Escuela Nacional de Salud Pública. Se solicitó autorización a la Ucnfv para utilizar la base de datos. La información personal de pacientes y notificador estuvieron condición de confidencialidad.
RESULTADOS
Del 2003 al 2013 la tasa de reporte de RAM fue de 1 537,6 x 105 embarazadas, con un promedio de 173 notificaciones por año. Predominó el grupo de edad de 40 años y más con una tasa de notificación de 2 357, 8 x 105 gestantes, seguido del grupo de 20 a 29 años con tasa de 1 634,2 x 105 (Tabla 1).
No se especificó la edad gestacional en 988 (51, 8 %) reportes de RAM, mientras que en 464 (24,3 %) se indicó que las embarazadas estaban en el tercer trimestre, 300 (15,7 %) en el segundo y 156 (8,2 %) en el primer trimestre.
Los licenciados en farmacia fueron los profesionales que más notificaron con 709 reportes (37,2 %), le siguieron los médicos con 683 (35,8 %) y los licenciados y técnicos en enfermería con 270 (14,2 %) y 97 (5,1 %), respectivamente. Las pacientes de menor número de reporte fueron los técnicos en farmacia (2,8 %) y los estomatólogos (0,1%). Se identificaron otros notificadores (4,8 %), entre ellos estudiantes, trabajadores de la industria farmacéutica y farmacoepidemiólogos.
También se apreció que predominaron las RAM detectadas en la atención secundaria de salud con 1 163 (60,9 %), prosiguieron con 744 (39,0 %) del nivel primario de salud y un reporte (0,1 %) del nivel terciario.
Entre los cinco tipos de reacciones adversas con mayor número de reportes se destacaron el vómito (22,8 %) y la cefalea (8,5 %). Los sistemas de órganos más afectados fueron el digestivo (44,1 %) y la piel (14,6 %). Dentro de los cinco grupos farmacológicos sobresalieron los antivirales (21,1 %) y los antibacterianos (15,1 %). Predominaron los medicamentos con categoría de riesgo C y B en el embarazo con 655 (34,3 %) y 645 (33,8 %) de los reportes de RAM, respectivamente (Tabla 2).
Tabla 2. Reacciones adversas por medicamentos
en embarazadas según diferentes características.
| Características | No. | %* |
| RAM más frecuentes | ||
| Vómito | 436 | 22,8 |
| Cefalea | 164 | 8,5 |
| Constipación | 150 | 7,8 |
| Náusea | 106 | 5,5 |
| Erupción cutánea | 99 | 5,1 |
| Sistemas de órganos más afectados | ||
| Digestivo | 843 | 44,1 |
| Piel y anejos | 279 | 14,6 |
| Sistema nervioso central | 215 | 11,2 |
| Cardiovascular | 155 | 8,1 |
| Grupos farmacológicos más involucrados | ||
| Antivirales | 419 | 21,1 |
| Antibacterianos | 288 | 15,1 |
| Vitaminas y minerales | 260 | 13,6 |
| Vacunas | 248 | 12,9 |
| General | 133 | 6,9 |
| Categoría de riesgo de los medicamentos en el embarazo | ||
| A | 74 | 3,9 |
| B | 645 | 33,8 |
| C | 655 | 34,3 |
| D | 20 | 1,0 |
| X | 32 | 1,8 |
| No clasificado | 482 | 25,2 |
Fuente: Base FarmaVigiC de la Unidad Coordinadora Nacional de Farmacovigilancia.
Nota: * % del total de RAM.
Dentro de los fármacos catalogados como B se destacaron la betametasona con 99 reportes, el metronidazol (46) y metildopa (42). En la categoría A, el fumarato ferroso (56); en los riesgos D, el diazepam (2), fenobarbital (2) y metrotexate (3) y entre los descritos como X, el misoprostol (16) y la oxitocina (6). Sin clasificación se destacan Prenatal® (248) y vacuna Pandermix ® (218).
Los diez medicamentos más involucrados en las reacciones adversas de las embarazadas y los tipos de efectos indeseables más notificados por fármacos aparecen en la Tabla 3. Sobresalieron el oseltamivir con 418 (21,9 %) reportes de RAM, Prenatal ® con 242 (12,6 %) y la vacuna antiinfluenza A H1N1 con 218 (11,4 %).
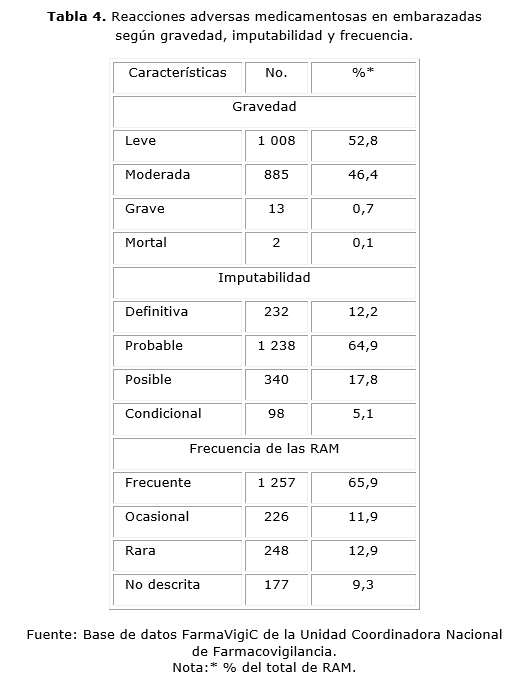
Predominaron las RAM leves (52,8 %), las probables (64,9 %) y las de aparición frecuente (65,9 %) (Tabla 4). Las RAM mortales fueron inconsciencia por paracetamol y paro cardiaco por dextrán-40. Las RAM graves fueron taquicardia ventricular por bupivicaína (3); choque anafiláctico por penicilina G sódica (3) y cefazolina (1); disnea por Prenatal® (1), cefazolina (1) y ketamina (1); paro cardiorespiratorio por lidocaína hiperbárica (1) y oxitocina (1), así como hemorragia vaginal por clotrimazol (1).
En el proceso para identificar nuevas RAM se detectaron siete avisos, una alerta y una sospecha de señal. Los siete avisos de señal contenían 27 pares de medicamento-reacción adversa no descritas, que constituyeron 15,2 % de las 177 halladas en el período de estudio. Los avisos de señal fueron betametasona-rubefacción (6 reportes de RAM), oseltamivir-somnolencia (5), penicilina-náusea (4) y penicilina-cefalea, fumarato ferroso-eritema, gentamicina-taquicardia y propranolol-cefalea con tres reportes cada uno.
La sospecha de señal fue oseltamivir-somnolencia con RRP de 81,2 (IC-95 %: 16,8 a 393,1), estadísticamente significativo (p< 0,05). Esta sospecha fue catalogada como señal y constituye 14,1 % de los avisos de señal.
DISCUSIÓN
La salud de la embarazada es cardinal en la sociedad cubana debido a la disminución de la natalidad. La vigilancia de la seguridad poscomercialización de los medicamentos en las gestantes es esencial para protegerlas de los efectos adversos de los fármacos y es responsabilidad de la salud pública.
Del 2003 al 2013 se recibieron 1 908 notificaciones de reacciones adversas en embarazadas, que representaron una proporcion baja, menos del 2,0 %, de los 140 017 reportes de efectos adversos detectados en toda la población por el sistema de FV de Cuba. La tasa de notificación de RAM de 1 537,6 /105 embarazadas estimada en el presente estudio, es menor que la reportada en toda la población.31 Ello hace considerar que exista mayor infranotificacion de RAM en las gestantes que en la población general, a pesar que estas pacientes son más vulnerables de padecerlas, debido a los cambios farmacocinéticos y farmacodinámicos, que alteran los efectos farmacológicos de los medicamentos en las embarazadas.15,16 Se deben implementar intervenciones para estimular el reporte de RAM en las embarazadas cubanas.
No obstante, los resultados muestran mejorias en la deteccion de RAM en embarazadas, al compararlas con otras poblaciones de riesgo en FV, ya que la tasa de notificacion encontrada fue superior a la que establece otro estudio en ancianos cubanos en igual periodo de estudio.32 Dato relevante para trazar las estrategias de intervencion.
Los resultados sobre la edad de las embarazadas coinciden de forma parcial con los datos de un estudio cubano24 y de otro en Canadá en el 2009.33 Ambos muestran que el grupo de 20 a 30 años es el de mayor frecuencia de RAM.
El predominio de las gestantes mayores de 40 años puede ser consecuencia que la edad del primer embarazo se incrementa, con una mayor frecuencia por encima de los 30 años, con enfermedades previas que requieren tratamiento y más probabilidad de RAM.15 Una situación similar acontece en Cuba.34 La edad de 20 a29 años, es considerada como la óptima para el embarazo por el desarrollo biológico y psicológico de la mujer35 y la intensa labor educacional realizada en la población cubana por el Programa Materno Infantil.
Los medicamentos pueden dañar al feto en cualquier momento del embarazo, pero el período de mayor riesgo es el primer trimestre, 15 análisis que no se pudo efectuar porque el dato de la edad gestacional estuvo ausente en más de la mitad de los reportes. La boleta oficial de notificación de RAM de Cuba, no cuenta con un acápite específico para esta información, por lo que el Sistema de FV debe valorar incluirlo en el modelo para su recogida sistemática.
Los licenciados en farmacia y los médicos enviaron más del 70,0 % de las notificaciones de RAM en embarazadas al sistema de FV. Estudiosinternacionales36,37 y cubanos en gestantes 24,25 muestran que los galenos son los más notificadores de RAM. Los licenciados en farmacia reportaron más que los médicos, lo que pudo estar relacionado con sus responsabilidades durante la farmacovigilancia activa de los fármacos que se emplearon en la epidemia por virus de la influenza A H1N1 en 2010,38 cuya administración predominó en gestantes hospitalizadas.
Por primera vez, se identificó que el nivel secundario de salud es el principal emisor de reportes de RAM en las embarazadas. Ello se explica porque las embarazadas son remitidas al segundo nivel de atención ante cualquier complicación y hace suponer que los profesionales que prestan asistencia médica en ese nivel de salud, profundicen en el diagnóstico diferencial, al colocar al medicamento como fuente de enfermedad y a la FV activa durante la epidemia de H1N 1.38 El resultado sorprende y abre interrogantes al no seguir la dinámica de los datos que refieren los informes anuales de la Ucnfv,31,39 que identifican la atención primaria de salud, como el nivel de atención con mayor aporte de notificaciones de RAM.
Los vómitos, cefalea, constipación, náusea y erupción cutánea representan casi la mitad de los tipos de RAM en embarazadas detectados en el estudio. Estos efectos adversos, en particular los de la piel y el sistema digestivo, se asocian más a daños producidos por medicamentos.8 Los resultados divergen de forma parcial con otro estudio cubano, con ventana de observación es 2003 a 2007, que detecta la diarrea como RAM más frecuente. Las diferencias pueden deberse al período de observación más amplio en la presente investigación y la introducción de nuevos fármacos para la epidemia de gripe por H1N1 de forma masiva, oseltamivir provocó dos tercios de los vómitos, con FV activa, que influyeron en el patrón de las RAM de las gestantes.
Los cinco sistemas de órganos más afectados agruparon más de las tres cuartas partes de las RAM que afectaron a las embarazadas. Similar hallazgo muestra una investigación cubana,24 excepto para el sistema general, organismo como un todo. No se localizaron investigaciones internacionales que analicen dicha variable. Los SOA en embarazadas se corresponden con los sistemas que frecuentemente se comprometen por las RAM que afectan a toda la población y son reportadas a la Ucnfv de Cuba,31,38 ello explica parte del resultado obtenido.
Los grupos farmacológicos identificados que más se asociaron con RAM sonparecidos a los que encuentra una investigación internacional 40 y otra nacional,24 pero no coinciden en las vacunas y los antivirales, debido a lo antes explicado para la epidemia de gripe por virus influenza AH1N1, lo que modificó el patrón de grupos farmacológicos en las gestantes. Ello indica la importancia de combinar procedimientos activos y pasivos en FV y alerta como los eventos epidemiológicos pueden influir en los patrones de seguridad poscomercialización de los fármacos.
Los medicamentos con categoría de riesgo C y B fueron los que predominaron. Similares resultados encuentran investigaciones en Estados Unidos41 y en Francia,42 pero difieren con un estudio en Etiopía que muestra mayor frecuencia de exposición a fármacos de categoría A.43 La cuarta parte de los medicamentos asociados a RAM no tienen clasificación de riesgo en el FNM. Coinciden con estos resultados una investigación cubana precedente.24 Situación preocupante, porque para hacer una prescripción racional en embarazadas, se necesita la información de seguridad embrionaria de los medicamentos.
No obstante, las clasificaciones de riego teratogénico más utilizadas, como la de la Agencia Reguladora de Medicamentos y Alimentos de Estados Unidos utilizada por el FNM de Cuba, presentan limitaciones pues la clasificación se sustenta casi exclusivamente de los datos procedentes de animales y no toman encuentra la gravedad, la diversidad de los efectos adversos, la dosis, la vía de administración, la indicación, ni la edad gestacional. Hoy se desarrolla una nueva clasificación con estos elementos que conllevará reclasificar el riesgo embriogénico de los fármacos.18
Diez medicamentos fueron los que produjeron más de dos tercios de las RAM en embarazadas en 11 años de FV. Estos fármacos se utilizan de forma habitual en motivos de consultas frecuentes, excepto el antiviral y la vacuna, como anemia, ruptura prematura de membrana, inmadurez pulmonar fetal e hipertensión arterial, entre otras.22,28 Los efectos indeseables más reportados por estos fármacos, se describen como frecuentes u ocasionales.22
Los resultados coinciden de forma parcial con un trabajo de Pakistán 39 y otro de Cuba24 en que son los suplementos de vitaminas y minerales, los más reportados productores de RAM en gestantes. Lo encontrado para el Prenatal® está en correspondencia con su uso generalizado para prevenir la anemia según Programa Materno Infantil de Cuba.44 El oseltamivir y la vacuna Pandermix® se utilizaron de forma masiva en el tratamiento y prevención de la gripe por el virus influenza AH1N 1 en grupos vulnerables como las embarazadas, con FV intensiva de sus RAM,38 lo que puede explicar el resultado.
Se apreció un cambio del patrón de fármacos más asociados a RAM en embarazadas, pues el Prenatal® es el más reportado en el quinquenio 2003 a 200724y fue desplazado por el oseltamivir que encabeza la lista de medicamentos reportados que producen RAM en 11 años de estudios. El cambio de patrón debe ser divulgado al sistema sanitario y a los profesionales para mejorar el uso de los productos farmacéuticos.
Los resultados encontrados en cuanto a severidad, imputabilidad y frecuencias de aparición de las RAM coinciden con un estudio en gestantes cubanas cuya ventana de observación fue de 5 años a partir de 200324 y con los informes del Sistema Cubano de FV en toda la población;31,38 lo cual puede explicar los hallazgos detectados. No se localizaron trabajos internacionales que aborden estas variables en dichas pacientes. Por ende, la información aportada constituye una referencia para futuras investigaciones.
Las RAM graves y mortales son consideradas serias, mientras que las ocasionales, raras y no descritas se catalogan como baja frecuencia de aparición.21 Ambos tipos representaron una baja proporción en la población estudiada. La FV debe captar las RAM serias y de baja frecuencia, que son las que no aparecen en los ensayos clínicos precomercialización. Sería pertinente incrementar su detección para mejorar el perfil de seguridad de los medicamentos en poblaciones vulnerables como las embarazadas, mediante intervenciones educativas y de gestión, así como por FV activa.
La presencia mayoritaria de las RAM probables denota una alta posibilidad de asociación entre el fármaco y la reacción adversa según el algoritmo de Karch y Lasagna,21 ya que solo falta la reexposición al fármaco para catalogarlos como definitivos y a su vez denota la calidad de los reportes de RAM.
Los avisos de señales contenían más de una veintena de RAM no descritas, que indicaban que se disponía de información para estudiar potenciales señales, lo que reafirma la necesidad de utilizar más las bases de datos de FV en investigaciones que apliquen la minería de datos y obtener resultados útiles para los sistemas sanitarios. Por su parte, en el proceso para determinar las alertas de señal se identificaron 6 pares fármacos-RAM, que se describen en la literatura internacional y no en el FNM de Cuba. Esto puede provocar prescripción irracional e intensificar la infranotificación por desconocer la RAM.11
La identificación de una sospecha de señal demostró que el procedimiento aplicado es válido para discriminar en las características de las RAM notificadas y confirma la utilidad del RRP en las condiciones de trabajo del Sistema Cubano de FV, cuyo rendimiento se demuestra en investigaciones poscomercialización.45,46
Resultados parecidos encuentra un trabajo en el Reino Unido, que determina como alertas de señal el 40 % de los pares medicamento-reacción adversa en toda la población47 y con un estudio cubano en niños que identifica 17 sospechas de señales, el 56,0 % de los avisos.48 La no coincidencia de resultados puede deberse a la cantidad de registros analizados, mayor en los estudios de referencia, a los estratos de población estudiados y a las técnicas cuantitativas empleadas.
La evaluación cualitativa de la Comisión Nacional de FV determinó que el par oseltamivir-somnolencia era una señal de una nueva RAM detectada en embarazadas. La proporción de señales detectadas en las alertas difiere de lo que encuentra una investigación internacional49 y otra nacional. 47 Las diferencias pueden ser consecuencia de las poblaciones incluidas. El estudio norteamericano incluye a las RAM de toda la población y el cubano se asienta en niños.
La señal detectada se manifestó por un efecto adverso que se reporta habitualmente31,38 e involucró un medicamento que estaba en vigilancia intensiva por la Ucnfv.22 Esto reafirma la idea que muchas RAM aparecen después de la comercialización de un fármaco,7 incluso de aquellos que tienen una larga estadía en el mercado.50 Se deben realizar investigaciones adicionales para su fortalecimiento.51,52
La detección de señales muestra la capacidad del Sistema Cubano de FV para detectar RAM no descritas y realizar su búsqueda sistemática por técnicas cuantitativas. La investigación cubre el vacío en el conocimiento de las asociaciones fármacos-RAM no descritas en poblaciones especiales.
Las RAM en embarazadas reportadas durante más de una década al Sistema Cubano de FV muestran características diferentes a lo reportado a nivel internacional y nacional, en cuanto a grupo de edad, tipo de RAM, grupo farmacológico, notificador y nivel de atención. Esta situación pudo deberse a la farmacovigilancia activa realizada a los fármacos utilizados en la prevención y tratamiento de la epidemia de influenza AH1N1.
Se generó la señal de una nueva reacción adversa por un antiviral que estaba en vigilancia intensiva en embarazadas, no detectada por el Sistema Cubano de FV, lo que demuestra la necesidad de aplicar criterios cuantitativos para la búsqueda proactiva y sistemática de señales en la base de datos de farmacovigilancia de Cuba, sobre todo en poblaciones vulnerables.
Se identificaron reacciones adversas descritas en la literatura internacional, que no aparecen en el Formulario Nacional de Medicamentos de Cuba. Se recomienda realizar futuras investigaciones que aborden la prevención y los factores de riesgos asociados con la producción de RAM en embarazadas y comunicar la señal identificada al sistema de salud de Cuba y al Centro de Control Estatal de la Calidad de Medicamentos y Equipos Médicos.
REFERENCIAS BIBLIOGRÁFICAS
1. Organización Mundial de la Salud. La Farmacovigilancia: garantía de seguridad en el uso de los medicamentos. Perspectivas políticas de la OMS sobre medicamentos[internet]. 2004[citado 12 Ago 2017];9:1-5. Disponible en: http://apps.who.int/medicinedocs/pdf/s6166s/s6166s.pdf
2. Bouvy JC, De Brouin ML, Koopmanschap MA. Epidemiology of drug reactions in Europ: A Review of Recente Obsevational Studies. Drug Safety. 2015[citado 12 ago 2017];38:457-53. Disponible en: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4412588/
3. Gandhi TK, Weingart SN, Borus J, Seger AC, Peterson J, Burdick E, et al. Adverse drug events in ambulatory care. N Engl J Med. 2003[citado 12 jul 2017]; 348:1556-64. Disponible en: https://www.nejm.org/doi/10.1056/NEJMsa020703?url_ver=Z39.88-2003&rfr_id=ori:rid:crossref.org&rfr_dat=cr_pub%3dwww.ncbi.nlm.nih.gov
4. Laporte JR. Fifty years of pharmacovigilance- Medicines safety and public health. Drug Saf. 2016[citado 15jun2017]; 25:725-32. Disponible en: https://onlinelibrary.wiley.com/doi/full/10.1002/pds.3967
5. Vallano Ferraz A, Agustí Escasany A, Pedrós Xolvi C, Arnau de Bolós JM. Revisión sistemática de los estudios de evaluación del coste de las reacciones adversas a medicamentos. Gac Sanit. 2012[citado 14 jun 2017];26(3):277-83. Disponible en: http://scielo.isciii.es/pdf/gs/v26n3/revision.pdf
6. Laporte JR. Principios básicos de investigación clínica. Barcelona: Astra Zeneca; 2001.
7. Hoffman KB, Dimbil M, Erdman CB, Tatonetti NP, Overstreet BM. The Weber Effect and the United States Food and Drug Administration's Adverse Event Reporting System (FAERS): Analysis of Sixty-Two Drugs Approved from 2006 to 2010.Drug Saf. 2014[citado 22jul 2017];37:283-94. Disponible en: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3975089/
8. Herrera R, Alesso L. La Farmacovigilancia en el proceso de seguridad de los medicamentos. En: Bignone I, Schiaffino S. Farmacovigilancia, hacia una mayor seguridad en el uso de los medicamentos[internet]. Buenos Aires: Raquel Herrera Ediciones; 2015[citado 10 jul 2017]. p. 3-12. Disponible en: http://apps.who.int/medicinedocs/documents/s22289es/s22289es.pdf
9. Alfonso I, Jiménez G. Métodos de Farmacovigilancia. En: Furones JA, Lara C, Barbado DM, Jiménez G, Pérez J, Cruz MA (ed). Farmacoepidemiología. Uso racional de medicamentos. La Habana: Editorial Academia; 2010. p. 98-119.
10. Organización Panamericana de la Salud. Buenas Prácticas de Farmacovigilancia. Red PARF, Documento Técnico No. 5[internet]. Washington D.C: OPS; 2011[citado 12 ago 2017]. Disponible en: https://www.paho.org/hq/index.php?option=com_docman&view=download&category_slug=documentos-8499&alias=33513-buenas-pra-cticas-farmacovigilancia-ame-ricas-2010-513&Itemid=270&lang=es
11. Jiménez G, Alfonso I. Gestión del riesgo en Farmacovigilancia. En: Furones JA, Lara C, Barbado DM, Jiménez G, Pérez J, Cruz MA (ed). Farmacoepidemiología. Uso racional de medicamentos. La Habana: Editorial Academia; 2010. p. 120-142.
12. Uppsala Monitoring Centre. Signal. WHO Pharmaceuticals Newsletter. 2012 [citado 12 ago 2017];1:[aprox. 9 p.]. Disponible en: http://www.who.int/medicines/publications/PharmNewsletter1_12/en/
13. A. Bate MA, S.J.W.Evans BA. Quantitative signal detection using spontaneous ADR reporting. Pharmacoepidemiology and Drug Safety. 2009[citado 26 sep 2018];18:427-36: Disponible en: https://onlinelibrary.wiley.com/doi/pdf/10.1002/pds.1742
14. Artama M, Gissler M, Malm, Ritvanen A. Nationwide register‐based surveillance system on drugs and pregnancy in Finland 1996–2006. Pharmacoepidemiol Drug Saf. 2011[citado 26 sep 2017];20:729–38.Disponible en: https://onlinelibrary.wiley.com/doi/full/10.1002/pds.2159
15. Sánchez MB, Armijo JA. Influencia de los factores genéticos y ambientales, la edad y el embarazo sobre la respuesta a los fármacos. En: Flores J, Armijo JA, Mediavilla A. Farmacología Humana. 6ta edición. Barcelona: Masson-SA; 2014. p. 121-55.
16. Moretti M. Collection and Analysis of Drug Safety Data In Pregnancy. Can J ClinPharmacol. 2007[citado 16 jul 2017];14(1):[aprox. 10 p.]. Disponible en: http://www.jptcp.com/pubmed.php?articleId=104
17. Bakker MK, Jentink J, Vroom F, Van Den Berg PB, De Walle HEK, De Jong‐Van Den Berg LTW Maternal medicine: Drug prescription patterns before, during and after pregnancy for chronic, occasional and pregnancy‐related drugs in the Netherlands. BJOB. 2006[citado 26 sep 2018];113(5):559-68. Disponible en: https://obgyn.onlinelibrary.wiley.com/doi/abs/10.1111/j.1471-0528.2006.00927.x
18. Papale RM. Embarazo y medicamentos. En: Bignone I, Schiaffino S. Farmacovigilancia, hacia una mayor seguridad en el uso de los medicamentos[internet]. Buenos Aires: Raquel Herrera Ediciones; 2015[citado 10 jul 2017]. p. 227-240. Disponible en: http://apps.who.int/medicinedocs/documents/s22289es/s22289es.pdf
19. Colvin L, Slack-Smith L, Stanley FJ, Bower C. Pharmacovigilance in pregnancy using population-based linked datasets. Pharmacoepidemiol Drug Saf. 2009[citado 26 jun17];18(3):211-25. Disponible en: https://onlinelibrary.wiley.com/doi/pdf/10.1002/pds.1705
20. Dias Oliveira-Filho A, Soares Vieira AE, Cruz da Silvab R, Felizardo Neves AJ, Barros Gama TA, VieiraLima R, et al. Adverse drug reactions in high-risk pregnant women: A prospective study. Saudi Pharmaceutical Journal. 2017[citado 26 sep18];25(7):1073-7. Disponible en: https://www.sciencedirect.com/science/article/pii/S1319016417300191
21. Alonso Orta I, Jiménez López G. Normas y procedimientos de trabajo delSistema Cubano de Farmacovigilancia. La Habana: Minsap, Dirección deMedicamentos, Departamento de Farmacoepidemiología; 2015.
22. Calvo Barbado DM, Delgado Martínez I, Alfonso Orta I, Alonso Carbonel L, Alonso Galván P, Cruz Barrios MA y cols. Formulario Nacional de Medicamentos. La Habana: ECIMED; 2014.
23. Aagaard L, Strandell J, Melskens L, Petersen PGS, Hansen EH. Global Patterns of Adverse Drug Reactions Over a Decade Analyses of Spontaneous Reports to VigiBase. Drug Saf. 2012[citado 12 may 2017];35 (12):1171-82. Disponible en: https://www.researchgate.net/profile/Lise_Aagaard/publication/232277028_Global_Patterns_of_Adverse_Drug_Reactions_Over_a_Decade_Analyses_of_Spontaneous_Reports_to_VigiBase/links/57f249f608ae886b897b89c3.pdf
24. Furones-Mourelle JA, López Verde L, Jiménez López G, Ávila Pérez J. Reacciones adversas por medicamentos en embarazadas, reportadas al sistema de farmacovigilancia de Cuba en los años 2003 - 2007. Electron J Biomed. 2011[citado 12 sep 2016];2:[aprox. 9 p]. Disponible en: http://biomed.uninet.edu/2011/n2/furones.html
25. Furones-Mourelle JA, Druyet-Castillo D, López-Aguilera AF, Cruz-Barrios MA, Jiméne-López G. Reacciones adversas no descritas en embarazadas de Cuba. Rev Cub Farmacia. 2015[citado 20jul 2017];49(2):291-303. Disponible en: http://scielo.sld.cu/pdf/far/v49n2/far09215.pdf
26. WHO. International Monitoring of Adverse Reactions to drugs. Adverse reaction terminology. The Uppsala Monitoring Centre. Uppsala, Sweden: WHO; 2012.
27. WHO Collaborating Centre for Drug Statistics Methodology. Guidelines for ATC classification and DDD assignment [Internet]. 2013. [citado 12 Jun 2017]. Disponible en: http://www.whocc.no/atc_ddd_index/
28. Sweetman SC (editor).Martindale The Complete Drug Reference. 38th edition. London-Chicago: Pharmaceutical Press; 2011.
29. Aronson JK (editor). Meyler´s Side effects of drugs. The International Encyclopedia of Adverse Drug Reactions and Interactions. 15th edition. Amsterdam: Elsevier; 2006.
30. Cuba. Ministerio Salud Pública. Metodología para la generación de señales. PNO: 003[internet]. La Habana: MINSAP; 2007[citado 10 agos 2017]. Disponible en: http://files.sld.cu/cdfc/files/2010/02/pno-generacio.pdf
31. Cuba. Ministerio de Salud Pública. Departamento Nacional de Farmacoepidemiología. Unidad Coordinadora Nacional de Farmacovigilancia. Informe Anual 2014 [internet]. 2014 [citado 10 agos 2017]. Disponible en: http://files.sld.cu/cdfc/files/2015/01/farmacovigilancia-cuba-ano-2014.pdf
32. Furones-Mourelle JA, Cruz-Barrios MA, López-Aguilera AF, Pérez-Piñero J. Reacciones adversas por medicamentos en ancianos cubanos 2003- 2013. Rev Cubana Salud Pública. 2016[citado 20 jul17];42(4):1-17. Disponible en: http://www.revsaludpublica.sld.cu/index.php/spu/article/view/868
33. Yang T, Walker MC, Krewski D, Yang Q, Nimrod C, Garner P, et al. Maternal characteristics associated with pregnancy exposure to FDA category C, D, and X drugs in a Canadian population. Pharmacoepidemiol Drug Saf. 2008[citado 10 jul 2017];17(3):270-7. Disponible en: https://onlinelibrary.wiley.com/doi/pdf/10.1002/pds.1538
34. García Alonso I, Alemán Mederos MM. Riesgos del embarazo en la edad avanzada. Rev Cubana Obstet Ginecol. 2013 Jun[citado 10 jul 2017];39(2):[aprox. 8 p.]. Disponible en: http://scieloprueba.sld.cu/scielo.php?script=sci_arttext&pid=S0138-600X2013000200007&lng=es
35. Yogev Y, Melamed N, Bardin R, Tenenbaum-Gavish K, Ben-Shitrit G, Ben-Haroush A. Pregnancy outcome at extremely advanced maternal age. Am J Obstet Gynecol. 2010[citado 10 jul 2017];203(6):558.e1-e7.Disponible en: https://www.sciencedirect.com/science/article/pii/S0002937810009233?via%3Dihub
36. Ramírez RC, Faúndez LE, Orellana BR. Reporte de reacciones adversas a medicamentos con compromiso mucocutáneo en Hospital Clínico Universidad de Chile durante los años 2004-2010. Rev Hosp Clin Univ Chile. 2011[citado 14 julio 2017];22:104 -12. Disponible en: https://www.redclinica.cl/Portals/0/Users/014/14/14/Publicaciones/Revista/reacciones_adversas_medicamentos.pdf
37. Holguín E, Orozco J. Medicación potencialmente inapropiada en ancianos en un hospital de cuarto nivel en Bogotá. Revista Universitas Médica. 2011[citado 14 julio 2017];52(2):[aprox. 21 p.]. Disponible en: http://www.redalyc.org/articulo.oa?id=231022511003
38. Cuba. Ministerio de Salud Pública. Centro para el Desarrollo de la Farmacoepidemiología. Unidad Coordinadora Nacional de Farmacovigilancia. Informe anual 2010 [Internet]. 2011[citado 1 jun 2017]. Disponible en: http://files.sld.cu/cdfc/files/2011/03/fvinforme-anual-2010.pdf
39. Cuba. Ministerio de Salud Pública. Departamento Nacional de Farmacoepidemiología. Unidad Coordinadora Nacional de Farmacovigilancia. Informe anual 2012 [Internet]. 2013[citado 1 jun 2017]. Disponible en: http://files.sld.cu/cdfc/files/2013/02/balance-anual2012fv.pdf
40. Rohra DK, Das N, Azam SI, Solangi NA, Memon Z, Shaikh AM, Khan NH. Drug-prescribing patterns during pregnancy in the tertiary care hospitals of Pakistan: a cross sectional study BMC Pregnancy Child birth. 2008[citado 24 jun 2017];15(8):[aprox. 8 p.]. Disponible en: http://www.ncbi.nlm.nih.gov/pmc/articles/PMC2491594/
41. Thorpe PG, Gilboa SM, Hernandez-Diaz S, Lind J, Cragan JD, Briggs G et al. Medications in the first trimester of pregnancy: most common exposures and critical gaps in understanding fetal risk.Pharmacoepidemiol Drug Saf. 2013[citado 21 Jun 2017];22:1013-8. Disponible en: https://onlinelibrary.wiley.com/doi/full/10.1002/pds.3495
42. Demailly R, Escolano S, Quantin C, Tubert Bitter P, Ahmed I. Prescription drug use during pregnancy in France: a study from the national health insurance permanent sample. Pharmacoepidemiol Drug Saf. 2017[citado 27 sep 2018];26:1126. Disponible en: https://onlinelibrary.wiley.com/doi/pdf/10.1002/pds.4265
43. Binyam K, Teferi G and Ashebir G. Assessment of drug use among pregnant women in Addis Ababa, Ethiopia. Pharmacoepidemiol Drug Saf. 2009 [citado 21 Jun 2017]; 18: [aprox. 7 p.]. Disponible en: http://onlinelibrary.wiley.com/doi/10.1002/pds.1732/epdf
44. Cuba. Ministerio de Salud Pública. Manual de procedimientos, diagnósticos y tratamiento en Obstetricia y perinatología. La Habana: ECIMED; 1991.
45. Almenoff J, Tonning JM, Lawrence Gould A, Szarfman A, Hauben M, Ouellet-Hellstrom R, et al. Perspectives on the Use of Data Mining in Pharmacovigilance Drug Safety. 2005[citado 21 Jun 2017];28(11):981-1007. Disponible en:https://www.researchgate.net/profile/A_Lawrence_Gould/publication/7534434_Perspectives_on_the_Use_of_Data_Mining_in_Pharmacovigilance/links/541849060cf203f155ada51a.pdf
46. Harpaz R, DuMouchel W, LePendu P, Bauer-Mehren A, Ryan P, Shah NH. Performance of PharmacovigilanceSignal-Detection Algorithms for the FDA Adverse Event Reporting System. Clinical Pharmacology & Therapeutics. 2013[citado 21 Jun 2017];93(6):539-46. Disponible en: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3857139/pdf/nihms525848.pdf
47. Evans SJW, Waller PC, Davis S. Use of proportional reporting ratios for signal generation from spontaneous adverse drug reaction reports. Pharmacoepidemiol Drug Saf. 2001[citado 21 Jun 2017];10:483-6. Disponible en: https://onlinelibrary.wiley.com/doi/pdf/10.1002/pds.677
48. Furones-Mourelle JA, Barbón-Pérez N, Cruz-Barrios MA, López-Aguilera AF, Jiménez-López G, Broche-Villarreal L. Señales de nuevas reacciones adversas medicamentosas en niños. Revista Cubana de Salud Pública. 2015[citado 16 jul 2017];41(2):217-26. Disponible en: http://www.revsaludpublica.sld.cu/index.php/spu/article/view/369
49. Cheng CM, Shin J, Guglielmo B. Trends in Boxed Warnings and Withdrawals for Novel therapeutic Drugs, 1996 Through 2012. JAMA InternMed. 2014[citado 16 Jul 2017];174(10):1704-5. Disponible en: https://jamanetwork.com/journals/jamainternalmedicine/fullarticle/1897290
50. Seguridad de los medicamentos: señales y alertas generadas en 2013-2014.INFAC. 2015[citado 16 Jul 2017];23(3):[aprox. 9 p.]. Disponible en: http://www.osakidetza.euskadi.eus/contenidos/informacion/cevime_infac/es_cevime/adjuntos/INFAC_Vol_23_n_3_se%C3%B1ales_alertas_2013_2014.pdf
51. Lin KJ, Mitchell AA, Wai-Ping Y, Louik C, Hernández-Díaz S. Safety of macrolides during pregnancy. Am J Obstet Gynecol. 2013 [citado 16 Jul 2017];208(3):221.e1-221.e8. Disponible en: https://www.sciencedirect.com/science/article/pii/S0002937812022521
52. Nezvalová-Henriksen K, Spigsetb O, Nordeng H. Effects of ibuprofen, diclofenac, naproxen, and piroxicam on the course of pregnancy and pregnancy outcome: a prospective cohort study. BJOG. 2013[citado 16 Jul 2017];120(8):948-59.Disponible en: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3683088/pdf/nihms443483.pdf
Recibido: 24 enero de 2018.
Aprobado: 25 febrero 2018.
Juan Antonio Furones-Mourelle. Escuela Nacional de Salud Pública. La Habana. Cuba.
Correo electrónico: furones@infomed.sld.cu