Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Obstetricia y Ginecología
versión On-line ISSN 1561-3062
Rev Cubana Obstet Ginecol vol.44 no.3 Ciudad de la Habana jul.-set. 2018
GINECOLOGÍA Y RIESGO REPRODUCTIVO
Tasa de gestación y niveles de βHCG en transferencia de embriones congelados y frescos
Gestation Rate and βhcg Levels in Frozen and Fresh Embryos Transfer
Rosa Cristina Ramos Galindo,1 Rubí Nieves Rodríguez,1 Raquel Blanes Zamora,1 Stephany Hess Medler2
1 Departamento de Obstetricia y Ginecología, Pediatría, Medicina Preventiva y Salud Pública, Toxicología, Medicina Legal y Forense y Parasitología. Facultad de Ciencias de la Salud. Universidad de La Laguna. Complejo Hospitalario Universitario de Canarias. Unidad de Reproducción Humana. Tenerife, España.
2 Departamento de Psicología Clínica, Psicología y Metodología de las de las Ciencias del Comportamiento. Facultad de Psicología. Universidad de La Laguna.
RESUMEN
Introducción: En los ciclos de estimulación de la ovulación, el endometrio es sometido a unos niveles hormonales supra fisiológicos que conducirían a alteraciones morfológicas y bioquímicas y un ambiente endometrial responsable de un fallo de implantación y tasas de éxito más bajas, además de una asincronía respecto a los embriones a transferir, lo que no sucede en la transferencia de los embriones congelados (TEC), en que se transfieren en un entorno que no ha sufrido los efectos deletéreos hormonales de los ciclos FIV/ICSI.
Objetivo: Analizar la efectividad de la vitrificación de todos los embriones o lo que se conoce como "freeze all" y su transferencia en un segundo tiempo.
Métodos: Comparamos los parámetros epidemiológicos y el tratamiento de reproducción asistida, las tasas de implantación, gestación y niveles de βHCG en 168 pacientes de ciclos de TEC y 200 pacientes de ciclos TE realizadas desde enero de 2015 a noviembre de 2016. El análisis estadístico se realizó con la prueba t de Student, Chi cuadrado, y ANOVA. (Paquete estadístico SPSS, versión 20.0).
Resultados: Existieron diferencias significativas en el valor sérico de βHCG que fue mayor para TEC. La tasa de embarazo positivo fue mayor para TEC, con mayor probabilidad de βHCG positivo en el grupo TE. La tasa de gestación clínica evolutiva no presentó diferencias significativas.
Conclusiones: A pesar de que hallamos una diferencia significativa en valores de βHCG en TEC, la tasa de gestación clínica y los resultados obstétricos no resultaron ser diferentes.
Palabras clave: transferencia embriones congelados; transferencia embriones en fresco, βHCG.
ABSTRACT
Introduction: In the cycles of ovulation stimulation, the endometrium is subjected to supra-physiological hormone levels that would lead to morphological and biochemical alterations and to an endometrial environment responsible for implantation failure and lower success rates, in addition to an asynchrony with respect to the embryos to transfer. However, this does not happen in frozen embryos transfer (Frozen ET), in which embryos are transferred in an environment that has not suffered deleterious hormonal effects of IVF / ICSI cycles.
Objective: To evaluate if the results are superior in frozen ET cycles and if fresh embryos transfer (TE) can replace the transfer of frozen embryos, and to establish the effectiveness of vitrifying all embryos or "freeze all", as it is known, and transfer them in a second time.
Methods: We compared the epidemiological parameters and the treatment of assisted reproduction, implantation rates, gestation and βHCG levels in 168 patients of cycles of frozen ET and 200 patients of ET cycles, carried out from January 2015 to November 2016. The statistical analysis was performed with the Student's t-test, Chi-square, and ANOVA. (Statistical package SPSS, version 20.0).
Results: There were significant differences in β-HCG serum value that was higher for frozen ET. The positive pregnancy rate was higher for frozen ET, with higher probability of βHCG positive in relation to the TE group. The evolutionary clinical gestation rate did not present significant differences.
Conclusions: Although we found a significant difference in βHCG values in frozen ET, the clinical pregnancy rate and obstetric results did not turn out to be different.
Keywords: frozen embryos transfer; fresh transfer embryos, βhcg.
INTRODUCCIÓN
El primer embarazo tras una congelación embrionaria, con el método lento, se produjo en 1983 en Australia1, y el primer recién nacido vivo en 1984, en Holanda2
Con posterioridad se desarrolló un nuevo procedimiento de congelación, la vitrificación, que es una técnica ultrarrápida de criopreservación, en la que los compartimentos intra y extracelular del embrión se vitrifican tras la deshidratación, pasando de manera casi inmediata de temperatura ambiente a 196º C,3 lo que requiere la utilización de unas concentraciones elevadas de crioprotectores.4
La vitrificación embrionaria (VE) es decisiva en los casos de cancelación de transferencia embrionaria, bien sea por riesgo del síndrome hiperestimulación ovárica (SHO) en ciclos antagonistas,5 por elevación de los niveles de progesterona sérica en el día de la punción, por sangrado endometrial, 6 o por mal desarrollo endometrial en general.
Ha sido el primer método de elección para la preservación de la fertilidad en pacientes oncológicas y de edad avanzada.7 Permite reducir el número de embriones a transferir en fresco, 6 y llevar a cabo, en un segundo tiempo, la transferencia de los embriones sobrantes, lo que posibilita realizar más de un intento de transferencia embrionaria por ciclo FIV que favorece un aumento de la tasa acumulada de gestación.8-9
En los ciclos FIV/ICSI con TE se efectúa una hiperestimulación ovárica controlada con niveles elevados de estradiol y, en ocasiones, incluso una elevación prematura de progesterona,10 elevación de citocinas,11 además de una alteración de la expresión génica del endometrio,12 que afectan negativamente la receptividad endometrial13-14 lo cual conduce a alteraciones morfológicas y bioquímicas, con un endometrio más avanzado, que podría causar una asincronía con los embriones transferidos, y que sería responsable de fallo de implantación y afectar las tasas de éxito.15
En los ciclos de TEC, los embriones se transfieren a un entorno que no ha sufrido los efectos deletéreos hormonales supra fisiológicos de los ciclos FIV/ICSI.16 Henningsen17 señala que el TEC puede tener un mejor pronóstico, en cuanto a tasas de gestación, y que los resultados de FIV/ICSI se pueden mejorar mediante su uso. Por otro lado, en el TEC solo se vitrifican embriones de buena calidad, para garantizar su supervivencia tras la descongelación, lo que resultará en un mejor desarrollo fetal7-18
Roque16 demuestra que las pacientes con TE tenían una tasa de implantación e índices de recién nacidos vivos estadísticamente inferior frente a aquellos con TEC, y sugieren que la transferencia del mejor embrión en un endometrio preparado médicamente es más recomendable, en lo que sería la TEC personalizada.19-20 Incluso, hay autores que señalan que el vitrificar todos los embriones "freeze all", y transferirlos en un ciclo TEC es coste-efectivo.21 En los resultados perinatales, diversos autores han encontrado que en TE hay una mayor frecuencia de partos prematuros, recién nacidos con bajo peso al nacer y menor peso para la edad gestacional, relacionando éstos resultados perinatales con los efectos de los cambios epigenéticos secundarios a la hiperestimulación ovárica.22 Otros autores encuentran mejores resultados perinatales en las gestaciones únicas tras TEC.7
Para analizar si hay diferencias significativas entre ambas, y si son superiores los resultados en los ciclos TEC, hemos comparado las tasas de implantación, gestación y niveles de βHCG entre ciclos TE y TEC, parámetros epidemiológicos y el tratamiento de reproducción asistida, y así analizar si la transferencia de embriones en fresco puede ser sustituida por la transferencia de embriones congelados, y establecer la efectividad de vitrificar todos los embriones o "freeze all" y transferirlos en ciclos posteriores.
MÉTODOS
Se realizó un estudio retrospectivo de cohorte observacional comparativo en 368 pacientes, 168 de ellas con βHCG positiva, que habían sido sometidas a un TEC tras un ciclo de FIV/ICSI, de un total de 544 pacientes (30,88 %) y 200 pacientes con βHCG positiva sometidas a TE en ciclos FIV/ICSI, de un total de 943 pacientes (21,20 %), en la Unidad de Reproducción Humana del Complejo Hospitalario Universitario de Canarias (CHUC) desde enero de 2015 hasta noviembre de 2016.
La tasa de implantación se define como la relación del número de sacos gestacionales visualizados respecto al número de embriones transferidos.
Consideramos embarazo bioquímico, cuando se detectó niveles séricos de βHCG ≥ 50 mUI/ml sin visualizarse vesícula vitelina, y como embarazo clínico la visualización ecográfica vaginal de uno o más sacos gestacionales intraútero. También comparamos el valor de la βHCG en ambos grupos.
Establecimos cuatro categorías para la edad de la paciente en el momento de inicio del TRA:23
Se valoraron los antecedentes, hábitos tóxicos, la etiología de esterilidad y los resultados obstétricos.
Protocolo de estimulación TE
Los protocolos de estimulación de la ovulación utilizados fueron el agonista largo y el antagonista usando FSH recombinante y en algunos ciclos combinando con HMG.
Protocolo de estimulación TEC
La transferencia de TEC se lleva a cabo bien en un ciclo natural, o en un ciclo sustitutivo con parches de estradiol, con la administración, en ambos casos, de progesterona micronizada por vía vaginal, 200 mg cada 12 horas, unos 2-5 días antes de la transferencia. Tras ella, se mantiene la dosis de estrógeno y se incrementa la de progesterona a 200 mg. cada 8 horas, hasta el día de control de la βHCG.
Clasificación de calidad embrionaria
La calidad embrionaria se estableció según los criterios ASEBIR para los ciclos TE.24 La calidad de los embriones de TEC se basó en el porcentaje de supervivencia embrionaria > 50 %.25-26-27
Para poder establecer una comparación entre la calidad embrionaria de ambos grupos, al no existir ninguna previamente publicada, diseñamos la siguiente equivalencia:
Análisis estadístico
El análisis estadístico se hizo con el programa IBM SPSS Statistics 21. Se realizó análisis estadístico clásico con prueba de t de Student, Chi cuadrado, y ANOVA. Se establece un nivel de confianza del 95% (p-valor ≤0.05).
RESULTADOS
La mayoría de las pacientes tenían entre 35 y 39 años, (TE 41,7% TEC vs 47% TE), con una media de 34 años en ambos grupos, mientras que en las de más de 40 años hubo un predominio de TEC (5,4% vs 1,5%). Estas diferencias no fueron significativas (χ 23=6´894; p=0´075).
No encontramos diferencias en los antecedentes ni en el diagnóstico de esterilidad (Tabla 1).
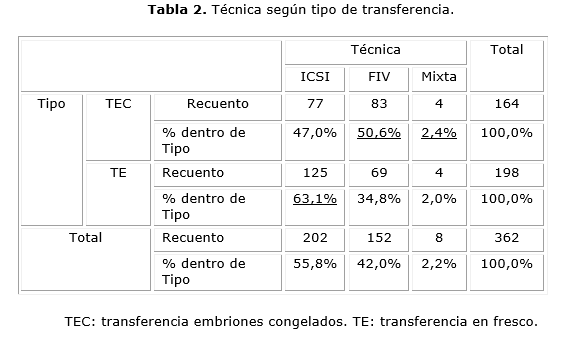
El ICSI se efectuó con más frecuencia en las pacientes con TE (63,1%) respecto a TEC (47%), y la FIV más en los ciclos de TEC (TEC 50,6% vs TE 34,8%). Las diferencias encontradas fueron estadísticamente significativas (χ22= 9´587; p=0´008) (Tabla 2).
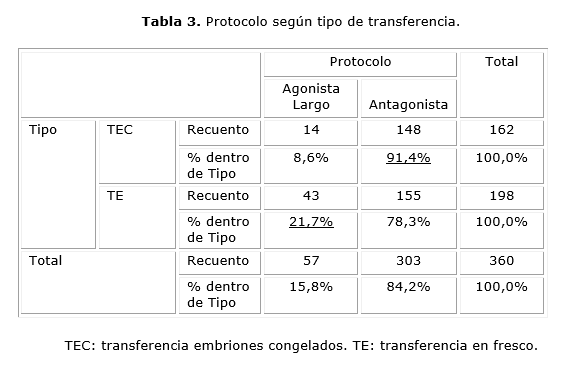
En ambos grupos se utilizó con mayor frecuencia el protocolo antagonista (TEC 91,4% vs TE 78,3%), en tanto que el agonista largo se empleó más en TE (TE 21,7% vs TEC 8,6%). Las diferencias encontradas fueron estadísticamente significativas (χ2 1= 11´430; p=0´001)
(Tabla 3).
De los 168 ciclos de VE, 65 casos provenían de Bolo Agonista de la GnRh (leuprorelina 0,4 cc.) (38,7%), 21 casos de RSHO (12,5%), 74 casos de embriones sobrantes tras la transferencia en fresco (44%), 5 casos de no transferencia por progesterona elevada (3%) y 3 de criopreservación de ovocitos (1,8%).
El mayor número de gestaciones se obtuvo en la primera transferencia (TEC (65,8% vs TE 56,2%), seguido del segundo y tercer ciclo, ambos con mayor proporción para TE.
La transferencia se efectuó sobre todo en el día D+3 en ambos grupos (TEC 58,1% vs TE 49%), continuado por el D+2 (TE 45,4% vs TEC 30%). En último lugar, en estadio de blastocisto (TEC 11,9% vs 5,6%). Las diferencias fueron estadísticamente significativas (x2 2= 10´922; p=0´004).
Se transfirió un único embrión en 16 casos (9,5 %) de TEC, mientras que en TE llevó a cabo en 25 pacientes (12,5%). La media de embriones transferidos fue de 2 en ambos grupos (t364= 1,151; p=0,251).
Con mayor frecuencia el primer embrión transferido fue de calidad A (91,7% TEC vs 69% TE), seguido de calidad B (5,4% TEC vs 24% TE), y menor de C (0,6% TEC vs 7% TE), siendo dichos resultados estadísticamente significativos (x23= 40´350; p=0´000).
El segundo embrión transferido fue, de calidad A (67,9% TEC vs 39,5% TE), seguido de B (16,7% TEC vs 29,5% TE) y C (6% TEC vs 17,5% TE) y solo 2 casos de embriones de calidad D en TE. Siendo estas diferencias estadísticamente significativas (x24= 32´722; p=0´000).
La calidad del tercer embrión transferido fue del tipo C en TEC con un único caso (0,6%), TE con 3 casos, 2 B (1%) y 1C (0,5%) (x2 2= 1´703; p=0´0427).
La media de la medida del grosor endometrial fue de 10 mm. en ambos grupos (t358= -0,773; p=0,44), con un rango que osciló entre 8 y 10 mm. y fue superior en TEC (TEC 50% vs TE 40,8%). No se encontraron diferencias significativas. La media de la tasa de implantación en ambos grupos fue de 0,6 sacos/ embrión transferido (t359= -0,285; p=0,776).
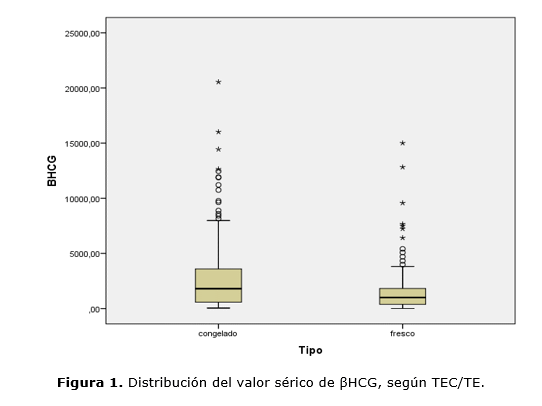
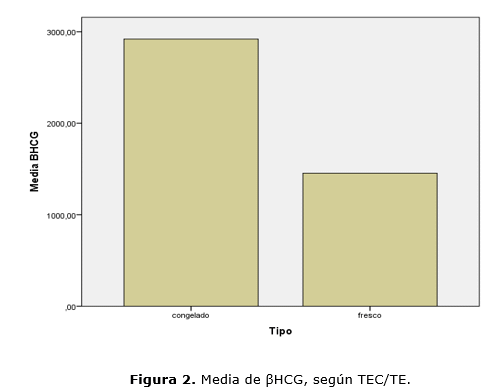
La determinación de la βHCG se realizó con una media de 17 días post-transfer en ambos grupos (t354= -0,167; p=0,868), con un valor sérico de media superior para TEC (TEC 2918,11 mUI/ml vs TE 1517,75 mUI/ml) con significancia estadística (t346 =4,700; p=0,000). La distribución de los valores de βHCG fue mayor en TEC. El 95 % de las pacientes de TEC tuvieron mayor valor sérico de βHCG al igual que los valores extremos (Fig. 1). Realizamos ANOVA 2x2x3 para tipo de transferencia, técnica y protocolo empleado, a fin de confirmar o descartar su influencia sobre el valor sérico de βHCG (variable dependiente), coyunturalmente se encontró una asociación (F1,336 = 3,695; p= 0,055). A fin de poder llevar a cabo un mejor análisis de los datos, restringimos día de determinación sérica de βHCG ≥ 15 y ≤ 20 días post transferencia embrionaria y se excluyó el protocolo mixto (2,2%), a través de ANOVA 2x2x2. Sobre el valor sérico de βHCG se encontró significativo, la influencia de estos tres factores (F1,283 = 5,215; p= 0,023). También se encontró significativa la influencia del tipo de transferencia sobre el valor sérico de βHCG (F1,283 = 5,470; p= 0,020) (Fig. 2).
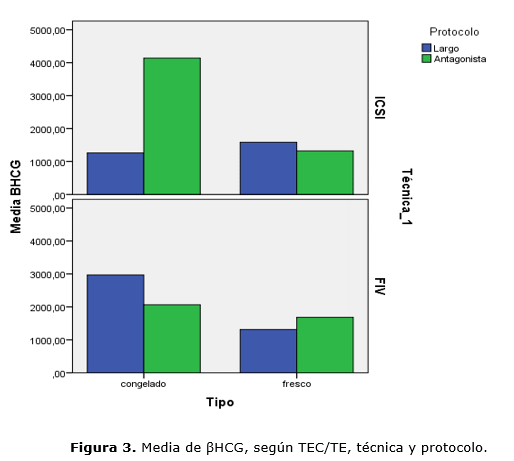
Realizamos una comparación por pares, a fin de contrastar la diferencia entre pareja de medias. Encontramos una relación significativa entre técnica (ICSI) con protocolo antagonista y TEC (p=0,000), sobre el valor sérico de βHCG. Y entre protocolo (antagonista), con TEC e ICSI (p=0,034) (Fig. 3).
El protocolo antagonista presenta unos niveles de βHCG más elevados en ICSI-TEC, en tanto que el protocolo largo se asoció con mayor valor de βHCG en FIV-TEC.
La tasa de embarazo positivo fue del 31% en el grupo de TEC y 21% en el grupo de TE. El grupo de TE tienen menos probabilidad de βHCG positivo respecto al grupo TEC (OR 0,60 IC 95% 0,47-0,77 p<0,0001). Se encontró que estas diferencias fueron estadísticamente significativas.
Para aquellas pacientes con embarazo positivo para ambos grupos, se determinó la tasa de gestación clínica, que fue mayor en el grupo de TE con un 94%, frente a TEC de un 88%. Pero esta diferencia no fue estadísticamente significativa (OR 2,03 IC 95% 0,97-4,21 p=0,0585).
(Tabla 4).
Se analizaron los resultados obstétricos (180 casos), con una mayor proporción de abortos (bioquímico o precoz) (TEC 63% vs TE 52,5%). El porcentaje de partos, fórceps y cesáreas fue mayor en TE con 47,5% frente a TEC con 37%. Estas diferencias no fueron significativas.
Y se estudió la relación entre tipo de transferencia y media de βHCG con el resultado obstétrico, objetivando un enorme solapamiento entre el intervalo de confianza de los resultados obstétricos de aborto y parto entre TEC y TE. No se encontró diferencia en cuanto al tipo de transferencia y media de βHCG (f 1,170 = 2,002; p= 0,159).
DISCUSIÓN
Conforme se incrementa la edad de la mujer disminuye su fertilidad, precisamente uno de los criterios de exclusión para TRA en la Unidad de Reproducción del CHUC es tener una edad ≥ 40 años. Dentro de nuestros resultados se encontraron 9 (5,4 %) pacientes de ≥ 40 años en el grupo de TEC, estas pacientes tienen la opción del uso de sus embriones sobrantes criopreservadas mientras cumplan los requisitos clínicamente adecuados, para la realización de la TRA. Para TE solo se encontraron 3 pacientes en el mismo rango etario al haber solicitado inclusión en la UR próximo al límite de edad. En el grupo de TEC destaca la frecuencia de asma bronquial (7,7 %), un estudio publicado por Gade,28 concluye que el asma se asocia con valores más bajos de VEGF en las secreciones endometriales uterinas, lo que podría afectar la receptividad endometrial. El efecto parece estar asociado al asma no atópica con aumento general de la inflamación sistémica.
Cabe destacar que las pacientes que consumían tabaco, lo hacían en un número superior a 10 cigarrillos/día, Quartim publicó que las mujeres fumadoras de más de 10 cigarrillos al día, presentan mayor dificultad para lograr un embarazo espontáneo.29
Según algunos autores,30 los factores etiológicos se distribuyen en un 30 % de causas masculinas, un 30 % femeninas, un 15-30 % en factores mixtos y aproximadamente un 10 % esterilidad de origen desconocido o sin causa aparente (EOD). En nuestro estudio el factor etiológico más prevalente fue la etiología mixta en un 45,1 %, seguida del femenino con un 29,5 %, 17,8 % para masculina y EOD con un 7,4 %.
Con mayor frecuencia se efectuó una ICSI en los casos de TE (63,1 %) respecto a TEC (47 %). Para FIV los TEC (50,6 %), con una mayor proporción que TE (34,8 %) (x22= 9´587; p=0´008) esto es debido a que en nuestra unidad, los ciclos con menos de cinco ovocitos se inseminan con la técnica ICSI y son ciclos con menos probabilidades de tener VE y, por otra parte, los ciclos con muchos ovocitos y a los que se les hace FIV suelen tener un mayor número de embriones criopreservados. Se ha descrito en los últimos años en Estados Unidos un incremento en el uso de ICSI con aumento relativo entre los ciclos sin diagnóstico de infertilidad masculina, a favor de infertilidad inexplicada, bajo rendimiento de ovocitos y edad aumentada (47 %). De ahí que la probabilidad de poder obtener embriones sobrantes en este grupo y de criopreservarlos sea menor.31
En ambos grupos de transferencia el protocolo más usado fue el antagonista, con una mayor proporción para TEC (91,4 %), en tanto que el protocolo agonista largo fue más utilizado en los ciclos TE (21,7 %), probablemente por una mayor indicación de este protocolo en mujeres de mayor edad o bajas respondedoras, lo que resultará en un menor número de embriones a criopreservar. Además, dentro de las indicaciones de VE figura el RSHO en ciclos antagonistas, para prevenirlo se realiza la inducción de la ovulación con un bolo de análogos de la GnRh, con criopreservación y transferencia embrionaria diferida.5 Así, en nuestro estudio de los 168 ciclos de TEC, 65 casos procedieron de Bolo Agonista, con protocolo antagonista, 21 casos de RSHO (2 casos agonista largo, 19 antagonista), los 3 casos de vitrificación ovocitaria y 5 por progesterona elevada, procedieron de protocolo antagonista. Y de los 74 casos de embriones sobrantes tras la transferencia en fresco, 60 procedieron de antagonistas. De igual manera, este protocolo fue el más frecuente en TE. Las pacientes potencialmente respondedoras altas, el protocolo antagonista puede, en cierta medida, reducir la cancelación y las tasas de incidencia de SHO.32
Respecto al día en que se realizó la transferencia, encontramos que en ambos grupos fue superior en el día D+3,24 como pauta general se recomienda transferir en D+3 en lugar D+2 para seleccionar los mejores embriones respetando siempre las horas de observación establecidas. En nuestro estudio la mayor proporción fue para transferencia en D+3, mayor para TEC (58,1 %), en comparación a TE (49 %), (x22= 10´922; p=0´004). Probablemente por la tendencia a criopreservar los mejores embriones.
En lo que compete a la calidad del primer y segundo embrión transferido, en ambos grupos fue mayor el tipo A, seguido de la calidad B. Los hallazgos encontrados se corresponden con las recomendaciones de ASEBIR,24 preferiblemente no deben ser transferidos ni congelados los embriones con más de dos alteraciones morfológicas que caracteriza a la categoría D, o que no se han dividido durante 24 horas, debido a que su tasa de implantación es prácticamente nula. En consecuencia, encontramos una mayor proporción de calidad A y B en TEC.
La vitrificación embrionaria ha permitido en los últimos años que se haya logrado unas tasas de recuperación embrionaria similares a las de embriones en fresco.8-9-33 Precisamente en nuestro estudio no hubo diferencias respecto a la tasa de implantación entre TEC y TE.
Con respecto al día de la determinación sérica de βHCG, tuvo una media de 17 días para ambos grupos. Encontramos que la media del valor sérico de βHCG fue mayor para TEC (2918,11mUI/ml) casi el doble del valor, respecto a TE (1517,75 mUI/ml) con significancia estadística (t346=4,700; p=0,000). La distribución de los valores para βHCG fue mayor en TEC, el 95 % de las pacientes de este grupo tuvieron mayor valor sérico de βHCG, igualmente los valores extremos superiores fueron mayores. Probablemente sea debido a una mejor sincronía entre endometrio y embriones transferidos. 15
Encontramos una asociación significativa entre transferencia, técnica y protocolo empleado, sobre el valor sérico de βHCG (f1,339 = 5,354; p= 0,021), una media mayor con respecto a protocolo antagonista, ICSI y TEC. ¿Podríamos entonces recomendar TEC en pacientes que han recibido un protocolo antagonista con ICSI?
Aflatoonian34 encuentra que la tasa de embarazo bioquímico fue de 27 % (54/200) en el grupo de TEC y 22,1 % (122/500) en el grupo TE. En nuestro estudio, encontramos igualmente que la tasa de gestación bioquímica fue mayor para TEC frente a TE. Nosotros no encontramos diferencias significativas, con respecto a la tasa gestación clínica en los grupos de estudio, al igual que Ku PY.35
En un metaanálisis16 se observó una mayor tasa de aborto espontáneo en su grupo de TE en comparación con el de TEC, pero esta diferencia no alcanzó significación estadística. En nuestro estudio la proporción de aborto fue mayor para TEC (63 %) frente a TE (52,5 %) igualmente la diferencia no fue significativa. Lo mismo para la proporción de partos, fórceps y cesáreas fue mayor en TE con 47,5 %, frente a TEC con solo 37 %.
Los métodos de TRA son costosos, con una implicación notable de tiempo y energía de las parejas infértiles,15 por lo que se deben optimizar los resultados. Algunos autores,36-37 han demostrado que la estrategia de congelación de todos los embriones no sólo disminuye el riesgo de SHO, sino también conduce a una mejor tasa de embarazos. Gomaa38 analizó las tasas de embarazo después de la transferencia de embriones únicos en TEC v.s. TE, encontrando asociación de mayores tasas de embarazo y de nacidos vivos en comparación con la transferencia de embriones individuales frescos. En la actualidad, hay una tendencia hacia la criopreservación de todos los embriones después de una FIV con la transferencia de un embrión descongelado en un ciclo posterior, con la posibilidad de pruebas genéticas y una separación de la transferencia de embriones del estrés y rigores de la estimulación ovárica. La cuestión relativa al beneficio de la crioconservación de todos los embriones con la subsiguiente transferencia en ciclos más fisiológicos no está exenta de controversia.36 Resulta conveniente estudiar otros factores que podrían afectar la tasa de gestación. Si bien el estudio de la receptividad del endometrio está todavía en evolución, el campo está creciendo rápidamente y es seguro que mejorará nuestra capacidad para diagnosticar y tratar a las parejas con infertilidad.39
En conclusión, no hemos encontrado diferencias en la epidemiología de las pacientes. Encontramos diferencias significativas en la técnica utilizada, mayor proporción de ICSI en TE y de FIV en TEC, esta última se aplica en casos con mayor número de ovocitos y por tanto mayores opciones de congelación. El protocolo antagonista fue el más utilizado y además, el protocolo largo está más presente en TE como cabe esperar de pacientes con menor expectativa de obtención de ovocitos. En ambos grupos la transferencia en día +3 fue significativamente mayor y la media de embriones transferidos fue de dos en ambos grupos. Respecto a la calidad embrionaria fue predominante la calidad A seguida de la calidad B y menor frecuente la calidad C y se dio en proporción ligeramente superior en TEC lo que se atribuye a la selección de la calidad embrionaria previa a la congelación.
La determinación sérica de βHCG se realizó con una media de 17 días postransfer y la media del valor fue significativamente mayor para el grupo de TEC (2918,11mUI/ml) de manera estadísticamente significativa.
La mayor tasa de βHCG positiva se dio en protocolo antagonista con técnica ICSI y en ciclo TEC, lo que nos lleva a plantear la opción de que en este grupo de pacientes de protocolo antagonista con ICSI, realizar criopreservación de sus embriones y diferir el transfer.
A pesar de que hallamos una diferencia significativa en valores de βHCG en TEC, la tasa de gestación clínica y los resultados obstétricos no resultaron ser diferentes.
REFERENCIAS BIBLIOGRÁFICAS
1. Trounson A, Mohr L. Human pregnancy following cryopreservation, thawing and transfer of an eight-cell embryo. Nature. 1983; 305:707-709.
2. Zeilmaker GH. Two pregnancies following transfer of intact frozen-thawed embryos. Fertil Steril. 1984; 42(2):293-296.
3. Saragusty J, Arav A. Current progress in oocyte and embryo cryopreservation by slow freezing and vitrification. Reproduction. 2011; 141:1-19.
4. Vajta G, Nagy ZP. Are programmable freezers stillneeded in the embryo laboratory? Review on vitrification. Reprod Biomed Online. 2006; 12:779-96.
5. Evans J, Hannan NJ, Edgell TA, Vollenhoven BJ, Lutjen PJ, Osianlis T, et al. Fresh versus frozen embryo transfer: backing clinical decisions with scientific and clinical evidence. Hum Reprod Update. 2014; 20(6):808-21.
6. Konc J, Kanyó K, Kriston R, Somoskyi B, Cseh S. Cryopreservation of Embryos and Oocytes in Human Assisted Reproduction Biomed Res Int [Internet]. 2014; 9 pag. Disponible en: doi: http://dx.doi.org/10.1155/2014/307268
7. Zhang L, Yan LI, Zhi X, Yan j, Qiao J. Female Fertility: Is it Safe to "Freeze?". Chin Med J. 2015; 128:390-397.
8. Simopoulou M, Asimakopoulos B, Bakas P, Boyadjiev N, Tzanakaki D, Oocyte and embrio vitrification in the IVF laboratory: A comprehensive review. Folia Med. 2014; ![]() 56(3):161-9.
56(3):161-9.
9. Wong KM, Mastenbroek S. Cryopreservation of human embryos and its contribution to in vitro fertilization success rates. Fertil Steril.2014; 102(1):19-26.
10. Groenewoud ER, Macklon NS, Cohlen BJ. The effect of elevated progesterone levels before HCG triggering in modified natural cycle frozenthawed embryo transfer cycles [Internet]. Reprod Healthc. 2017; 34:546 - 554. Disponible en: http://dx.doi.org/10.1016/j.rbmo.2017.02.008
11. Sabry D, Nouh O, Marzouk S, Hassouna A. Pilot study on molecular quantitation and sequencing of endometrial cytokines gene expression and their effect on the outcome of in vitro fertilization (IVF) cycle. J Adv Res. 2014; 5: 595- 600.
12. Haouzi D, Bissonnette L, Gala A, Assou S, Entezami F, Perrochia H, Dechaud H, Hugues HJ, Hamamah S. Endometrial Receptivity Profile in Patients with Premature Progesterone Elevation on the Day of hCG Administration [Internet]. Biomed Res Int. 2. Volume 2014, Article ID 951937, 10 pag. Disponible en: http://dx.doi.org/10.1155/2014/951937
13. Herington JL, Guo Y, Reese J, Paria BC. Gene profiling the window of implantation: Microarray analyses from human and rodent models. J Reprod Health Med. 2016; 2(2): s19-s25.
14. Bellver J, Martínez-Conejero JA, Labarta E, Alamá P, Horcajadas JA. Endometrial gene expression in the window of implantation is altered in obese women especially in association with polycystic ovary syndrome. Fertil Steril. 2011; 95(7): 2335-2341.
15. Basirat Z, Adib H, Esmailzadeh S, Gholam S, Jorsaraei A, Hajian- Tilaki K, Pasha H, Ghofrani F. Comparison of pregnancy rate between fresh embryo transfers and frozen-thawed embryo transfers following ICSI treatment. Int J Reprod BioMed. 2016; 14(1):39-46.
16. Roque M, Lattes K, Serra S, Sola I, Geber S, Carreras R, Checa MA. Fresh embryo transfer versus frozen embryo transfer in in vitro fertilization cycles: a systematic review and meta-analysis. Fertil Steril. 2013; 99(1):156-162.
17. Henningsen AK, Pinborg A, Lidegaard, Vestergaard C, Forman JL, Andersen AN. Perinatal outcome of singleton siblings born after assisted reproductive technology and spontaneous conception: Danish national sibling-cohort study. Steril. 2011; 95: 959-963.
18. Shih W, Rushford DD, Bourne H, Garrett C, McBain JC, Healy DL, Baker HW. Factors affecting low birthweight after assisted reproduction technology: difference between transfer of fresh and cryopreserved embryos suggests an adverse effect of oocyte collection. Hum Reprod 2008; 23 (7):1644-1653.
19. Rodriguez-Purata J, Lee J, Whitehouse M, Duke M, Grunfeld L, Sandler1 B, Copperman A, Mukherjee T. Reproductive outcome is optimized by genomic embryo screening, vitrification, and subsequent transfer into a prepared synchronous endometrium. J Assist Reprod Genet. 2016; 33:401-412.
20. Simon C, Vladimirov IK, Castillon Cortes G, Ortega, Cabanillas S, Vidal C, et aI. Prospective, randomized study of the endometrial receptivity analysis (ERA) test in the infertility wok-up to guide personalized embryo transfer versus fresh or deferred embryo transfer. ASRN. 2016.
21. Roque M, Valle M, Guimarães F, Sampaio M, Geber S. Cost-Effectiveness of the Freeze-All Policy. JBRA Assist Reprod. 2015;19(3):125-130.
22. Vidal M, Vellvé K, González Comadran M, Robles A, Prat M, Torné M, et al. Perinatal outcomes in children born after fresh or frozen embryo transfer: a Catalan cohort study based on 14,262 newborns. Fertil Steril. 2017: 107(4):940947.
23. Thijssen A, Creemers, A, Van der Elst, W, Creemers, A, Vandormael E, et al. Predictive value of different covariates influencing pregnancy rate following intrauterine insemination with homologous semen: a prospective cohort study. Reprod Biomed Soc [Internet]. 2017; 34(5):463-472. Disponible en: https://doi.org/10.1016/j.rbmo.2017.01.016
24. Cuadernos ASEBIR: Criterios ASEBIR de Valoración Morfológica de Oocitos, Embriones Tempranos y Blastocistos Humanos. 2015: 3º Edición. Disponible en: http://asebir.com/cuadernos-asebir/criterios-asebir-de-valoracion-morfologicade-oocitos-embriones-tempranos-y-blastocistos-humanos/
25. Bdolah Y, Zemet R, Aizenman E, Lossos F, Abram TB, Shufaro Y. FrozenThawed Embryo Transfer Success Rate is Affected by Age and Ovarian Response at Oocyte Aspiration Regardless of Blastomere Survival Rate [Internet]. JBRA Asistencia Reprod. 2015; 19 (4): 210-5. Disponible en: 10.5935 / 1518-0557.20150041.
26. Solé M, Santaló J, Rodríguez I, Boada M, Coroleu B, Barri PN, Veiga A. Correlation between embryological factors and pregnancy rate: development of an embryo score in a cryopreservation programme [Internet]. J Assist Reprod Genet (2011) 28:129-136. Disponible en: DOI 10.1007/s10815-010-9498-0
27. O'Shea LC, Hughes C, Kirkham C, Mocanu EV. The impact of blastomere survival rates on the competition of embryo development Cryo-Thawed Day 2 [Internet]. 2016 Feb, 197: 98-102. Disponible en: https://www.ncbi.nlm.nih.gov/pubmed/26722995 .
28. Gade EJ, Thomsen SF, Lindenberg S, Backer V. Female Asthma Has a Negative Effect on Fertility: What Is the Connection? ISRN Allergy [Internet]. Volume 2014, Article ID 131092, 6 pag. Disponible en: http://dx.doi.org/10.1155/2014/131092
29. Quartim C. Melo MA, Reis S. Estilo de vida y ambiente. Remohí J. Manual práctico de Esterilidad y Reproducción Humana. 4º edición. Madrid. Editorial panamericana; 2012. 13-23.
30. García Velasco JA. Epidemiología de la esterilidad. máster en reproducción humana IVI [Internet]. 2012. 9 pag. Disponible en: www.equipoivi.es/cursos/masterurjc2013/formacion/docdow.php?id=3&ver=1
31. Boulet SL, Mehta A, Kissin DM, Trends in reproductive use and outcomes associated with intracytoplasmic sperm injection. JAMA. 2015; 313 (3): 255 - 263.
32. Xing W, Lin H, Li Y, Yang D, Wang W, Zhang Q. Is the GnRH Antagonist Protocol Effective in Prevention of OHSS for Potentially Elevated Responders Undergoing IVF / ICSI? [Internet]. PLoS Uno. 2015: 10 (10). Disponible en: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4607293/
33.- Herrero, L., Martínez, M. y García-Velasco, JA Estado actual de ovocitos humanos y la criopreservación de embriones. Curr Opin Obstet Gynecol. 2011; 23:245-250.
34. Aflatoonian A, Mansoori Moghaddam F, Mashayekhy M, Mohamadian F. Comparison of early pregnancy and neonatal outcomes after frozen and fresh embryo transfer in ART cycles. J Assist Reprod Genet. 2010; 27: 695 - 700.
35. Ku PY, Lee RK, Lin SY, Lin MH, Hwu YM. Comparison of the clinical outcomes between fresh blastocyst and vitrified-thawed blastocyst transfer. J Assist Reprod Genet. 2012; 29 (12): 1353 - 6.
36. Kurt T, Bamhart. Are we ready to eliminate the transfer of fresh embryos in vitro fertilization? Fertil Steril. 2014; 102(1):1-2.
37. Borges E, Alemida Ferreira DP, Setti AS, Vingris LS, Figueira RC, Laconelli A. Strategies for the manegent of OHSS: Results from freezing-all cycles. Assist Reprod. 2016; 20(1):08-12.
38.Gomaa H, Baydoun R, Sachak S, Lapana I, Soliman S. Elective single embryo transfer: Is frozen better than fresh? Assist Reprod. 2016; 20(1):03-07.
39. Lessey B. Endometrial receptivity and the window of implantation. Baillieres Best Pract Res Clin Obstet Gynaecol; 2000 :14(5):775-88.
Recibido: 2 de febrero de 2018.
Aprobado: 26 de marzo de 2018.
Rosa Cristina Ramos Galindo. Departamento de Obstetricia y Ginecología, Pediatría, Medicina Preventiva y Salud Pública, Toxicología, Medicina Legal y Forense y Parasitología. Facultad de Ciencias de la Salud. Universidad de La Laguna. Complejo Hospitalario Universitario de Canarias. Unidad de Reproducción Humana. Tenerife, España.
Correo electrónico: rcristinaramos@yahoo.es