INTRODUCCIÓN
Los mecanismos y las barreras de defensa naturales como: la piel, la mucosidad, el epitelio ciliado y las secreciones que contienen sustancias antibacterianas (p. ej., lisozima, defensinas), dificultan la entrada en el organismo de las bacterias. Sin embargo, algunas veces estas barreras se alteran (p. ej., un desgarro cutáneo, una ulcera intestinal), lo que crea una vía de entrada para las bacterias, o bien estas pueden tener los medios para perturbar la barrera e invadir el organismo. (1,2
El mecanismo más común de actividad antibiótica es la interferencia en la síntesis de la pared celular bacteriana. La mayoría de los antibióticos activos sobre la pared se clasifican en antibióticos b-lactámico (p. ej., penicilinas, cefalosporinas, Cefamicinas, carbapenems, monobactams, inhibidores de b-lactamasa), así denominados porque comparten una estructura de anillo b-lactámico común.3) Las cefalosporinas tienen el mismo mecanismo de acción que las penicilinas; sin embargo, tienen un espectro antibacteriano más amplio, son resistentes a muchas b-lactamasas y tienen propiedades farmacocinéticas mejoradas.
La actividad de los antibióticos de primera generación de corto espectro queda restringida principalmente a especies de Escherichia coli, Klebsiella, Proteus mirabilis y cocos Gram positivos sensibles a oxacilina. Muchos de los antibióticos de segunda generación poseen una actividad adicional frente a Haemophilus influenzae y especies de Enterobacter, Citrobacter y Serratia, y algunos anaerobios, como Bacteroides fragilis. Los antibióticos de tercera generación de amplio espectro y los antibióticos de cuarta generación de espectro extendido son activos frente a la mayoría de las enterobacterias y Pseudomonas aeruginosa. Los antibióticos de espectro extendido ofrecen la ventaja de una mayor estabilidad frente a las b-lactamasas.4
El nombre del género Staphylococcus se refiere a que estos cocos Gram positivos se desarrollan en un patrón que recuerda a un racimo de uvas; sin embargo, los microorganismos presentes en muestras clínicas aparecen como células aisladas, en pares o en cadenas cortas. Estas bacterias están presentes en la piel y las mucosas del ser humano.5
Las tendencias en la sepsis de inicio tardío muestran un incremento en la sepsis a Staphylococcus coagulase-negativo; la mayoría de estos aislamientos son susceptibles a cefalosporinas de 1ra generación. La piel del recién nacido, el tracto respiratorio, conjuntiva, tracto gastrointestinal, y muñón umbilical puede colonizarse desde el ambiente y tal colonización producir sepsis tardía por microorganismos invasivos. Vectores para tal colonización pueden incluir catéteres vasculares o urinarios o por el contacto con los cuidadores quienes tienen colonización bacteriana.6
La sepsis de inicio precoz a Gram positivo ha reducido su incidencia a nivel mundial gracias a la prevención oportuna y a la aplicación de protocolos bien estandarizados.7,8,9
Las infecciones de la herida quirúrgica amenazan la vida de millones de pacientes cada año y contribuyen a la propagación de la resistencia a los antibióticos. En los países de ingresos bajos y medios, el 11 por ciento de los pacientes sometidos a cirugía están infectados en el proceso. En África, hasta el 20 por ciento de las mujeres sometidas a una cesárea contraen una infección quirúrgica, comprometiendo su propia salud y su capacidad de cuidar a sus bebés. Pero estas infecciones no son solo un problema para los países más desfavorecidos, en Estados Unidos, contribuyen a que los pacientes necesiten más de 400 000 días adicionales de ingreso hospitalario, a un costo de 900 millones de dólares adicionales por año.10,11
En Cuba, la sepsis del sitio quirúrgico en la puérpera cesareada es un factor que incrementa la morbilidad y prolonga la estadía hospitalaria.12,13
Manet Lahera, en un estudio realizado en Santiago de Cuba, en una unidad neonatal encontró alta resistencia a cefalosporinas de 3ra generación frente a gérmenes Gram positivos.14
En las Tunas, se realizó un estudio de sepsis neonatal que arrojó el 75,8 % de positividad en los hemocultivos y el Staphylococcus coagulasa negativo como germen predominante en esa unidad.15
Sin embargo, otro estudio más reciente en Santiago de Cuba (2016) mostró el predominio de los gérmenes Gram negativos como causantes de infecciones neonatales nosocomiales.16
Los protocolos de actuación de ambas especialidades incluyen a las cefalosporinas de 3ra generación como terapéutica antibiótica a considerar frente a las infecciones; sin embargo, un germen tan frecuente en nuestro medio como el Staphylococcus Áureos muestra la elevada resistencia, por esta razón nos motivamos a la realización de esta investigación. El objetivo del trabajo fue identificar los gérmenes aislados por servicios y determinar la resistencia del Staphylococcus Aureus a las cefalosporinas por generación y por servicios.
MÉTODOS
Se realizó un estudio retrospectivo, transversal y descriptivo en hospital Ginecobstétrico de Guanabacoa desde enero de 2014 hasta diciembre de 2016. Se seleccionaron como variables, los gérmenes aislados y el patrón de resistencia del germen que predominó frente a todas las generaciones de cefalosporinas. En el laboratorio de microbiología se utilizaron pruebas de sensibilidad antimicrobiana de difusión en Agar donde se vierte sobre la superficie del medio con Agar una concentración estandarizada de bacterias y a continuación se colocan sobre la superficie de Agar discos o tiras de papel impregnados con antibióticos. Después de una noche de incubación, se observó una zona de inhibición del crecimiento que rodeaba los discos o las tiras de papel. El tamaño del diámetro de inhibición correspondió con la actividad del antibiótico; cuanto más sensible sea el microorganismo al antibiótico, mayor es el diámetro de inhibición del crecimiento. Los datos se obtuvieron del registro de infecciones del centro y de los informes al Comité de infecciones hospitalarias. Nos auxiliamos del mapa microbiano que confeccionó el departamento de Microbiología anualmente. Los resultados se expresaron en tablas y gráficos y se utilizaron como prueba estadística los números y porcientos. La información se procesó en una Laptop Hp Intel Cor i5y se utilizaron los programas de Microsoft Excel para confeccionar las tablas y gráficos.
RESULTADOS
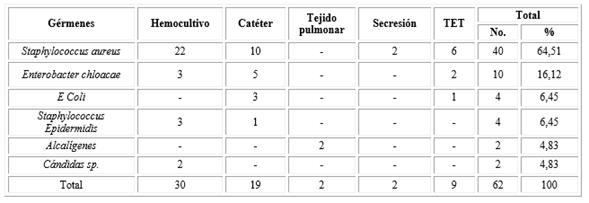
En el servicio de neonatología se aislaron diferentes gérmenes en la que predominó el Staphylococcus Áureos (40), el cual representa 64, 51 % del total de microorganismo aislados seguidos de Enterobacter chloacae (10) y la E. Coli y Staphylococcus epidermidis con igual número (4).
El hemocultivo fue el medio donde se aisló con mayor frecuencia los gérmenes y en este medio predominó el Staphylococcus Áureos, seguido de Enterobacter chloacae y Staphylococcus epidermidis. Las cándidas solo se aislaron en Hemocultivos, resultados que se muestran en la tabla 1.
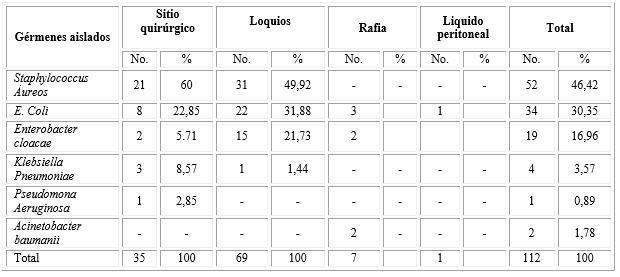
En la tabla 2 se relacionan los resultados del estudio en el servicio de Puerperio. Igualmente, el germen que predominó fue el Staphylococcus Áureos (52; 46, 42 %), seguidos de E. Coli (34; 30,35 %) y el Enterobacter chloacae (19; 16, 96 %).
Fueron los loquios (69) y el sitio quirúrgico el sitio de mayor aislamiento (35) seguidos de la rafia (7).
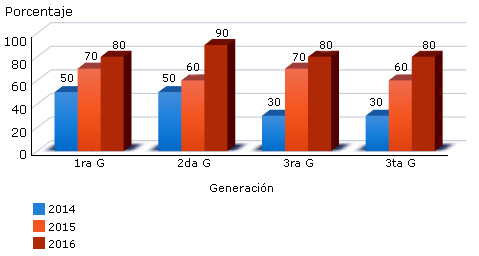
La figura 1 refleja que durante el trienio estudiado hubo un incremento de la resistencia de este germen frente a todas las generaciones de cefalosporinas, las más usadas en nuestros neonatos son las de amplio espectro, 3ra y 4ta generación, sin embargo, vemos como la resistencia osciló entre 50 a 80 %.
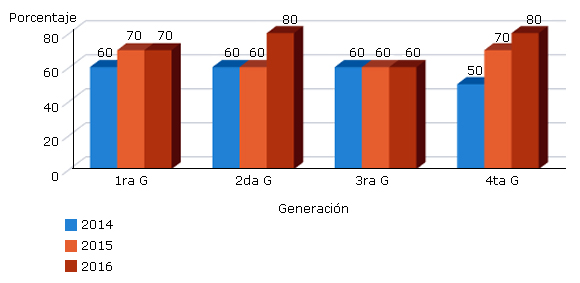
Fig. 1. Resistencia del Staphylococcus aureus frente a las cefalosporinas en el servicio de Neonatología.
En el servicio de Puerperio, la resistencia del Staphylococcus Aureus frente a las cefalosporinas se ha ido incrementando cada año, las más usadas son las de 1ra generación en la profilaxis quirúrgica con un 80 % de resistencia en el 2016; sin embargo, esta protocolizado. Igualmente, el incremento de la resistencia a las cefalosporinas de 3ra generación osciló de un 30 % en el 2014 a un 80 % en el 2016 motivo por el cual algunas infecciones necesitan otras terapéuticas alternativas. Resultados que se expresan en la figura 2.
DISCUSIÓN
El hemocultivo es uno de los procedimientos más importantes que se llevan a cabo en el laboratorio de microbiología clínica.
El éxito de esta prueba se relaciona directamente con los métodos utilizados para recoger la muestra de sangre. El factor más importante que determina el éxito del hemocultivo es el volumen de sangre procesada. Por ejemplo, un 40 % más de los cultivos son positivos en relación con microorganismos si se cultivan 20 mL en vez de 10 mL de sangre, porque más de la mitad de todos los pacientes sépticos tienen menos de un microorganismo por mililitro de sangre. Se deben recoger aproximadamente 20 mL de sangre de un adulto por cada frasco de hemocultivo, y se deben recoger volúmenes proporcionalmente más pequeños de niños y de neonatos.17,18
La bacteriemia y la fungemia se definen como la presencia de bacterias y hongos, respectivamente, en la sangre, y estas infecciones reciben colectivamente la denominación de septicemia. La mortalidad secundaria a la sepsis puede ser tan alta como 50 % de los pacientes no tratados. La infección es la mayor causa de letalidad durante el primer mes de vida, contribuyendo al 13 -15 % de todas las muertes neonatales. El bajo peso y la sepsis a Gram negativo son asociados a resultados adversos. (15
Los resultados de las pruebas de sensibilidad a los antimicrobianos son valiosos para seleccionar los agentes quimioterápicos activos frente al microorganismo infeccioso. Las pruebas in vitro son sencillamente una determinación del efecto del antimicrobiano frente al microorganismo en unas condiciones específicas. La selección de un antibiótico y el desenlace del paciente se ven influidos por una variedad de factores interrelacionados, como son las propiedades farmacocinéticas de los antibióticos, la toxicidad del fármaco, la enfermedad clínica y el estado médico general del paciente. Así, algunos microorganismos que son resistentes a un antibiótico persistirán en la infección, y algunos microorganismos que son sensibles a un antibiótico serán eliminados. (19
Los estafilococos desarrollaron una rápida resistencia a los antibióticos después de la introducción de la penicilina, y en la actualidad una proporción inferior al 10 % de las capases sensible a este antibiótico. Esta resistencia esta mediada por la enzima penicilinasa (b-lactamasa específica para las penicilinas), la cual hidroliza el anillo b-lactámico de la penicilina. Los problemas asociados a los estafilococos resistentes a la penicilina impulsaron el desarrollo de penicilinas semisintéticas resistentes a la hidrolisis por b-lactamasas (p. ej., meticilina, nafcilina, oxacilina, dicloxacilina). Lamentablemente, los estafilococos desarrollaron también resistencia a estos antibióticos. En este momento, la mayor parte de Staphylococcus aureus responsables de las infecciones hospitalarias y comunitarias son resistentes a estos antibióticos, conocidos como estafilococos resistentes a meticilina (SARM) y estas cepas de SARM son resistentes frente a todos los antibióticos b-lactámico (es decir, penicilinas, cefalosporinas, carbapenems). Los estafilococos han demostrado una gran capacidad para desarrollar resistencia a la mayoría de los antibióticos. Hasta hace poco tiempo, el único antibiótico que había mantenido su actividad de manera uniforme frente a los estafilococos era la vancomicina, el antibiótico de elección en la actualidad como tratamiento de los SARM. (20
Múltiples investigaciones reportan predominio de microorganismos Gram positivos y reflejan los factores asociados a las infecciones, así como las variables clínicas y químicas que acompañan a la sepsis neonatal. (21,23
La transmisión horizontal de los estafilococos de una persona a otra es más difícil de prevenir. Un ejemplo de esto son las infecciones de la herida quirúrgica, las cuales pueden ser producidas por un número relativamente bajo de microorganismos debido a la posible presencia de cuerpos extraños o tejido desvitalizado. Aunque no resulta realista esterilizar al personal de quirófano y el ambiente, el riesgo de contaminación durante una intervención quirúrgica se puede disminuir mediante un lavado correcto de manos y la cobertura de las superficies de piel expuestas.24,25
Calderón26) reflejó en su estudio de comparación de la sepsis puerperal poscesárea versus posparto, el aumento de la endometritis en este último, resultados similares a los nuestros; sin embargo, Oliver demostró el predominio del Staphylococcus aureus aislados en secreciones de heridas en el puerperio quirúrgico.27
La Organización Panamericana de la Salud presentó desde 2014 un proyecto para la vigilancia epidemiológica de las infecciones asociadas al puerperio con el propósito de disminuir su prevalencia.11