Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Medicina Militar
versión impresa ISSN 0138-6557versión On-line ISSN 1561-3046
Rev Cub Med Mil v.26 n.2 Ciudad de la Habana jul.-dic. 1997
Actividad hepatoprotectora del "ergopanin" melito
My. José L. Pérez de Alejo,1 Dra. María del C. Sotolongo Baró,2 Téc. Roberto Miranda Flores3 y Téc. Gilda Rodríguez Rodríguez3- Licenciado en Bioquímica. Investigador Auxiliar.
- Especialista de I grado en Anatomía Patológica.
- Técnico en Investigaciones Fisiológicas.
RESUMEN
Se ensaya farmacológicamente la actividad hepatoprotectora del "ergopanin" melito en un modelo experimental de hepatoxicidad por tetracloruro de carbono (C14C) con administración intra peritoneal (IP) y a la dosis de 0,5 ml/kg, 2 veces por semana, durante 3 semanas. La actividad hepatoprotectora se evalúa mediante valores de transaminasas (pirúvica y oxalacética) y examen histológico a la segunda y tercera semanas de administrado el Cl4C. Se encuentra que el preparado "ergopanin" en dosis de 10 mg/kg reduce a valores normales las concentraciones de ambas transaminasas a la segunda y tercera semanas de tratamiento, disminuyendo a su vez el grado de los índices histológicos medidos en el mismo período.Descriptores DeCS: HÍGADO/anatomía & histología; GINSEN/efectos de drogas; EXTRACTOS VEGETALES/farmacología; ALANINA AMINOTRASNFERASA/sangre; ASPARTATO AMINOTRANSFERASA/sangre; TETRACLORURO DE CARBONO/toxicidad; RATA.
El "ergopanin" melito es un producto elaborado a partir de sustancias naturales, en cuya composición interviene el extracto fluido de Polyscia fruticosa (aralia), como principio activo. La Polyscia fruticosa ha sido empleada en países como China, Viet Nam, Laos y Cambodia como estimulante, cuyos efectos son comparables al del Panax ginseng, planta conocida como "elixir de la vida" y a la cual se le atribuyen múltiples propiedades medicinales desde tiempos ascentrales. El Panax fruticosum, nombre que se le da a la Polyscia fruticosa en otros países, se cultiva en Cuba como planta ornamental y es muy frecuente verla en jardines y patios. Pérez de Alejo et al. han demostrado en estudios experimentales que tanto el extracto fluido como el preparado "ergopanin", aumentan la resistencia de los animales a la fatiga.1 En la Academia
de Medicina Militar de Viet Nam, en un ensayo clínico controlado se demostró que a la dosis de 0,23-0,50 g (polvo seco) o en infusión, el Panax fruticosum aumentaba la resistencia del cuerpo humano.2 En estudios cromatográficos en capa delgada, recientemente realizados por Pérez de Alejo et al. se comprobó que la Polyscia fruticosa, nativa de Cuba, tiene una composición en saponósidos triterpénicos (Panaósidos) muy similar al del Panax ginseng.
Se ha determinado por diversos investigadores mediante métodos cromatográficos la composición, así como las estructuras de los saponósidos triterpénicos que componen al Panax ginseng y a los cuales se les atribuyen la mayoría de las propiedades medicinales. De esta forma se han podido identificar en el ginseng 9 ginsenósidos conocidos3 como RO, RB1, Rb2, Rc, Rd, Re, Rf1, Rg1, y Rg2. Composiciones similares al del ginseng han sido también encontradas en especies relacionadas, como son los casos del Panax quinquefolium y Panax japonicum.4
T.B. Ng et al. demostraron que los ginsenósidos Rb1, Rb2, Rc y Rg1 suprimen la lipogénesis y lipolisis inducida por corticostropina en adipocitos aislados de ratas;5,6 Tsang et al. demostraron que el extracto butanólico de ginsenósidos inhibe la captación de GABA, ácido glutámico, dopamina, noradrenalina y serotonina por los sinaptosomas de cerebro de ratas.7 Hiquino et al. demuestran la actibidad antihepatotóxica de algunos ginsenósidos del Panax ginseng en un modelo de hepatotoxicidad inducida por tetracloruro de carbono y galactosamina.8
Teniendo en cuenta los reportes de la literatura sobre la actividad de los panaósidos y de la composición similar de la Polyscia; nos dimos a la tarea de probar actividad hepatoprotectora del "ergopanin" melito.
MÉTODOS
La Polyscia fruticosa fue obtenida en los jardines del "Parque Almendares" en Ciudad de La Habana e identificada botánicamente por el doctor Víctor Fuentes Fiallo del Instituto Nacional de Investigaciones Fundamentales de la Agricultura Tropical (INIFAT). El polvo se obtuvo a partir de la corteza de las raíces, que después de limpias de arena y tierra, fueron cortadas en trozos pequeños y secados en horno a 40°; después de secas fueron trituradas hasta polvo fino. Con el polvo de Polyscia fue elaborado por el departamento de fitoquímica de nuestro laboratorio un extracto fluido por percolación con pH de 6,35, IR de 1,369; d=0, 9488 y sólidos totales de 7,3 g/100 mL y un contenido alcohólico de 57,64 %. El extracto fluido fue utilizado como principio activo en la elaboración del "ergopanin" melito por el departamento de fórmulas farmacéuticas de nuestro laboratorio. De igual forma se preparó un melito blanco, sin principio activo, y con los demás ingredientes del preparado para ser utilizado en el grupo control.Para evaluar el efecto hepatoprotector del "ergopanin" melito fue seleccionado un modelo experimental de hepatotoxicidad en ratas por tetracloruro de carbono descrito por Reckhgel9 en 1967. La dosis de tetracloruro de carbono empleada fue de 0,5 mL/kg de peso por vía intraperitoneal (ip), administrado 2 veces/sem durante 3 semanas.
Fueron ensayados los siguientes grupos experimentales:
- Grupo control salina
- Grupo control tetracloruro (Cl4C)
- Grupo experimental dosis-1 + Cl4C
- Grupo experimental dosis- 2 + Cl4C
- Grupo experimental dosis-3 + Cl4C
RESULTADOS
Los valores de transaminasa glutámico pirúvica disminuyeron significativa mente en la segunda semana de tratamiento en las 3 dosis empleadas del "ergopanin" melito, con valores muy significativos (p < 0,002) en la primera y segunda dosis. En la tercera semana de tratamiento también se produce una disminución significativa en los valores de esta enzima en la segunda y tercera dosis, con valores muy significativos (p < 0,002) en la dosis-3; sin embargo, en la tercera semana la dosis-1 no fue efectiva en la recuperación del valor enzimático en lo que respecta a la transaminasa glutámico pirúvica (tabla 1, figuras 1 y 2). Similar comportamiento se observa para la transaminasa glutámico oxalacética en la segunda semana de tratamiento y tercera semana con valores muy significativos (p < 0,002) para la dosis-3 que van desde 241,20 U/I en el grupo CL4C hasta 83,80 U/I en la dosis-3. Estos resultados en los valores de las transaminasas se interpretan como actividad hepatoprotectora del "ergopanin" melito a las dosis utilizadas.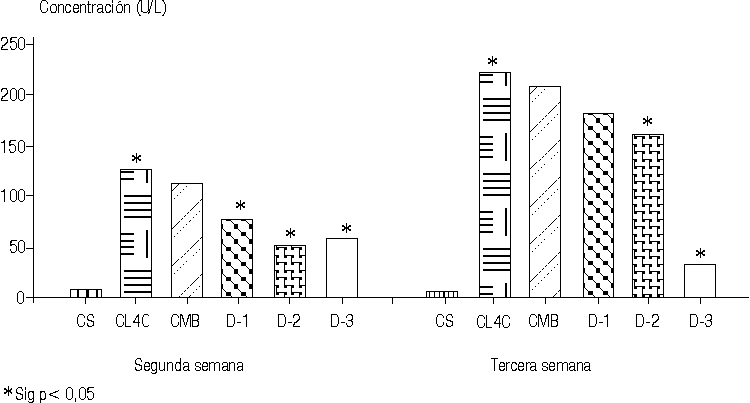
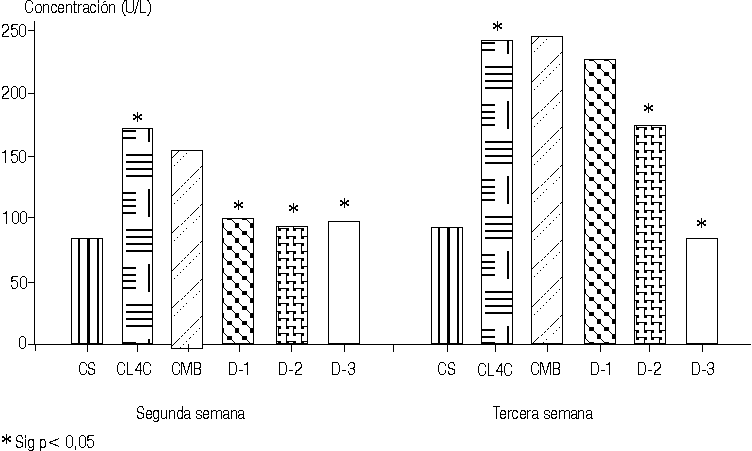
TABLA 1. Valores de TGP y TGO (media, DE) en la segunda y tercera semana en los diferentes grupos de estudios
| | | |||||||
| | | | | |||||
| | | | | | | | | |
| Control sal. | | | | | | | | |
| Control melito blanco | | | | | | | | |
| Control CL4C | | | | | | | | |
| Exp. dosis-1+ CL4C | | | | | | | | |
| Exp. dosis-2+ CL4C | | | | | | | | |
| Exp. dosis-3+ CL4C | | | | | | | | |
| (1) SE | | | | | ||||
| (2) SE | | | | | ||||
| (3) SE | | | | | ||||
| (4) SE | | | | | ||||
| (5) SE | | | | | ||||
DE. Desviación estándar
SE. Significación estadística
COMPARACIONES: (1). Salina vs CL4C
(2). CL4C vs dosis-1
(3). CL4C vs dosis-2
(4). CL4C vs dosis-3
(5). CL4C vs Melito blanco
En la tabla 2 se muestran los resultados del examen histológico de los hígados de las ratas en los diferentes grupos de estudios y el grupo CL4C corresponde el mayor grado de hepatoxicidad y una disminución progresiva de este grado en la medida que aumenta la dosis del "ergopanin" melito en los animales tratados. Aún se observa un grado moderado de necrosis centrolobulillar en esta tercera semana de tratamiento.
TABLA 2. Resultados histológicos a la tercera semana de administrado el CL4C (media) en los grupos de estudio
| | | | | | |
| Congestión | | | | | |
| Necrosis centrolobulillar | | | | | |
| Infiltración grasa | | | | | |
| Infiltrado mononuclear | | | | | |
| Degeneración hialina | | | | | |
| Hemorragia intraparenquimatosa | | | | | |
| Tumefacción hepática | | | | | |
De todo esto es necesario concluir que el retorno de la transaminasa glutámico pirúvica y oxalacética a valores normales para las ratas en los grupos de tratamiento con las dosis de 2,5; 10 y 25 mg/kg de peso, corroboran actividad hepatoprotectora del "ergopanin" melito. Además, en la tercera semana de tratamiento con las diferentes dosis del "ergopanin" melito se observaron signos significativos de recuperación celular y menos hepatotoxicidad, que aumenta según aumentan las dosis.
SUMMARY
The hepatoprotective activity of "ergopanin" melito was pharmacologically assayed in an experimental model of hepatotoxicity due to carbon tetrachloride (C14C) by intraperitoneal route and with a dose of 0,5 ml/kg, twice a week for 3 weeks. The hepatoprotective activity was evaluated by th determination of transaminase (pyruvic and oxaloacetic) values and histologic examination at the second and third weeks after the administration of C14C. It was found that the preparation "ergopanin" in a dose of 10 mg/hg reduces the concentrations of both transaminases to normal values at the second and third weeks of treatment, decreasing the degree of the histologic indexes measured during the same period.Subject headings: LIVER/anatomy&histology; GINSEN/drug effects; PLANT EXTRACTS/pharmacology;ALANINE AMINOTRANSFERASE/blood; ASPARTATE AMINOTRANSFERASE/blood; CARBON TETRACHLORIDE/toxicity; RATS.
REFERENCIAS BIBLIOGRÁFICAS
1. Pérez de Alejo JL, Miranda R, Rodríguez G. "Ergopanin". Un melito con actividad estimulante y/o ergogénica. Rev Cubana Med Milit 1996;25(1):37-40.
2. Dotat L. Las plantas y especies medicinales de Vietnam. Ed Hanoi 1981;t1:44-53.
3. Rosella MA col. Analítica de panax ginseng meyer (araliaceae) y especies relacionadas. II. TLC de ginsenósidos. Acta Farm Bonarence 1985;4(1):27-32.
4. Rosella MA. Estado actual del conocimiento del panax ginseng C.A. meyer y especies relacionadas. Acta Farm Bonaerence;1(1):39-47.
5. Ng TB, Li WW, Yeung HW. Effects of ginsenosides, lectins and Momordica charantia insulin-like peptide on corticosterone production by isolatet rat adrenal cell. J Ethnopaharmacol 1987;21:21-9.
6. Ng TB, Wong CM, Yeung HW. Effect of ginsenosides Rg1. Rc, and Rb2 on hormone-induced lipolisis and lipogenesis in rat epididymal fat cell. J Ethnopharmacol 1986;16:191-9.
7. Tsang D, Yeung HW, Tso WW, Peck H. Ginseng saponins: Influence of neurotransmitter uptake in rat brain synaptosomes. Planta Médica 1985;2:221-4.
8. Hiroshi H. Antihepatotoxic actions of ginsenosides from panax ginseng roots. Planta Médica 1984;9:62-4.
9. Reckhgel R. Hepatotoxicity of carbon tetraclorure. Clin Biochem Acta 1967;2(1):24-9.Recibido: 12 de marzo de 1997. Aprobado: 17 de abril de 1997
My. José L Pérez de Alejo. Instituto Superior de Medicina Militar "Dr. Luis Díaz Soto". Avenida Monumental, Habana del Este, CP 11700. Ciudad de La Habana, Cuba.














