Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Medicina Militar
versión On-line ISSN 1561-3046
Rev Cub Med Mil v.29 n.3 Ciudad de la Habana sep.-dic. 2000
Trabajos de Revisión
Instituto Superior de Medicina Militar "Dr. Luis Díaz Soto"Métodos para medir el daño oxidativo
Dr. Pedro Luis Pérez Gastell 1 y My. José Luis Pérez de Alejo 2RESUMEN
El desbalance en la producción de especies reactivas del oxígeno y la defensa antioxidante provoca un daño oxidativo conocido como estrés oxidativo, que lleva a una variedad de cambios fisiológicos y bioquímicos, los cuales provocan el deterioro y muerte celular. Se puede medir este tipo de daño mediante métodos directos e indirectos. Entre los primeros tenemos la medición de la concentración de agentes oxidantes, que es muy difícil por su corta vida media y lo costoso que resultan los equipos, lo que hace imprescindible medirlos indirectamente mediante: 1) Determinación de productos terminales de la acción oxidante sobre biomoléculas: los métodos para medir peróxidos lipídicos son el patrón de oro, cuando se trata de probar el papel de los oxidantes en algún tipo de daño celular. 2) Medición de la concentración de antioxidantes: los resultados de diferentes estudios muestran que los niveles de antioxidantes pueden disminuir o aumentar en muchas enfermedades, por lo que al monitorearlos pueden ser utilizados como marcadores de enfermedad o para el seguimiento terapéutico. 3) Medición del estado antioxidante total: este método refleja el balance dinámico entre el sistema antioxidante y los prooxidantes y es beneficioso en un sinnúmero de enfermedades. Son incontables los esfuerzos que se realizan en el ámbito mundial para el desarrollo de nuevos y más sencillos métodos. Quién sabe si dentro de algunos años los médicos pueden indicar a sus pacientes, de forma rutinaria, junto al colesterol o la glucosa, la medición del daño oxidativo.Descriptores DeCS: ESTRES OXIDATIVO; ESPECIES DE OXIGENO REACTIVO.
A partir de que en 1954 la doctora argentina Rebeca Gerschman sugiriera por primera vez que los radicales libres eran agentes tóxicos y generadores de enfermedades,1 este campo de investigación estuvo confinado a la física, la química y la biología. Solo en los últimos años ha sido incorporado este tema al pensamiento clínico y son cada vez más los médicos que le prestan atención.
El oxígeno es esencial para la vida, pero posee una paradoja en los organismos aerobios. Este elemento desempeña una función importante como aceptor terminal de electrones durante la respiración celular, y constituye lo que se conoce como el "soporte de la vida"; pero también constituye el punto de partida para un tipo de daño celular conocido como "estrés oxidativo".
El desbalance en la producción de especies reactivas del oxígeno (EROs) y la defensa antioxidante provoca el "estrés oxidativo" que lleva a una variedad de cambios fisiológicos y bioquímicos, los cuales provocan el deterioro y muerte celular.
El "estrés oxidativo" puede provenir de:
- Una deficiencia del sistema de defensa antioxidante.
- Un incremento de la formación de EROs, cuya alta reactividad puede provocar: peroxidación lipídica, daño de la membrana celular, rotura del ADN, degradación proteica.
Especies reactivas del oxígeno (eros)
La mayor parte del oxígeno celular es reducido a través de reacciones enzimáticas, pero del 2-5 % escapa a esta reducción bivalente y elige la monovalente, y de ello resulta la formación de radicales libres de oxígeno (RLO), que no son más que átomos o moléculas que poseen un número impar de electrones en su órbita más externa, y que también se generan cuando ocurre una adición a un doble enlace. Son muy inestables y pueden reaccionar con otras moléculas, entregando o recibiendo un electrón.3,4 Últimamente prefiere llamársele EROs, para agrupar a algunos compuestos que como el peróxido de hidrógeno, no constituyen un verdadero radical.Estas EROs son moléculas altamente reactivas que atacan constantemente al cuerpo humano mediante reacciones bioquímicas de REDOX, que ocurren como parte normal del metabolismo celular o por la exposición a factores ambientales3-6 (fig) y se forman de la manera siguiente: La reducción univalente del O2 produce el radical superóxido (O2.-) cuya fuente más importante es la NADPH oxidasa durante el estallido respiratorio. La reacción univalente subsecuente, genera el peróxido de hidrógeno (H2O2) a través de la enzima superóxido dismutasa (SOD), que no es un RLO, pero tiene una alta capacidad oxidante por vía de la reacción de Fenton, y forma el radical hidroxilo (OH) que es varios miles de veces más reactivo que el O2.- y deriva fácilmente a la formación de nuevos radicales libres.
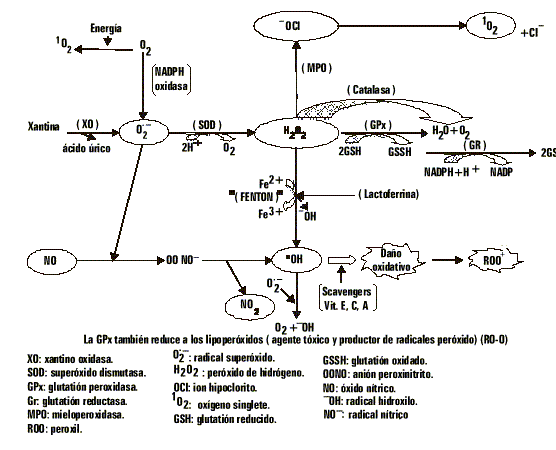
Las especies reactivas explicadas hasta ahora no son las únicas, existen otras como el peroxil (ROO.) y el alcoxil (RO.), resultantes de la acción del .OH, que constituyen la fase inicial de la peroxidación lipídica. También existe el oxígeno singlete (1O2), el óxido nítrico (NO.), el anión peroxinitrito (OONO.) y el ion hipoclorito (OCl) formado a partir del H2O2 por la enzima mieloperoxidasa (MPO).
Sistema de defensa contra las eros
Todos los seres vivos que utilizan el oxígeno para obtener energía, liberan EROs. Esta situación es incompatible con la vida, a menos que existan en las células mecanismos de defensa que las neutralicen. A estas defensas se les denomina antioxidantes y se considera como tal a cualquier sustancia que en concentraciones normales posea una afinidad mayor que cualquier otra molécula para interaccionar con un radical libre. El antioxidante, al colisionar con un RLO le cede un electrón, que se oxida a su vez y se transforma en un RLO débil no tóxico (la vitamina E). No todos actúan de esta forma, en el caso de las enzimas catalizan o aceleran reacciones químicas que utilizan substratos que a su vez reaccionan con los RLO.3,7,8Existe una primera línea de defensa antioxidante constituida por enzimas y scavengers o eliminadores de radicales.
Enzimas:
- La citocromo oxidasa está encargada de evitar la reducción univalente del oxígeno.
- La superóxido dismutasa está especializada en captar el radical anión superóxido mediante una dismutación y así convertirlo en peróxido de hidrógeno.
- Catalasa y peroxidasas ?glutatión peroxidasa (GPx) y glutatión reductasa (GR)? que neutralizan al H2O2 y lo convierten en agua.
- La vitamina E o a tocoferol neutraliza al radical .OH por su ubicación en las membranas donde su protección es particularmente importante.
- La vitamina C, por su carácter reductor, reacciona rápidamente en el O2. y con el .OH, también es captor del oxígeno singlete y del ion hipoclorito.
- El glutatión (GSH), además de captar el H2O2 como substrato de la GPx, también capta al 1O2 y al .OH.
- La transferrina y la ceruloplasmina son transportadoras de metales de transición, hierro y cobre respectivamente, que son generadores de RLO.
- Sistemas reparadores de biomoléculas que reparan el daño producido al ADN y que pudieran propiciar trastornos genéticos o cancerígenos.
- Sistemas eliminadores de componentes celulares oxidados como las macroxiproteinasas y las endonucleasas.
Cómo medir el daño oxidativo
El daño oxidativo se puede medir de forma directa o indirecta:Métodos directos
Medición de la concentración de agentes oxidantes. Durante los últimos años se ha tratado de medir la concentración de agentes oxidantes en el organismo, pero ha resultado difícil en muchos casos, por tener éstos un tiempo de vida media muy corto. El radical hidroxilo tiene una vida de 10-10. La espectrometría de la resonancia de la rotación (espín) de electrones es la única técnica analítica que mide directamente las EROs, pero su aplicación en el ser humano no es factible aún, además de ser muy caros los equipos necesarios.Recientemente ha sido desarrollado un equipo fotométrico con reactivos incluidos para determinar los niveles de RLO en sangre (anunciado en Clin Lab International 1998;22(5):12).
La prueba está basada en el hecho de que los metales de transición, una vez liberados de su forma quelante, forma en que generalmente se encuentran en el plasma y dentro de las células, tienen la capacidad de catalizar reacciones del tipo REDOX, cuyos productos son atrapados por derivados fenólicos, que resultan en la formación de una solución coloreada que puede ser medida espectrofotométricamente.
Métodos indirectos
- Determinación de productos terminales de la acción oxidante. Se han desarrollado métodos para medir algunas de las EROs, pero indirectamente, mediante los productos terminales de su acción oxidante sobre proteínas, ADN y lípidos.
Más de 12 metabolitos son producidos durante el ataque radicálico al ADN, pero sólo algunos han podido ser utilizados como marcadores de dicho ataque: thymidine glycol (TG) y 8-OH-2?--deoxiguanosin (OH8dg).13-16
La peroxidación lipídica es un proceso complejo, en el cual los ácidos grasos no saturados en los fosfolípidos de las membranas celulares son atacados por radicales que provocan la abstracción de un hidrógeno, formándose hidroperóxidos que son de difícil medición por degradarse rápidamente. No obstante, la lipoperoxidación constituye el patrón de oro cuando se trata de probar la función de los radicales libres en algún tipo de daño celular, y existen varias formas de medirla:
- Medición de compuestos que reaccionan con el ácido tiobarbitúrico: se basa en la reacción del tiobarbitúrico con el malondialdehído (MDA), producto este del desdoblamiento de los hidro-peróxidos, formándose así un color susceptible de ser medido directamente. Su análisis es usado por su buena practicabilidad y sencillez, pero le falta sensibilidad, por lo que se recomienda, para aumentarla, utilizar procedimientos fluorométricos o cromatográficos.17,18
- Medición de otros aldehídos procedentes también de la lipoperoxidación: el 4 hidroxinonenal, susceptible de ser medido por HPLC con detección ultravioleta.
- Medición de hidrocarburos volátiles en el aire expirado: principalmente etano y pentano, respectivamente derivados de los hidroperóxidos de los ácidos grasos insaturados de las series omega-3 y omega-6. No es un método invasivo, pero por lo complicado resulta muy molesto a los pacientes.
- Medición de compuestos fluorescen-tes de la lipoperoxidación: mide la lipofuscina, producto final de la destrucción oxidativa de los lípidos, pero sólo es útil para etapas tardías de la peroxidación.
- Medición de la concentración de antioxidantes. Los resultados de diferentes estudios muestran que los niveles de antioxidantes pueden disminuir o aumentar por diferentes enfermedades, por lo que al monitorearlos pueden ser utilizados como marcadores de enfermedades y para el seguimiento terapéutico.
- Medición del estado antioxidante total. El estado antioxidante refleja el balance dinámico entre el sistema antioxidante y los prooxidantes (EROs) y es utilizado como instrumento para estimar el riesgo de daño oxidativo.24
Se han desarrollado productos diagnósticos que conceden, según sus autores (Randox Free radicals and reactive oxigen species. Clin Lab International 1998;22(5):6), una exacta y rápida medición del rango de parámetros antioxidantes.
Dentro de esta amplia gama, los más comercializados son los que miden antioxidantes de tipo enzimáticos: superóxido dismutasa y catalasa.
Algunas casas comerciales también producen juegos de reactivos para determinar antioxidantes no enzimáticos como las vitaminas C, A y E, y la ubiquinona.19-21
Además se pueden medir antioxidantes de segunda línea, como son las enzimas reparadoras del daño al ADN, nombradas redoxiendonucleasas. 14,22,23
La medición del estado antioxidante es beneficiosa en un sinnúmero de enfermedades.
De la misma manera que son medidas innumerables sustancias relacionadas con el daño oxidativo, son múltiples los métodos empleados en tal medición y van desde la simple espectrofotometría, pasando por el HPLC, hasta llegar a la moderna quimioluminiscencia.18,24,25
En el país se ha desarrollado una cultura sobre este tema con la celebración de diversos eventos donde diferentes autores exponen periódicamente sus estudios. Algunos centros determinan las vitaminas C, A y E; otros la concentración de algunas enzimas antioxidantes como la Gpx, la catalasa26,27 y la SOD.
Son enormes los esfuerzos que se realizan a escala mundial para el desarrollo de nuevos y más sencillos métodos que nos llevarán a la mayor utilización de los datos aportados por la medición del daño oxidativo. Quién sabe si dentro de algunos años los médicos indiquen a sus pacientes, de forma rutinaria, junto al colesterol o la glucosa, la medición de este tipo de daño.
SUMMARY
The imbalance in the production of reactive oxygen species and the antioxidant defense brings about oxidative damage known as oxidative stress that leads to a series of physiological and biochemical changes which cause cell deterioration and death. This type of damage may be measured by direct or indirect methods. The direct methods comprise, among others, the measurement of oxidant agent concentrations, which is a difficult procedure because of the short lifetime of such agents and the high cost of equipment; therefore, it is necessary to measure them by indirect methods such as 1) Determination of terminal products from oxidant action on biomolecules: the methods to measure lipid peroxides are the golden pattern for proving the role of oxidants in any kind of cellular damage.2) Measurement of antioxidant concentrations: the results of several studies showed that the levels of antioxidants may diminish or increase in lot of diseases, so if they are monitored, they may serve as markers of diseases or for therapeutical follow-up. 3) Measurement of the total antioxidant state: it shows the dynamic balance between the antioxidant system and the prooxidants, being useful for a lot of diseases. Innumerable efforts are made worldwide for developing new and simpler methods. Who knows if, in the years to come, physicians will prescribe their patients as a routine procedure, the measurement of cholesterol and glucose together with the determination of oxidative stress.Subject headings: OXIDATIVE STRESS; REACTIVE OXYGEN SPECIES.
REFERENCIAS BIBLIOGRÁFICAS
1.Gershman R. Oxigen poisoning and x-irradiation: a mechanism in common. Science 1954;119:623-6.2.Fulbert JC, Cals MJ. Free radicals in clinical biology. Origin, pathogenic effect and defense mechanisms. Pathol Biol 1992;40:66-77.
3. Delatre J, Bonnefont-Rousselot D. Oxidative stress, free radicals and aging. Biotech Lab Int 1998;3(2):21-3.
4. Halliwell B, Gutteridge JMC. Free radicals in biology and medicine. 2 ed. Oxford: Clarendon; 1989:94-6.
5. Ansari KN. The free radicals-the hidden culprits-an update. Indian J Med Sci 1997;51(9):319-36.
6. Fernández V, Videla LA. Biochemical aspects of cellular antioxidant systems. Biol Res 1996;29(2):177-82. Block G. A role for antioxidants in reducing cancer risk. Nutr Res 1992;SO:207-13.
7. Jacob RA. The integrated autoxidant system. Nutr Res 1995;15:755-66.
8. Levin RL, Garland D, Oliver CN. Determination of carbonyl content in oxidatively modified proteins. Methods Enzimol 1990;186:464-78.
9. Butterfield DA, Howard BJ, Yatin S. Free radicals oxidation of brain proteins. Proc Natl Acad Sci USA 1997;94:674-8.
10. Maragon K, Deveraj S, Jialal I. Measurement of protein carbonyls in plasma of smokers and in oxidized LDL by an ELISA. Clin Chem 1999;45:577-8.
11. Buss H, Can T, Sluis K, Domigan N, Winterbourn C. Protein carbonyl measurement by a sensitive ELISA method. Free Radical Biol Med 1997;23:361-6.
12. Ghatak A, Brar MJ, Aganwal A, Boel N. Oxy free radical system in heart failure and therapeutic role of oral vitamin E. Int J Cardial 1996;57(2):119-27.
13. Shigenaga MK, Gimeno C, Ames BN. Urinary 8-hidroxi-2, deoxignanosine as a biological markers of in vivo oxidative DNA damage. Proc Nate Acad Sci USA 1989;86:9697-701.
14. Fraga CG, Shigenaga MK, Park JW. Oxidative damage to DNA during aging. Proc Natl Acad Sci USA 1990;87:4533-7.
15. Muscari C, Giaccari A, Giordano E. Role of reactive oxigen species in cardiovascular aging. Mol Cell Biochem 1996;160:150-66.
16. Visioli F, Colombo C, Balli C. Oxidation of individual fatty acids yields different profiles of oxidation markes. Biochem Biophys Res Commun 1998;245(2):487-9.
17. Reylly MP, Lawson JA, Fitz Gerald GA. Eicooanoids and Iooeicosanoids: indices of cellular function and oxidant stress. J Nutr 1998;128(2 Suppl):434 S-8S.
18. Alessio HM, Exercise-induced oxidative strees before and after vitamin C supplementation. Int J Soport Nutr 1997;7(1):1-9.
19. Lagendijk J, Ubbink JB, Vermaak WJ. Measurement of the ratio between the reduced and oxidized forms of coenzyme Q10 in human plasma as a posible marker of oxidative stress. J Lipid Res 1996;37(1):67-75.
20. Rimm EB. Vitamin E consumption and the risk of coronary heart disease in men. N Engl J Med 1994;328:1450-6.
21. Pacifici RE, Davies KJA. Protein lipid and DNA repair sistems in oxidative stress. Gerontology 1991;37:166-80.
22. Harnam D. Role of antioxidant nutrients in aging: over view. Age 1995;18:51-82.
23. Papas AM. Determinants of antioxidant status in humans. Lipids 1996;31(Suppl):577-82.
24. Takayama F, Egashira T. Assay for oxidative stress injury bu detection of luminol-enhanced chemiluminescence. Nippon Yakurigsako Zasshi 1998;111(3):177-86.
25. Céspedes EM, Hernández I, Llópiz N. Enzimas que participan como barreras biológicas para eliminar las radicales libres: II Catalasa. Rev Cubana Invest Biomed 1996;15(2):75-81.
26. Cisneros E, Pupo J, Céspedes EM. Enzimas que participan como barreras piriolóicas para eliminar las radicales libres: III. Glutatión peroxidosa. Rev Cubana Invest Biomed 1997;16(1):10-5.
Dr. Pedro Luis Pérez Castell. Instituto Superior de Medicina Militar "Dr. Luis Díaz Soto". Avenida Monumental, Habana del Este, CP 11700, Ciudad de La Habana, Cuba.
1 Especialista de I Grado en Laboratorio Clínico.
2 Doctor en Ciencias Médicas. Especialista de I Grado en Bioquímica Clínica. Investigador Auxiliar.














