My SciELO
Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Cubana de Medicina Militar
Print version ISSN 0138-6557
Rev Cub Med Mil vol.43 no.4 Ciudad de la Habana Oct.-Dec. 2014
ARTÍCULO DE REVISIÓN
Tumores del cordón espermático y las túnicas escrotales
Spermatic cord and scrotal tunica tumors
MSc. Tomás Lázaro Rodríguez Collar
Hospital Militar Central Dr. "Carlos J. Finlay". La Habana, Cuba.
RESUMEN
Entre los tumores paratesticulares, los del cordón espermático y las túnicas escrotales son los más frecuentes y en su mayoría benignos. En este trabajo se realizó la actualización del tema; se hizo énfasis en aspectos del diagnóstico y tratamiento. Se efectuó una búsqueda bibliográfica en libros de consulta, así como en las bases de datos de Hinari, PubMed/MEDLINE, LILACS y en el motor de búsquedas de Google, entre el 2009 y el 2013. Se utilizaron los términos del MeSH, en idiomas español e inglés: tumores paratesticulares, tumores intraescrotales, tumores del cordón espermático y tumores de las túnicas escrotales. Clínicamente, es básico realizar el diagnóstico diferencial con la hernia inguinal y con el hidrocele. El ultrasonido es el estudio de imagen de elección para su valoración inicial, aunque por su inespecificidad se recurre a la tomografía axial computarizada y a la resonancia magnética nuclear, para obtener más detalles. Para establecer el diagnóstico de certeza, se recomienda la biopsia por congelación transoperatoria, vía inguinotomía. La citología aspirativa con aguja fina, es una opción confiable para clasificarlos si existe sospecha preoperatoria de benignidad, es posible la tumorectomía en los benignos y se evita la orquiectomía radical con ligadura alta del cordón espermático, indicada para los malignos. Una vez confirmado el diagnóstico histológico y el estadio, el manejo debe ser onco-urológico para decidir la conveniencia de tratamientos adyuvantes. Los tumores malignos recurren con mucha frecuencia y a veces tardíamente, lo que obliga al seguimiento estricto y prolongado de estos pacientes.
Palabras clave: tumores paratesticulares, tumores intraescrotales, tumores del cordón espermático, tumores de las túnicas escrotales, citología aspirativa con aguja fina, inguinotomía exploratoria, biopsia por congelación transoperatoria.
ABSTRACT
Among the paratesticular tumors, the spermatic cord and the scrotal tunica tumors are the most frequent and benign. This paper updated this topic, making emphasis in diagnosis and treatment issues. A literature search was made in books and in Hinari, PubMed/MEDLINE, LILACS databases and in Goggle in the period of 2009 through 2013.
The MeSH terms in English and Spanish were used: paratesticular tumors, intrascrotal tumors, spermatic cord tumors and scrotal tunica tumors. From the clinical viewpoint, it is fundamental to make the differential diagnosis with the inguinal hernia and hydrocele. The US testing is the imaging study of choice for initial assessment, although its lack of specificity makes specialists to resort to computer axial tomography and nuclear magnetic resonance to have more details of the case. For the purpose of reaching a precise diagnosis, the transoperative freezing biopsy through inguinotomy was recommended. The fine needle aspiration cytology is a reliable option to classify them if the case is suspected of benignancy preoperatively. It is possible to perform tumorectomy in the benign tumors, thus avoiding radical orchiectomy with upper ligature of the spermatic cord, which is the indicated approach to the malignant ones. Once the histological diagnosis and the staging are confirmed, the management should be oncological and urological in order to decide whether the adjuvant treatments are convenient or not. The malignant tumors recurred very frequently and sometimes in later phases, so these patients must be strictly followed-up for a long time.
Keywords: paratesticular tumors, intrascrotal tumors, spermatic cord tumors, scrotal tunica tumors, fine needle aspiration cytology, exploratory inguinotomy, transoperative freezing biopsy.
INTRODUCCIÓN
Los tumores paratesticulares representan entre el 7 y el 10 % de las tumefacciones intraescrotales. De estos, los del cordón espermático (TCE) y las túnicas escrotales (TTE), representan entre el 75 y el 90 % del total, son hasta el 70 % benignos.1 Los principales diagnósticos diferenciales incluyen: hernia inguinal, hidrocele y epididimitis crónica.2
Se caracterizan por ser unilaterales, de consistencia firme, crecimiento lento y tamaño variable, oscilan entre 1,5 y 30 cm. Con frecuencia son indoloros y a veces el paciente acude al médico por sensación de peso escrotal. El ultrasonido (US) es el estudio de imagen primario empleado para su apreciación, con una sensibilidad del 95 al 100 %, mediante el cual estos se distinguen de los tumores del testículo y del epidídimo. No obstante, los hallazgos ecográficos son de costumbre variables e inespecíficos, por lo que se necesita de la tomografía axial computarizada (TAC) y de la resonancia magnética nuclear (RMN), para definir con más precisión la localización exacta del tumor, las características morfológicas del tejido y determinar su extensión a órganos vecinos.3,4
En general, se considera que la exéresis local en los benignos y la orquiectomía radical con ligadura alta del cordón espermático, con márgenes microscópicos libres de tumor para los malignos, constituye la base fundamental del tratamiento. La recurrencia de los malignos es muy frecuente, lo que obliga a largos períodos de vigilancia. La quimioterapia y la radioterapia adyuvantes para estos últimos, son aun controversiales, aunque existan indicaciones precisas según la edad del paciente, el tipo histológico y el estadio de la enfermedad.3,4
La rareza de estos tumores hace que no existan publicaciones de grandes series de casos, sobre todo de los malignos, lo que dificulta establecer consensos sobre el manejo terapéutico de estos. Por tal motivo se realizó la presente actualización, con vistas a profundizar en aspectos del diagnóstico y tratamiento de los tumores más frecuentes del cordón espermático y las túnicas escrotales.
Se efectuó una búsqueda bibliográfica en libros de consulta, así como en las bases de datos de Hinari, PubMed/MEDLINE, LILACS y en el motor de búsquedas de Google, entre el 2009 y el 2013. Se utilizaron los términos del MeSH, en idiomas español e inglés: tumores paratesticulares, tumores intraescrotales, tumores del cordón espermático y tumores de las túnicas escrotales.
SÍNTESIS DE LA INFORMACIÓN
RECUENTO ANATÓMICO DEL CORDÓN ESPERMÁTICO Y LAS TÚNICAS ESCROTALES
CORDÓN ESPERMÁTICO
El cordón espermático es una estructura de la anatomía masculina, de forma cilíndrica, que toma su nombre a partir de su formación en el anillo inguinal externo o profundo, atraviesa el canal inguinal y se dirige de atrás hacia adelante y de arriba hacia abajo, termina en el interior de la bolsa escrotal, a nivel de la porción media del contorno posterior del testículo (Fig. 1).
Está compuesto por una serie de elementos rodeados por tejido conjuntivo laxo, a saber: tres arterias: la testicular, la cremasteriana y la del conducto deferente; tres nervios: rama genital del genito-femoral, fibras aferentes autonómicas y viscerales, y el ilioinguinal; el plexo venoso pampiniforme, el conducto deferente y vasos linfáticos.5
TÚNICAS ESCROTALES
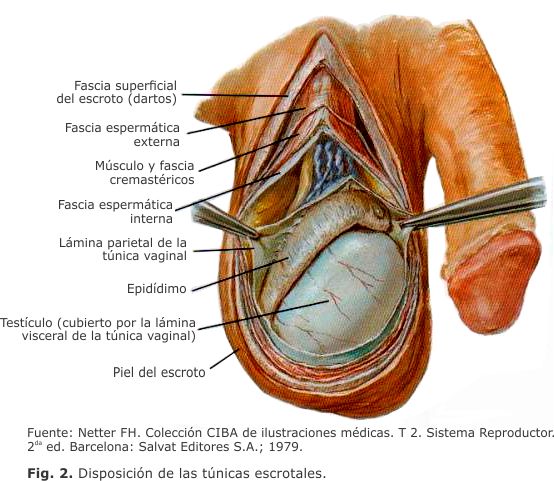
Las túnicas escrotales están localizadas por debajo de la piel del escroto, envuelven a las diferentes estructuras del cordón espermático en la mayor parte de su recorrido inguino-escrotal. A continuación de la piel se sitúa el dartos, un estrato musculoso delgado muy vascularizado. Luego se ubican varias capas músculo-aponeuróticas, que derivan de la pared abdominal y acompañan al testículo en su trayecto de descenso hacia la bolsa escrotal, a saber: fascia espermática externa, músculo cremáster, fascia espermática interna y las hojas parietal y visceral, de la túnica vaginal (Fig. 2).5
TUMORES DEL CORDÓN ESPERMÁTICO
Los TCE se clasifican en primarios y secundarios o metastásicos, según se formen a partir de estructuras propias o provengan de tejidos de otro órgano del cuerpo. A su vez los primarios se subdividen en benignos y malignos, de acuerdo con el tipo de tejido que presenten en el análisis histológico.
1. Tumores primarios
a) Benignos
- Lipoma
- Leiomioma
- Linfagioma
- Quiste dermoide
- Rabdomioma
- Fibroma
- Angiofibroma
- Angiofibrolipoma
- Neurofifroma
- Hamartoma fibroso
- Ganglioneuromab) Malignos
- Rabdomiosarcoma
- Leiomiosarcoma
- Liposarcoma
- Fibrohistiocitoma maligno
- Fibrosarcoma
2. Tumores secundarios o metastásicos
- Tracto gastrointestinal (estómago y colon)
- Páncreas
- Próstata
- Riñón
TUMORES BENIGNOS
Lipoma
Es el más común de todos los tumores,1,3,4 representa hasta el 45 % del total.2 Es más frecuente entre la cuarta y la quinta décadas de vida; constituye un hallazgo habitual durante la cirugía por hernia inguinal, entidad nosológica con la que se debe establecer el diagnóstico diferencial.2,6-8
Clínicamente se caracteriza por aumento de volumen a nivel del canal inguinal, inclusive se puede extender al interior del hemiescroto correspondiente. A la palpación son indoloros, renitentes, móviles y de consistencia blanda, acompaña en muchas ocasiones a una hernia inguinal.2 La mayoría son de pequeño tamaño, oscilan entre 1 y 3 cm, aunque los hay de 10 cm o más y se les considera entonces como gigantes.6,7 Su peso puede oscilar entre unos pocos gramos hasta algo más de 3 km. En otras ocasiones no se asocian a saco herniario y pueden ser causa de dolor inguinal crónico en algunos pacientes.8
En el US tienen generalmente un aspecto hiperecogénico y homogéneo; aunque la gran gama de imágenes informadas por este estudio no permiten establecer el diagnóstico preoperatorio con certeza.3 Otros estudios de imágenes como la TAC y la RMN podrían ayudar a dar un diagnóstico más certero. En la primera los lipomas se presentan como lesiones de baja atenuación y, en la segunda, se muestran como imágenes hiperintensas en T 1 y con baja señal en imágenes con supresión de la grasa.
Como la mayoría de las veces su hallazgo es incidental, en el transcurso de una intervención por hernia inguinal,6,8 se extirpa de una vez y, en muchas ocasiones, no se envía a estudio histopatológico, el cirujano se apoya en las características macroscópicas del tumor. En un artículo consultado,6 con el que concuerda el autor, se plantea que los lipomas de la región inguinoescrotal, una vez diagnosticados, deben ser extirpados y sometidos a estudio anátomo-patológico, sobre todo aquellos de gran tamaño y larga evolución, los cuales pudieran degenerar en un liposarcoma. También a todo TCE de aspecto lipomatoso en los estudios de imágenes, que durante el acto quirúrgico tengan consistencia aumentada a la palpación, cambios de coloración o signos infiltrativos locales, se les debe realizar biopsia por congelación, con vistas a descartar malignidad, ya que de confirmarse esta la conducta quirúrgica varía sustancialmente.
Macroscópicamente, se caracterizan por ser de color amarillo claro, redondeados y polilobulados. Al corte son blandos y de superficie lobulada. Histológicamente, se describe la presencia de adipocitos dispuestos en lóbulos, junto a áreas fibrosas dispersas.
Se han notificado casos en los cuales estos tumores han recidivado luego de su extirpación, y en el estudio microscópico, se han encontrado adipocitos maduros, células fusiformes con núcleos irregulares, junto a elementos lipoblásticos multivacuolados y pleomórfico disperso. En estos pacientes se ha diagnosticado tumor lipomatoso atípico, y en ellos la inmunohistoquímica refleja que la mayoría de las células adiposas tienen proteína S-100 positiva, mientras que el componente fusocelular puede serlo para el CD34.8
Leiomioma
El leiomioma es un tumor benigno que se origina a partir de cualquier estructura que contenga músculo liso.9 Dentro del sistema genitourinario, son más frecuentes a nivel de la cápsula renal,10,11 y ocupan el segundo lugar dentro de los TCE.4,6 Los leiomiomas del cordón espermático afectan, principalmente, a hombres de piel blanca entre la 4ta y la 9na décadas de la vida.11,12
Desde el punto de vista clínico se trata de una masa tumoral, a nivel de la región inguinal, de consistencia fibroelástica, límites imprecisos e indoloros y de crecimiento lento. En el US se reportan como masas hipoecogénicas y homogéneas, aunque también pueden tener apariencia heterogénea con calcificaciones interiores.12
Microscópicamente, son lobulados y al corte, la superficie de sección es blanca y brillante, de aspecto fasciculado y consistencia fibroelástica.16 En el estudio microscópico, el tumor está constituido por haces entrelazados de células de músculo liso. Las células tumorales son ahusadas, contienen un nucléolo central y no presentan ni actividad mitótica ni atipia nuclear. Desde el punto de vista inmunohistoquímico, son positivos para vimentina, desmina y actina, son negativos para la proteína S-100 y la queratina.9
La conducta terapéutica a seguir con el leiomioma es su exéresis total. En muchas ocasiones simulan hernias inguinales, son hallados en el transcurso de intervenciones quirúrgicas por ese motivo.11,12
Linfangioma
El linfangioma es el tercer TCE benigno por orden de frecuencia.2 Se trata de malformaciones congénitas del sistema linfático, muy raras, pero más frecuentes en la infancia. Su localización habitual es en el cuello y en la axila y, ocasionalmente, en el mediastino, retroperitoneo, muslo, perineo, escroto y cordón espermático; en las tres últimas localizaciones son extremadamente infrecuentes.13-15
El linfangioma se forma como resultado del drenaje inadecuado de la linfa, provocado por el secuestro o atresia de vasos linfáticos, o la falta de comunicación entre estos y las venas, con la consecuente dilatación de los conductos y la formación de masas quísticas. También se describen linfangiomas adquiridos, debido a la obstrucción de los vasos linfáticos secundaria a inflamación, a traumatismos o a la degeneración de estos.13-15 El linfangioma se clasifica en simple, cavernoso y quístico, en dependencia del tamaño de las dilataciones linfáticas. El tipo quístico es el que más abunda en la región inguinal.13,14
Desde el punto de vista clínico es uno de los diagnósticos diferenciales a tener en cuenta ante los tumores de la región inguino-escrotal, pues en muchas ocasiones puede confundirse con hernia, varicocele, hidrocele, quistes del epidídimo o entidades que conforman el síndrome escrotal agudo.13-15 Se caracteriza por la presencia de un aumento de volumen por debajo de la piel, a veces doloroso, de consistencia blanda y crecimiento lento.14,15
En el US se describe como una lesión multiquística extratesticular con tabiques en su interior. Se ha informado además la presencia de ecos internos, debido a detritos celulares o a hemorragias intralesionales.15 También se plantea que la TAC y la RMN pueden aportar información valiosa, sobre todo en referencia a la extensión del linfangioma y su relación con los tejidos adyacentes, datos importantes para planificar la intervención quirúrgica.14
El tratamiento de elección para esta afección es su exéresis total en bloque, que incluye la piel suprayacente a la lesión. De no realizarse la extirpación total, el índice de recidivas es muy alto.13-15
Quiste dermoide
El quiste dermoide, también conocido como teratoma quístico maduro, es una entidad extremadamente rara, que debe tenerse en cuenta en los diagnósticos diferenciales de las masas tumorales de la región inguino-escrotal.16-18 Se diagnostica con mayor frecuencia en la adultez, aunque existen informes de casos en niños.16
Se forman cuando la piel y sus estructuras quedan atrapadas durante el desarrollo fetal, a nivel de las líneas de cierre embrionario.17 Los sitios de localización más frecuentes son la cara, el cuello y el cuero cabelludo. Otras zonas menos usuales incluyen: intracraneales, intraespinales, paraespinales, escroto, pene, ovario y epiplón. Se manifiesta como una masa inguinal o inguino-escrotal irreductible, blanda y generalmente indolora. En el US se reporta como una lesión quística con ecos internos. En su interior siempre existe epitelio escamoso estratificado y apéndices de la piel, como folículos pilosos, pelo y glándulas sudoríparas y sebáceas. Además se ha descrito la presencia de otros tipos de tejidos como: cartílago, hueso, ojo, uñas, dientes y tiroides.17,18
El tratamiento del quiste dermoide consiste en su extirpación quirúrgica, tiene un excelente pronóstico al tratarse de una afección benigna que no produce recidivas.16-18
TUMORES MALIGNOS
Rabdomiosarcoma
El rabdomiosarcoma (RMS) es el sarcoma más frecuente del cordón espermático, predomina en las dos primeras décadas de la vida, excepcional en el adulto.3,19 En la infancia es más común entre el primer y el quinto años de vida20 y tiene otro pico alrededor de los 18 años.21
Se localiza en el canal inguinal o intraescrotal. Se caracteriza por ser unilateral, de crecimiento progresivo, mayoritariamente indoloro, que no produce fiebre, su tamaño oscila entre 1 y 20 o 30 cm y en ocasiones se acompaña de hidrocele.3,20 A la palpación tiene consistencia firme y superficie irregular, aunque casi siempre se le logra distinguir del testículo y del epidídimo. Según el tamaño que alcance puede llegar al anillo inguinal externo.19
Histológicamente se describen tres variedades, a saber: embrionario, alveolar y pleomórfico. El primero de ellos es el más frecuente en la infancia (60 %)20 y el que tiene mejor pronóstico; es el alveolar el de peor augurio.20,22,23
En el US se presenta una masa independiente del testículo y del epidídimo, de ecogenicidad variable, con predominio heterogéneo, debido a zonas de hemorragia y necrosis intratumorales.21,23,24 Al aplicar el efecto Doppler se detecta incremento del flujo sanguíneo interno.3,20 La TAC y la RMN de las regiones torácica, abdominal e inguino-escrotal, se emplean sobre todo para conocer la extensión de la enfermedad, la cual puede producirse tanto localmente como a distancia, por vía linfática a los nódulos pélvicos y retroperitoneales, y por vía hematógena fundamentalmente a pulmón, hígado y hueso.3,21 Aproximadamente un tercio de los casos tienen metástasis a distancia, en el momento del diagnóstico.20,23
El diagnóstico definitivo del RMS, como el del resto de los sarcomas, es histológico. Aunque no está plenamente establecido,3 se ha informado la realización de la citología aspirativa con aguja fina para el diagnóstico preoperatorio de este tumor.25 El autor de este artículo apoya la realización de este proceder diagnóstico, cuando las manifestaciones clínicas del paciente y los estudios de imágenes, hagan sospechar la presencia de una lesión benigna. Así, de diagnosticarse una lesión benigna, se realiza solamente su exéresis y se evitan orquiectomías radicales innecesarias. Cuando no sea así, lo apropiado es obtener un fragmento del tumor mediante inguinotomía para biopsia por congelación, con previo pinzamiento del cordón espermático.
Una vez confirmado el diagnóstico histológico, la conducta terapéutica definitiva consiste en la orquiectomía radical con ligadura alta del cordón espermático, en la cual se debe extirpar la mayor cantidad de tejido peritumoral posible. Además, es muy importante conocer si existe o no lesión en los extremos del tumor, con vistas a evitar la recidiva local, tan frecuente y temida en el RMS, que obligaría a una reintervención quirúrgica futura empobreciendo el pronóstico del paciente. Esto hace que el seguimiento de los pacientes tenga que ser por largos periodos de tiempo.19,25 Se debe hacer la hemiescrotectomía simultánea, en los pacientes en que exista infiltración de la pared escrotal o en los casos en que se haya tenido que utilizar la escrototomía, al ser imposible la extracción de la pieza por vía inguinal debido a su gran volumen.3,20,21
El papel de los tratamientos adyuvantes, como la quimio y radioterapia, no está del todo definido.3 Algunos autores plantean que en niños y adolescentes, la terapia multimodal (orquiectomía radical, quimioterapia y radioterapia) se debe aplicar a todos los casos, ya que favorece un mejor pronóstico y se curan muchos pacientes.19,21,26 Otros recomiendan los dos tratamientos adyuvantes para todos los adolescentes, independientemente del estadio, y en los niños con diseminación retroperitoneal de la enfermedad.20,25
En pacientes adultos, la radioterapia se reserva para los casos con márgenes positivos de tumor y cuando existe recidiva local luego de la cirugía.3,27 La quimioterapia está indicada en todos los pacientes, con independencia de la etapa de la enfermedad.3,23
Leiomiosarcoma
El leiomiosarcoma (LMS) es un tumor raro y ocupa el segundo lugar en frecuencia dentro de los sarcomas del cordón espermático, representando cerca del 10 % del total.28,29 Desde el punto de vista topográfico, el LMS de subdivide en tres grupos según el American Joint Committee on Cancer Staging System: de tejidos blandos profundos, cutáneo y subcutáneo, y de origen vascular; el LMS paratesticular pertenece al de los tejidos blandos profundos.29
Aunque no se conoce con certeza el origen del LMS, se cree que se puede formar por la degeneración neoplásica de un leiomioma preexistente, a partir de fibras de músculo liso que forman parte de estructuras del cordón espermático, como: músculo cremáster, conducto deferente y los vasos sanguíneos.30
Histológicamente se clasifican en grados I, II y III, de acuerdo con la cantidad de mitosis, al pleomorfismo nuclear y a la existencia o no de necrosis tumoral, son los de más alta gradación los más agresivos y de peor pronóstico. En los estudios de inmunohistoquímica, los LMS muestran positividad frente a actina, desmina, CD 34, miogenina, Ki-67, proteína S-100 y citoqueratinas.28,31
Son más frecuentes en adultos entre la sexta y la octava décadas de vida. Clínicamente se manifiestan como masas inguinales, intraescrotales o en ambas regiones, de crecimiento lento, indoloras, irreductibles a la presión manual y de consistencia firme, que usualmente se acompañan de hidrocele. Los diagnósticos diferenciales más frecuentes a tener en cuenta incluyen: la hernia inguinal, el hidrocele idiopático de la vagina y los tumores del testículo y del epidídimo.30,31
En el momento del diagnóstico su tamaño oscila entre los 2 y 5 cm, aunque se han descrito casos de mayores dimensiones.28,29,31 Las vías principales de diseminación son a través del torrente linfático a los ganglios iliacos externos y comunes, hipogástricos y retroperitoneales; por vía hematógena, sobre todo a los pulmones, y por extensión local infiltran el escroto y al canal inguinal y a la pelvis, siguen el trayecto del conducto deferente.29
En el US se describen como una masa heterogénea y con alta vascularización al aplicar el efecto Doppler. La TAC se emplea para conocer la extensión local del tumor y si existen metástasis abdominales. No obstante, ni en el US ni en la TAC, existen imágenes específicas del LMS.29
El tratamiento del LMS es la orquiectomía radical con ligadura alta del cordón espermático.19,28,29,32 Se recomienda la resección amplia del tumor y los tejidos adyacentes, dado el alto índice de recurrencias locales. Se señalan como factores que aumentan la recurrencia: el tamaño del tumor, su localización en la región inguinal y los márgenes positivos de la pieza quirúrgica. El seguimiento debe ser por largos periodos de tiempo. Aunque en sentido general, el papel de los tratamientos adyuvantes para el LMS, no está del todo claro,31 se plantea que la radioterapia adyuvante, ha disminuido el índice de recurrencias del LMS; sin embargo, otros consideran que, como la mayoría de las metástasis se producen por vía hematógena, la radioterapia profiláctica carece de sentido. La quimioterapia se reserva para la enfermedad metastásica y para los LMS de alto grado.29
Liposarcoma
El liposarcoma (LPS) sigue en orden de frecuencia al LMS, representa del 3 al 7 % de los sarcomas del cordón espermático.33,34
Se presentan sobre todo en la sexta y séptima décadas de vida,1,2,35 con un rango de edades que va de 16 a 90 años.2,33-35
Según la Organización Mundial de la Salud36 se clasifican en cinco subtipos, a saber: bien diferenciado, indiferenciado, pleomórfico, mixto y mixoide; es este último el más frecuente con hasta un 40 % del total.34 Se originan a partir de células mesenquimatosas primitivas; cerca del 70 % se asientan en las extremidades y en el retroperitoneo.2 En muy pocos pacientes con LPS, se ha informado el antecedente de traumatismo o cirugía escrotal previos.34
Clínicamente se identifican como masas tumorales inguino-escrotales de crecimiento lento (desde semanas a más de 10 años),2 indoloras, lobuladas y cuyo tamaño puede oscilar entre 1,5 y 30 cm o más. Muchas veces se les confunde con hernias y con hidrocele.1,2,34,35
En el US se muestran como tumores sólidos, hiperecoicos y heterogéneos.2,35 En la TAC presentan baja densidad, propia del tejido adiposo, por lo que no ofrece hallazgos contundentes para diferenciar al LPS del lipoma.35 Se le emplea también en el pre y posoperatorio, para conocer si existen metástasis intrabdominales o recidivas locales.34 La RMN ofrece información valiosa referente a la extensión local del LPS.33,35
El LPS se propaga primeramente por infiltración local al cordón espermático, para finalmente llegar al canal inguinal y al interior de la cavidad abdominal.1 La diseminación a distancia ocurre primero por vía hematógena y luego a través del sistema linfático.
El tratamiento inicial del LPS es quirúrgico, debe realizarse la orquiectomía radical con ligadura alta del cordón espermático.1,33,34,37 La resección debe ser localmente amplia, con vistas a lograr márgenes libres de tumor, y así evitar las recurrencias locales tan frecuentes en los LPS, sobre todo en los de alto grado; esto hace que los casos deban ser evolucionados por largo tiempo.35
El LPS se considera un tumor relativamente radiosensible y se estima que la radioterapia es útil para prevenir las recidivas locales. La radioterapia se recomienda para aquellos pacientes con evidencias de tener LPS agresivos, es decir, cuando no existen márgenes libres, recurrencia local, alto grado o existe diseminación linfática. Debido a que habitualmente los LPS presentan quimiorresistencia, no existe consenso en cuanto al beneficio de la quimioterapia adyuvante para estos.34
TUMORES SECUNDARIOS O METASTÁTICOS
Los tumores secundarios o metastásicos del cordón espermático son en extremo infrecuentes y tienen siempre mal pronóstico.38-41 Para algunos autores, los sitios neoplásicos primarios más frecuentes son: el tracto gastrointestinal, páncreas, próstata y riñones;38 otros plantean que son el estómago y la próstata, en ese orden, los que tienen la más alta incidencia.39
Lo habitual es que reaparezcan meses o años después de haberse diagnosticado y tratado el sitio primario;38-41 aunque se han descrito casos de sincronismo con la fuente originaria del cáncer.39 En el caso de los tumores de origen renal, se plantean dos posibles vías de diseminación tumoral, a saber: retrógrada a través de las venas espermáticas y directamente a través de un proceso vaginal peritoneo-escrotal permeable.40,41
Clínicamente se presentan como masas inguinales o inguino-escrotales, no dolorosas, de consistencia dura y fijas a los tejidos adyacentes.38 En el US se describen como lesiones sólidas, heterogéneas e hipoecogénicas.38-40 En la TAC contrastada aparecen como lesiones sólidas con realce heterogéneo. En la RMN muestran hiperintensidad en imágenes ponderadas en T 2, isointensidad en imágenes ponderadas en T 1 y realce heterogéneo en el estudio ponderado en T 1 contrastado.38
La conducta a seguir consiste en la orquiectomía radical con ligadura alta del cordón espermático, con márgenes libres de tumor.38-41 Una vez confirmado el origen metastásico de la lesión, por la histología, los pacientes deben ser evaluados por el oncólogo para establecer el tratamiento adyuvante apropiado según el caso.
Tumores de las túnicas escrotales
Los TTE son muy raros. Dentro de ellos se encuentran los benignos, entre los que se destaca el pseudotumor fibroso (PTF), y los malignos, el más común es el mesotelioma maligno (MM).
Pseudotumor fibroso
El PTF es un tumor raro y tiene varias denominaciones en la literatura consultada: periorquitis crónica proliferativa, pseudotumor inflamatorio, proliferación fibrosa difusa y nodular, funiculitis proliferativa, periorquitis fibromatosa, fibroma, tumor fibroso benigno paratesticular, mesotelioma fibroso, periorquitis pseudofibromatosa, fibrosis peritesticular inespecífica y periorquitis reactiva.42,43
Su localización más frecuente es en las túnicas escrotales, sobre todo en la vaginal, aunque también se puede encontrar en el epidídimo, túnica albugínea y cordón espermático.44,45
La causa no se conoce aun, aunque se le asocia a traumatismo, infecciones, cirugías escrotales previas y a hidrocele de larga evolución que pudieran provocar lesiones reactivas locales.42,46,47 Estudios ultraestructurales y de inmunohistoquímica, en los primeros casos informados, sugirieron la existencia de una proliferación localizada de miofibroblastos, derivados tanto de fibroblastos convencionales como de células mesenquimales primarias.43 No obstante, hallazgos recientes plantean la posibilidad de que el PTF esté dentro de las enfermedades relacionadas con un trastorno de IgG4, tales como: fibrosis retroperitoneal, pancreatitis y colangitis esclerosante, tiroiditis de Riedel y sialoadenitis esclerosante.48,49
Este tumor es más frecuente entre la tercera y la cuarta décadas de vida, aunque se pueden presentar a cualquier edad.47 Los pacientes refieren aumento de volumen indoloro y de crecimiento lento, en uno de los hemiescrotos. Al examen físico se constata la presencia de un tumor de consistencia dura, en la mayoría de los casos es difuso e infiltra el tejido vecino, y no permite delimitarlo del testículo y el epidídimo;43,46 en otras ocasiones es localizado y bien definido, a forma nodular, de diferentes dimensiones, oscila entre 0,5 y 8 cm.42,47
En el estudio microscópico del PTF se muestra la presencia de fibroblastos y tejido hialinizado, en un estroma con abundante vascularización, haces de fibras colágenas y focos de calcificación; también se han descrito la osificación y la degeneración mixoide. Los estudios de inmunohistoquímica señalan la presencia de fibroblastos, positividad para vimentina, actina específica para músculo liso, actina y negatividad para la proteína S-100, keratina y desmina.47
Desde el punto de vista imaginológico se informa en el US, la presencia de una masa sólida hipo o hiperecoica, según la cantidad de tejido fibroso que posea, y que afecta a las túnicas paratesticulares.45 Al aplicar el efecto Doppler existe aumento de la vascularización característica del PTF, que podría confundirse con un tumor maligno.50 No obstante, la mayoría de los autores consultados plantean que los hallazgos ecográficos no son específicos.42,46,47,49 En la RMN muestran, usualmente, señales de baja intensidad en imágenes T 1 y T 2.49
El diagnóstico de certeza del PTF se obtiene mediante el estudio histológico. La biopsia por aspiración con aguja fina es una opción fiable, poco invasiva y rápida, que en manos de un patólogo experimentado ayuda a clasificar este tumor, lo que posibilitaría su exéresis y evitaría la realización de orquiectomías radicales.47 No obstante, en ocasiones la dureza de esta afección impide tomar la muestra adecuada, por lo que para confirmar el diagnóstico se tiene que recurrir a la biopsia por congelación transoperatoria, a través de una inguinotomía con pinzamiento alto del cordón espermático.44,47 Otras veces la extensión difusa de la lesión a lo largo de las túnicas escrotales, impide su resección y conservar la gónada, tiene que realizarse la orquiectomía irremisiblemente.46
Mesotelioma maligno
El MM es un tumor infrecuente que se desarrolla en las cavidades corporales tapizadas por mesotelio, como la pleura, el peritoneo y con menos frecuencia en el pericardio.51-54 La túnica vaginal que se forma por una protrusión del peritoneo a través del canal inguinal, es una localización muy poco frecuente, representa menos del 1 % de todos los MM.51,52 Su rareza obliga a descartar primero el posible origen en pleura y peritoneo, antes de asegurar que se trata de un MM primario de las túnicas escrotales.52
Se informa como factor predisponente para el desarrollo del MM, la exposición crónica al asbesto hasta en un 30-40 % de los casos, aunque se han notificado pacientes más jóvenes, que nunca estuvieron expuestos a las fibras de asbesto.54 También se le ha asociado a traumatismos previos y a hidrocele de larga evolución.51-53 Se presenta con más frecuencia entre los 50 y los 70 años,53 con un rango de edades que va de 26 a 74 años.52 Se informa que los pacientes menores de 60 años tienen más oportunidades de sobrevivir a un MM, que los de mayor edad.52
El MM se clasifica histológicamente en tres tipos: epiteliode, sarcomatoide y bifásico; el 75 % de los MM paratesticulares son del tipo epiteliode.51
Los pacientes aquejan una masa escrotal indolora, de consistencia firme y superficie irregular que se ubica en posición intraescrotal, independientemente del testículo. La obtención de una muestra de biopsia transoperatoria para estudio histológico por congelación, es determinante para clasificar la naturaleza del MM. La inmunohistoquímica es un arma muy importante para confirmar el diagnóstico; se plantea por algunos autores, que la mayoría de los MM expresan positividad para citoqueratinas, vimentina, EMA y calretinina.51
La orquiectomía radical con ligadura alta del cordón espermático, es el tratamiento de elección para los MM sin extensión metastásica. Las recidivas tumorales locales son habituales; más del 60 % de los pacientes las presentan dentro de los dos primeros años de operados, empobreciendo significativamente el pronóstico de vida.51,53 La quimioterapia y la radioterapia adyuvantes, solas o combinadas, se han ensayado en pacientes con enfermedad diseminada; se han obtenido disímiles resultados, pero la insuficiente cantidad de series con numerosos casos no ha permitido arribar a conclusiones definitivas.51
CONCLUSIONES
Se concluye que desde el punto de vista clínico, es básico realizar el diagnóstico diferencial de los TCE y los TTE, con la hernia inguinal y con el hidrocele. El US es el estudio de imagen inicial para su valoración, aunque por su inespecificidad se recurre a la TAC y a la RMN para obtener más detalles. Para establecer el diagnóstico de certeza, se recomienda la biopsia por congelación transoperatoria vía inguinotomía. La citología aspirativa con aguja fina, es una opción confiable para clasificarlos si existe sospecha preoperatoria de benignidad; es posible la tumorectomía en los benignos y se evita la orquiectomía radical con ligadura alta del cordón espermático, indicada para los malignos. Una vez confirmado el diagnóstico histológico y el estadio, el manejo debe ser onco-urológico para decidir la conveniencia de tratamientos adyuvantes. Los tumores malignos recurren con mucha frecuencia y a veces tardíamente, lo que obliga al seguimiento estricto y prolongado de estos pacientes.
REFERENCIAS BIBLIOGRÁFICAS
1. Fernández F, García HA. Liposarcoma gigante desdiferenciado de cordón espermático. Arch Esp Urol [Internet]. 2009 [citado 14 Dec 2013];62(9):[aprox. 5 p.]. Disponible en: http://dx.doi.org/10.4321/S0004-06142009000900012
2. Rodríguez Tardido A, Guzmán Martínez-Valls PL, Miñana López B. Patología intraescrotal benigna. En: Castiñeiras Fernández J. Libro del Residente de Urología. Asociación Española de Urología. Madrid: Gráficas Marte, SL; 2007. p. 915-26.
3. Rodríguez D, Olumi AF. Management of spermatic cord tumors: a rare urologic malignancy. Ther Adv Urol [Internet]. 2012 Dec [cited 2013 Dec 11];4(6):[about 9 p.]. Available from: http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3491755/
4. Román Birmingham PI, Navarro Sebastián FJ, García González J, Romero Barriuso G, Guijarro Espadas A. Tumores paratesticulares. Descripción de nuestra casuística general a lo largo de un período de 25 años. Arch Esp Urol [Internet]. 2012 [citado 14 Dec 2013];65(6):[aprox. 7 p.]. Disponible en: http://www.redalyc.org/articulo.oa?id=181025863011
5. Tanagho EA. Anatomía del aparato genitourinario. En: Tanagho EA, McAninch JW, editores. Urología General de Smith. 13 ed. México D.F.: Manual Moderno; 2005. p. 11-2.
6. Wroński K. Surgical treatment giant spermatic cord lipoma. Case report. New Medicine [Internet]. 2013 [cited 2013 Dec 11];17(2):[about 3 p.]. Available from: http://www.newmedicine.pl/shown.php?ktory=4447
7. Vashu R, Subramaniam M. Large lipoma of the spermatic cord presenting as posoperative recurrent hernia in a middle aged gentleman: A case report. Cases Journal [Internet]. 2009 [cited 2013 Dec 11];2:[about 2 p.]. Available from: http://www.casesjournal.com/content/2/1/8500
8. Pérez Rodríguez E, Gutiérrez Hernández PR, Álvarez Argüelles H, González Álvarez RJ, Fernández Ramos J, Vivancos Garbayo S, et al. Tumor lipomatoso atípico. A propósito de un caso. Rev Int Androl [Internet]. 2009 [citado 14 Dec 2013];7(2):[aprox.3 p.]. Disponible en: http://dialnet.unirioja.es/servlet/articulo?codigo=3127002
9. Bremmer F, Kessel FJ, Behnes CL, Trojan L, Heinrich E. Leiomyoma of the tunica albuginea, a case report of a rare tumour of the testis and review of the literature. Diagnostic Pathologic [Internet]. 2012 [cited 2013 Dec 11];7:[about 1 p.]. Available from: http://www.diagnosticpathology.org/content/7/1/140
10. Kullolli VS, Kullolli S, Pawar S, Gautam D. Leiomyoma of testis. A case report. Indian J Surg [Internet]. 2011 May-Jun [cited 2013 Dec 11];73(3):[about 3 p.]. Available from: http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3087073/
11. Tsaroucha AK, Papachristou F, Simopoulou MC, Pitakoudis MS, Sivridis E, Simopoulus CE. Leiomyomas of spermatic cord and testis presenting as hernia. Chromosomal analysis. Acta Chir Iugosl [Internet]. 2010 [cited 2013 Dec 11];57(2):[about 4 p.]. Available from: http://www.ncbi.nlm.nih.gov/pubmed/20949702
12. Pereira BJ, Meruje M, Azinhais P, Conceiçao P, Borges R, Leâo R, et al. Leiomioma paratesticular volumoso. Acta Urológica [Internet]. 2009 [cited 11 Dec 2013];2:[aprox.1 p.]. Disponible en: http://www.apurologia.pt/acta/2-2009/c27.pdf
13. Goel R, Agarwal A, Lomanto D. Large limphangioma presenting like irreducible inguinal hernia: A rare presentation and literature review. Ann Acad Med Singapore [Internet]. 2011 Nov [cited 2013 Dec 11];40(11):[about 2 p.]. Available from: http://www.ncbi.nlm.nih.gov/pubmed/22206072
14. Jamal YS, Abdel-Halim AR, Moshref SS, Kurdi MO, Sandugji HI. Cystic lymphangioma of spermatic cord: A case report and literature review. JKAU Med Sci [Internet]. 2009 [cited 2013 Dec 11];16(4):[about 8 p.]. Available from: http://www.kau.edu.sa/Files/320/Researches/57304_27535.pdf
15. Kajal P, Rattan KN, Malik VS, Garsa V. Lymphangioma. A rare cause of swelling. APSP J Case Pep [Internet]. 2012 [cited 2013 Dec 13];4(5):[about 1 p.]. Available from: http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3525287/
16. Prada Arias M, Ortiz Rey JA, Fernandez Erie P, Montero Sanchez M, Lema Carril A, Segade Andrade R. Dermoid cyst of the spermatic cord in children. J Pediatr Surg [Internet]. 2010 Oct [cited 2013 Dec 13];45(10):[about 3 p.]. Available from: http://www.ncbi.nlm.nih.gov/pubmed/20920730
17. Surriah MH, Muneer QAR. Dermoid cyst of the spermatic cord: A rare case of benign inguinal lump. Iraqi Postgrad Med J [Internet]. 2013 [cited 2013 Dec 14];12(2):[about 5 p.]. Available from: http://www.iasj.net/iasj?func=fulltext&aId=76528
18. Skoniakov MS, Camacho Ramírez A, Soto Delgado M, Clavo Durán A, Sánchez Bernal C. Quiste dermoide del cordón espermático. Una masa paratesticular. Un caso y revisión de la literatura. Arch Esp Urol [Internet]. 2011 [citado 14 Dec 2013];64(10):[aprox 4 p.]. Disponible en: http://www.redalyc.org/articulo.oa?id=181022517014
19. Richie JP, Steele GS. Tumors of testicular adnexa. In: Wein AJ, Kavoussi LR, Novick AC, Partin AW, Craig CA, editors. Campbell-Walsh Urology. 9 th ed. [CD-ROM]. Philadelphia: Saunders Elsevier; 2007.
20. Hernández Martínez SJ, Peña Ruelas CI, Hernández Bautista IG, Sánchez Arbea PC, Sánchez Venegas JC. Rabdomiosarcoma embrionario paratesticular. A propósito de un caso. Acta Pediatr Mex [Internet]. 2011 [citado 14 Dic 2013];32(5):[aprox. 5 p.]. Disponible en: http://www.revistasmedicasmexicanas.com.mx/download/actapediatrica/Septiembre-Octubre2011/Acta%205.10%20Rabdomiosarcoma.pdf
21. Bouchikhi AA, Mellas S, Tazi MF, Lahlaidi K, Kharbach Y, Benhayoune K, et al. Embryonic paratesticular rhabdomyosarcoma: A case report. J Med Case Rep [Internet]. 2013 [cited 2013 Dec 14];7:[about 4 p.]. Available from: http://www.jmedicalcasereports.com/content/7/1/93
22. Keskin S, Ekenel M, Basaran M, Kilicaslan I, Tunc M, Bavbek S. Clinicopathological characteristics and treatment outcomes of adult patients with paratesticular rhabdomyosarcoma (PRMS): A 10 year single centre experience. Can Urol Assoc J [Internet]. 2012 Feb [cited 2013 Dec 14];6(1):[about 4 p.]. Available from: http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3289696/
23. Caballero Mora FJ, Muñoz Calvo MT, García Ros M, Rodríguez de Alarcón J, Fernández Pérez ML, Casco F, et al. Tumores testiculares y paratesticulares en la infancia y adolescencia. An Pediatr Barc [Internet]. 2013 [citado 14 Dic 2013];78(1):[aprox. 8 p.]. Disponible en: http://www.sciencedirect.com/science/article/pii/S169540331200272X
24. Montgomery S, Bloom DA. The diagnosis and management of scrotal masses. Med Clin North Amer [Internet]. 2011 Jan [cited 2013 Dec 14];95(1):[about 9 p.]. Available from: http://www.ncbi.nlm.nih.gov/pubmed/21095426
25. Kishore B, Khare P, Gupta RJ, Gupta C, Khare V. A rare case of paratesticular pleomorfic rhabdomyosarcoma diagnosed by fine needle aspiration: A case report. Diagn Cytopathol [Internet]. 2010 Feb [cited 2013 Dec 14];38(2):[about 6 p.]. Available from: http://www.ncbi.nlm.nih.gov/pubmed/19790247
26. Ferrari A, Meazza C, Vajna de Pava M, Clerici CA, Casanova M. Rhabdomyosarcoma inadequately treated: The problem of referral. J Adolesc Young Adult Oncol [Internet]. 2011 Sep [cited 2013 Dec 14];1(3):[about 3 p.]. Available from: http://www.ncbi.nlm.nih.gov/pubmed/23610735
27. Hazariwala R, Morris CG, Gilbert S, Algood C, Zlotecki RA. Radiotherapy for spermatic cord sarcoma. Am J Clin Oncol [Internet]. 2013 Aug [cited 2013 Dec 14];36(4):[about 3 p.]. Available from: http://www.ncbi.nlm.nih.gov/pubmed/22772428
28. Celik O, Unlu G. A rare case: Paratesticular leiomyosarcoma. Asian J Androl [Internet]. 2013 [cited 2013 Dec 14];15:[about 2 p.]. Available from: http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3854056/
29. Kyratzi I, Lolis E, Antypa E, Lianou MA, Exarhos D. Imaging features of a huge spermatic cord leiomiosarcoma: Review of the literature. World J Radiol [Internet]. 2011 Apr [cited 2013 Dec 14];3(4):[about 5 p.]. Available from: http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3084435/
30. Moloney J, Drumm J, Fanning DM. A rare case of paratesticular leiomiosarcoma. Clinics and Practice [Internet]. 2012 [cited 2013 Dec 14];2:[about 2 p.]. Available from: http://www.clinicsandpractice.org/index.php/cp/article/view/cp.2012.e29
31. Marla TN, Hegde A, Hanumanthappa B, Marla N, Shetty SS. Rare paratesticular leiomiosarcoma: A case report. J Evolut Med Dent Scien [Internet]. 2013 Nov [cited 2013 Dec 14];44(2):[about 5 p.]. Available from: http://www.jemds.com/data_pdf/tejaswi%20marla.pdf
32. Patil V, Verma A, Pattar RS, Nandar S. Paratesticular leiomyosarcoma. A case report. J Nepal Med Assoc [Internet]. 2013 [cited 2013 Dec 14];52(191):[about 3 p.]. Available from: http://www.jnma.com.np/jnma/index.php/jnma/article/view/2283
33. Mafra RSCP, Alves PR, Neto JM, Mafra de Oliveira RSCP, Albeeti LR. Liposarcoma de cordão espermatico. Resisão de literatura e relato de caso. Rev Med Res [Internet]. 2012 Abr-Jun [cited 2013 Dec 14];4(2):[about 4 p.]. Available from: http://www.crmpr.org.br/publicacoes/cientificas/index.php/revista-do-medico-residente/article/viewFile/252/242
34. Alyousef H, Osman EM, Gomba MA. Paratesticular liposarcoma: A case report and review of the literature. Case Rep Urol [Internet]. 2013 [cited 2013 Dec 14];[about 3 p.]. Available from: http://www.hindawi.com/crim/urology/2013/806289/
35. Faria Silva L, Fraga Corrêa L, Faria Pessoa A, de Oliveira Lamas D. Metastatic paratesticular liposarcoma: Case report and literature review. Applied Cancer Research [Internet]. 2010 [cited 2013 Dec 14];30(4):[about 3 p.]. Available from: http://www.appliedcr.org.br/detalhe_artigo.asp?id=196
36. Christopher D, Unni K, Mertens F. Adipocytic tumors. In: WHO classification of tumors. Pathology and genetics: Tumors of soft tissues and bone. Lyon, France: IARC; 2002. p. 19-46.
37. Vukmirović F, Zejnilović N, Ivović J. Liposarcoma of the paratesticular tissue and spermatic cord: A case report. Vojnosanit Pregl [Internet]. 2013 Jul [cited 2013 Dec 14];70(7):[about 4 p.]. Available from: http://www.ncbi.nlm.nih.gov/pubmed/23984620
38. Lee KY, Park SJ, Moon SK, Kim HC. Unilateral spermatic cord metastasis from gastric cancer: A case report. Iran J Radiol [Internet]. 2012 Nov [cited 2013 Dec 14];9(4):[about 3 p.]. Available from: http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3569555/
39. Valizadeh N, Oskuie AE, Tehranchi A. Spermatic cord metastasis as early manifestation of small bowel adenocarcinoma. Urol Ann [Internet]. 2013 Jan-Mar [cited 2013 Dec 14];5(1):[about 3 p.]. Available from: http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3643327/
40. Tran M, Daly P, Tran T, Heathcote P. Renal cell carcinoma metastases to the spermatic cord: Review of the literature and case presentation. J Clin Urol [Internet]. 2013 Nov [cited 2013 Dec 14];6:[about 5 p.]. Available from: http://uro.sagepub.com/content/6/6/427.abstract?rss=1
41. Ansari S, Miri-Aliabab G, Rakhshani N. Bilateral Wilms' tumor metastasis to right spermatic cord. Int J Hematol Oncol Stem Cell Res [Internet]. 2013 [cited 2013 Dec 14];7(4):[about 4 p.]. Available from: http://ijhoscr.tums.ac.ir/index.php/ijhoscr/article/view/435.pdf
42. Memon AA, Soomro Q. Diffuse fibrous pseudotumor of paratesticular tissue. J Surg Pakistan [Internet]. 2009 Apr-Jun [cited 2013 Dec 14];14(2):[about 3 p.]. Available from: http://www.jsp.org.pk/Issues/JSP%2014-2%20%20April%20-June%202009/Aijaz%20Ahmed%20Memon.pdf
43. Miyamoto H, Montgomery EA, Epstein JI. Paratesticular fibrous pseudotumor: A morphologic and inmunohistochemical study of 13 cases. Am J Surg Pathol [Internet]. 2010 [cited 2013 Dec 14];34(4):[about 6 p.]. Available from: http://www.ncbi.nlm.nih.gov/pubmed/20216379
44. Gordetsky J, Findeis-Hosey J, Erturk E, Messing EM, Yao JL, Miyamoto H. Role of frozen section analysis of testicular/paratesticular fibrous pseudotumours: A five case experience. Can Urol Assoc J [Internet]. 2011 Aug [cited 2013 Dec 14];5(4):[about 5 p.]. Available from: http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3148395/
45. Tarhan H, Divrik RT, Akarken I, Altok M, Zorlu F. Bening intrascrotal lesion: Fibrous pseudotumor of testis. Arch Ital Urol Androl [Internet]. 2011 Jun [cited 2013 Dec 14];83(2):[about 3 p.]. Available from: http://www.ncbi.nlm.nih.gov/pubmed/21826885
46. Mutreja D, Murali M, Arya A. Pseudotumors of paratesticular region mimicking malignancy. Arch Int Surg [Internet]. 2013 [cited 2013 Dec 14];13 (3):[about 3 p.]. Available from: http://www. archintsurg.org/text.asp?2013/3/1/70/117142
47. Rodríguez Collar TL, Valdés Estévez B, Nagua Valencia MA, Salinas Olivares MR. Pseudotumor fibroso calcificado del cordón espermático. Rev Cubana Cir [Internet]. 2009 Sep-Dic [citado 14 Dic 2013];48(4):[aprox. 6 p.]. Disponible en: http://scielo.sld.cu/scielo.php?pid=S0034-74932009000400015&script=sci_arttext
48. Bösmüller H, von Weyhern CH, Adam P, Alibegovic V, Mikuz G, Fend F. Paratesticular fibrous pseudotumor: An IgG4 related disorder? Virchows Arch [Internet]. 2011 Jan [cited 2013 Dec 14];458(1):[about 5 p.]. Available from: http://www.ncbi.nlm.nih.gov/pubmed/20957491
49. Dieckmann KP, Strauss WJ, Frey U, Nahler-Wildenhain M. Paratesticular fibrous pseudotumor in young males presenting with histological features of IgG4 related disease: Two case reports. J Med Case Rep [Internet]. 2013 Sep [cited 2013 Dec 14];7(1):[about 1 p.]. Available from: http://www.jmedicalcasereports.com/content/7/1/225
50. Lee GE, Rha SE, Byun JY, Lee K, Kim SW. Paratesticular solitary fibrous tumor: A rare cause of a hipervascular extratesticular mass. J Ultrasound Med [Internet]. 2011 [cited 2013 Dec 14];30:[about 3 p.]. Available from: http://www.jultrasoundmed.org/content/30/2/279.full.pdf
51. Ahmed S, Menon S, Desai S. Epithelioid malignant mesothelioma of tunica vaginalis with deciduoid features: An unusual malignancy clinically masquerading an inguinal hernia. Indian J Pathol Microbiol [Internet]. 2012 [cited 2013 Dec 14];55:[about 3 p.]. Available from: http://www.ncbi.nlm.nih.gov/pubmed/22499310
52. Meng X, Guzzo TJ, Bing Z. Malingnant mesotheliomas in spermatic cords: Reports of two cases and brief review of literature. Rare Tumors [Internet]. 2013 Feb [cited 2013 Dec 14];5(1):[about 5 p.]. Available from: http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3682456/
53. Busto Martin L, Portela Pereira P, Sacristan Lista F, Busto Castañón L. Mesothelioma of the tunica vaginalis. Case report. Arch Esp Urol [Internet]. 2013 May [cited 2013 Dec 14];66(4):[about 5 p.]. Available from: http://www.ncbi.nlm.nih.gov/pubmed/23676545
54. Mrinakova B, Ondrus D, Kajo K, Kunderlik M, Tkacova M, Ondrusova M. Paratesticular mesothelioma in young age. Case report. Klin Onkol [Internet]. 2012 [cited 2013 Dec 14];25(4):[about 4 p.]. Available from: http://www.ncbi.nlm.nih.gov/pubmed/22920171
Recibido: 3 de marzo de 2014.
Aprobado: 19 de junio de 2014.
Tomás Lázaro Rodríguez Collar. Hospital Militar Central "Dr. Carlos J. Finlay". Avenida 114 y 31, Marianao. La Habana, Cuba. Correo electrónico: tomasrc@infomed.sld.cu