Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Medicina Militar
versión impresa ISSN 0138-6557versión On-line ISSN 1561-3046
Rev Cub Med Mil vol.45 no.2 Ciudad de la Habana abr.-jun. 2016
ARTÍCULO ORIGINAL
Diagnóstico de tripanosomiasis americana en estudiantes de la Escuela Latinoamericana de Medicina
Diagnosis of American Trypanosomiasis in Students of the Latin American School of Medicine
Jorge Pável Delgado La O',I Daysi Montoto Concepción,II Valia Dean Álvarez,II Fidel Ángel Núñez Fernández,II Salvador Roberto Mora González,II Jorge Fraga NodarseII
I Hospital Militar Central Dr. "Carlos J. Finlay". La Habana. Cuba.
II Instituto de Medicina Tropical "Pedro Kourí". La Habana. Cuba.
RESUMEN
Introducción: los países donde no es endémica la enfermedad de Chagas (EC) enfrentan, entre sus desafíos, la determinación de su prevalencia en personas provenientes de áreas endémicas.
Objetivos: determinar la presencia de anticuerpos anti-Trypanosoma cruzi por diferentes métodos serológicos en muestras de suero de estudiantes de la Escuela Latinoamericana de Medicina (ELAM), detectar la presencia del genoma del parásito mediante técnica de reacción en cadena de la polimerasa (PCR-kDNA) en el grupo estudiado y evaluar, preliminarmente, los métodos utilizados en el algoritmo de trabajo para el diagnóstico de EC en Cuba.
Métodos: estudio descriptivo transversal en estudiantes de la ELAM, entre septiembre y noviembre de 2012, a quienes, debido a la pesquisa del Programa de Control Sanitario Internacional (CSI) del Ministerio de Salud Pública (MINSAP), se les realizaron, a su ingreso a Cuba, estudios serológicos y moleculares para el diagnóstico de EC, mediante cuatro métodos comerciales de diagnóstico serológico, con empleo paralelo de la técnica de PCR-kDNA.
Resultados: la seropositividad, mediante métodos serológicos, fue de 6,25 %, detectándose el parásito en cinco estudiantes seropositivos. Se mostró presencia del genoma del parásito (sensibilidad y especificidad diagnósticas: 100%) para la técnica de PCR-kDNA. La sensibilidad y especificidad diagnósticas de esta, halladas en este estudio preliminar, permiten considerarla una herramienta útil para diagnosticar EC en pacientes en fase crónica indeterminada.
Conclusiones: los métodos serológicos y moleculares del algoritmo para corroborar EC utilizados en esta investigación, mostraron validez, seguridad diagnóstica y concordancia suficientes para justificar su uso en cada uno de los niveles de confirmación.
Palabras clave: enfermedad de Chagas; tripanosomiasis; Trypanosoma cruzi.
ABSTRACT
Introduction: countries where Chagas disease is not endemic (CD) confront, among their challenges, the determination of its prevalence in endemic area people.
Objectives: determine the presence of anti-Trypanosoma cruzi antibodies by different serological methods in serum samples of students from the Latin American School of Medicine (ELAM), detect the presence of the parasite genome by polymerase chain reaction (PCR-kDNA) in the studied group and evaluate, preliminarily, the methods used in the working algorithm for the diagnosis of Chagas disease in Cuba.
Methods: a cross-sectional descriptive study of ELAM students was conducted from September to November 2012. These students underwent serological and molecular studies for the diagnosis of CD, due to the research carried out by the Ministry of Public Health (MINSAP) To Cuba, using four commercial methods of serological diagnosis, with parallel use of the PCR-kDNA technique.
Results: seropositivity, using serological methods, was 6.25%, and this parasite was detected in five seropositive students. The presence of the parasite genome (diagnostic sensitivity and specificity: 100%) was shown for the PCR-kDNA technique. The diagnostic sensitivity and specificity, found in this preliminary study, allow it to be considered a useful tool to diagnose CD in patients with chronic indeterminate phase. The serological and molecular methods of the algorithm to corroborate CD used in this research showed sufficient validity, diagnostic reliability and concordance to justify its use at each of the confirmation levels.
Keywords: Chagas disease; Trypanosomiasis; Trypanosoma cruzi.
INTRODUCCIÓN
Las enfermedades parasitarias representan un problema de salud importante para los países subdesarrollados y, de manera creciente, para los del primer mundo, dados los actuales estándares de vida y las migraciones humanas. Parasitosis localizadas en regiones endémicas en el pasado, ganan hoy espacios en otras zonas del planeta.
Países no endémicos de la Enfermedad de Chagas (EC), causada por el Trypanosoma cruzi, enfrentan la necesidad de determinar su prevalencia en grupos de personas procedentes de áreas endémicas donde permanecen por largos períodos de tiempo.
De acuerdo a Rassi y otros,1 al menos 18 países son endémicos de EC en América Latina y el 20 % de su población está en riesgo de adquirir la enfermedad.
Según Requena-Mendez A y otros,2 la situación epidemiológica se complica hoy en muchos países de Europa y otras regiones, como consecuencia del flujo de inmigrantes provenientes de regiones endémicas, convirtiéndose la enfermedad en un problema de salud importante, por el creciente número de individuos infectados.
Ello concita significativa atención y esfuerzos diagnósticos y terapéuticos. De acuerdo a criterios de Granjon 3, Castro-Sesquen y otros 4 se ha incrementado la necesidad de detener el actual patrón de diseminación de tripanosomiasis americana en y desde países endémicos hacia regiones no endémicas, por lo que el diagnóstico tiene un rol principal.
Dada la ausencia de vectores de la enfermedad en países no endémicos, los sistemas de control sanitario e higiénico epidemiológico difieren de los implementados para regiones endémicas de EC. Por ello, se recomienda una estrategia de prevención basada en un sistema de pesquisa serológica integrada a algoritmos diagnósticos que aseguren eficacia, eficiencia y efectividad en el enfrentamiento de esta entidad.
Se impone ejecutar medidas higiénico-sanitarias y antiepidémicas sobre las vías de transmisión no asociadas a los vectores (transfusiones de sangre, trasplantes de órganos, congénita) y, sobre todo, vigilancia epidemiológica de individuos con permanencia en áreas endémicas.5
Pioneros en ello fueron los ingleses, que cuentan desde 1999 con un sistema de cribado para donantes de sangre con riesgo de infección por T. cruzi. Más tarde le siguieron Italia y España (2005), Francia (2009) y Suiza (2013).2,6 En Australia, Suecia y Portugal, los individuos con riesgo de infección por T. cruzi son excluidos de las donaciones de sangre y en Holanda, quienes padecen EC no son autorizados a efectuar donaciones de sangre u órganos.7 En muchos países no endémicos de la enfermedad no existen estos sistemas de pesquisa y control, debido al poco desarrollo de técnicas diagnósticas. No existe una legislación internacional para pesquisa de gestantes provenientes de áreas endémicas, con excepción de algunas regiones de Italia y España, aunque en Portugal, Suiza, Estados Unidos y el Reino Unido se han implementado algunas iniciativas no gubernamentales.2
El diagnóstico de infección por T. cruzi depende de la fase de la enfermedad en que se halle el paciente y debe apoyarse en la información epidemiológica, clínica y pruebas de laboratorio.1,8
En la fase crónica de la enfermedad, el diagnóstico parasitológico directo está comprometido por la baja parasitemia. Este es esencialmente serológico, por lo que las técnicas más comunes son el ensayo inmunoenzimático sobre fase sólida (ELISA), la inmunofluorescencia indirecta (IFI) y la hemaglutinación indirecta (HAI).9 Este diagnóstico debe ser realizado usando, al menos, dos pruebas serológicas de principios metodológicos diferentes. La Organización Panamericana de la Salud y la Organización Mundial de la Salud (OPS/OMS) recomiendan considerar positivos los individuos con dos pruebas serológicas positivas.10,11
Dada la persistencia de la respuesta inmunológica, los métodos serológicos son poco útiles para definir el criterio de curación y poseen baja especificidad por la posibilidad de reacciones cruzadas con otros parásitos, fundamentalmente Leishmanias s pp y Trypanosoma rangeli.12
Mundialmente, se conocen hasta 11 métodos serológicos para diagnóstico rápido, alcanzando los mejores desempeños el SERODIA®-Chagas test, el Immuno Comb® II Chagas Ab Kit, y el SD Bioline Chagas Ab Rapid test.13
También se investigan métodos para diagnóstico molecular a partir de ADN proveniente del cinetoplasto. Duarte y otros evaluaron cinco métodos serológicos y dos moleculares para diagnóstico rápido y determinaron que el Bioelisa Chagas® test mostró las mejores sensibilidad y especificidad diagnósticas. La amplificación del ADN de T. Cruzi por PCR exhibió bajos valores de sensibilidad y altos índices de especificidad.14
El diagnóstico rápido de EC es un reto. En 2011, la OMS estimó una tasa mundial de subregistro diagnóstico cercana al 94 %. Ello impone continuar desarrollando investigaciones en el diagnóstico de EC.
Según Reis-Cunha JL y otros, es aconsejable realizar la pesquisa e identificación de nuevos antígenos de T. cruzi.15 Enríquez GF y otros, expresaron que existen nuevas técnicas que podrían incluirse en algoritmos más eficientes, como la PCR en tiempo real, de mayor sensibilidad y rapidez diagnósticas, para identificar individuos con alta parasitemia.16 La técnica de Western blot sobre antígenos de excreción-secreción de epimastigotes de T. cruzi, ha mostrado efectividad en el diagnóstico temprano y confirmatorio.17
Las limitaciones en sensibilidad y especificidad de las pruebas parasitológicas y serológicas, especialmente para diagnóstico de la fase crónica, explican el interés y la necesidad de establecer un método directo más sensible, que permita el monitoreo del parásito y confirmar la etiología.18 La principal técnica probada en la investigación de T. cruzi, directamente en la sangre de pacientes, es el ensayo molecular por la Reacción en Cadena de la Polimerasa (PCR).19
Diferentes secuencias blanco se han utilizado para diagnóstico molecular por PCR. Entre ellas: los minicírculos del cinetoplasto (kDNA),14 la región nuclear repetitiva de 195pb,20 los miniexones,21 el ARNr 24S y la proteína flagelar F29,22 la región repetitiva de 1025pb 23 y la histona H2A.24-26
La PCR se recomienda indistintamente para diagnóstico de la tripanosomiasis americana en diferentes programas de control en países endémicos y no endémicos de esta parasitosis y el diagnóstico en la fase crónica, si las pruebas serológicas no son conclusivas.27,28 Además, se preconiza como prueba confirmatoria solo después de tamizaje de donantes de sangre y para el diagnóstico de infecciones en fase aguda o congénitas y para el seguimiento terapéutico después del diagnóstico.29 Se considera un paciente con EC si resulta positivo a dos pruebas serológicas o positivo a PCR, cuando se sospecha una enfermedad crónica.29,30
En Cuba, Ruiz y otros31 estudiaron un grupo de 46 estudiantes entre 2002 y 2003, hallando una seropositividad de 13,4 % (6/46 estudiantes), utilizando dos métodos serológicos. Serra y otros,32 hallaron (2012) 50 positivos (6,6 %), al estudiar, entre 2009 y 2010 a 756 estudiantes, de la Facultad de Ciencias Médicas Salvador Allende. Estos estudios tienen como debilidad haber empleado solo el método serológico UMELISA® CHAGAS para determinar y reportar la presencia de la enfermedad.
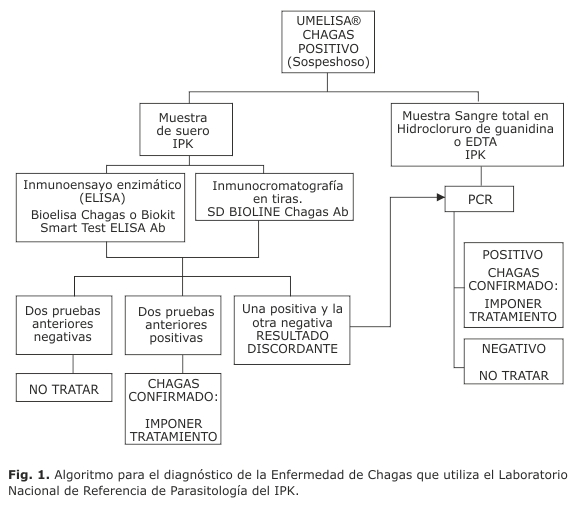
Desde hace algunos años se estableció un algoritmo (ver Anexo) para el diagnóstico de EC, con el tamizaje inicial como base, utilizando la técnica de diagnóstico serológico desarrollada y producida en Cuba, UMELISA® CHAGAS y la confirmación posterior en el Laboratorio Nacional de Referencia de Parasitología del IPK (LNRP-IPK) de las muestras positivas mediante dos métodos serológicos de principios diferentes y el método de PCR-kDNA. Esta estrategia permite proteger la población cubana contra esta enfermedad exótica, reforzar la vigilancia epidemiológica sobre el personal foráneo y colaborar con los países de la región. Sin embargo, es importante evaluar el algoritmo diagnóstico aplicado y la utilidad de cada uno de los métodos empleados hoy en cada una de las etapas de este.
Por ello el objetivo es determinar la presencia de anticuerpos anti- Trypanosoma cruzi por diferentes métodos serológicos en muestras de suero de estudiantes de la ELAM, detectar la presencia del genoma del parásito mediante la técnica de reacción en cadena de la polimerasa (PCR-kDNA) en el grupo estudiado, y evaluar, de forma preliminar, los métodos utilizados en el algoritmo de trabajo para el diagnóstico de enfermedad de Chagas en Cuba.
MÉTODOS
Estudio descriptivo transversal a un grupo de 80 estudiantes de la ELAM, durante el periodo septiembre - noviembre de 2012, empleando métodos serológicos y moleculares. Se determinó la seropositividad teniendo en cuenta los criterios internacionales establecidos por la OPS/OMS, que consideran una muestra de suero positiva si son reactivos al menos dos de los cuatro métodos serológicos utilizados (UMELISA® CHAGAS, Smart Test ELISA Ab, ySD BIOLINE Chagas Ab Rapid Test). Se utilizó el paquete del programa Epidat 3.1 (Dirección Xeral de Saude Pública, Organización Panamericana de la Salud, Galicia, España). Se realizó la detección molecular mediante extracción de ADN a partir de sangre periférica utilizando la técnica de RCP-ADNk, con los cebadores sintéticos específicos S35 y S36.
Para la evaluación preliminar del algoritmo de confirmación se evaluó cada uno de los métodos serológicos utilizados. Se precisó su validez a partir de la determinación de la sensibilidad y especificidad diagnósticas, utilizando como regla de oro la positividad a dos de los tres métodos serológicos empleados. La seguridad se evaluó a partir de la determinación de los valores predictivos positivos y negativos. Finalmente, se determinó la concordancia de los métodos serológicos utilizados entre sí y entre los métodos serológicos y molecular, a partir del índice de kappa de Cohen's calculado mediante el programa Epidat 3.1. Para la interpretación de la concordancia entre los métodos se utilizó la escala de valoración propuesta para este índice: 0: sin acuerdo; 0,01-0,20: insignificante, 0,21-0,40: baja, 0,41-0,60: moderada, 0,61-0,80: buena; 0,81-1,00: excelente.
RESULTADOS
Hallamos cinco seropositivos (6,25 %), con el empleo de cuatro métodos comerciales de diagnóstico serológico. Este valor de seropositividad coincide con la seroprevalencia de EC estimada en Bolivia (6,75 %) reportada por Bern y Montgomery en 2009.33
Utilizamos la técnica de PCR-kDNA (S35-S36) observándose la banda específica de 330 pb, lo que demuestra infección exclusiva por T. cruzi (ninguno infectado con T. rangeli, ni con una infección mixta de ambos parásitos).
DISCUSIÓN
El uso de la PCR para diagnóstico de la enfermedad de Chagas crónica es objeto de controversia. El rango de su sensibilidad diagnóstica varía entre 50-100 %, aunque la especificidad se acerca, en la mayoría de los estudios, a 100 %.25 La variabilidad de estos valores de sensibilidad depende de factores técnicos tales como: el volumen de la muestra colectada, las condiciones y conservación de la muestra, el método utilizado para la extracción del ADN, la secuencia blanco del parásito y los cebadores seleccionados, los reactivos usados, así como las condiciones en el termociclador. La variabilidad de la sensibilidad de la PCR también ha sido explicada, en parte, por la presencia intermitente y la cantidad de parásitos circulantes en el momento que se colecta la muestra de sangre.18 De ahí la necesidad de continuar los estudios de evaluación de técnicas de PCR y comparación de diferentes ensayos, con vistas a determinar el método con mejor sensibilidad y especificidad diagnósticas, sobre todo en la fase crónica de la EC.
La sensibilidad y especificidad diagnósticas de la técnica de PCR en nuestro estudio, teniendo en cuenta la positividad a cuatro pruebas serológicas con fundamentación diferente, fue del 100 %. Este resultado concuerda con los reportados por Ávila y otros34 quienes, al estudiar 114 pacientes en fase crónica de la enfermedad, 91 seropositivos y 23 seronegativos (teniendo en cuenta la positividad a dos métodos serológicos), encontraron 100 % de sensibilidad y especificidad. La actual constituye una evaluación preliminar de este ensayo, teniendo en cuenta el número de individuos estudiados. Futuros trabajos, donde se evalúe un mayor número de estudiantes, permitirán determinar la validez y seguridad diagnósticas de la PCR-kDNA, contribuir a los estudios de evaluación de técnicas de PCR y comparar diferentes ensayos, para determinar el método con mejor sensibilidad y especificidad para el diagnóstico de EC, específicamente en la fase crónica.
Hoy, el algoritmo de trabajo (fig. 1) para confirmación diagnóstica de EC, tiene como base el tamizaje inicial, utilizando la técnica serológica desarrollada y producida en Cuba, UMELISA® CHAGAS (Centro de Inmunoensayo, Cuba), método que se realiza a todas las personas con sospecha clínica de la enfermedad o como parte de la pesquisa que realiza el programa de CSI a quienes laboran por largos períodos en países endémicos o a estudiantes latinoamericanos que comienzan a estudiar en Cuba. Seguidamente, a los pacientes seropositivos mediante el UMELISA® CHAGAS, se les practica dos métodos serológicos de principios diferentes en el LNRP-IPK: SDBIOLINE Chagas Ab Rapid Test y Smart test ELISA Abo Bioelisa Chagas, Biokit, así como el método de PCR-kDNA. La positividad de los métodos serológicos y/o de la PCR indica la presencia de T. cruzi y, por ende, la confirmación de la enfermedad.
En cuanto al diagnóstico de laboratorio, la infección por T. cruzi es una entidad compleja y su evolución natural se relaciona a la eficacia de los diagnósticos parasitológico y serológico. La demostración del parásito es efectiva, principalmente, en la fase aguda. Desafortunadamente, el 98 % de los afectados se diagnostica en la fase crónica. En ella, la herramienta que permite demostrar la infección por este protozoo es, principalmente, la determinación de los anticuerpos Ig G anti- T. cruzi específicos. Aunque se realizan numerosos estudios para evaluar las distintas pruebas de detección de anticuerpos específicos anti - T. cruzi,35,25 no existe consenso en la elección de una técnica de referencia. Recientemente, Afonso y otros,36 publicaron una revisión sistemática sobre el diagnóstico serológico de EC, que incluyó 80 estudios publicados y 61 ensayos sobre la precisión de los métodos serológicos para el diagnóstico de EC y hallaron una sensibilidad de 90 % y especificidad de 98 %. La comparación de los ensayos ELISA con los que no son ELISA halló sensibilidad y especificidad similares. Los métodos comerciales resultaron más sensibles que otros (91 % vs 81 %) pero fueron igualmente específicos (99 % vs 97 %).
Los cuatro métodos serológicos empleados en nuestro estudio forman parte del algoritmo diagnóstico del LNRP-IPK. La sensibilidad (100 %), del UMELISA® CHAGAS, apoya su uso para esta etapa inicial de tamizaje. Estos mostraron excelente concordancia con otros métodos comerciales empleados en esta investigación. La especificidad diagnóstica (98,7 %) fue congruente con lo indicado por el fabricante (sensibilidad y especificidad diagnósticas de 100 %). No existen, hasta donde conocemos, otros estudios donde se evalúen la validez y seguridad diagnósticas de este método.
Seguidamente, el algoritmo utiliza un segundo ensayo comercial inmunocromatográfico, como método confirmatorio serológico, que mostró elevada validez y seguridad diagnósticas (sensibilidad y especificidad de 100 %), en nuestro estudio, además de rapidez y facilidad para su utilización. Nuestros resultados, concuerdan con lo propuesto por los fabricantes y la evaluación de Ji y otros,37 quienes informan una sensibilidad diagnóstica entre 99,2 % y 99,3 % y especificidad de 100 % para la prueba rápida SD BIOLINE Chagas Ab Rapid Test. Estos resultados avalan su empleo como segunda técnica serológica para confirmar los casos positivos por UMELISA® CHAGAS.
El LNRP-IPK utiliza un método serológico tipo ELISA comercial. Se propone el uso preferencial del Smart Test ELISA Ab, con elevada validez y seguridad diagnósticas, en concordancia con lo informado por el fabricante (sensibilidad y especificidad diagnósticas de 98 %). Estos resultados no descartan la utilización del Bioelisa Chagas, Biokit, ensayo que mostró validez y seguridad diagnóstica coherentes con lo informado por el fabricante (sensibilidad diagnóstica entre 99,3 % y 100 % y especificidad de 98,6 %) y otros estudios de comparación de técnicas serológicas publicados.38 Este método mostró excelente concordancia según los datos obtenidos en los estudiantes evaluados en nuestra investigación.
Una posible explicación técnica de los resultados falsamente positivos en el ELISA (Bioelisa Chagas Biokit), podría deberse a la composición del conjugado. Este contiene anti - Ig M además de anti - Ig G humana. Si bien algunos autores defienden la utilidad diagnóstica de la evaluación de los anticuerpos Ig M,39 estos, por su baja especificidad, pueden generar resultados discordantes.40
En este estudio la PCR evaluada demostró validez y seguridad diagnósticas elevadas, con excelente concordancia con los métodos serológicos utilizados. Ello parece apoyar su empleo en el algoritmo, sobre todo en la futura estrategia terapéutica en los pacientes y en los resultados discordantes que pueden ocurrir con métodos serológicos, si bien generalmente el número de casos estudiados, lógicamente, es limitado en países no endémicos.
En este estudio preliminar, nuestros resultados demostraron la utilidad de cada uno de estos métodos dentro del algoritmo que utiliza el LNRP-IPK para el diagnóstico de la enfermedad. Estudios futuros deben evaluar un mayor número de muestras, para comparar los métodos serológicos utilizados en nuestro país para el diagnóstico de esta parasitosis y valorar mejor el algoritmo diagnóstico que hoy se emplea, a fin de perfeccionar nuestras herramientas de control sanitario internacional y garantizar una eficaz vigilancia epidemiológica para mantenerlo libre de esta parasitosis. Los métodos serológicos utilizados en el algoritmo diagnóstico para confirmar EC en Cuba, en los resultados de este estudio, mostraron validez, seguridad diagnóstica y suficiente concordancia para justificar su uso en cada uno de los niveles de confirmación del diagnóstico.
La sensibilidad y especificidad diagnósticas, halladas en nuestro estudio (100 %), mediante la técnica de reacción en cadena de la polimerasa (PCR-kDNA), permitieron considerarla una herramienta útil para el diagnóstico de la enfermedad de Chagas en pacientes en fase crónica indeterminada.
REFERENCIAS BIBLIOGRÁFICAS
1. Rassi AJ, Rassi A, Marcondes de Rezende J. American trypanosomiasis (Chagas disease). Infect Dis Clin North Am. 2010;26:275-91.
2. Requena-Méndez A, Aldasoro E, de Lazzari E, Sicuri E, Brown M, Moore DA, et al. Prevalence of Chagas disease.In: Latin-American migrants living in Europe: a systematic review and meta-analysis. PLoS Negl Trop Dis. 2015 Feb 13; [cited 5 mar 2016]; 9(2):e0003540. Available from: http://www.ncbi.nlm.nih.gov/pmc/articles/pmid/25680190
3. Granjon E, Dichtel-Danjoy ML, Saba E, Sabino E, Campos de Oliveira L, Zrein M. Development of a Novel Multiplex Immunoassay Multi-cruzi for the Serological Confirmation of Chagas Disease. PLoS Negl Trop Dis. 2016 Apr 1 [cited 5 mar 2016]; 10(4):e0004596. Available from: http://www.ncbi.nlm.nih.gov/pubmed/27035146
4. Castro-Sesquen YE, Gilman RH, Mejia C, Clark DE, Choi J, Reimer-McAtee MJ, et al. Use of a Chagas Urine Nanoparticle Test (Chunap) to Correlate with Parasitemia Levels in T. cruzi/HIV Co-infected Patients: Comparison of a PCR test based on the histone H2A/SIRE genes with classical serological tests for the diagnosis of chronic Chagas disease in Colombian patients. PLoS Negl Trop Dis. 2016 Feb 26 [cited 5 mar 2016];10(2):e0004407. Available from: http://www.ncbi.nlm.nih.gov/pubmed/26919324
5. Coura JR. The main sceneries of Chagas disease transmission: The vectors, blood and oral transmissions--a comprehensive review. Mem Inst Oswaldo Cruz. 2015 May [cited 5 mar 2016];110(3):277-82. doi: 10.1590/0074-0276140362. Epub 2014 Dec 2. Available from: http://www.ncbi.nlm.nih.gov/pmc/articles/PMC4489464/
6. Marín C, Concha-Valdez F, Cañas R, Gutiérrez-Sánchez R, Sánchez-Moreno M. Anti-Trypanosoma cruzi antibody detection in eastern Andalusia (Spain). Trans R Soc Trop Med Hyg. 2014 Mar [cited 5 mar 2016];108(3):16572. Available from: http://www.ncbi.nlm.nih.gov/pubmed/24463719
7. Albajar-Viñas P, Jannin J. The hidden Chagas disease burden in Europe. Euro Surveill. 2011 [cited 5 mar 2016];16(38):pii=19975. Available from: http://www.eurosurveillance.org/ViewArticle.aspx?ArticleId=19975.
8. Lescure FX, Le Loup G, Freilij H, Develoux M, Paris L, Brutus L, et al. Chagas disease: changes in knowledge and management. Lancet Infect Dis. 2010;10:556-70.
9. Gomes YM, Lorena VM, Luquetti AO. Diagnosis of Chagas disease: what has been achieved? What remains to be done with regard to diagnosis and follow up studies? Mem Inst Oswaldo Cruz. 2009;104:115-21.
10. Ministerio de Salud. Guía Clínica: Guías de Diagnóstico, Tratamiento y Prevención de la Enfermedad de Chagas. Santiago de Chile: MINSAL; 2010.
11. Ministerio de Salud. Guía Clínica: Guía de Diagnóstico, Tratamiento y Prevención de la Enfermedad de Chagas. Santiago de Chile: MINSAL; 2011.
12. Corredor Arjona A, Álvarez Moreno CA, Agudelo CA, Bueno M, López MC, Cáceres E, et al. Prevalence of Trypanosoma cruzi and Leishmania chagasi infection and risk factors in a Colombian indigenous population. Rev Inst Med Trop. Sao Paulo 1999;41:229-34.
13. Jamonneau V, Camara O, Ilboudo H, Peylhard M, Koffi M, Sakande H, et al. Accuracy of Individual Rapid Tests for Serodiagnosis of Gambiense Sleeping Sickness in West Africa. PLoS Negl Trop Dis. 2015 Feb [cited 5 mar 2016]; 9(2): e0003480. Available from: http://www.ncbi.nlm.nih.gov/pmc/articles/PMC4314185
14. Duarte LF, Florez O, Rincon G, Gonzalez CI. Comparison of seven diagnostic tests to detect Trypanosoma cruzi infection in patients in chronic phase of Chagas disease. Colomb Med. 2014;45(2):61-6.
15. Reis-Cunha JL, Mendes TA, de Almeida LR, Ribeiro DR, Machado-de-Avila RA, de Oliveira TM, et al. Genome-wide screening and identification of new Trypanosoma cruzi antigens with potential application for chronic Chagas disease diagnosis. PLoS ONE. 2014;9:e106304.
16. Enriquez GF, Bua J, Orozco MM, Wirth S, Schuman AG, Gurtler RE, et al. High levels of Trypanosoma cruzi DNA determined by qPCR and infectiousness to Triatoma infestans support dogs and cats are major sources of parasites for domestic transmission. Infect Genet Evol. 2014;25:36-43.
17. Escalante H, Jara C, Davelois K, Iglesias M, Benites A, Espinoza R. Western blot technique standardization for specific diagnosis of Chagas disease using excretory-secretory antigens of Trypanosoma cruzi epimastigotes. Rev Peru Med Exp Salud Publica. 2014;31:644-51.
18. Schijman AG, Bisio M, Orellana L, Sued M, Duffy T, Mejia Jaramillo AM, et al. International study to evaluate PCR methods for detection of Trypanosoma cruzi DNA in blood samples from Chagas disease patients. PLoS Negl Trop Dis. 2011;5:e931.
19. Gulh F, Jaramillo C, Carranza C, Vallejo GA. Molecular Characterization and Diagnosis of Trypanosoma cruzi and T. rangeli. Arch Med Res. 2002;33:362-70.
20. Moser DR, Kirchhoff LV, Donelson JE. Detection of Trypanosoma cruzi by DNA amplification using the polymerase chain reaction.JClinMicrobiol.1989;27:1477-82.
21. Murthy VK, Dibbern KM, Campbell DA. PCR amplification of mini-exon genes differentiates Trypanosoma cruzi from Trypanosoma rangeli. Mol Cell Probes. 1992;6:237-43.
22. Souto RP, Vargas N, Zingales B. Trypanosoma rangeli: discrimination from Trypanosoma cruzi based on a variable domain from the large subunit ribosomal RNA gene. Exp Parasitol. 1999;91:306-14.
23. Requena JM, Jimenez-Ruiz A, Soto M, Lopez MC, Alonso C. Characterization of a highly repeated interspersed DNA sequence of Trypanosoma cruzi: its potential use in diagnosis and strain classification. Mol Biochem Parasitol. 1992;51:271-80.
24. Gil J, Pavia P, Montilla M, Florez AC, Quintero C, Mercado M, et al. Comparison of a PCR test based on the histone H2A/SIRE genes with classical serological tests for the diagnosis of chronic Chagas disease in Colombian patients. Biomedica. 2007;27:83-91.
25. Brasil PE, Castro R, Castro L. Commercial enzyme-linked immunosorbent assay versus polymerase chain reaction for the diagnosis of chronic Chagas disease: a systematic review and meta-analysis. Mem Inst Oswaldo Cruz. 2016 Jan [cited 5 mar 2016];111(1):119. doi: 10.1590/0074-02760150296. Available from: http://www.ncbi.nlm.nih.gov/pubmed/26814640
26. Ramirez JC, Cura CI, da Cruz Moreira O, Lages Silva E, Juiz N, Velázquez E. Analytical Validation of Quantitative Real Time PCR Methods for Quantification of Trypanosoma cruzi DNA.In: Blood Samples from Chagas Disease Patients. J Mol Diagn. 2015;17(5):60515.
27. Ministerio de Salud. Guía Clínica. Guía de Diagnóstico, Tratamiento y Prevención de la Enfermedad de Chagas. Gobierno de Chile. Santiago de Chile: 2011. [citado 20 nov 2015]. Disponible en: http://ivl.ispch.cl/_Documentos%5CTrypanosoma%5CGu%C3%ADa_Clinica_Enf_de_Chagas_2011.pdf
28. Ministério da Saúde (BR). Secretaria de Vigilância em Saúde. Consenso Brasileiro em Doença de Chagas. Rev Soc Bras Med Trop. 2005; 38 Suppl 3:S30. [citado 11 nov 2015]. Disponível em: http://www.suvisa.ba.gov.br/sites/default/files/doenca_transmissao_vetorial/arquivo/2013/08/28/consenso_chagas.pdf
29. Soriano-Arandes A, Angheben A, Serre-Delcor N, Treviño-Maruri B, Prat JG, Jackson Y. Control and Management of Congenital Chagas Disease in Europe and Other Non-Endemic Countries: Current Policies and Practices. Trop Med Int Health. 2016 Mar 2. [cited 5 de mar 2016]. Available in: http://dx.doi.org/10.1111/tmi.12687
30. Roca Saumell C, Soriano Arandes A, Solsona Díaz L, Gascón Brustenga J; Grupo de consenso Chagas-APS. Documento de consenso sobre el abordaje de la enfermedad de Chagas en Atención Primaria de salud de áreas no endémicas. Rev Pediatr Aten Primaria. 2015 [citado 28 mar 2015]; 17:e1-e12. Disponible en: http://www.pap.es/FrontOffice/PAP/front/Articulos/Articulo/_IXus5l_LjPoCV3t1fS0Dm5E9UMK4k4Vi
31. Ruiz A, Pelayo L, Chávez A, Alberti E, Núñez FA, Sarracent J. Estudio sero epidemiológico de la Enfermedad de Chagas en estudiantes de la Escuela Latinoamericana de Medicina. Rev Panam Infectol. 2010;12(3):13-6.
32. Serra MA, Cardosa M, Serra M. Prevalencia de enfermedad de Chagas en estudiantes de medicina de 16 países latinoamericanos de la Escuela Salvador Allende. Medwave. 2012 Jun [citado 26 dic 2015];12(5):e5414. Disponible en: https://plu.mx/medwave/a/0Glv0oykTj9Hu0DrXAiRujVe6nb6tEos8yQL7EvUX0k
33. Bern C, Montgomery SP. An estimate of the burden of Chagas disease in the United States. Clin Infect Dis. 2009 Sept 1;49(5):e52-4.
34. Ávila HA, Pereira JB, Thiemann O, De Paiva E, De Grave W, Morel CM, et al. Detection of Trypanosoma cruzi in blood specimens of chronic chagasic patients by polymerase chain reaction amplification of kinetoplast minicircle DNA: comparison with serology and xenodiagnosis. J Clin Microbiol.1993;31:2421-6.
35. Otani MM, Vinelli E, Kirchhoff LV, del Pozo A, Sands A, Vercauteren G, Sabino EC: WHO comparative evaluation of serologic assays for Chagas disease. Transfusion. 2009;49:1076-82.
36. Afonso AM, Ebell MH, Tarleton RL. A Systematic Review of High Quality Diagnostic Tests for Chagas Disease. PLoS Negl Trop Dis. 2012;6:e1881.
37. Ji MJ, Noh JS, Cho BK, Cho YS, Kim SJ, Yoon BS. Evaluation of SD BIOLINE Chagas Ab Rapid kit. Korean J Lab Med. 2009;29:48-52.
38. Flores-Chávez M, Cruz I, Rodríguez M, Nieto J, Franco E, Gárate T, et al. Comparación de técnicas serológicas convencionales y no convencionales para el diagnóstico de la enfermedad de Chagas importada en España. Enferm Infecc Microbiol Clin. 2010 May [citado 28 mar 2015];28:284-93. Disponible en: http://ac.els-cdn.com/S0213005X0900439X/1-s2.0-S0213005X0900439X-main.pdf?_tid=3c18739e-08cc-11e6-ab39-00000aab0f6c&acdnat=1461358575_2adec615b6f59fd08789a044b8040a84
39. Corral RS, Altcheh JM, Freilij HL. Presence of Ig M antibodies to Trypanosoma cruzi urinary antigen in sera from patients with acute Chagas' disease. Int J Parasitol. 1998 Apr;28(4):589-94.
40. Boes M. Role of natural and immune IgM antibodies in immune responses. Mol Immunol. 2000;37:1141-9.
Recibido: 15 de febrero de 2016.
Aprobado: 15 de abril de 2016.
Jorge Pável Delgado La O': Hospital Militar Central Dr. Carlos J. Finlay. La Habana. Cuba. Correo electrónico: maternofetal@infomed.sld.cu