INTRODUCCIÓN
El hidrocloruro de amantadina (I) (triciclo [3.3.1.1 (3,7)] clorhidrato de decan-1-amina) es un medicamento contra las infecciones por influenza A, su actividad antiviral fue descubierta en 1964 por Davies WL y otros.1 Más tarde, se estudió y aplicó para tratar otras afecciones, como la enfermedad de Parkinson en el período de síntomas tempranos, y la discinesia. Fue aprobado por la Administración de Drogas y Alimentos de los EE.UU. en 19662 y fue utilizado para tratar la infección por influenza A, en la epidemia de influenza asiática.
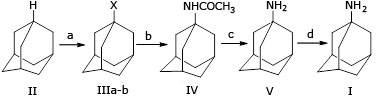
Sistemáticamente, se han informado métodos de modificación y mejora de la síntesis de amantadina y de hidrocloruro de amantadina (I), con el uso una de las siguientes materias primas: adamantano (II),3,4,5,6,7 1-bromoadamantano (III),8,9,10 ácido 1-adamantanocarboxílico,11,12,13 1-adamantanol,14,15 bromuro de 1-adamantil-magnesio,16,17,18 y tetrahidrodiciclopentadieno.19
Muchos estudios han informado la síntesis de hidrocloruro de amantadina a partir de adamantano, a través de tres o cuatro pasos3,5 mediante los cuales la bromación o nitración de adamantano, produce 1-bromoadamantano (IIIa) o nitrato de 1-adamantilo (IIIb), respectivamente. Sin embargo, en la etapa de conversión de (IIIa) o (IIIb) en N- (1-adamantil) acetilamida (IV), se utiliza ácido sulfúrico concentrado y acetonitrilo, luego se trata con hidróxido de sodio en polietilenglicol (PEG), en condiciones de reflujo (240 - 250 °C) para producir amantadina (V). Finalmente, para la formación de sal de amantadina se utiliza HCl anhidro en solución de éter, para producir hidrocloruro de amantadina, con rendimientos globales relativamente bajos, de 45 % a 58 % (Fig. 1).20,21
A partir de esos estudios, para producir hidrocloruro de amantadina (I) a escala industrial, deben abordarse varios problemas. Primero, la etapa de bromación se lleva a cabo bajo reflujo, y puede emitir vapor de bromo, que es venenoso. En segundo lugar, el 1-bromoadamantano (IIIa) es sensible a la humedad y, por lo tanto, no es adecuado para el almacenamiento a largo plazo.22 En tercer lugar, la preocupación por el uso de disolventes, productos químicos y el problema de la temperatura, ya que el benceno y el dietilenglicol (DEG) son muy tóxicos a altas temperaturas.20,21 Especialmente, el DEG se puede descomponer exotérmicamente cuando se calienta a 230 °C, libera gas hidrógeno explosivo y humo ácido.22 Finalmente, el uso de éter como disolvente para la extracción de amantadina, y la posterior formación de hidrocloruro con HCl anhidro en éter, es motivo de preocupación debido a su alta inflamabilidad y formación de peróxidos.20,21,23,24
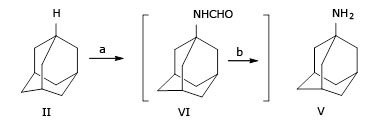
Aunque Wolfgang H ha descrito la síntesis de amantadina (V) a partir de adamantano, a través de dos pasos en un solo lugar, mediante la formamidación de adamantano en n-hexano con una mezcla de ácido hidrociánico líquido y butanol terciario, en presencia de sulfúrico ácido a 25 °C / 2 h para proporcionar N- (1-adamantil) formamida (VI) con una relación molar entre (ácido sulfúrico 96 %: adamantina: n-hexano: ácido hidrocianico líquido: t-butanol) = (65: 1: 1,17: 17: 4). Luego se hidroliza N- (1-adamantil) formamida mediante tratamiento con hidróxido de sodio y dietilenglicol (DEG), en condiciones de reflujo (245 - 259 °C durante 10 h), el producto amantadina se aisla de la mezcla de reacción mediante extracción con éter etílico y produce amantadina (V) con rendimiento del 70 % (Fig. 2):23
Sin embargo, el procedimiento anterior tiene todavía varias desventajas, que incluyen:
el líquido hidrociánico empleado, es un reactivo raro y tóxico.
la relación molar de reactivos entre el ácido sulfúrico 96 %: adamantano: n-hexano: ácido hidrocianico líquido: t-butanol) = (65: 1: 1.17: 17: 4) indica que el ácido sulfúrico y el ácido hidrociánico líquido, son usados en exceso.
el éter como disolvente para la extracción de amantadina, es motivo de preocupación debido a su alta inflamabilidad.
En este artículo, informamos un método modificado para la síntesis de clorhidrato de amantadina, a partir de adamantano, en dos pasos por separado o dentro de una sola locación, con un rendimiento general relativo más alto. En cada paso, se optimizaron las condiciones que afectan el rendimiento del producto intermedio y final. Además, evitar el uso de ácido sulfúrico y de ácido hidrociánico líquido, es también una solución para proteger el medio ambiente, debido a la contaminación resultado de la producción industrial.
MÉTODOS
Con el propósito de establecer las condiciones de reacción adecuadas, para aplicar a escala industrial, se trataron de reducir todos los factores que influyen en el rendimiento del hidrocloruro de amantadina.
1. Efecto de los parámetros de reacción sobre el rendimiento de N- (1-adamantil) formamida (VI).
1.1. Efecto de la temperatura de reacción sobre el rendimiento de N- (1-adamantil) formamida.
Experimento: al ácido nítrico (5 ml, 0,12 mol), se añadió adamantano (II) (1,4 g, 0,01 mol) durante 15 minutos a 25 - 30 °C, luego a esta mezcla se añadió cianuro de potasio (1,47 g, 0,02 mol) en porciones, con agitación a 25 - 30 °C durante 10 minutos. La mezcla de reacción se agitó a 40 - 45 °C, 50 - 55 °C, 50 - 60 °C, 60 - 65 °C, 65 - 70 °C, 70 - 75 °C hasta que concluyó (el final de la reacción se indicó mediante cromatografía de capa fina (TLC); disolvente: mezcla de n-hexano y acetona = 4: 1). Al final de la reacción, la mezcla de reacción se añadió a agua con hielo (15 ml) y se agitó durante 1 h a 0 - 5 °C. Se precipitó un sólido blanco, que se filtró y se lavó con agua fría. El producto obtenido se secó al vacío para producir N- (1-adamantil) formamida (VI) (tabla 1).
Tabla 1 Efecto de la temperatura de la reacción y el tiempo de reacción en el rendimiento de N-(1-adamantil) formamide (VI)

La temperatura de reacción óptima fue de 60 - 65 °C y el tiempo de reacción fue de 5,5 h (véase el número 4 en la tabla 1).
1.2. Efecto de la relación molar entre ácido nítrico y adamantano, sobre el rendimiento de N- (1-adamantil) formamida.
Experimento: en la reacción para la síntesis de N- (1-adamantil) formamida (VI) se realizó la misma operación, que sobre el efecto de la temperatura de reacción y el término de reacción, sobre el rendimiento de N- (1-adamantil) formamida anterior, pero la temperatura de reacción fue de 60 - 65 °C, tiempo de reacción de 5,5 h, e indiferente la relación molar de ácido nítrico y adamantano, de 10: 1 a 16: 1 (tabla 2).
Tabla 2 Efecto de la relación molar entre ácido nítrico y adamantano sobre el rendimiento de N- (1-adamantil) formamida (VI)

El resultado mostró que el uso de la relación molar de (cianuro de potasio: adamantano) = (13:1) obtuvo el mayor rendimiento de N- (1-adamantil) formamida (VI) (véase el número 3 en la tabla 2).
1.3. Efecto de la relación molar entre el cianuro de potasio y el adamantano, sobre el rendimiento de N- (1-adamantil) formamida.
Experimento: en la reacción para la síntesis de N- (1-adamantil) formamida, se realizó la misma operación que sobre el efecto de la relación molar entre ácido nítrico y adamantano, y el rendimiento de N- (1-adamantil) formamida (VI) anterior, pero la relación molar de nítrico y adamantina ácida fue 13: 1 e indiferente la relación molar entre cianuro de potasio y adamantina, de 1.25: 1; 1.5: 1; 1,75: 1; 2.0: 1 y 2.0: 1 (tabla 3).
Tabla 3 Efecto de la relación molar entre cianuro de potasio y adamantano sobre el rendimiento de N- (1-adamantil) formamida (VI)
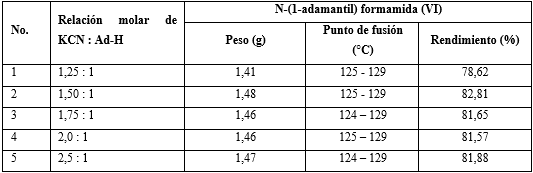
Se encontró que usando una relación molar de (cianuro de potasio: adamantano) = (1,5: 1), se obtuvo el mayor rendimiento de N- (1-adamantil) formamida (VI) (ver No. 2 en la tabla 3).
Para obtener el mayor rendimiento de N- (1-adamantil) formamida (VI), la combinación de los parámetros de reacción fue: temperatura = 60 - 65 °C; tiempo = 5,5 h; relación molar de (ácido nítrico: cianuro de potasio: adamantano) = (13: 1.5: 1).
2. Efecto de los parámetros de reacción sobre la síntesis de amantadina. HCl (I).
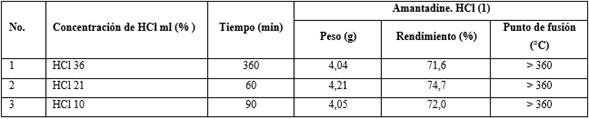
2.1. Efecto de la concentración de HCl sobre el rendimiento de hidrocloruro de amantadina.
Una mezcla de una solución de hidrocloruro (0,09 mol) en diferentes concentraciones (36 %, 21 %, 10 %) y N-formil-1-amino-adamantano (VI) (5,40 g; 0,03 mol), se agitó a temperatura ambiente durante 10 minutos, y luego se calentó a reflujo hasta que la reacción terminó (el final de la reacción se indicó por TLC; disolvente: una mezcla de cloroformo: metanol: 25 % de NH3 acuoso = 6: 1: 1). Luego, la mezcla de reacción se concentró hasta secarla al vacío, se le añadió acetato de etilo (8 ml), la mezcla de reacción se calentó a reflujo durante 0,5 h y luego a 5 - 10 °C durante 1 h. Se precipitó un sólido blanco, que se filtró y se lavó con acetato de etilo enfriado y se secó al vacío para dar hidrocloruro de 1-adamantilamina (I), pf > 360 °C (sin fusión del etanol), Rf = 0,5 (CHCl3: metanol: 25 % de NH3 ac. = 6: 1: 1) (tabla 4).
La concentración óptima de HCl fue del 21 %, y el tiempo de reacción es de 60 minutos (véase el número 2 en la tabla 4).
Experimento: en la reacción para la síntesis de hidrocloruro de amantadina, se realizó con la misma operación que sobre el efecto de la concentración de HCl sobre el rendimiento de amantadina.HCl (I) anterior, pero indiferente a los solventes agua, etanol y metanol (tabla 5).
Los resultados encontraron que el uso de etanol como solvente obtuvo el mayor rendimiento de amantadina. HCl (I) (ver No. 1 en la tabla 5).
2.3. Efecto de la relación molar de HCl: compuesto (VI) sobre el rendimiento de hidrocloruro de amantadina.
Experimento: en la reacción para la síntesis de hidrocloruro de amantadina se realizó la misma operación que sobre el efecto de la concentración de HCl sobre el rendimiento de amantadina. HCl (I) anterior, pero en diferente proporción molar entre HCl y N- (1 -adamantil) formamida (VI) 3: 1, 4: 1, 5: 1, 5.5: 1, 6: 1 (tabla 6).
La combinación de parámetros de la reacción que proporcionaron mayor rendimiento de amantadina. HCl fueron: temperatura = 80 - 85 °C; tiempo = 60 minutos; relación molar de (HCl: N- (1-adamantil) formamida = (5.5: 1); relación de solución de HCl % y etanol = 1: 1 (V/V).
RESULTADOS
En base a las condiciones óptimas, se decidió sintetizar el compuesto intermedio y final.
N- (1-adamantil) formamida (VI):
Se añadió adamantano (II) (5,51 g, 0,04 mol) al ácido nítrico (22 ml, 0,52 mol), con agitación a 25 - 30 °C durante 10 minutos y luego a esta mezcla se añadió cianuro de potasio (3,95 g, 0,06 mol) en porciones, con agitación a 25 - 30 °C durante 20 minutos. La mezcla de reacción se agitó a 60 - 65 °C durante 5,5 h. Al final de la reacción, se añadió agua helada (30 ml) a la mezcla de reacción, con agitación durante 1 h, a 0 - 5 °C. Se precipitó un sólido blanco, que se filtró y se lavó con agua fría. El producto obtenido se secó al vacío para producir N- (1-adamantil) formamida (VI). Rendimiento: 5,94 g (82,85 %). Pureza (GC): 99,20 %, tR 15,90 min; p.f. 125 - 129 °C. MS, m / z: 180,26 [M + 1]+; 166,40; 158,96; 1H-NMR (400 MHz, CDCl3), δ (ppm): 8.27 (d, J = 12,3 Hz, 0,67 H); 8,03 (d, J = 1,7 Hz, 0,33 H); 5,82 (s, 0,65 H); 5,132 (s, 0,35 H); 2,10 (d, J = 18,6 Hz, 3H), 1,84 (d, J = 2,4 Hz, 2 H); 1,74 (d, J = 2,2 Hz, 4 H), 1,69 - 1,65 (m, 6 H); 13C - NMR (100 MHz, CDCl3), δ (ppm): 162,28; 160,30; 52,09; 50,65; 44,11; 41,83; 36,2; 35,80; 29,30; 29.28.
Hidroclururo de amantadina (I):
Una mezcla de N- (1-adamantil) formamida (VI) (5,42 g, 0,03 mol), etanol (13 ml) y HCl concentrado al 36 % (13 ml, 0,165 mol) se agitó a 80 - 85 °C durante 1 h, luego se evaporó al vacío para producir un sólido blanco. Se añadió acetato de etilo (8 ml), se agitó a 50 °C durante 0,5 h, y luego a 0 - 5 °C durante 1 h adicional. El producto sólido blanco, se filtró y se secó al vacío para dar hidrocluro de amantadina (I). Rendimiento: 5,27 g (93,68 %). Rf = 0,5 (CHCl3 / MeOH / NH3 acuoso al 25 % = 6: 1: 1). Pureza (GC): 99,22 %, tR10,10 min; pf 360 °C. MS, m / z: 151,9 [M + 1]+; 134,9 [M-NH2] +; 1H-NMR (500 MHz, CDCl3), δ (ppm): 8,28 (br, s, 3H, NH2.HCl); 2,15 (s, 3H, C3-H, C5-H, C7-H); 2,04 (s, 6H, C4-H2, C6-H2; y C9-H2); 1,69 (s, 6H, C2-H2, C 8-H2, C10-H2); 13C-NMR (125 MHz, CDCl3), δ (ppm): 52,9 (C1); 40,6 (C3 + C5 y C7); 35,4 (C2 + C8 y C10); 29,0 (C4 + C6 y C 9).
Síntesis in situ de hidrocloruro de amantadina (I) a partir de adamantano:
Se añadió adamantano (138 g, 1,0 mol) al ácido nítrico (550 ml, 13 mol) con agitación a 25 - 30 °C durante 30 minutos, luego a esta mezcla se añadió cianuro de potasio (99 g, 1,5 mol) en porciones, con agitación a 25 - 30 °C durante 40 min. La mezcla de reacción se agitó a 60 - 65 °C durante 5,5 h. Al final de la reacción, se añadió agua helada (700 ml) a la mezcla y se agitó durante 1 h 0 - 5 °C. Se precipitó un sólido blanco, que se filtró y se lavó con agua fría. Al producto obtenido se añadió a una mezcla de metanol (430 ml) y una solución de clorhidrato al 36 % (430 ml, 5,5 mol) y se agitó a temperatura ambiente durante 10 minutos, se calentó a reflujo (80 - 85 °C) durante 1 h, luego se evaporó al vacío para producir un sólido blanco, al cual se añadió acetato de etilo (200 ml), se agitó a 50 °C durante 0,5 h, y luego a 0 - 5 °C durante 1 h adicional. El producto final se recogió mediante filtración y fue secado al vacío para producir hidrocloruro de amantadina. Rendimiento: 146 g (77,75 %). Rf = 0,5 (CHCl 3 / MeOH / NH3 acuoso al 25 % = 6: 1: 1).
DISCUSIÓN
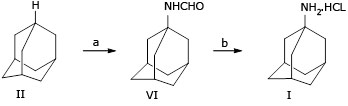
En esta investigación, el compuesto N- (1-adamantil) formamida (VI) se identificó como un intermediario adecuado para preparar hidrocloruro de amantadina, a través de un paso desde adamantano: la conversión directa de adamantano a N- (1-adamantil) formamida (VI) es el paso clave en la síntesis de hidrocloruro de amantadina. La formamidación de adamantano con ácido nítrico y cianuro de potasio, se agitó a 60 - 65 °C durante 5,5 horas y el producto se vertió en hielo, y se obtuvo N- (1-adamantil) formamida (VI). La conversión de N- (1-adamantil) formamida (VI) a hidrocloruro de amantadina se llevó a cabo en condiciones más suaves, sin usar solventes peligrosos (en una solución de HCl al 36 % y etanol al 96 % a 80 - 85 °C hidrocloruro de amantadina), el rendimiento global fue del 78 % (Fig. 3).
Síntesis de N- (1-adamantil) formamida (VI): el compuesto se preparó a partir de adamantano en un paso mediante la reacción de Ritter. En esta reacción, el ácido nítrico indujo la adición de un nitril (−C≡N) al ion de carbenio del adamantano, que en el tratamiento con agua produce N- (1-adamantil) formamida (VI). Este método evitó la bromación o nitración de adamantano (Fig. 1, paso a), eliminando así la necesidad de bromo líquido o ácido nítrico fumante (Fig. 1, paso a), no hizo falta usar ácido hidrociánico líquido ni demasiado ácido sulfúrico (Fig. 2). Además, la temperatura de reacción y el tiempo de reacción (ver tabla 1), la relación molar entre los reactivos (tabla 2 y tabla 3) se optimizaron para reducir el uso de ácido nítrico. El resultado mostró que la reacción se llevó a cabo a 60 - 65 °C durante 5,5 h, la relación molar de (adamantina II: ácido nítrico: cianuro de potasio) fue 1: 13: 1.5 (en cambio, la relación molar de adamantina: ácido sulfúrico: hidrocianico líquido ácido: t-butanol fue 65: 1: 17: 4 en un informe anterior 23). Finalmente, se usó agua como disolvente alternativo al benceno para el aislamiento y la separación de N- (1-adamantil) formamida (VI). Este cambio redujo el nivel de toxicidad del procedimiento descrito.
Síntesis de hidrocloruro de amantadina (I): conversión de N- (1-adamantil) formamida (VI) en hidrocloruro de amantadina en condiciones más suaves y tiempos de reacción más cortos, sin usar solventes peligrosos. Esta reacción de hidrólisis se realizó en una mezcla de una solución de HCl y etanol a 80 - 85 °C durante 1 h, en lugar de hidróxido de sodio en dietilenglicol (DEG) a reflujo 245 - 250 °C durante 15 h (en la Fig. 1) o hidróxido de sodio en dietilenglicol (DEG) a reflujo durante 10 h (en la Fig. 2). La concentración de HCl, el tipo de disolvente para la defomilación de N- (1-adamantil) formamida (VI) en hidrocloruro de amantadina y la relación molar entre HCl y N- (1-adamantil) formamida (VI) también se optimizó para la desformilación (ver tabla 4, tabla 5 y tabla 6), resultó en una temperatura de reacción más baja (80 - 85 °C) y un tiempo de reacción más corto (1 h) que el descrito anteriormente (es decir, 240 - 245 °C; 10 - 15 h).20,21,23
En resumen, la Fig. 3 presenta una síntesis segura y económicamente competitiva de hidrocloruro de amantadina, que es adecuada para trabajar a escala de hectogramos. El compuesto hidrocloruro de amantadina se obtuvo en dos pasos o con dos pasos en una sola locación, con un alto rendimiento general del 78 % (en comparación con rendimientos globales del 45 - 58 % en cuatro pasos 20,21).











 texto en
texto en