INTRODUCCIÓN
Descubierto y descrito por Warren y Marshall, Helicobacter pylori (H. pylori), constituye desde 1983 el agente etiopatogénico de enfermedades gastroduodenales como las úlceras pépticas, cáncer gástrico (CG) y linfoma del tejido linfoide asociado a mucosa (linfoma MALT).1 Existe fuerte asociación de H. pylori con el desarrollo de CG. Desde 1994, está catalogado como carcinógeno tipo 1.2
África, América Latina y el Caribe son las áreas más afectadas, con prevalencias que ascienden hasta 79,1 %, 63,4 % y 54,7 %, respectivamente.3) La infección se relaciona con el nivel socioeconómico bajo, condiciones higiénicas deficientes y elevado hacinamiento.4) Por lo general, se adquiere durante la infancia.
En los países desarrollados el riesgo de infección es de 40 a 60 %. Sin embargo, en países en desarrollo, fundamentalmente en Latinoamérica, puede alcanzar hasta 90 %.5) Estudios publicados en Cuba, reportan altas tasas de prevalencia de H. pylori. Entre ellos, en el año 2009 (en el Instituto de Gastroenterología), González-Carbajal y otros encontraron una prevalencia de 96 % mediante estudio histopatológico.6) Una investigación del año 2016, de Martínez y otros, reportó 83,3 % de prevalencia con el empleo de tres métodos de diagnóstico (serología, histología y cultivo).7
No todas las personas con infección por H. pylori desarrollan CG, cuestión que es importante tener en cuenta, pues no se trata de realizar campañas masivas para erradicar esta infección, sino de diagnosticar y tratar a aquellos que tienen enfermedades relacionadas con esta bacteria. La incidencia del CG varía de acuerdo con la zona geográfica. Esta enfermedad tiene una alta tasa de mortalidad.5) Se encuentra ubicada entre las cinco principales localizaciones de cáncer en el mundo y constituye la segunda causa de muerte por neoplasias malignas.
En los EE.UU., el CG fue la causa principal de muerte por cáncer hasta finales de los años 30. En el año 2015, “se diagnosticaron 24 590 casos (15 540 hombres y 9 050 mujeres), según los cálculos de la Sociedad Americana Contra El Cáncer”.1 Diagnosticar esta enfermedad en estadios iniciales es un reto para la comunidad médica, para disminuir la mortalidad, pues los pacientes en etapas avanzadas tienen peor sobrevida.5
Esta es una de las enfermedades malignas de mayor mortalidad, aun cuando las tasas de CG han disminuido en la mayor parte del mundo.8) En los países en desarrollo el CG se diagnostica casi siempre en etapas avanzadas, lo que explica la poca supervivencia de los pacientes. Japón, sin embargo, realiza campañas de cribado poblacional, lo cual ofrece la posibilidad de diagnosticar en estadios precoces hasta un 60 % de pacientes y esto mejora la supervivencia.9 Como menos del 10 % de los casos son diagnosticados como cáncer incipiente, la supervivencia a cinco años en la población general es casi nula en pacientes con CG.10
Las enfermedades no transmisibles ocupan más de la mitad de la carga mundial de morbilidad, en los momentos actuales. El cáncer es una de ellas y afecta a un gran número de personas. Esto conlleva un cambio de estrategia tanto en el panorama internacional como nacional para el control de estas enfermedades. No se trata solo de diagnosticar, sino también de prevenir y en los casos que no sea posible la prevención porque la enfermedad ya está establecida, por lo menos realizar el diagnóstico en estadios iniciales.
Romero Pérez y otros plantearon que “según datos publicados por GLOBOCAN,10 para el año 2025 se estiman alrededor de 19,3 millones de nuevos casos de cáncer, 11,4 millones de muertes por esta causa, y las proporciones aumentarán en un 59 % y un 68 %, respectivamente, en las regiones menos desarrolladas”.
Cuba tiene altas tasas de incidencia y mortalidad por cáncer.10 “Al cierre de 2016, la tasa de mortalidad general más elevada por tipos de cáncer, correspondió a los tumores malignos de tráquea, bronquios y pulmón, seguida de próstata e intestino, excepto el recto y mama de la mujer”.10) En el año 2015 el CG ocupó el noveno lugar en la población masculina y en los mayores de 20 años, en las tasas de incidencia de cáncer según sexo y edad. Esto convierte a esta enfermedad en un grave problema de salud, que afecta a todas las edades y constituye la primera causa de años de vida potenciales perdidos hasta los 74 años. La “prevención y control de este problema, forma parte de las prioridades del Sistema Nacional de Salud”.10
Cuba cuenta con un programa de atención integral para el control del cáncer, que incluye diferentes acciones preventivas. Aun así, no existen reportes nacionales que caractericen los grupos de riesgo para el CG, ni tampoco hay consenso nacional para el diagnóstico de lesiones precursoras del CG.
Para la revisión bibliográfica se consultaron artículos científicos indexados en idioma español e inglés, relacionados con el tema de la infección por H. pylori y CG, publicados en las bases de datos Pubmed, Scielo, Medline y Cochrane, pertenecientes a autores dedicados al estudio de esta problemática. Los términos empleados para la búsqueda fueron: H. pylori, atrofia gástrica, metaplasia intestinal y displasia.
Criterios para la selección de los artículos revisados: teniendo en cuenta el impacto de la revista donde estaban publicadas y la vigencia del tema en cuestión, se utilizaron 24 citas para realizar la revisión: 18 (últimos cinco años), 3 (últimos 10 años) y 3 con más de 10 años.
El objetivo de esta revisión bibliográfica, es profundizar en los conocimientos relacionados con la infección por H. pylori y el diagnóstico de lesiones precursoras de CG causadas por esta bacteria.
DESARROLLO
El proceso de carcinogénesis gástrica es multifactorial. El H. pylori, aunque es un carcinógeno tipo I, como se dijo anteriormente, no es el único factor de riesgo para esta enfermedad. La interacción entre el huésped y diversos factores ambientales determinan su surgimiento.
Solo 1 - 2 % de los pacientes con H. pylori desarrollan CG.1 Factores genéticos, medioambientales, la infección conjunta por H. pylori y virus de Ebstein-Barr, el bajo nivel socioeconómico, la dieta (consumo de carnes procesadas, pobre ingestión de frutas y vegetales) la anemia perniciosa, la enfermedad de Ménétrier, el grupo sanguíneo A, la inmunodeficiencia variable común y algunas ocupaciones laborales (personas que trabajan en las industrias de metal, carbón y hule) y el tabaquismo, incrementan el riesgo de CG. Los familiares de primer grado de pacientes con CG tienen mayor probabilidad de desarrollarlo.1
El carcinoma gástrico representa la mayor proporción de CG (95 %).12 Otras neoplasias malignas como los linfomas y otros cánceres gástricos primarios (sarcomas y tumores neuroendocrinos), son menos frecuentes.12
H. pylori se ha relacionado con el desarrollo de gastritis crónica atrófica, metaplasia intestinal y displasia, lesiones que pueden evolucionar a carcinoma gástrico.11 Existen investigaciones que demuestran que la erradicación de esta bacteria disminuye el riesgo de progresión histopatológica de las lesiones preneoplásicas, excepto la metaplasia intestinal y la displasia.
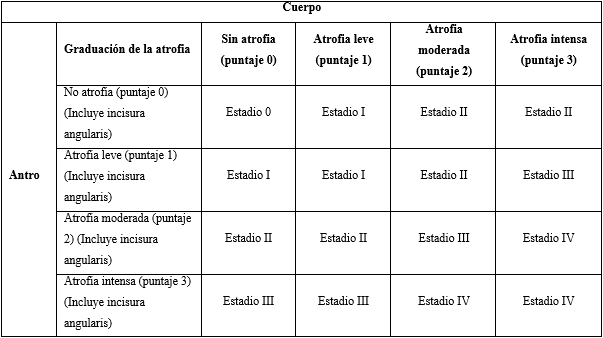
En 1994 las gastritis fueron clasificadas en atróficas y no atróficas por un grupo internacional de gastroenterólogos y patólogos. Posteriormente, Rugue y Correa en el año 2002, definieron a la atrofia gástrica “como la pérdida de glándulas apropiadas de la mucosa gástrica, asumieron bajo este nuevo concepto la atrofia sin metaplasia y la atrofia con metaplasia”.13 Años más tarde, el propio Rugue lideró un grupo internacional de patólogos, que formuló un nuevo sistema histopatológico de estadiaje, al cual denominaron OLGA (Operative Link on Gastritis Assessment)13 que se basó en los conceptos anteriores. El sistema OLGA enfatiza a la atrofia gástrica, como la lesión histopatológica representativa de progresión de la gastritis crónica.( 3)
En el sistema de estadificación OLGA, la atrofia gástrica es considerada una lesión histopatológica representativa de progresión de la enfermedad.13 El estadio de la gastritis resulta de la combinación de la extensión de la atrofia de acuerdo con la clasificación histopatológica con la topografía de la atrofia, identificada mediante mapeo por biopsia (tabla 1). El sistema OLGA confiere una evaluación inmediata de la gravedad de la enfermedad crónica y el riesgo futuro de desarrollar CG.11
El H. pylori causa una respuesta inflamatoria (crónica activa) que, aunque se inicia en el antro, puede afectar toda la mucosa gástrica. Es el agente etiológico más importante asociado a gastritis. Como ya se mencionó, esta infección está relacionada con el surgimiento de lesiones secuenciales preneoplásicas en la mucosa gástrica (gastritis crónica atrófica, metaplasia intestinal y displasia) que pueden evolucionar al CG. La probabilidad de que eso ocurra es mayor en zonas de riesgo elevado para esta enfermedad. Los linfomas primarios de MALT también pueden presentar lesiones preneoplásicas similares en la mucosa gástrica circundante.14
No todas las cepas de H. pylori causan el mismo daño en la mucosa gástrica. La gravedad de la respuesta inflamatoria inducida por H. pylori es determinada por la acción de diversas proteínas citotóxicas; las más reconocidas son CagA y VacA, citoxinas que se asocian con la atrofia y la metaplasia intestinal. CagA, es considerado el marcador de islote de patogenicidad, codifica la síntesis de la proteína citotóxica CagA. Las formas más graves de gastritis y el carcinoma gástrico están relacionados con su presencia.15 VacA está presente en todas las cepas de H. pylori, codifica la proteína citotóxica vacuolizante VacA, con mayor proporción en las cepas VacA s1/m1. Las cepas VacA s1/m1 se relacionan con lesiones preneoplásicas y carcinoma gástrico.15
En poblaciones de alto riesgo el adenocarcinoma gástrico de tipo intestinal está precedido por cambios secuenciales que tienen como común denominador la inflamación, en quienes puede surgir la atrofia y la metaplasia intestinal, para proseguir con la displasia y culminar en cáncer invasor.16 El correcto diagnóstico de gastritis crónica tiene una gran importancia en la práctica clínica, debido a que su progresión, está asociada a un aumento del riesgo de CG.
El sistema Sydney sobreestima la intensidad de la atrofia (solo usa el valor más alto encontrado), por esta razón el sistema OLGA es más preciso. El sistema Sidney no permite pronosticar el riesgo de desarrollar CG.14 La extensión de la atrofia de la mucosa está relacionada con el riesgo de desarrollar cáncer y así lo confirman diferentes estudios. El concepto de atrofia gástrica (anteriormente definida como la pérdida glandular), fue sustituido por la "pérdida de las glándulas adecuadas" en el sistema de Sidney modificado. Para varios autores la atrofia es el dato más importante por evidenciar la progresión hacia enfermedad maligna.14
Cuando se comparan el sistema Sidney y OLGA pueden encontrarse diferencias sustanciales. En el sistema Sydney la atrofia lleva a adelgazamiento de la mucosa y está definida como la pérdida del tejido glandular. Este sistema no proporciona un pronóstico del riesgo futuro de CG. Sin embargo, en el sistema OLGA la atrofia no reemplaza el espesor completo de la mucosa gástrica nativa y esta es el resultado del cambio metaplásico que afecta diferentes partes de la unidad glandular original. OLGA tiene estadios progresivos (0-I-II-III-IV). Los estadios III y IV son de alto riesgo para CG. Dichos estadios se obtienen al combinar el porcentaje de superficie afectada y su proporción al sitio de donde se obtuvo.14
El adenocarcinoma gástrico puede dividirse en dos tipos: el tipo intestinal (tiene buena a moderada diferenciación histopatológica) y el tipo difuso (con grado de diferenciación histopatológica pobre), de acuerdo con la clasificación de Lauren. Existe, además, una variante poco frecuente que es el tipo indeterminado.17
Con frecuencia, el tipo intestinal, se localiza en la porción distal del estómago y predomina en hombres y en personas de bajos ingresos. Se relaciona con factores ambientales como H. pylori. Este tipo de CG tiene una fase precancerosa que inicia con la presencia de gastritis crónica atrófica, seguida de metaplasia intestinal, displasia y finalmente llega al adenocarcinoma.18
Los linfomas gástricos tienen baja incidencia (2 - 5 % de las neoplasias malignas de estómago). Desde el punto de vista histopatológico se clasifican como linfomas no Hodgkin. La infección por H. pylori está fuertemente relacionada con el linfoma MALT,19) de forma tal que la curación de la infección por H. pylori es actualmente el tratamiento de elección de la mayoría de los linfomas MALT gástricos de bajo grado y en estadios iniciales. Sin embargo, en los linfomas MALT gástricos de alto grado o en estadios más avanzados, la erradicación de H. pylori no es suficiente y debe complementarse el tratamiento con quimioterapia, radioterapia o, con menos frecuencia, la cirugía.
Diferentes estudios han relacionado la presencia de H. pylori con el desarrollo de CG.20 La etiología del CG es multifactorial y así lo demuestran los enigmas africano y asiático. En África, la presencia de H. pylori no se correlaciona con el riesgo de desarrollar CG. Asimismo, países asiáticos como la India, Bangladesh, Malasia, Pakistán y Tailandia, presentan elevada prevalencia de H. pylori, sin embargo, la incidencia de CG es más baja que en otros países asiáticos como Japón.21 Existen observaciones interesantes en relación con la dieta. Por ejemplo: la ingesta de curry tiene un efecto protector contra la GCA, los alimentos salados y conservados poseen efecto carcinogénico.22,23
De acuerdo con lo planteado, podría asegurarse que en Cuba también existe un “enigma cubano”, relacionado con las altas tasas de prevalencia de la infección por H. pylori que se han reportado en diferentes estudios realizados en el país, y las tasas de incidencia y prevalencia de CG registradas en el anuario estadístico, en las cuales el CG permanece en el octavo lugar en las tasas de incidencia y prevalencia.13¿O pudiera tratarse de un subregistro de las lesiones precursoras de CG y su búsqueda no adecuada?
Son muchas las hipótesis que tratan de explicar el papel de la infección por H. pylori en la carcinogénesis gástrica, pero hasta la fecha el mecanismo exacto no está bien esclarecido. H. pylori causa un incremento en la proliferación celular y daña el DNA (a partir de la activación y migración de neutrófilos hacia el tejido gástrico, que favorece la producción de óxido nítrico, junto con metabolitos tales como el superóxido e iones hidroxilo, originando mutaciones y transformación maligna en las células del tejido gástrico). También reduce, en la secreción gástrica, los potenciales factores protectores como la vitamina C. Además, se han encontrado alteraciones en genes supresores de tumores en aproximadamente el 50 % de los tumores gástricos de tipo intestinal.22 Otra hipótesis planteada en el proceso de carcinogénesis gástrica es la “migración de células de la médula ósea”, en la que el cáncer se desarrolla a partir de células derivadas de la médula ósea que se diferencian en células gástricas en presencia de H. pylori.22
La carcinogénesis gástrica incluye dos procesos: la muerte celular programada y la hiperproliferación. La apoptosis surge como un mecanismo de protección para prevenir la replicación del DNA mutado. La GCA puede ser el resultado de la muerte celular programada, que está incrementada en los pacientes con H. pylori. Estos fenómenos revierten luego del tratamiento erradicador de la bacteria.24
Las cepas CagA A y VacA positivas se asocian con mayor daño epitelial, mayor inflamación de la mucosa mediada por la producción de interleuquina 8 y el desarrollo de úlcera péptica y CG. Ciertos polimorfismos en la interleuquina 1 beta y otras citoquinas como el factor de necrosis tumoral incrementan el riesgo de desarrollar adenocarcinoma gástrico, al inducir una respuesta de tipo atrófica e hipoclorhidria en la mucosa gástrica en respuesta a la infección por H. pylori. Factores nutricionales como las dietas bajas en vitaminas antioxidantes y la baja ingesta de vegetales y frutas frescas favorecen la conversión de la gastritis crónica activa, en sus estadios iniciales, a GCA.22
Lo anteriormente expuesto, deja explícito que, aunque H. pylori está implicado en la carcinogénesis gástrica la etiología de esta es multifactorial y no puede ser explicada solo por la infección con dicha bacteria. Los esfuerzos de la comunidad médica deben encaminarse tanto al diagnóstico y tratamiento de H. pylori, en los casos que lo requieran, como a la búsqueda de los factores de riesgo que favorecen el desarrollo de CG y a la pesquisa de lesiones premalignas gástricas (atrofia, metaplasia intestinal y displasia), bajo la premisa de la medicina preventiva.