INTRODUCCIÓN
Actualmente no existe tratamiento que detenga la evolución de la esclerosis múltiple (EM). Los objetivos del tratamiento son: disminuir el número de brotes, reducir el número de lesiones cerebrales y su volumen, para retrasar la progresión de la enfermedad. El tratamiento se divide en varias categorías: tratamiento de brotes, fármacos modificadores de la enfermedad (FME), sintomático y rehabilitador.1
Los FME se agrupan en 2: terapias de primera línea (interferón beta-1a, acetato glatiramer) y terapias de segunda línea (fingolimod, natalizumab).
Hay diferentes presentaciones de la EM, la más frecuente es la esclerosis múltiple remitente-recurrente (EMRR). En esta los síntomas ocurren en forma de brotes, que aparecen durante un período, seguidos por otro de recuperación parcial o completa. Por tanto, se pueden controlar adecuadamente con las primeras opciones terapéuticas, en cuanto al control anual de brotes. Los efectos adversos son transitorios y bien tolerados, generalmente.2
Los interferones son una familia de citoquinas que poseen propiedades antivirales, antiproliferativas e inmunomoduladoras. Se pueden clasificar en 2 grupos: el tipo I incluye las variedades alfa y beta; el tipo II, el gamma. El interferón beta fue el primer fármaco inmunomodulador utilizado como tratamiento para la EM. El interferón beta-1a (INF β-1a) tiene propiedades inmunomoduladoras, ha demostrado ser seguro y bien tolerado en pacientes con EMRR. Aunque el mecanismo de acción no se conoce completamente, se sugiere un potencial efecto antiinflamatorio en el sistema nervioso central, que podría contribuir a retrasar la progresión de la enfermedad.3
El inicio de la terapia con interferón ha sido y es el primer paso en el tratamiento de muchos pacientes con EM, pero la respuesta es variable.1 La persistencia de la actividad biológica de la enfermedad, a pesar del tratamiento, se manifiesta por la aparición de nueva actividad clínica (nuevos brotes o progresión de la discapacidad) y de nueva actividad en la resonancia magnética nuclear (RMN).4
En la actualidad no se dispone de biomarcadores que predigan con precisión qué pacientes tendrán una buena respuesta a los FME. La detección de la respuesta al tratamiento es fundamental para seleccionar a los candidatos a recibir un tratamiento alternativo.
El presente estudio tiene como objetivo identificar los marcadores clínicos de respuesta al tratamiento con interferón beta-1a de pacientes con esclerosis múltiple remitente- recurrente.
MÉTODOS
Se realizó un estudio observacional, descriptivo, longitudinal, prospectivo, de una serie de casos de pacientes con diagnóstico de EMRR, que recibieron tratamiento con INF β-1a, en el Hospital Provincial Universitario “Arnaldo Milián Castro”, en el periodo comprendido entre enero del 2014 a diciembre del 2020. Se incluyeron 39 pacientes que cumplieron con los criterios de inclusión.
Los criterios de inclusión fueron:
Pacientes mayores de 18 años de edad, con diagnóstico de EMRR, según los criterios diagnósticos McDonald.5
Que aceptaran voluntariamente participar en el estudio, mediante la firma del consentimiento informado.
Iniciar o haber iniciado tratamiento con INF β-1a s.c. a dosis de 44 𝜇g, administrado en 3 dosis semanales.
Completar 12 meses de tratamiento con buena adherencia y disponer de un seguimiento mínimo de 3 años.
Los criterios de exclusión fueron:
Pacientes afectados de formas secundarias progresivas, o con un síndrome clínicamente aislado.
Haber presentado un brote de la enfermedad durante los últimos 30 días previos al inicio del estudio.
Se estudiaron las siguientes variables:
Edad: según años cumplidos en el momento del estudio.
Sexo.
Origen étnico: caucásico y no caucásico.
Años de evolución: tiempo de evolución de la enfermedad, en años.
Bandas oligoclonales (BO) en el líquido cefalorraquídeo (LCR): presencia o ausencia de BO en el LCR.
IgG en LCR: presencia o ausencia de concentraciones de IgG en el LCR.
Nivel de discapacidad: según la escala Expanded Disability Status Scale (EDSS); presenta una puntuación entre 0 y 10.
Brotes: según número de episodios de exacerbación de la enfermedad; dado por la aparición de un nuevo síntoma o empeoramiento de un déficit previo, atribuibles a la EM, que persiste durante más de 24 horas.
Lesiones que realza el gadolinio (Gd): presencia de actividad inflamatoria reciente en forma de lesiones que se realzan tras la administración de gadolinio en secuencias potenciadas en T1.
Nuevas lesiones en T2: número de nuevas lesiones en secuencias potenciadas en T2.
Edad de inicio de la enfermedad
Tasa anualizada de brotes: se calcula como el número total de brotes dividido para el número total de tiempo por paciente en riesgo de brote.
Lesiones activas en RMN: número de lesiones en T1 que se realzan tras la administración de gadolinio, o nuevas lesiones identificadas en secuencias potenciadas en T2.
Rio score (RS): este sistema puntúa a los pacientes de 0 a 3, basado en la presencia de brotes, el incremento de al menos 1 punto en la EDSS o la presencia de lesiones activas en la RMN durante el primer año de tratamiento con INF β-1a.
La tabla 1 muestra la línea temporal del estudio, así como los instrumentos utilizados para realizar las mediciones de las variables.
Tabla 1 -Línea temporal e instrumentos utilizados para realizar las mediciones de las variables
|
Línea base (medición inicial) |
Primer año de tratamiento (12 meses) |
Segundo año de tratamiento (24 meses) |
Tercer año de tratamiento (36 meses) |
|---|---|---|---|
| EDSS inicial | EDSS | EDSS | EDSS |
| Tasa anualizada de brotes | Brotes | Brotes | Brotes |
| Edad de inicio de la enfermedad | NE | NE | NE |
| Tiempo de evolución antes del tratamiento | NE | NE | NE |
| Taza anulizada de brotes | NE | NE | NE |
| RMN inicial | RMN | NE | NE |
EDSS (Expanded Disability Status Scale), RMN (resonancia magnética nuclear), NE (no evaluado).
Para demostrar la respuesta al tratamiento con INF β-1a durante los 24 y 36 meses se utilizó la combinación de las variables: presencia de brotes o progresión confirmada por EDSS.
Los registros se procesaron mediante el paquete estadístico SPSS v.22.
Se utilizaron medidas descriptivas para las variables edad, sexo, origen étnico, años de evolución, BO en el LCR, IgG en LCR, nivel de discapacidad (EDSS), brotes, lesiones que realza el Gd y nuevas lesiones en T2. Para las variables progresión por EDSS, brotes, edad de inicio de la enfermedad, tiempo evolución antes del tratamiento, tasa anualizada de brotes antes tratamiento, más de 2 lesiones activas, lesiones que realzan Gd y RS, se utilizó el odds ratio (OR) con un intervalo de confianza del 95 % (IC95 %). En las tablas de contingencia se utilizó de la prueba de ji cuadrado (X2). Se calcularon los valores porcentuales de la presencia o ausencia de progresiones por EDSS y brotes y se determinó el OR en los momentos evaluados. Se trabajó con un nivel de significación de p< 0,05.
El estudio se realizó según los requisitos éticos previstos en la Declaración de Helsinski6 para las investigaciones con seres humanos. Se mantuvo el anonimato de los pacientes. El estudio fue autorizado por el Consejo Científico y el Comité de Ética de las Investigaciones del Hospital Provincial Universitario “Arnaldo Milián Castro”.
RESULTADOS
La media de edad y desviación estándar de los pacientes fue 34,54 ± 9,22. Con respecto al sexo, hubo 29 mujeres y 10 hombres. En cuanto al origen étnico, 33 son caucásicos y 6 no caucásicos.
La evolución de la enfermedad muestra una media/desviación estándar de 8,05 ± 3,60 años. Hubo presencia de BO y concentraciones de IgG en el estudio inmunológico del LCR, en el 66,7 % y 87,2 % respectivamente.
El EDSS tuvo las siguientes medias/desviación estándar: en la línea base (1,76 ± 1,29), 12 meses (1,91 ± 1,39), 24 meses (2,1 ± 1,64) y 36 meses (2,37 ± 1,86).
La media/desviación estándar de los brotes fue, en la línea base (1,13 ± 0,52), 12 meses (0,26 ± 0,44), 24 meses (0,38 ± 0,59) y a los 36 meses (0,13 ± 0,33).
La media/desviación estándar de las lesiones que mostraban realce con gadolinio fue en la línea base de 0,59 ± 0,54 y tras los 12 primeros meses de tratamiento, de 0,36 ± 0,66.
Las lesiones nuevas en T2, en la en la línea base fue de 11,38 ± 1,95 y a los 12 meses, de de 0,90 ± 1,16.
En la tabla 2 se muestra la respuesta al tratamiento con IFNb-1a de acuerdo al riesgo de actividad clínica durante el seguimiento en función de la evaluación durante el primer año de tratamiento, en cuanto a la variable combinada progresión por EDSS o brotes durante el seguimiento (24; 36 meses), en función de la evolución durante el primer año de tratamiento: se identifica que la progresión (según la EDSS durante los 12 primeros meses), la tasa anualizada de brotes antes del tratamiento, la edad de inicio de la enfermedad, tiempo de evolución de la enfermedad y lesiones que realzan gadolinio se asociaron de forma significativa según el OR, con mayor probabilidad de no progresión de la enfermedad.
Las variables medidas durante los primeros 12 meses: progresión por EDSS, los brotes, la edad de inicio de la enfermedad, la tasa anualizada de brotes antes del tratamiento y el RS se asociaron de forma significativa según el OR, de no presentar brotes en los siguientes 24 a 36 meses.
La tasa anualizada de brotes antes del tratamiento y un RS 2 se asoció de forma significativa según el OR, de no progresión por EDSS en los siguientes 24 a 36 meses.
Tabla 2 -Respuesta al tratamiento con IFNb-1a de acuerdo al riesgo de actividad clínica durante el seguimiento, en función de la evaluación durante el primer año de tratamiento

*OR: odds ratio; IC 95 %
En la tabla 3 se muestra la progresión en el tiempo, según la EDSS. A partir del momento inicial se manifiestan diferencias que se observan a los 24 meses y al final. Muestra una cifra de progresión inferior en un 51 %. El OR= 2,37 para la no progresión en ese periodo.
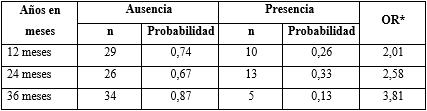
En la tabla 4 se presenta el contraste entre la presencia o ausencia de brotes en el seguimiento. Con el test de ji cuadrado se obtuvo una p= 0,002; se muestra además el OR para cada periodo, lo cual expresa un aumento, entre 2 y 4 veces, de la protección contra la aparición de brotes.
DISCUSIÓN
Estos resultados son mejores que los reportados por Alenda Asensi R,7 que evaluaron cambios en biomarcadores en respuesta al INF β-1a en pacientes con EM y encontraron un porcentaje de respuesta positiva menor que en el presente estudio. Solo el 37,8 % de sus pacientes respondieron al tratamiento con respuesta óptima.
De acuerdo con una investigación de Traboulsee y otros,8 los pacientes fueron asignados al azar a IFN β-1a 22 μg (n= 189), IFN β-1a 44 μg (n= 184) o placebo (n= 187). Al año, los 2 grupos que usaron el IFN β-1a, redujeron el riesgo de progresión de la discapacidad y el número medio de lesiones T2 activas por paciente medicado, en comparación con el placebo. Más pacientes tratados con IFN β-1a lograron el estado de no evidencia de enfermedad activa (no evidence of disease activity - NEDA), en comparación con el placebo. Los resultados clínicos, radiológicos y NEDA en el primer año 1 fueron consistentes con los resultados al segundo año.
Drulovic y otros9 ratifica que el tratamiento con IFN β-1a retrasó el tiempo para alcanzar puntuaciones EDSS 4 y 6 desde el reclutamiento. El retraso para el desarrollo de una puntuación EDSS ≥ 4 desde la primera visita fue de 1,6 años. También hubo diferencias significativas en alcanzar puntuaciones EDSS 4 y 6, a favor del grupo tratado con INF β-1a. Estos datos coinciden con los resultados de esta investigación en la cual hubo retraso para el desarrollo de puntuaciones EDSS hacia valores mayores en la mayor cantidad de pacientes.
Los resultados en este estudio son similares a los reportados por Alcoriza Rodríguez y otros10 quienes obtuvieron un mejor grado de respuesta de la EMRR al tratamiento con INF β-1a. Otro estudio realizado por Castilló Justribó J11 evalúa indicadores precoces de respuesta al tratamiento con interferón en pacientes con EM y reporta que solo el 6,7 % empeora en la escala EDSS tras 1 año de tratamiento. Además, 32 pacientes presentaron al menos un brote de la enfermedad. La valoración de la escala EDSS y los brotes en los pacientes de este estudio muestran resultados favorables en ambos grupos y más en el grupo que llevaba tratamiento con INF β-1a.
Otro estudio12 reciente encuentra menor cantidad de lesiones que realzaban con gadolinio después del tratamiento con INF β-1a. Además, de evidencias de que a menor actividad radiológica de la enfermedad en los primeros 2 años de tratamiento, corresponden mejores resultados clínicos a largo plazo, que aquellos pacientes con evidencias de mayor actividad de la enfermedad. Esto coincide con los resultados que se presentan en esta investigación, que evalúa la actividad radiológica en el primer año de tratamiento.
En un estudio13 realizado en Cuba (el primero de su tipo en el que se comprueba la efectividad del INF β-1a) se observó una reducción significativa en el número de brotes, la puntuación de la escala de discapacidad y el número de lesiones en la RMN. Como resultado se obtuvo que la evaluación de la discapacidad basada en la EDSS mostró una puntuación significativamente menor al final del tratamiento en pacientes con EMRR, en comparación con el estado antes del tratamiento. Ese resultado coincide con los de esta investigación.
Un reporte14) sobre evaluación clínica, radiológica y electrofisiológica de terapias inmunomoduladores en EM compara el uso de IFN β-1a con acetato de glatiramer y Avonex (IFN β-1a intramuscular) y los resultados respaldan la efectividad del INF β-1a en EMRR. En el presente estudio, el RS se analizó de forma longitudinal, con el objeto de evaluar su utilidad en la práctica clínica diaria. Los resultados ratifican los hallazgos previos y demuestran que el RS en pacientes con EMRR tratados con INF β-1a, identifican a los pacientes con mayor riesgo de desarrollar recaídas o progresión de la discapacidad en los 2 años siguientes.
Por otro lado, investigaciones15 previas confirman que el RS= 1 no predice de manera significativa el riesgo de nueva actividad clínica o progresión de la enfermedad en los 2 años siguientes. Estos resultados apoyan el bajo valor predictivo de la presencia de brotes aislados durante los primeros meses de tratamiento con INF β-1a y su baja especificidad, para predecir una progresión confirmada de la discapacidad. De acuerdo con esta investigación, es recomendable la monitorización clínica y radiológica estricta durante los primeros meses de tratamiento, para identificar a los pacientes con riesgo elevado de respuesta clínica subóptima y adoptar medidas terapéuticas oportunas que puedan mejorar el pronóstico antes de que se haya instaurado una discapacidad irreversible.
Una limitación de este estudio es su diseño descriptivo. Sin embargo, muestra los resultados en las condiciones de práctica clínica diaria, en que la utilización de las variables EDDS y brotes ayuda a predecir la actividad clínica futura.
Las variables clínicas, nivel de discapacidad y brotes, constituyen marcadores de respuesta al tratamiento a los pacientes con interferón INF β-1a. Se identifican marcadores clínicos de respuesta al tratamiento con IFN β -1a que ayudan a valorar la respuesta al tratamiento, lo cual repercute de forma positiva en la evolución de la enfermedad.