INTRODUCCIÓN
The American College of Obstetricians and Gynecologists1 considera a la preeclampsia como una de las principales causas de morbilidad y mortalidad materna en todo el mundo. A su vez, tiene una mayor tendencia a desarrollar complicaciones futuras y que los hijos puedan presentar complicaciones a edades tempranas.2 Por ello existe la necesidad de identificar esta enfermedad de manera precoz y evitar estadios clínicos graves.
En forma global, la preeclampsia afecta del 2 % al 8 % de los embarazos.3 En América Latina y el Caribe, los trastornos hipertensivos son responsables del 26 % de las muertes maternas,4 y en EE.UU. se ha producido una incidencia del 25 % en las últimas 2 décadas,5 mientras que en África y Asia contribuyen al 9 % de las muertes.6 En el Perú se ha estimado la razón de mortalidad materna de 82,6 por cada 100 mil nacidos vivos;7 los trastornos hipertensivos son la primera causa directa de muerte con el 21,4 % del total.8
El conocimiento variado de los factores desencadenantes de la preeclamsia podría posibilitar la intervención desde el inicio del embarazo;9 sin embargo, el enfoque nutricional ha sido poco estudiado. A la fecha, existen algunos ensayos clínicos10,11,12 que han evaluado la efectividad de la suplementación de vitamina C y E en conjunto10,11,2,13 y por separado,14,15,16 plantean la hipótesis que la suplementación temprana con estas vitaminas, con función antioxidantes, podría ser eficaz para disminuir el estrés oxidativo y mejorar la función del endotelio vascular, previniendo así el curso de esta enfermedad;17,18 sin embargo, aún existen controversias al respecto.
En este contexto, se tiene como objetivo realizar una revisión sistemática con metanálisis, para demostrar la eficacia conjunta de la Vitamina C y E en la prevención de la preeclamsia.
MÉTODOS
Diseño del estudio
Revisión sistemática (RS) con metanálisis de ensayos clínicos aleatorizados. Se utilizó la declaración PRISMA como guía para este estudio,19 disponible en el material complementario. Esta RS se registró en PROSPERO (CRD42021287051).
Para la búsqueda de artículos científicos se utilizaron las siguientes bases de datos: Pubmed/Medline, SCOPUS, Web of Science, Cochrane Library, EMBASE, y Clinical Trials. Los términos clave que se utilizaron fueron los siguientes: Pre-Eclampsia, vitamin C y vitamin E. La estrategia de búsqueda por cada base de datos se encuentra disponible en el material complementario.
Selección de estudios
Para la selección de estudios se utilizó el software Rayyan (https://rayyan.qcri.org) con el objetivo de guardar los artículos encontrados en la búsqueda de cada base de datos. Dos investigadores principales se encargaron de manera independiente de realizar una revisión de títulos y resúmenes de los artículos encontrados por el software, cumplen con los criterios de selección mencionados.
Los 2 investigadores, de manera independiente clasificaron los artículos y luego compararon sus resultados. Si ambos estaban de acuerdo con que un artículo debía ser “incluido”, se incluía. De igual manera, con los artículos en los cuales cada revisor de forma independiente no estuviera de acuerdo, no se incluía. En caso de haber algún desacuerdo, un tercer revisor tomó la decisión definitiva, luego de evaluar el artículo en cuestión.
Después de la revisión inicial, se procedió a revisar el texto completo de todos los artículos incluidos en el paso anterior. Cada artículo se colocó en una hoja Excel. Ahí, se definió si el estudio era incluido finalmente en la revisión o si era descartado. De ser este último, se escribía adicionalmente la razón de la exclusión.
Finalmente, se obtuvieron los artículos seleccionados para la RS. Como método adicional, se realizó una búsqueda de las referencias bibliográficas en busca de artículos no incluidos. Este proceso también fue realizado por duplicado y siguiendo la metodología previamente ya comentada.
Extracción de datos
Para la extracción de datos de los artículos seleccionados se realizó una ficha de recolección de datos en Microsoft Excel 2016. Se extrajo la siguiente información de cada artículo seleccionado: autor, año de publicación, título, país, población de estudio, periodo de estudio (descripción de días, meses y años), criterios de inclusión, criterios de exclusión, contexto de estudio, intervención, control, desenlaces, financiamiento, y conflicto de intereses de los autores.
Evaluación de riesgo de sesgo
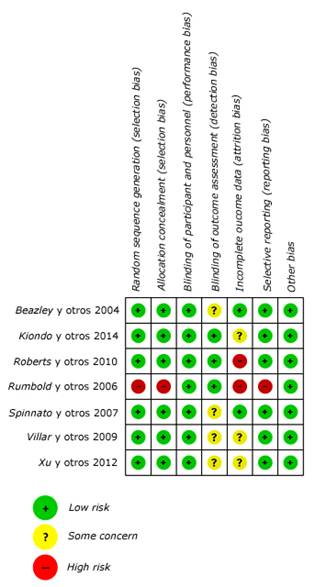
Para evaluar la calidad de estudios seleccionados se utilizó la herramienta de riesgo de sesgo Cochrane versión 2.20 Este proceso fue realizado por 2 investigadores independientes y en caso de un desacuerdo, un tercer investigador tomó la decisión final.
Supervisión y monitoreo de actividades
Se procedió a realizar reuniones interdiarias con el investigador principal, para evaluar el avance del trabajo. Sin embargo, para el proceso inicial de diseño de estrategia de búsqueda, el asesor revisó las estrategias previamente. Esta estrategia de búsqueda fue realizada por el equipo de investigación.
Flujograma de recolección de datos
Se usó un flujograma para mostrar todas las citaciones evaluadas y revisadas, también para los artículos que fueron incluidos, se realizó un diagrama de flujo PRISMA. Esto permitió observar el total de estudios que fueron incluidos en la revisión, así como los que fueron excluidos (Fig. 1).
Análisis cualitativo
Se realizó una evaluación de todos los artículos recolectados con el fin de transmitir una compresión sobre las características de las herramientas de ayuda para la toma de decisiones compartidas. Se describieron características clínicas y metodológicas (estudios incluidos, tamaño de muestra, criterios de inclusión y exclusión), fortalezas y debilidades de todos los estudios incluidos. También se incluyó cómo el diseño o la ejecución de estudios que pudieron sesgar los resultados, la relación entre las características del estudio y los resultados reportados.
Análisis cuantitativo
El metanálisis solamente se realizó cuando al menos 3 estudios estaban disponibles. Las variables de interés se trabajaron de forma dicotomizada. La variable independiente fue desarrollo de preeclamsia y se expresó en si la presentaba o no. La variable dependiente fue la combinación de vitamina C y E, que se trabajó de igual manera, de forma dicotomizada, en si recibió o no. Estos datos categóricos se expresaron como riesgo relativo (RR). Se consideró como criterio de significación un valor de p< 0,05. A su vez, las medidas de asociación fueron calculadas con su intervalo de confianza al 95 % (IC95 %).
La heterogeneidad fue identificada por el I cuadrado (I2).21 Se interpretó de acuerdo con el manual Cochrane: 0 a 40 %= podría no ser importante; 30 a 60 %= puede representar una heterogeneidad moderada; 50 a 90 %= puede representar una heterogeneidad sustancial; 75 a 100 %= heterogeneidad considerable.22 Debido a la heterogeneidad, se realizó un análisis de modelos aleatorios.
Aspectos éticos
El presente estudio es un análisis secundario de estudios primarios publicados en revistas científicas, por lo cual no se solicitó ningún consentimiento a los autores para analizar y presentar la siguiente información.
Este trabajo de investigación fue sometido a evaluación del Comité de Ética en Investigación de la Facultad de Medicina Humana de la Universidad Ricardo Palma (código PG 126 - 021), Lima, Perú.
RESULTADOS
Estudios elegibles
Se identificaron un total de 1 475 publicaciones. Después de remover los duplicados (364) se evaluaron 1 111 manuscritos a través del título y resumen. Luego se excluyeron 1 079 estudios y se obtuvieron 32 artículos a texto completo. Finalmente, luego de aplicar los criterios de selección, se quedó con 7 artículos (Fig. 1).
Características de los estudios
En la tabla 1 se encuentran las principales características de los estudios. De los 7 estudios incluidos, la muestra estuvo conformada desde 109 hasta 2 640 gestantes. Todos los incluidos fueron ensayos clínicos controlados aleatorizados. Del total de casos, el riesgo de preeclampsia con suplementación con las vitaminas C y E tuvo una incidencia del 3,1 % hasta 41,6 %. Mientras que el riesgo de preeclampsia con placebo tuvo una incidencia del 4,1 % hasta 41,3 %. Las mujeres tuvieron un tratamiento diario con vitamina C (1 000 mg) y vitamina E (400 UI) en 6 estudios. En 1 estudio solo se utilizó vitamina C (1 000 mg). Las mujeres tomaron como placebo la celulosa microcristalina, que era idéntica a las tabletas de vitamina C en forma, color y tamaño, y aceite de semilla de girasol, que era idéntica a las tabletas de vitamina E. Las participantes de los estudios tuvieron visitas prenatales de rutina; en cada visita se les tomaba la presión arterial, el peso y excreción de proteínas urinarias.
Un total de 6 estudios definían preeclampsia como 2 tomas de presión arterial con un intervalo de 4 horas entre toma y toma, en el cual la presión arterial sistólica sea mayor de 140 mmHg o una diastólica de 90 mmHg después de la semana 20. La proteinuria se midió con una tira reactiva, en una muestra de orina limpia y en el chorro medio. En 6 estudios lo definieron como proteinuria 300 mg por 24 horas, o 2 o más cruces en 2 o más ocasiones, con 4 horas de diferencia. Finalmente, un estudio no describió como evaluó el evento.
Evaluación del riesgo de sesgo
Los 7 estudios seleccionados fueron evaluados usando la herramienta Rob 2 para ensayos clínicos aleatorios. Seis manuscritos tuvieron una calidad moderada/alta, mientras que uno tuvo una calidad baja. No se evaluó sesgo de publicación debido a la poca cantidad de manuscritos (menos de 10) (Fig. 2).
Metanálisis para Vitamina C y E por preeclampsia
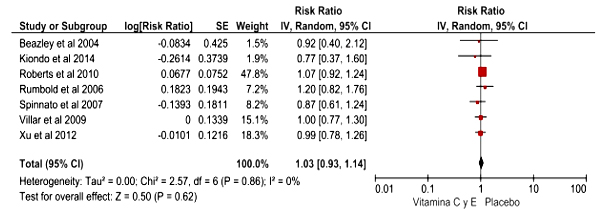
Los estudios de forma independiente no presentaron una asociación estadísticamente significativa. De igual manera, al unir los estudios, de manera global, tampoco hubo una asociación estadísticamente significativa entre ambas variables de interés (RR: 1,03; IC95 %: 0,78-1,26) (Fig. 3).
Todos los estudios incluidos en el análisis presentaron baja heterogeneidad: ji cuadrado (p= 0,85) e I cuadrado (0 %).
DISCUSIÓN
La preeclampsia desencadena efectos materno fetales adversos, por lo que existe una urgencia mayor en identificar predictores clínicos y de laboratorio, es aún más importante identificar formas seguras de prevenir esta enfermedad.23 El presente estudio encontró que la suplementación de estas vitaminas en forma conjunta durante el embarazo, no reduce el riesgo de preeclampsia.
Si bien ya han existido revisiones sistemáticas, con un tiempo de antigüedad de hace más de 10 años,24,25 se consideró necesario una nueva, para detallar si las conclusiones anteriores, de la no utilidad de estas vitaminas, podría haber cambiado con la inclusión de nuevos estudios.
Las razones detrás de la hipótesis del uso de estas vitaminas para la preeclampsia, recaen en el rol oxidativo que se presenta en esta enfermedad.26 Es así como el uso de sustancias antioxidantes podrían servir como un mecanismo preventivo.10,11 Además, el suplemento de otras vitaminas, como la vitamina D,27,28 ha demostrado tener un rol preventivo en la preeclamsia, sin embargo, dado los resultados, no se vio dicho efecto.
A partir de aquí se pueden abordar diferentes explicaciones. Por un lado, es probable que, si bien el estrés oxidativo esté presente en la preeclampsia, su papel no sea muy importante; por lo tanto, no sería posible que su reversión reduzca el riesgo de preeclampsia. Sin embargo, se debe considerar que hay estudios, que han demostrado su rol patogénico en las enfermedades crónicas, incluida esta, por lo que no se puede ignorar su importancia.24 Frente a ello, otra explicación, y la más acertada, es el factor tiempo; la ingesta de estas vitaminas en los ensayos clínicos inició después del embarazo. Justamente, se sabe que el rol nutricional es importante, pero no actúa de manera inmediata, necesita tiempo para ejercer su efecto.24 Si se inició la ingesta en el mismo periodo que inició el embarazo, es probable que no haya tiempo suficiente para actuar sobre la placentogénesis13 y prevenir el desarrollo de la preeclampsia.
Por otro lado, no se puede ignorar el efecto que tiene la vitamina C y E sobre las enfermedades crónicas. Por citar un ejemplo, se ha encontrado que los pacientes con diabetes mellitus tipo 2 tienen niveles bajos de antioxidantes, por lo que se investigó la hipótesis de que estas deficiencias representan una compensación inadecuada de un aumento del estrés oxidativo.29 Frente a ello, en un ensayo clínico aleatorizado30 se mostró que los pacientes diabéticos que recibieron suplementación con vitamina C (1 000 mg) presentaban niveles más bajos de glucosa en sangre, a diferencia de los que no lo tomaron.
Es importante reconocer que en el embarazo existe mayor demanda nutricional, en el que una alimentación materna inadecuada estaría más propensa a complicaciones, como preeclampsia, partos prematuros e incluso aumento de mortalidad.31 Por ello, también es importante cuantificar los niveles de vitaminas en este grupo de pacientes.
El presente trabajo presenta las siguientes limitaciones: en primer lugar, varios de los estudios seleccionados presentaron diferencias de cómo fueron seleccionados los criterios para definir la preeclampsia. Incluso, uno de ellos no mencionaba cómo fue medido dicho resultado. En segundo lugar, existen diferencias en la variación de los tamaños de muestra, el mínimo fue 109 mujeres y el máximo 2 640. Otro aspecto es la duración de la terapia con la suplementación de vitamina C y E, algunas fueron reclutadas entre las 12 y 22 semanas de embarazo, hasta el momento del nacimiento. Esta variación puede ser debido a falta de conocimiento sobre estos aspectos por parte de la comunidad científica.
A pesar de estas limitaciones, la fiabilidad de los resultados está respaldada por el uso de la metodología más rigurosa para realizar una revisión sistemática de ensayos controlados aleatorizados; la inclusión de ensayos planificados que investigaron la eficacia de las vitaminas C y E para la prevención de preeclampsia y los estrechos intervalos de confianza obtenidos, que hicieron que estos resultados sean más precisos.
La suplementación dual de vitamina C y E no previene la preeclamsia en gestantes con riesgo de padecer la enfermedad.