Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de Salud Animal
versión impresa ISSN 0253-570X
Rev Salud Anim. v.31 n.2 La Habana Mayo-ago. 2009
Artículo original
NIVELES DE AFLATOXINA M1 EN QUESOS FRESCOS PRODUCIDOS EN DIFERENTES ZONAS DE MÉXICO
LEVELS OF AFLATOXIN M1 IN FRESCH CHEESES PRODUCED IN MEXICO
G. Urbán*, J. Pérez*, F. Martínez*, J. Salas*, G. Díaz*, M.L. Ramírez*, G. Castro*, S. Vega*, R. Gutiérrez* y A. Escobar**
*Departamento de Producción Agrícola y Animal. Universidad Autónoma Metropolitana Unidad Xochimilco, México, D.F. 1*E-mail: svega@correo.xoc.uam.mx; **Centro Nacional de Sanidad Agropecuaria (CENSA), Apartado 10, San José de las Lajas, La Habana, Cuba
RESUMEN
El objetivo de este estudio fue evaluar el contenido de aflatoxina M1 (AFM1) en quesos frescos tipo panela producidos en varias zonas de México. Las muestras se tomaron durante el periodo de agosto del 2007 a abril del 2008 en supermercados de la ciudad de México, donde se ofertan quesos provenientes de diversas industrias y zonas de México. Las muestras se procesaron y aalizaron por cromatografía de líquidos de alta resolución (HPLC) bajo las directrices de métodos propuestos por la AOAC. Los resultados evidenciaron que todas las industrias queseras presentaron incidencia de AFM1. El 27 % de las muestras positivas estuvieron por encima del nivel de tolerancia establecido por algunos países (0.25 µg/Kg) como Austria, Honduras, Suiza y Turquía.
Palabras clave: aflatoxina M1; queso; México
ABSTRACT
The aim of this study was to evaluate the content of aflatoxin M1 (AFM1) in fresh cheeses type panela produced in several places of Mexico. Samples were taken during the period from August, 2007 to April, 2008 in supermarkets of Mexico City, where cheeses from diverse industries and places of Mexico are offered. Samples were tried and analyzed by high pressure liquid chromatography (HPLC) under the directives of methods proposed by the AOAC. The results showed that all cheese industries had incidence of AFM1. The 27 % of the positive samples was overheading of the tolerance level established by some countries (0.25 µg/Kg) like Austria, Honduras, Switzerland and Turkey.
Key words: aflatoxin M1; cheese; Mexico
INTRODUCCIÓN
Las aflatoxinas son sustancias tóxicas producidas en el metabolismo secundario de varias especies de Aspergillus y Penicillium y aparecen como contaminantes naturales en los alimentos cuando las condiciones climáticas (humedad y temperatura) son propicias (1) Se estima que el 25% de la producción mundial de cereales se encuentra contaminada con algún tipo micotoxinas (2).La aflatoxina M1 (AFM1) es un metabolito hidrolizado de la aflatoxina B1 (AFB1) que se excreta en la leche de animales lactando en una relación entre el 1-3% de la concentración inicial de AFB1 presente en el alimento consumido, variando de animal a animal, de día a día o de ordeño a ordeño(3).
Se ha demostrado el efecto carcinogénico, teratogénico e inmunosupresor de ambas aflatoxinas en diferentes especies, lo que ha permitido que la Agencia Internacional para la Investigación del Cáncer (IARC) ha clasificado a las aflatoxinas B1 y M1 en el grupo 1 como carcinógenos humanos (4).
Se ha demostrado que la AFM1 presente en la leche no se degrada totalmente durante su proceso tecnológico en la producción de derivados lácteos (5-7) y por otra parte la unión de la AFM1 a las proteínas de la leche hace que su concentración sea mayor en la cuajada que en la propia leche (5,6,8). Todo lo anterior constituye un problema muy serio para la inocuidad, lo que ha conllevado que más de 60 países han regulado el límite máximo permisible (LMP) de esta toxina en la leche y derivados lácteos, existiendo dos tendencias en su reglamentación 0.05 y 0.5 µg/kg (9). El LMP de 0.5 µg/kg ha sido establecido en la mayoría de los países América Latina y armonizado en MERCOSUR (10), mientras el 0.05 µg/kg lo asume la mayor parte de los países de Europa (11).
En México se ha reportado la presencia de AFM1 en leche en polvo y fluida comercializadas durante la década del 90 (12,13) y más recientemente en el estado de Hidalgo y en el Altiplano Mexicano (14,15), donde pone en evidencia que la presencia de aflatoxina M1 en leche es una problemática actual en México.
El alto porcentaje de AFM1 encontrado en la leche producida de manera convencional y orgánica en el estado de México sobrepasa el LMP (0.5 µg/kg) de esta sustancia en la leche (15) y la misma no se destruye por los procesos tecnológicos, lo que hace suponer una alta incidencia de esta toxina en productos lácteos con énfasis en la producción de queso, por lo que el objetivo de este trabajo fue evaluar por cromatografía de líquidos de alta resolución los contenidos de AFM1 en quesos producidos en varias zonas del país.
MATERIALES Y MÉTODOS
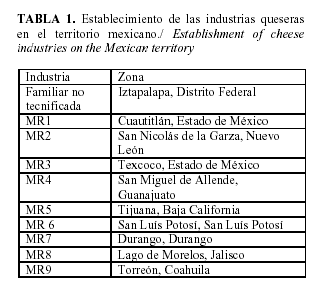
Toma de muestras. Se colectaron muestras de 250 g cada una de queso fresco tipo panela durante agosto del 2007 a abril del 2008, con una frecuencia mensual. Las muestras fueron provenientes de una unidad de producción de queso con características artesanales (industria familiar no tecnificada) y otras 9 industrias queseras con marcas registradas (MR) de diferentes zonas de México (Tabla 1). El número de muestras por industria fue de 10, para un total de 90. La toma de muestras se realizó según las directrices establecidas en Norma Mexicana (16).
Extracción y purificación de la AFM1. Se llevó a cabo según se describe en el método oficial de la AOAC 980.21 (17) La AFM1 se extrajo del queso (15 g) mediante cloroformo (100 mL) por agitación mecánica (licuadora), se filtró y este filtrado se purificó en columna de vidrio empacada con 2 g de sílica gel y sulfato de sodio anhidro, mediante un lavado con tolueno-acetato (9:1) y otro más con hexano-éter-acetonitrilo (5:3:2), finalmente se eluyó con cloroformo-acetona (8:2). El extracto que contenía las aflatoxinas se rotoevaporó hasta sequedad y se guardó a -20°C hasta su derivatización.
Derivatización. Se siguió lo establecido para leche fluida por el método 986.16 de la AOAC (18). Al extracto purificado y seco se le adicionaron 100 µL de hexano más 50 µL de TFA, se dejó reposar durante 40 minutos. Se llevó a sequedad bajo corriente débil de nitrógeno. Posteriormente se recuperó con 500 µL de fase móvil e inyectaron 50 µL al cromatógrafo de líquidos.
Análisis cromatográfico. Se utilizó un cromatógrafo de líquidos Merck-Hitachi con detector de fluorescencia (bomba L-6200 A y detector L-7480), longitud de onda de excitación y emisión: 365 y 425 nm respectivamente, y columna fase reversa (Lichrocart 100 C18, 5 µm, 250 x 0.4 mm). La fase móvil estuvo compuesta por acetonitrilo-metanol-agua (20:20:60) con un flujo de 1 mL/min. El volumen de inyección de las muestras y patrón de AFM1 fue de 50 µL, previamente filtrados por membrana millipore (0.45 µm Æ). Los cromatogramas fueron registrados utilizando una interfase Perkin Elmer NCI 900 y procesados con el Software Totalchrom versión 6.2.
Identificación y cuantificación. La preparación de la solución patrón de AFM1 (Sigma-Aldrich) se realizó por el método 971.22 (19). A continuación se prepararon diluciones del patrón en un rango de 0.5 a 10 µg/mL de metanol y se tomaron 50 µL de cada solución traspasándose a un tubo cónico cerrado. Cada solución se secó bajo corriente de nitrógeno y se derivatizaron de forma similar a lo expuesto en las muestras de queso. Para identificar y cuantificar la AFM1 en las muestras problemas se empleó el método de estándar externo comparando los perfiles cromatográficos (tiempos de retención y áreas de los picos).
Evaluación del desempeño del método
Especificidad Se preparó una solución madre (SM) de los patrones de aflatoxinas B1 y M1 en metanol a una concentración de 1 mg/mL. La solución de trabajo (ST) se preparó a partir de una dilución de la SM con la fase móvil a una concentración de 0.5 µg/mL.
Linealidad: Se procesaron cuatro concentraciones en un rango de 0.5-10 µg/mL del patrón de referencia por triplicado para determinar la pendiente, el intercepto y el coeficiente de correlación entre el área y la concentración del analito. Para la determinación del límite de detección y cuantificación se procesaron dos curvas, una en el rango normal de la determinación (0.5-10 ìg/mL) y la otra cercana al límite de detección (0.25 -0.7 ìg/mL) por triplicado en cada uno de los puntos. Se procedió a determinar los valores de LD y LC y se consideró tres y diez desviaciones estándar del blanco para (n) medidas individuales. (ecuaciones 1 y 2).
Límite de detección = (Ybl + 3 Sbl )/b (1)
Límite de cuantificación = (Ybl + 10 Sbl )/b (2)
La sensibilidad de calibración corresponde con la pendiente de la curva de calibración y la sensibilidad analítica es el cociente entre la sensibilidad de calibración y la desviación estándar de la medida.
Exactitud: Se prepararon dos niveles de concentración de aflatoxina M1 por triplicado (0.5 5 µg/L en una muestra de queso y se comparó con la misma muestra para el cálculo del recobrado por comparación de las cantidades teóricas con los valores determinados.
Técnicas estadísticas utilizadas. Exploración de datos, estadística descriptiva, análisis de la varianza seguido de la prueba de Tukey y regresión lineal simple. Se usó el paquete estadístico SPSS versión 15.0 para Windows.
RESULTADOS Y DISCUSIÓN
A diferencia de otros procedimientos oficiales que emplean columna de inmunoafinidad en la purificación y detección fluorescente para la determinación de AFM1 en queso (20-22), en este trabajo se combinó diferentes métodos de la AOAC: el uso de columna de extracción de fase sólida (C18) en la purificación, la prederivación de la muestra con acido trifluoroacético y la determinación por HPLC empleando columna de fase reversa con detección fluorescente.
Los resultados de especificidad se observa en la Figura 1 donde las aflatoxinas M1 y B1 aparecen a los tiempos de 3.08±0.10 y 5.21±0.10 min respectivamente pudiendo identificar las dos aflatoxinas con un nivel de resolución mayor que uno. En la figura 1B y 1C se observa que el queso blanco (libre de micotoxinas) no presenta picos interferentes en la región de 3.14 min donde aparece solamente la aflatoxina M1.
La linealidad del método presentó un coeficiente de determinación de 0.9982 y la ecuación de la recta de mejor ajuste fue y = 103281x - 5948.7. Los límites de detección y cuantificación fueron 0.221 y 0.560 µg/kg respectivamente. El recobrado medio (exactitud) de aflatoxina M1 en queso en los niveles de 0.5 y 5 µg/kg fue de 83.6±15%.
Los bajos tiempos de retención encontrado para AFM1 en este trabajo con respecto a otros reportados entre 8-12 min (23,24), se debe a que nosotros derivatizamos la AFM1 con ácido trifluoracético y se forma el derivado de aflatoxina M2a (AFM2a) que sale a un tiempo de retención menor que la AFM1. Resultados similares se obtuvieron por Stubblefield cuando optimizó las condiciones de reacción (25). Por otra parte al tener una mayor densidad de electrones en la AFM2a que la AFM1 en su estructura hace que se detecte menor concentración en la muestra analizada, debido a que incrementa su señal fluorescente (26). De manera general los parámetros de desempeño obtenidos están acorde con lo establecido para un método de análisis cuantitativo (27), lo que permite detectar las concentración de AFM1 exigida por los organismos reguladores (CODEX, UE, MERCOSUR) para queso (250ng/g).
En la Tabla 2 se observa que todas las industrias presentaron incidencia de AFM1, donde el D.F. y el Estado de México fueron las 2 zonas con mayor incidencia de ocurrencia en sus quesos (55.65%), mientras que en el estado de Tijuana (MR5) sólo una muestra se encontró contaminada (11.1%). De acuerdo al nivel de tolerancia de AFM1 en queso (0.25 µg/Kg) establecido por algunos países como Austria, Honduras, Suiza y Turquía (28) se observa que el 27.77% de las muestras analizadas presentaron niveles por encima del LMP, con una mediana que osciló entre 0.19 y 1.22 µg/kg. La alta variabilidad de los resultados puede estar dado por los niveles de AFM1 presente en la leche, donde se ha reportado valores que oscilan entre 0.5 y 50 µg de AFM1/kg en muestras procedentes del altiplano Mexicano (15) Estudios realizados en la determinación de AFM1 en quesos durante el 2000-2008 muestran una alta incidencia de esta toxina en diferentes variedades de queso (29-31), que si se compara con los resultados obtenidos durante las décadas del 70 al 90 se observa la misma problemática (32,33). Todo lo anterior corrobora la necesidad de contar con un sistema de análisis de riesgo de puntos críticos que favorezca la disminución de AFB1 en la ración que consumen los animales y a su vez una menor concentración de AFM1 en la leche (34).
En la Figura 1 se muestra que la mayor frecuencia de aparición de AFM1 en queso aparece a finales de la época de lluvia, aspecto que puede estar relacionado con condiciones climáticas de humedad y temperatura que pueden favorecer la proliferación de los hongos. En diversos países de Europa se ha reportado que la mayor incidencia de aflatoxina M1 en leche y derivados lácteos aparecen en los meses de invierno (35;36) y esto se explica porque se consume más concentrado debido al déficit de pasto en esa temporada. Un estudio realizado en México a finales de la década del 90 reportó la mayor incidencia de aflatoxicol y aflatoxina M1 en leche en los meses de septiembre a octubre(13,37), estos resultados confirman que ademas de la estación existen otros factores que están muy interrelacionados como son: el tipo de alimento, el sistema de producción y las propias condiciones climáticas que no permite distinguir el rol de cada variable en los niveles de contaminación (38).
Los resultados anteriores muestran que la situación en el estado de México es compleja dada la insuficiente investigación al respecto. Los estudios realizados en el país han evidenciado que la presencia de AFM1 en la leche y queso es frecuente y por tanto se deben formular políticas sanitarias para enfrentar este problema. La información de este trabajo es limitada, por lo que se sugiere tomar y analizar más muestras, ya que el queso es uno de los principales derivados de la leche y de los alimentos más importantes para el hombre en cualquier etapa de su vida, garantizando con ello un alimento inocuo para la población mexicana.
REFERENCIAS
1. Scussel VM. Micotoxinas em alimentos. Editora Insular Ltda, ME Editor Nelson Rolim de Moura. 1998; Capítulo 3:19-30.
2. FAO. Inocuidad y calidad de los alimentos. En: El Servicio de Calidad de los Alimentos y Normas Alimentarias (AGNS) de la FAO [cited 2008 octuber] avialble from http://www.faoorg/ag/agn/agns/chemicals_mycotoxins_esasp.
3. IPCS. Aflatoxin M1. En:Safety evaluation of certain mycotoxins in food. FAO Food and Nutrition PAPER 74, WHO Food Additives SERIES 47. 2001:1-102.
4. IARC. Some traditional herbal medicines, some mycotoxins, naphthalene and styrene En: IARC MONOGRAPHS ON THE EVALUATION OF CARCINOGENIC RISKS TO HUMANS. 2002;Vol 82.
5. Barbiroli A, Bonomi F, Benedetti S, et al. Binding of aflatoxin M1 to different protein fractions in ovine and caprine milk. J Dairy Sci. 2007; 90(2):532-40.
6. Battacone G, Nudda A, Palomba M, Pascale M, Nicolussi P, Pulina G. Transfer of Aflatoxin B1 from Feed to Milk and from Milk to Curd and Whey in Dairy Sheep Fed Artificially Contaminated Concentrates. J Dairy Sci. 2005;88(9):3063-9.
7. Deveci O, Sezgin E. Changes in concentration of aflatoxin M1 during manufacture and storage of skim milk powder. J Food Prot. 2006;69(3):682-5.
8. Oruc HH, Cibik R, Yilmaz E, Gunes E. Fate of aflatoxin M1 in kashar cheese. J Food Safety. 2007;27(1):82-90.
9. FAO. Reglamentos a nivel mundial para las micotoxinas en los alimentos y en las raciones en el año 2003. ESTUDIO FAO: ALIMENTACIÓN Y NUTRICIÓN ; Paper 81 [cited 2008 oct 3] Available from http://wwwfaoorg/docrep/007/y5499s/y5499s00htm.
10.MERCOSUR. Resoluciones Mercosur / Aflotoxinas. Mercosur - GMC - Res. N°056/94 - Incorporada por Resolución MSyAS N° 110 del 4.04.95, [cited 2008 oct 3] Available from http://wwwmaagbagovar/alimentacion/ ml_mercosur/ aflatoxinas_56-94_php.
11.van Egmond HP, Schothorst RC, Jonker MA. Regulations relating to mycotoxins in food: perspectives in a global and European context. Analytical And Bioanalytical Chemistry. 2007;389(1):147-57.
12.Esqueda M, Higuera-Ciapara I, Nieblas J. Aflatoxina M1 en leche comercializada en Hermosillo, Sonora, México. Rev Mex Mic 1995;11:179-83.
13.Carvajal M, Bolaños A, Rojo F, Méndez I. Aflatoxin M1 in pasteurized and ultrapasteurized milk with different fat content in Mexico. J Food Prot. 2003;66(10):1885-92.
14.Cordova A, Oaxaca J, Lang G, et al. Identification of M1 aflatoxin in milk of the collector tank. J Ani Vet Advances. 2007;6(2):194-7.
15.Pérez J, Gutiérrez R, Vega S, et al. Ocurrencia de aflatoxina M1 en leches cruda, ultrapasteurizadas y orgánica en el Altiplano Mexicano. Rev Salud Anim. 2008;30(2):103-9.
16.COFOCALEC. Sistema producto leche-Producto leche-Alimentos-Lácteos. Guía para el muestreo de leche y productos lácteos. México. Norma Mexicana NMX-F-718-COFOCALEC-2006 2006:P. 31.
17.AOAC. Aflatoxin M1 in milk and Cheese. Method 980.21. . In: Official Method of Analysis of AOAC International 16th Edition Volume II Food composition; additives; natural contaminants Cap 49 (49302 C y D )Natural Toxins Peter M Scott P 2000. p.37-38.
18.AOAC. Aflatoxins M1 and M2 in fluid milk. Liquid Chromatographic Method 986.16. In: Official Method of Analysis of AOAC International 17th Edition Volume II Ed Patricia Cinnif Cap 49(49306 E) Natural Toxins Peter M Scott P 2000. p.40-41.
19.AOAC. Standards for Aflatoxins. Method 971.22. In: Official Method of Analysis of AOAC International 17th Edition Volume II Food composition; additives; natural contaminants Cap 49(49203 B y C) Natural Toxins Peter M Scott P 2000. p.4-5.
20.Oruc HH, Cibik R, Yilmaz E, Kalkanli O. Distribution and stability of Aflatoxin M 1 during processing and ripening of traditional white pickled cheese. Food Additives & Contaminants. 2006;23(2):190-5.
21.Tekinsen KK, Ucar G. Aflatoxin M1 levels in butter and cream cheese consumed in Turkey. Food Control. 2008;19(1):27-30.
22.Dragacci S, Gleizes E, Fremy JM, Candlish AA. Use of immunoaffinity chromatography as a purification step for the determination of aflatoxin M1 in cheeses. Food Additives And Contaminants. 1995;12(1):59-65.
23.Gallo P, Salzillo A, Rosini C, Urbani V, Serpe L. Aflatoxin M1determination in milk: Method validation and contamination levels in samples from southern Italy. Ital J Food Sci. 2006;18(3):251-9.
24.Cavaliere C, Foglia P, Guarino C, et al. Aflatoxin M1 determination in cheese by liquid chromatography-tandem mass spectrometry. J Chromatogr A. 2006;1135(2):135-41.
25.Stubblefield RD. Optimum conditions for formation of aflatoxin M1-trifluoroacetic acid derivative. J Assoc Off Anal Chem. 1987;70(6):1047-9.
26.Beaver R. Effects of injection solvent and mobile phase on efficiency in reverse-phase liquid chromatographic determination of aflatoxin M1. J Assoc Off Anal Chem. 1990;73(1):69-70.
27.CENAM. Métodos analíticos adecuados a su propósito. Guía de laboratorio para la validación de métodos y temas relacionados. Segunda edición. Publicación técnica Centro Nacional de Metrología Publicación técnica CNM-MRD-PT-030 Querétaro, México P 67. 2005.
28.Colak H, Hampikyan H, Ulusoy B. Comparison of a competitive ELISA with an HPLC method for the determination of aflatoxin M1 in turkish white, kasar and tulum cheeses. Eur Food Res Technol. 2006;223(6):719-23.
29.Aycicek H, Aksoy A, Saygi S. Determination of aflatoxin levels in some dairy and food products which consumed in Ankara, Turkey. Food Control. 2005;16(3):263-6.
30.Elgerbi AM, Aidoo KE, Candlish AAG, Tester RF. Occurrence of aflatoxin M1 in randomly selected North African milk and cheese samples. Food Addit Contam. 2004;21(6):592-7.
31.Tekinºen K, Tekinºen O. Aflatoxin M1 in white pickle and Van otlu (herb) cheeses consumed in southeastern Turkey. Food Control. 2005;16(7):565-8.
32.Piva G, Pietri A, Carini E. Ocurrence of aflatoxin M1 in dairy products I.Italian milk and cheese. La Rivista della Societa Italiana di Scienza dell Alimentazione. 1985;14(1):59-62.
33.Barbieri G, Bergamini C, Ori E, Resca P. Aflatoxin M1 in Parmesan cheese:HPLC determination. J Food Sci. 1994; 59(6):1313&31.
34.Bergamo P, Torjusen H, Wyss G, Kirsten B. Producción de Leche. Control de la Calidad y Seguridad en las Cadenas de Producción Orgánica. [ update 2005, cited 2008 octuber] avialable from http://orgprintsorg/view/projects/eu-organic-haccphtml.
35.Kamkar A. A study on the occurrence of aflatoxin M1 in raw milk produced in Sarab city of Iran. Food Control. 2005;16(7):593-9.
36.Tajkarimi M, Shojaee Aliabadi F, Salah Nejad M, Pursoltani H, Motallebi AA, Mahdavi H. Aflatoxin M1 contamination in winter and summer milk in 14 states in Iran. Food Control 2008;19:1033-6.
37.Carvajal M, Rojo F, Méndez I, Bolaños A. Aflatoxin B1 and its interconverting metabolite aflatoxicol in milk: the situation in Mexico. Food Addit Contam. 2003;20(11):1077-86.
38.Galvano F, Galofaro V, De Angelis A, Galvano M, Bognanno M, Galvano G. Survey of the occurrence of aflatoxin M1 in dairy products marketed in Italy. J Food Protec. 1998; 61(6):738-41.
(Recibido 4-11-2008; Aceptado 10-4-2009)














