Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de Salud Animal
versión impresa ISSN 0253-570X
Rev Salud Anim. v.32 n.1 La Habana ene.-abr. 2010
Comunicación corta
IDENTIFICACIÓN DEL GEN syl EN AISLAMIENTOS CUBANOS Streptococcus suis PROCEDENTES DE CERDOS MEDIANTE LA REACCIÓN EN CADENA DE LA POLIMERASA (PCR)
IDENTIFICATION OF syl GENE IN CUBAN ISOLATES OF Streptococcus suis FROM SWINE USING THE POLYMERASE CHAIN REACTION (PCR)
Ivette Espinosa, Patricia Domínguez, Evelyn Lobo, P. Alfonso, Siomara Martínez
Dpto. Biología Molecular., Centro Nacional de Sanidad Agropecuaria (CENSA), Apartado 10, San José de las Lajas, La Habana. Correo electrónico: espinosa@censa.edu.cu
RESUMEN
Streptococcus suis es un coco anaerobio facultativo, considerado un importante agente asociado a meningitis, artritis, endocarditis y neumonía en cerdos. En este trabajo se realizó el aislamiento de S.suis a partir de diferentes condiciones clínicas como neumonía, abscesos en articulaciones y tonsilas de animales asintomáticos. Se identificaron 14 cepas de S. suis: 11 a partir de pulmones, 2 de abscesos y 1 de tonsila. Las cepas mostraron diferentes patrones de pruebas bioquímicas. El gen que codifica para la hemolisina denominados suilisina (syl) se detectó por PCR solamente en 5 cepas de las cuales 4 proceden de pulmón y una de tonsila. Sin embargo, en los aislamientos procedentes de abscesos y asociados a artritis no se detectó la presencia de este gen, lo cual muestra un comportamiento similar a las cepas presentes en Norte América syl -, asociadas a enfermedad invasiva.
Palabras clave: Streptococcus suis; PCR; suilisina; cerdos
ABSTRACT:
Streptococcus suis is a facultative anaerobic coccus considered an important agent associated to meningitis, arthritis, endocarditis and pneumonia. In this work, the isolation of S. suis from different clinical conditions such as pneumonia, joint and tonsil in asymptomatic animals was carried out. Fourteen strains of S. suis were identified: 11 from lungs, 2 from abscess and 1 from tonsils. The strains showed different pattern of biochemistry test. The syl gene codifying for suylisin was detected by PCR only in 5 strains, four coming from lung and one from tonsil. However, in the isolations from abscess and associated to arthritis, the presence of this gene was not detected showing a similar behaviour to the strains from North America (syl -) associated to invasive disease.
Key words: Streptococcu suis; PCR; suilysine; pigs
Streptococcus suis es una bacteria anaerobia facultativa y grampositiva. Se asocia a diferentes signos clínicos como meningitis, artritis, septicemia y muerte súbita en cerdos (1,2). También puede producir meningitis en humanos, fundamentalmente con riesgo ocupacional (3, 4, 5). Se han descrito 35 serotipos capsulares. El serotipo 2 es más frecuente aislado de animales enfermos (6,7). Sin embargo, existe una variación en el grado de virulencia entre las cepas, incluso del serotipo 2 (1,8).
Los estudios comparativos entre cepas virulentas y no virulentas han permitido proponer varios componentes celulares y extracelulares como potenciales marcadores de virulencia en S. suis, entre los cuales se encuentran la proteína liberadora de muramidasa (mrp), un factor extracelular (ef) y la suilisina (syl) (9,10). Sin embargo, la presencia de estos marcadores presenta gran variabilidad y algunos aislamientos procedentes de animales enfermos no poseen uno o más de ellos, indicando la heterogeneidad genética de los mismos (11,12).
La hemolisina producida por S. suis pertenece a una familia de toxinas que enlazan al colesterol y dañan la membrana de células epiteliales, endoteliales y fagocíticas (13,14). La presencia o ausencia de la syl en diferentes aislamientos de esta bacteria ha sido demostrada por PCR y por hibridación (15). El objetivo de este trabajo es detectar la presencia de S. suis por pruebas bioquímicas e identificar el gen syl por PCR a partir de diferentes muestras de origen porcino en producciones cubanas.
Colección e identificación de cepas de S. suis: se realizó el cultivo a partir de 100 muestras de pulmones y de tonsilas de cerdos procedentes de unidades productoras de las provincias La Habana, Camagüey y Cienfuegos durante el período del 2003 al 2008. Las muestras se sembraron en el medio agar sangre Columbia (Oxoid) suplementado con sangre de carnero al 5%. Los cultivos se incubaron a 37oC durante 48 horas, las colonias presuntivas del género Streptococcus sp. se identificaron según los siguientes criterios: presencia de colonias pequeñas con hemólisis alfa, cocos grampositivos en la tinción de gram. Todos los aislamientos se clonaron en el medio Agar Columbia después de tres pases sucesivos y posteriormente se tipificaron por pruebas bioquímicas mediante api 20 strep Biomeriux, France.
Preparación del ADN molde:
Se realizó la extracción del ADN a partir de cultivos líquidos de 5 mL en caldo cerebro corazón (Oxoid), los cuales se concentraron por centrifugación a 13000g por 5 minutos, se resuspendieron en 0.5 ml de solución tampón TE (Tris 0.01M pH 7.5 y EDTA 0.005M pH 8.0). A continuación se realizó la ruptura con 10mg/mL de lisozima y la lisis alcalina se realizó por la adición de dodecil sulfato de sodio (SDS) al 20% en solución tampón TE y proteinaza K a 20mg/ml. Se realizaron extracciones con cloroformo y fenol equilibrado con Tris pH 7.5. El ADN se precipitó del sobrenadante con etanol y se solubilizó en 50 µL de solución tampón TE (16).
Realización de la PCR:
Las muestras de ADN de las cepas de S. suis se analizaron por PCR con la siguiente pareja de cebadores:
5´-AAGTCGACATGAGAAAAAGTTCGCAC-3´ y 5´-AACTGCAGGATTACTCTATCACCTCA-3´ según lo reportado por Staaf et al. (17), los cuales amplifican un fragmento de 1426 pb del gen de la hemolisina.
La amplificación se realizó en un volumen final de 25 uL que contenía 10mM de Tris-HCl, pH 8.3; 50 mM de KCl; 3 mM de MgCl2; 0.1mg/mL de BSA, 10 mM de cada dNTP, 20 pmol de cada cebador y 1 uL de amplicen (2u/uL), CENSA, Cuba. Se adicionaron 2 ul del ADN molde. La mezcla de reacción se sometió a 35 ciclos de: 94ºC y 56 ºC durante un minuto en ambas temperaturas y la extensión final de 10 minutos a 72ºC.
Las reacciones de amplificación se realizaron en un termociclador Mastercycler personal eppendorf. Los productos de las reacciones de amplificación se analizaron por electroforesis en geles de agarosa al 0.8 % en buffer TBE 0.5X y tinción con bromuro de etidio 0,5 ug/mL. La corrida se realizó en tampón TBE 0.5X a un voltaje constante de 100 V por 30 min. Para determinar la talla aproximada del producto se incluyó un patrón de peso molecular de 1KB DNA Ladder (Promega). Las bandas se visualizaron en un transiluminador de luz ultravioleta LKB 2011 y se fotografiaron con cámara digital para recoger los resultados. La extracción de ADN y la amplificación por PCR del gen de hemolisina para cada cepa se realizó dos veces. La confirmación de los productos de amplificación se realizó mediante análisis enzimático de los amplicones con las enzimas Bgl 2 y Eco R1 (Promega) siguiendo las instrucciones de la casa productora.
Ensayo de la hemolisina: El ensayo para la detección de la actividad de hemolisina se realizó siguiendo el procedimiento descrito por King et al. (18), el cual brevemente consistió en colectar colonias de S. suis a partir de un cultivo en agar cerebro corazón, se preparó una suspensión en solución salina 0.85%, la cual se ajustó a la densidad de 1.6 a una longitud de onda de 560 nm. Esta suspensión se incubó durante 1 hora a 37°C y el sobrenadante se filtró a través de membranas de nylon de 0.45 µm de tamaño del poro. Se realizaron tres réplicas a partir de tres cultivos diferentes para cada cepa. Se utilizaron placas de 96 pocillos con fondo en U a los cuales se adicionaron alícuotas de 100ul de la solución tampón de fosfato pH 7.2, a continuación se añadió 100 ul del sobrenadante del cultivo de cada cepa al primer pocillo y se realizaron diluciones del mismo en el rango1/2 hasta 1/4096. Seguidamente se adicionó 100 ul de una suspensión de eritrocitos de carneros al 1% a cada pocillo y se incubaron las placas a 37°C por 2 horas en 6% CO2. La ausencia de actividad hemolítica se definió cuando se observó un precipitado de glóbulos rojos en el fondo de la placa.
Se detectaron por cultivo y pruebas bioquímicas, 14 cepas de S. suis de las cuales 11 proceden de pulmón de cerdo con signos de neumonía, una de tonsila de un animal asintomático y dos de abscesos en articulaciones de animales con severa artritis. Las infecciones causadas por S. suis han sido diagnosticadas en todos los países donde la industria porcina está desarrollada, considerándolas responsables de pérdidas económicas importantes por mortalidad, costos de tratamiento y profilaxis con antibióticos. Originalmente esta bacteria se ha implicado en casos de meningitis, pero ahora se le reconoce como responsable de una variedad de infecciones en los cerdos (19, 20).
Existe un debate sobre el papel de S. suis como agente primario de neumonía, debido a que muchos aislamientos de esta entidad se hacen en asociación con microorganismos considerados como significativos patógenos respiratorios tales como Actinobacillus pleuropneumoniae, Haemophilus parasuis, Pasteurella multocida y el virus de la influenza porcina (21, 22). Sin embargo, en las muestras que se procesaron en este trabajo S. suis se identificó en cultivos puros a partir de animales con neumonía, lo cual sugiere un papel potencial de este microorganismo como agente causal de procesos respiratorios en las producciones porcinas del país.
Las cepas tipificadas mostraron diferentes perfiles por pruebas bioquímicas, todas fermentaron los siguientes azúcares: trealosa, inulina y lactosa con excepción de dos cepas. Solamente dos aislados hidrolizaron la esculina. De manera general S. suis es una entidad que muestra gran heterogeneidad cuando se utilizan pruebas bioquímicas y moleculares en su caracterización. Todas las cepas biotipificadas por Pineda et al. (20) fermentaron la trealosa; sin embargo, a diferencia de nuestros resultados todas hidrolizaron también la esculina.
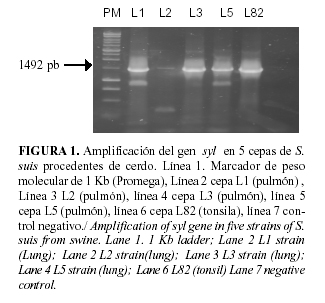
En la Figura 1 se muestra la amplificación de un fragmento de 1492 pb correspondiente al gen de la hemolisina. La pareja de cebadores utilizados amplificó este fragmento en 5 de un total de 14 aislamientos de S. suis. Los aislamientos L1, L2, L3 y L5 corresponden a cepas procedentes de pulmones de animales con neumonía, mientras la cepa L82 procede de tonsila de un animal asintomático. Los dos aislamientos procedentes de abscesos en articulaciones no mostraron un producto de amplificación con esta pareja de cebadores.
La secuencia correspondiente al gen syl de 1493 pb codifica para una proteína de 497 aminoácidos con un peso molecular de 65 Kda (15). La digestión con Bgl 2 mostró fragmentos de ADN de las tallas esperadas según la secuencia reportada del gen syl (17) 364 y 1129 pb, mientras la digestión con Eco RI produjo fragmentos de 861 y 632 pb los cuales también coinciden con las tallas reportadas (datos no mostrados).
A partir del ADN de la cepa L82 procede de la tonsila de un animal sin signos clínicos de neumonía, se realizó la amplificación del gen syl. Aunque numerosos trabajos informan la presencia de la suilisina en cepas virulentas (17,18) también se ha detectado en muestras de tonsilas de animales sanos (23, 24).
En la Tabla 1 se relacionan las características de los aislamientos identificados con respecto a la procedencia, la detección de actividad hemolítica, así como la detección del gen syl por PCR. Los resultados del ensayo para la detección de la actividad hemolítica, aun cuando la densidad celular de los cultivos se ajustó por espectrometría, mostraron diferentes niveles de actividad entre las diluciones de las diferentes cepas (datos no mostrados). Estas evidencias sugieren que existen diferencias en los niveles de transcripción para este gen entre los diferentes aislamientos.
Del total de aislamientos de S. suis solamente se detectó la presencia del gen syl en el 35 % de las muestras, mientras la actividad hemolítica se evidenció en el 64.4 % de las cepas. Staf et al en 1999 amplificaron el fragmento de 1492 pb del gen syl solamente en 5 aislamientos de S. suis. Sin embargo, todos los aislamientos contenían fragmentos del gen syl los cuales se detectaron por hibridación, no así por PCR es probable que hayan ocurrido deleciones o mutaciones en los extremos 3´ y 5´ por lo cual no son reconocidos por la pareja de cebadores (17). Estudios adicionales, serían necesario para confirmar la ausencia del gen, utilizando parejas de cebadores que reconozcan otra región dentro de este gen.
Las cepas L10 y L90 aisladas a partir de abscesos de animales con artritis no mostraron actividad hemolítica en este ensayo y resultaron también negativas por PCR. De manera general la presencia del gen syl se detectó mayoritariamente en cepas procedentes de animales con neumonía. El papel de la suilisina en la patogénesis de S. suis es un tema muy controvertido. Se ha sugerido que la suilisina es requerida en la colonización para la etapa inicial de infección en cerdos (25,26). Se ha señalado que es esencial para facilitar la penetración a tejidos profundos (27, 28). Por otra parte Lun et al. (29) plantean que syl no es esencial, para la patogénesis de la infección transmitida por aerosoles a la mucosa respiratoria en las condiciones de campo debido a que esta proteína es producida al final de la fase exponencial.
El gen syl se ubica entre los genes orf101 y nanE que codifican para una supuesta hydrolasa y una epimerasa respectivamente (8,18). En las cepas que carecen del gen syl se ha descrito una estructura alternativa, el gen orf102 (aún de función desconocida) que ocupa el lugar de syl. Para avanzar en la caracterización de nuestras cepas sería conveniente evaluar por PCR también la presencia del gen orf102.
A diferencia de nuestros resultados, donde el gen syl prevalece en cepas procedentes de pulmón, King et al. en el 2001 señalan una fuerte asociación entre el gen syl y un estado invasivo de la enfermedad al detectar su presencia mayoritariamente en muestras procedente de procesos invasivos y en menor número en cepas asociadas a neumonía (18).
En los últimos años se reportan datos que señalan las diferencias relacionadas a los marcadores de virulencia como la hemolisina, encontradas en cepas procedentes de diferentes regiones del mundo: Europa, Asia y Norte América. En América del Norte es escasa la presencia del gen syl, así como otros marcadores en cepas virulentas de S. suis asociadas a síntomas invasivos (30, 31, 32, 33). Entonces, es posible esperar que los aislamientos identificados en este trabajo a partir de casos de artritis muestren un comportamiento similar a las cepas virulentas del serotipo 2 que prevalecen en Norte América.
Para cualquier cepa de S. suis los resultados de la amplificación por PCR del gen syl deben ser interpretados con precaución y no deben reemplazar la evaluación de la actividad hemolítica de la cepa. Incluso se plantea que es posible que las cepas difieran en la expresión de la proteína bajo diferentes condiciones de crecimiento (34).
Los resultados de este trabajo corroboran la heterogeneidad de biotipos y genotipos, específicamente para el gen syl presente en las cepas de S. suis procedentes de producciones porcina del país, lo cual ha sido informado en numerosos trabajos (35, 36). La identificación y caracterización de factores de virulencia en S. suis por técnicas de avanzada como la amplificación de ácidos nucleicos permite incrementar el conocimiento sobre esta enfermedad en el país, especialmente la virulencia de los aislamientos presentes en las producciones porcinas y contribuir a la aplicación de medidas efectivas en el control de la misma.
REFERENCIAS
1. Allgaier A, Goethe H, Wisselink H, Smith P, Valentin W. Relatedness of Streptococcus suis isolates of various serotypes and clinical backgrounds as evaluated by macrorestriction analysis and expression of potential virulence traits. J Clin Microbiol. 2001; 39:445-453.
2. Gottschalk M, Segura M. The pathogenesis of the meningitis caused by Streptococcus suis: the unresolved questions. Vet Microbiol. 2000; 76:259-272.
3. Lutticken R, Temme N, Hahn G, Bartelheimer E.W. Meningitis caused by Streptococcus suis: case report and review of the literature. Infection. 1986; 14:181-185.
4. Ye C, Zhu X, Jing H, Du H, Segura M, Zheng H, et al. Streptococcus suis sequence type 7 outbreak, Sichuan, China. Emerg Infect Dis. 2006; 12: 1203-1208.
5. Yu H, Jing H, Chen Z, Zheng H, Zhu X, Wang H, et al. Human Streptococcus suis outbreak, Sichuan, China. Emerg Infect Dis. 2006; 12:914-920.
6. Higgins R, Gottschalk M, Boudreau M, Lebrun A, Henrichsen J. Description of six new capsular types of Streptococcus suis. J Vet Diagn Investig. 1995; 7:405-406.
7. Berthelot H, Marois C, Gottschal M, Kobisch M. Genetic diversity of Streptococcus suis strains isolated from pigs and humans as revealed by pulsed-field gel electrophoresis. J Clin Microbiol. 2002; 40:615-61.
8. Takamatsu D, Makoto O, Tsutomu S. Evidence for lateral transfer of the Suilysin gene region of Streptococcus suis. J Bacteriol. 2002; 84(7):2050-2057.
9. Vecht U, Wisselink H, Van Dijk J, Smith H. Virulence of Streptococcus suis type 2 strains in newborn germfree pigs depends on phenotype. Infect Immun. 1992;60:550-556.
10.Wisselink H, Smith H, Stockhofe Z , Peperkamp K, Vecht U. Distribution of capsular types and production of muramidase-released protein (MRP) and extracellular factor (EF) of Streptococcus suis strains isolated from diseased pigs in seven European countries. Vet Microbiol. 2000;74:237-248.
11.Jacobs A, Van den Berg J, Baars C, Nielsen B, Johannsen L. Production of suilysin, the thiol-activated haemolysin of Streptococcus suis, by field isolates from diseased pigs. Vet Rec. 1995;137:295-296. http://jb.asm.org/cgi/external_ ref?access_num=8533226&link_type=MED
12.Chatellier S, Gottschalk M, Higgins R, Brousseau R, Harel J. Relatedness of Streptococcus suis serotype 2 isolates from different geographic origins as evaluated by molecular fingerprinting and phenotyping. J Clin Microbiol. 1999;37:362-366.
13.Allen A, Steven B, Heather L, Shahid K, Clare B, Pam N, et al. Generation and Characterization of a Defined Mutant of Streptococcus suis Lacking Suilysin. Infec Immun. 2001;69(4):2732-2735.
14.Berthelot F, Herault H, Morvan Anne-Marie, Gottschalkc M, Marylène K Production of Muraminidase-Released Protein (MRP), Extracellular Factor (EF) and Suilysin by field isolates of Streptococcus suis capsular types 2, 1/2, 9, 7 and 3 isolated from swine in France Vet. Res. 2000;31: 473.479.
15.Okwumabua O, Abdelmagid O, Chengappa M. Hybridization analysis of the gene encoding a hemolysin (suilysin) of Streptococcus suis type 2: evidence for the absence of the gene in some isolates. FEMS Microbiol Lett. 1999;181:113-121.
16.Douglas A, Raúl A, Stephen P. Elucidation of the DNA sequence of Streptococcus uberis adhesion molecule gene (sua) and detection of sua in strains of Streptococcus uberis isolated from geographically diverse locations. Vet Microbiol. 2008;128(3):304-312.
17.Staats J , Brandon L, Plattner G, Chengappa M Presence of the Streptococcus suis suilysin gene and expression of MRP and EF correlates with high virulence in Streptococcus suis type 2 isolates. Vet Microbiol.1999;70:201-211.
18.King S, Heath P, Luque I, Tarradas C, Dowson C, Whatmore A. Distribution and Genetic diversity of suilysin in Streptococcus suis isolated from different diseases of pigs and characterization of the genetic basis of suilysin absence. Infect Immun 2001; 69:7572-82.
19.Cantin M, Harel J, Higgins R, Gottschalf M. Antimicrobial resistance patters and plasmid profiles of Streptococus suis isolates. J Vet Diagn Invest. 1992;4:170-174.
20.Pineda Y, De López A, De Aponte F, De Parra C, Jorge S. Aislamiento de cepas de Streptococcus suis y su susceptibilidad in vitro a los agentes antimicrobianos. Veterinaria Tropical. 1996;21(2): 155-165.
21.Heath P, Hunt B. Streptococcus suis serotypes 3 to 28 associated with disease in pigs. Vet Rec. 2001;148:207-208.
22.Macinnes J, Desrosiers R. Agents of the "suis-ide diseases" of swine: Actinobacillus suis, Haemophilus parasuis, and Streptococcus suis. Can J Vet Res. 1999;63:83-89.
23.Berthelot-Hérault F, Cariolet R, Labbé A, Gottschalk M, Cardinal J, Kobisch M. Experimental infection in specific pathogen free piglets with French strains of Streptococcus suis type 2. Can J Vet Res. 2001;65:196-200.
24.Tarradas C, Borge C, Arenas A, Maldonado R, Astorga A, Luque, I. Suilysin production by Streptococcus suis isolated from diseased and healthy carrier pigs in Spain. Vet Rec. 2001;148: 183-184. http://iai.asm.org/cgi/ijlink?link Type=ABST&journalCode =iai&resid=68/2/637
25.Berthelot-Hérault F, Gottschalk M, Hervé M, Kobisch M. Dilemma of virulence of Streptococcus suis: Canadian isolate 89-1591 characterized as a virulent strain using a standardized experimental model in pigs. Can J Vet Res. 2005;69(3):236-240.
26.Vanier G, Segura M, Friedl P, Lacouture S, Gottschalk M. Invasion of porcine brain microvascular endothelial cells by Streptococcus suis serotype 2. Infect Immun. 2004;72:1441-1449.
27.Lalonde M, Segura M, Lacouture S. Gottschalk M. Interactions between Streptococcus suis serotype 2 and different epithelial cell lines. Microbiology. 2000;146:1913-1921.
28.Charland N, Nizet V, Rubens C, Kim K, Lacouture S, Gottschalk M.. Streptococcus suis serotype 2 interactions with human brain microvascular endothelial cells. Infect Immun. 2000;68:637-643.
29.Lun S, Jose P, Wayne C, Willson P. Role of suilysin in pathogenesis of Streptococcus suis capsular serotype 2. Microbial Pathogenesis. 2003;34:27-37.
30.Tan C, Liu M, Jin M, Liu J, Chen Y, et al. The key virulence-associated genes of 1. Streptococcus suis type 2 are upregulated and differentially expressed in vivo. FEMS Microbiol Lett. 2008;278:108-114.
31.Fitipaldi N, Troy E, Janet F, Thomas L, Thaddeus J, Wolfram D, et al. Serotype distribution and production of muramidase-released protein, extracellular factor and suilysin by field strains of Streptococcus suis isolated in the United States. Vet Microbiol. 2009. Article in press.
32.Luciana M, Silva A, Christoph G, Baums A, Thomas R, Hen J, et al. Virulence-associated gene profiling of Streptococcus suis isolates by PCR Vet Microbiol. 2006;115:117-127.
33.Thomas R, Christoph G, Baums I, Birgit S, Martin B, Peter V, et al. Amplified fragment length polymorphism of Streptococcus suis strains correlates with their profile of virulence-associated genes and clinical background. J Med Microbiol. 2007;56:102-109.
34.Norton P, Rolph C, Ward P, Bentley R, Leigh J. Epithelial invasion and cell lysis by virulent strains of Streptococcus suis is enhanced by the presence of suilysin. FEMS Immunol Med Microbiol. 1999;26:25-35.
35.Korawan W, Naoki T, Sumalee P, Achara F, Gottschalk M, Volaluck S, et al. Genetic diversity of Streptococcus suis isolated from pigs and humans in Chiang Mai and Lamphun province, Thailand. International Congress Series. 2006; April 1289: 151-154.
36.Zigong W, Ran L, Anding Z, Hongkui H, Yafeng H, Jing X, et al. Characterization of Streptococcus suis isolates from the diseased pigs in China between 2003 and 2007. Vet Microbiol. 2009;137(1-2):196-201.
(Recibido 3-6-2009; Aceptado 30-10-2009)