Meu SciELO
Serviços Personalizados
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista de Salud Animal
versão impressa ISSN 0253-570X
Rev Salud Anim. vol.33 no.3 La Habana oct.-dez. 2011
VALIDACIÓN DE UN MÉTODO DE CROMATOGRAFÍA LÍQUIDA DE ALTA RESOLUCIÓN (CLAR), EMPLEANDO COMO MARCADOR LA EPIGALOCATEQUINGALATO,PARA EVALUAR LA CALIDAD DE UNA FORMULACIÓN SEMISÓLIDA OBTENIDA DE Rhizophora mangle L.
VALIDATION OF HIGH-PERFORMANCE LIQUID CHROMATOGRAPHY (HPLC) METHOD, USING EPIGALOCATEQUINGALLATE AS MARKER TO ASSESS THE QUALITY OF A SEMI-SOLID FORMULATION OBTAINED FROM Rhizophora mangle L.
A. Escobar*, R. Faure*, Dayana Sosa*, Tania Bueno*,Yanet Rodríguez*, Dulce M. Soler*
Dirección de Salud y Producción Animal; * Dirección de Producciones Biológicas, Centro Nacional de Sanidad Agropecuaria (CENSA). Apartado 10, San José de la Lajas, Mayabeque, Cuba. Correo electrónico: escobar@censa.edu.cu
RESUMEN
Con el objetivo de establecer un marcador químico de polifenoles y validar un método por cromatografía líquida de alta resolución (CLAR) para evaluar la calidad de productos semisólidos obtenidos a partir del extracto acuoso de la corteza de Rhizophora mangle L, se compararon cuatro procedimientos de extracción del analito de la muestra; donde la variante que emplea etil acetato y su aplicación directa al cromatógrafo fue la más efectiva. De los diferentes polifenoles identificados en la muestra, la epigalocatequingalato (EGCG) fue seleccionada como marcador. El producto semisólido en condiciones de estrés oxidativo muestra una disminución del marcador y cambios en el perfil cromatográfico. Los parámetros de desempeño del método revelan una linealidad en el rango de 1-15 µg/mL (r=0.999; p=0.05), con límite de detección y cuantificación de 2.5 µg/mL y 5.0 µg/mL respectivamente. El recobrado de la EGCG en un blanco de reactivos fue del 89±9%, y en el producto fue de 60.1±3.52 µg/g. Los valores de repetibilidad para el estándar y la muestra fueron de 1.29 y 10.67 % respectivamente. La reproducibilidad estimada a partir de la ecuación de Horwitz tuvo una variación entre 8-11%. Los lotes de productos tuvieron valores de EGCG que oscilaron entre 36.5 y 66.7 ug/g. El procedimiento analítico desarrollado empleando la EGCG como marcador químico resultó ser confiable para el control de calidad del producto semisólido evaluado.
Palabras clave: Rhizophora mangle L.; semisólido; EGCG; polifenoles; HPLC; validación.
ABSTRACT
With the aim of establishing a chemical marker of polyphenols and validating a HPLC method, for assessing the quality of semisolid products, obtained from Rhizophora mangle L aqueous bark extract, four methods for extracting the analyte from the sample, were compared. The variant using ethyl acetate and its direct application to the chromatograph was the most effective. The epigalocatequingallate (EGCG) was selected as a marker among other polyphenols identified. The semisolid product, under oxidative stress conditions, shows a decline and changes in the chromatographic profile. Performance parameters show a linear method in the range of 1-15 ug / mL with a regression coefficient of 0.999, and have a limit of detection and quantification of 2.5 ug / mL and 5.0 ug / mL, respectively. The recovered from EGCG in a reagent blank was 89 ± 9%, while, added to the product, was 60.1 ± 3.52 ug / g, due to interactions with the matrix. Repeatability studies (RSD) achieved for the standard and the sample were 1.29 and 10.67%, respectively. The reproducibility, estimated from Horwitz equation, showed a variation between 8-11%. EGCG assessment in product lots showed values ranging between 36.5 and 66.7 ug/ g. The analytical procedure developed, using EGCG as a chemical marker, proved to be reliable in the quality control of semi-solid products.
Key words: Rhizophora mangle L.; semisolid; EGCG; polyphenols; HPLC, validation.
(Recibido 28-9-2011; Aceptado 28-10-2011)
INTRODUCCIÓN
Diferentes estudios brindan evidencias de que las plantas con alto contenido de compuestos fenólicos, poseen efectos beneficiosos en pacientes que padecen enfermedades tales como el cáncer, diabetes tipo II y cardiovasculares (1,2,3).
En Cuba, el desarrollo de medicamentos a partir de productos naturales se ha incrementado, estableciéndose regulaciones que controlan su producción (4), y enfatizan el uso de marcadores químicos para el control de calidad.
En el Centro Nacional de Sanidad Agropecuaria (CENSA), se desarrolló un medicamento estimulante de la curación de heridas a partir de la corteza de Rhizophora mangle L, cuyo principio activo estriba en la concentración de taninos (5), y los controles de calidad se realizan de forma cuantitativa y cualitativa midiendo la concentración de taninos totales y los perfiles cromatográficos de los compuestos fenólicos polimerizados (6,7). Estos últimos no pueden ser cuantificados por no disponer de estándares comerciales.
La extracción de compuestos fenólicos con etilacetato, el empleo de la cromatografía líquida con columna de fase reversa y detectores ultravioleta acoplado a masa, constituyen los procedimientos más citados en la separación e identificación de polifenoles en fitomedicametos (8,9), en cualquier variante ensayada, se requiere de una validación del procedimiento propuesto para ser reconocida por los organismos reguladores (10).
Está demostrado que fracciones de etil acetato y butanólica obtenidas del extracto acuoso de la planta, poseen efectos antioxidantes (11), actividad inhibitoria de la enzima ciclooxigenasa2 y fosfolipasa A2 (12); lo que evidencia que la acción biológica del producto no se debe a una sola molécula. La identificación de un marcador químico en alguna de las fracciones antes mencionadas y la disponibilidad de su patrón en el mercado, permitirá el control de calidad de los nuevos productos que se generen de Rhizophora mangle L.
El objetivo del presente trabajo es establecer un marcador químico de polifenoles y validar un método por CLAR para evaluar la calidad de productos semisólidos obtenidos a partir del extracto acuoso de la corteza de Rhizophora mangle L.
MATERIALES Y MÉTODOS
Preparación de la muestra
Se utilizó una formulación semisólida derivada de un extracto acuoso de la corteza de Rhizophora mangle, producida a escala piloto (No. Lote 011107) con una concentración de 30mg de peso seco(ps) por gramo de gel. Los excipientes fundamentales que contiene el producto son Carbopol 940, Metilparabeno y Propilparabeno.
Desarrollo de una metodología para identificación de un marcador químico en productos semisólidos
Se evaluaron cuatro variantes en la preparación de la muestra para su posterior análisis por CLAR, las que se describen brevemente:
Variante A: Se procedió a disolver 1 g de la muestra en 15 mL de agua caliente (<80°C) hasta completa disolución, se centrifugó a 3500 rpm y el sobrenadante se pasó por columna de fase sólida C18 previamente condicionada con metanol y agua.
Variante B: El producto disuelto se precipitó con cloruro de sodio (0.36g de NaCl/mL) y se centrifugó a 3500 rpm a una temperatura de 4°C. Se separó el sobrenadante del precipitado por decantación y este fue disuelto en 10 mL del solvente a ensayar. (acetona al 70%, butanol y metanol) Cada eluato fue llevado a sequedad en baño de rotoevaporación y el producto fue resuspendido en 5 mL de agua para su purificación por columna de fase sólida C18 previamente condicionada con metanol y agua.
Variante C: El producto disuelto se pasó a un tubo de centrífuga y se adicionó 20 mL de butanol, se agitó durante 5 minutos en un agitador de tubo a 200 rpm; seguidamente se centrifugó a 3500 rpm a temperatura ambiente para separar las fase acuosa de la butanólica. Se repite el proceso dos veces más, todas las fases orgánicas se unen y se pasan por sulfato de sodio anhidro. La fase butanólica anhidra se rotoevaporó hasta sequedad, reconstituyéndose en 5 mL de agua para su purificación por columna de fase sólida C18 previamente condicionada con metanol y agua.
Variante D: El producto disuelto se pasó a un tubo de centrífuga y se adicionó 30 mL de etil acetato, se agitó durante 5 minutos en un agitador de tubo a 200 rpm, seguidamente se centrifugó a 3500 rpm a temperatura ambiente para separar las fase acuosa de la orgánica. Se repite el proceso dos veces más, uniéndose todas las fases de etil acetato y pasándose por sulfato de sodio anhidro. La fase orgánica anhidra se rotoevaporó hasta sequedad, reconstituyéndose en 2 mL de la fase móvil para su aplicación directa al cromatógrafo.
Fraccionamiento en columna de fase sólida: El extracto acuoso se pasó a una columna de extracción de fase sólida (C18) de 500 mg, previamente acondicionada con metanol y agua. Una vez introducida la muestra se lavó con 5 mL de agua y 15 mL de metanol al 30%. El eluato se llevó a sequedad por rotoevaporación y se reconstituyó en un mL de la fase móvil para su análisis.
Oxidación en condiciones drásticas: El gel disuelto se retó con un agente oxidante (peróxido de hidrógeno 30%), adicionándole 500µL permaneciendo en reposo toda la noche a 4°C. Al día siguiente se procedió a la extracción como se describe en la variante D.
Análisis por CLAR
Equipamiento: Se empleó un cromatógrafo líquido de la firma comercial Young Lin con detector UV 280 nm en un rango de 0.0025 y una columna de fase reversa (Teknokroma ODS25µm 15x0,4 cm). El flujo fue 1 mL/min y se aplicó 10 µl de la muestra previamente filtrada por 0,45µm. Los cromatogramas se procesaron por el software Clarity Version 2.6
Como fase móvil se evaluó la mezcla de agua:acetonitrilo:metanol:ácido acético (85.5:13:1:.5 v/v/v/v).
Los estándares empleados de catequina (C) epicatequina (EC); epigalocatequingalato (EGCG), epigalocatequin (EGC); galocatequingalato (GCG) y epicatequingalato (ECG) fueron adquiridos en la firma comercial SIGMA. Cada estándar se disolvió en metanol a una concentración de 1 mg/mL.
Especificidad: Se preparó una concentración de 10 µg/mL de cada uno de los estándares de catequina (C):epicatequina (EC),epigalocatequingalato (EGCG), epigalocatequin (EGC),galocatequingalato (GCG) y epicatequingalato (ECG) y se disolvieron en la fase móvil, aplicándose 10 µL de cada uno en la columna. Se determinó la resolución entre ellos a través de la siguiente ecuación:
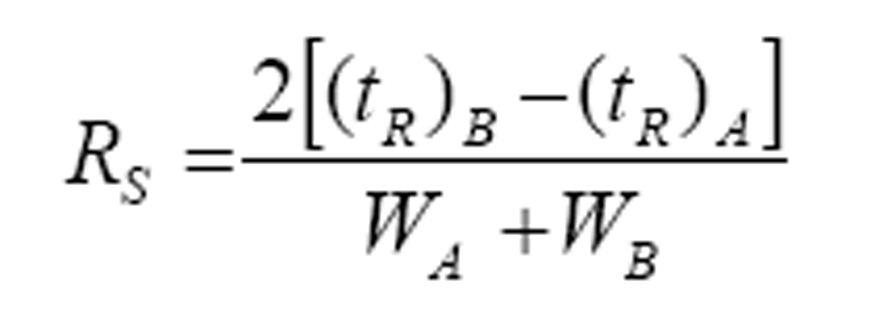 ecuación 1
ecuación 1
donde: tr corresponde a los tiempos de retención de los picos y W a los anchos de los picos medido en su base.
Se evaluaron las posibles interferencias de los excipientes que conforman el producto (carbopol, metil y propilparabeno) y se compararon con el producto total. Se pesaron 10 mg de cada uno de los excipientes y se preparó a una concentración final de 1 mg/mL de la fase móvil, aplicándose 10 µL de una dilución de 1:10 de la concentración original.
La aparición de productos de degradación se analizaron a partir de retar el producto con un agente oxidante como se mencionó anteriormente y también sometiéndolo a temperatura de 25 y 40°Cdurante seis y tres meses respectivamente.
Linealidad, Límite de detección y cuantificación: Se procesaron dos curvas. La primera en un rango de 2-15 µg/mL y la segunda cercano al punto de 2 µg/mL, para determinar la pendiente, el intercepto y el coeficiente de correlación entre el área y la concentración del analito, además de calcular la desviación estándar del blanco, todo lo anterior se procedió según Cuattrocchi y colaboradores (13).
Exactitud: Se realizó un blanco de reactivo contaminado con EGCG a una concentración de 40 µg/mL. Muestras de gel se contaminaron artificialmente con tres niveles de ECG (10, 20 y 40 µg/g) por triplicados.
Precisión: Se procesó quince veces una muestra en condiciones óptimas (equipo, analista y lotes de reactivos idénticos) realizando su análisis en el mismo día. Se determinó la desviación estándar (Sr) y el rango crítico (RC) mediante la ecuación (3 y 4) respectivamente.
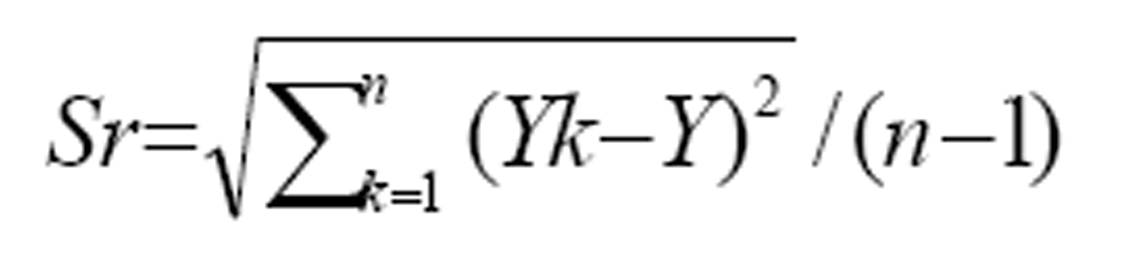 ecuación 2
ecuación 2
donde: n= número de réplicas
Yk = es el valor medido en el ensayo
Y= es el estimador de la media poblacional
![]() ecuación 3
ecuación 3
donde: f(n) es el factor de rango crítico para una n determinada
La reproducibilidad: se realizó en condiciones óptimas pero ejecutando 10 determinaciones en días sucesivos.
RESULTADOS Y DISCUSIÓN
Identificación del marcador químico en el producto semisólido
De los tratamientos ensayados en la muestra, solo C y D presentaron un extracto satisfactorio para el análisis por CLAR, en cuanto a solubilidad y densidad. En el caso de la variante A, se observó una obstrucción en la columna de fase sólida, producto de su saturación. En el caso B los recobrados fueron insatisfactorios debido a que al formarse el precipitado butanólico, se crea una capa hidrofóbica que impide su disolución. A su vez, la mezcla acuosa de metanol y acetona, permitió la disolución de los polifenoles, con el inconveniente de que, una vez secado y resuspendido en agua quedan adherido en las paredes del recipiente, lo cual afectó su recobrado.
Con el empleo de la variante C, se favorece la extracción de taninos condensados o poliméricos, mientras la extracción con etilacetato (variante D) se extraen más compuestos fenólicos de bajo peso molecular como son ácido elágico, ácido clorogénico, acido gálico, epicatequina y catequina, entre otros (14).
En la variante C no existieron coincidencias entre los estándares de referencias y los picos presentes en los perfiles cromatográficos de gel y el gel oxidado (Tabla 1), observándose tres picos (10.71, 15.39 y 17.30 min) como posible indicadores de calidad, ya que tuvieron un comportamiento distintivo ante el producto oxidado y el placebo, sin embargo, al no poder ser identificados, se ve limitado su empleo para el establecimiento de las especificaciones de calidad del producto.
En la variante D donde se empleó el etil acetato para la extracción, se identificaron como posibles indicadores los compuestos Epigalocatequin, Catequina y Epigalocatequingalato al estar presente en el extracto y en el producto formulado (Figura 1). En un estudio realizado con tabletas de Rhizophora mangle L. se empleó como marcador químico la Catequina (15), otros estudios donde evalúan los polifenoles en el extracto del Té, identifican la EGCG y ECG como marcadores confiables en las determinaciones de perfiles metabólicos y en la evaluación de la calidad en productos comerciales (16,17,18). En el presente trabajo se decidió escoger la EGCG como marcador en los productos semisólidos al estar en mayor concentración que el resto de las catequinas identificadas.
Evaluación del desempeño del método para la determinación de epigalocatequingalato (EGCG) en productos semisólidos de Rhizophora mangle L.
Especificidad
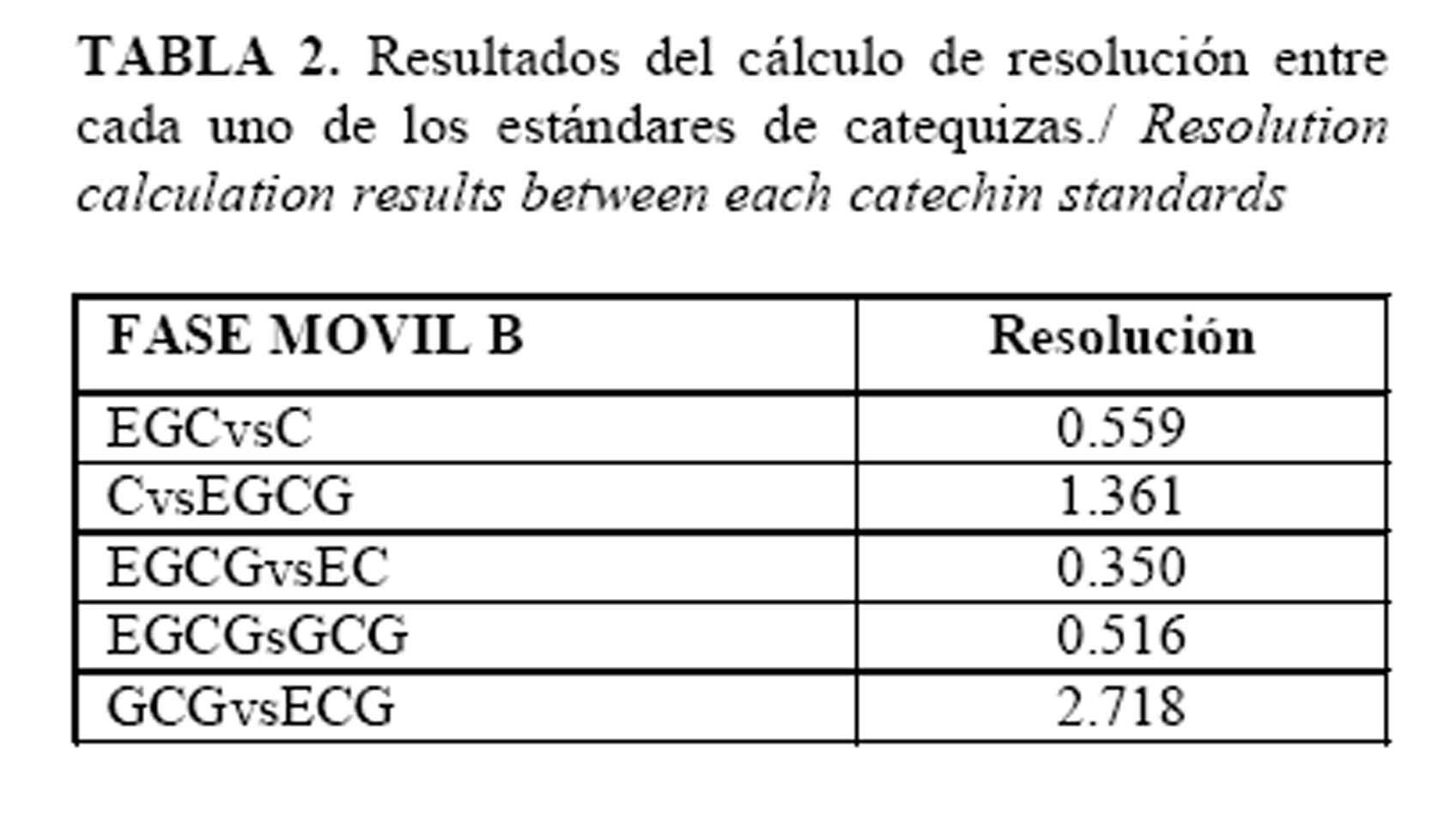
La resolución entre los diferentes compuestos fenólicos se muestran en la Tabla 2, donde la EGCG y EC no poseen una resolución adecuada (R< 1), solapándose ambos picos;no obstante,en el producto pueden aparecer concentraciones trazas de EC inferiores al límite de cuantificación (2µg/mL), aspecto este que no afectó la determinación de EGCG. Los productos de degradación presentes en el gel tratado con peróxido de hidrógeno al 1.5%, no interfirieron con la determinación de EGCG al no coincidir con su tiempo de retención, sin embargo aparece un pico a los 9.24 min el cual no fue identificado (Tabla 3, Figura 2). El área del pico de EGCG se afecta en más de un 80%, lo que se revela cuando se compara la relación entre las áreas del pico de EGCG (Tr 4.87 min) y el pico desconocido (Tr 9.24 min). En el producto intacto esta relación fue mayor que uno (2.55), mientras que en el producto oxidado la relación fue menor que uno (0.18) (Figura 2, Tabla 3). Otras observaciones no publicadas, donde se retó el producto con peróxido a una concentración inferior (0.12%) y se calentó a 40°C durante 60minutos, la relación que se obtuvo en el producto fue de 0.64, este incremento se debió a que el marcador seguido, no se degradó completamente como sucedió cuando se retó con una concentración mayor; sin embargo, en ambos casos la relación fue menor que uno, resultando útil este valor, como un indicador para confirmar la degradación del producto en el tiempo.
Los estudios de especificidad en sentido general garantizan que el principio activo seleccionado, se determine con una alta confiabilidad; de tal manera, que no existan falsos positivos por la presencia de interferencia de los constituyentes que conforma el producto o debido a elementos derivados de su descomposición. Los estudios en condiciones de estrés pueden degradar el producto formando nuevos picos, disminuyendo o incrementando la señal. De tal manera, se indicó que el peróxido de hidrógeno no oxida la tableta de Rhizophora mangle, en cambio las hidrólisis dan lugar a otros picos (15).
En la Figura 3 se muestra el comportamiento del gel retado a las temperaturas de 25 y 40°C observándose que las muestras retadas a 25°C a los dos meses en el lote 1, incrementó su valor inicial, mientras los lotes 2 y 3 incrementaron su valor a los tres meses. Los resultados de los lotes retados a 40°C a los dos meses mostraron diferencias significativas con respecto al lote no retado (p<0.05). Este incremento de valor puede deberse a la formación de algún compuesto que no es separado por el sistema analítico, ocasionando que el área del pico sea superior y en consecuencia, aparecer con una concentración estimada mayor, cuando se relaciona con el estándar. Esto se confirma en el perfil cromatográfico, cuando se compara el ancho de semi altura en el pico de referencia, el cual es menor que aquellos presentes en los perfiles de los geles expuestos a las temperaturas de 25 y 40°C.
Linealidad, Límite de detección y cuantificación
La curva de linealidad en el rango de 1-15 µg/mL responde a una ecuación ajustada de y = 9.33x - 4.90 (r=0.999, P<0,05), presentando un límite de detección y cuantificación de 2.5 µg/mL y 5.0 µg/mL respectivamente. Estos resultados nos permiten evaluar con un alto grado de exactitud la presencia de EGCG en las muestras semisólidas, donde el valor establecido como indicador es superior a los 25 µg/g de EGCG. Estudios donde determinan la presencia de polifenoles en frutas, jugos y Té, empleando columna de fase reversa y detección UV se han obtenidos en todos los casos correlaciones mayores de 0.99 para diferentes polifenoles (17, 19, 20).
Recobrado
En la Tabla 4 se muestran los recobrados para tres niveles de concentración donde el valor medio obtenido fue de 60.1±3.52 µg/g, Recobrados de 89±9.24 para EGCG fueron alcanzados con un blanco de reactivo para corroborar la eficiencia del sistema, demostrando que la extracción con etil acetato es adecuado y que los bajos recobrados se debe a la fuerte interacción existente entre las moléculas de los polifenoles que conforman el extracto de Rhizophora mangle L. que hacen que se unan a sustancias que no son extraíbles con el solvente tales como polifenoles poliméricos, que constituyen el 80% de los taninos totales presentes en el extracto acuoso (5).

Reproducibilidad
El estudio de reproducibilidad mostró valores consistentes en los tres lotes analizados, con un coeficiente de variación inferior al 25% (Tabla 5).
El criterio de aceptación puede ser variable y depende del objetivo que se persiga. La USP indica en general una RSD del sistema no mayor del 2%, pudiendo variar en función del límite de aceptación y el número de réplicas. En el presente reporte se obtuvo un valor del 2.7% con un límite de aceptación entre 95-105% y tres réplicas. Otro factor que influye en los resultados lo constituye la complejidad de la matriz y la cantidad de analito que se evalúa, y en estos casos, se consideran apropiados valores de RSD que pueden oscilar entre 5 y 10%, incluso pueden ser mayores. Horwitz plantea una ecuación empírica que relaciona la RSD de un método dado con la concentración del analito en la muestras (21). En nuestro caso, aplicando dicha ecuación y la concentración del marcador presente en la matriz, brindó un valor teórico de RSD entre 8-10%; y el valor práctico obtenido fue entre 8-11%. Los resultados anteriores evidencian, tanto para el sistema como para el método que contamos con un procedimiento confiable, pudiendo alcanzar una variabilidad máxima hasta de un 15%.
El método analítico validado para el estudio de la estabilidad de formulaciones semisólidas de mangle empleando la EGCG como marcador químico, resultó ser especifico, lineal, preciso y exacto en el rango de 0-15 µg/mL.
Repetibilidad
Los estudios de repetibilidad(RSD) obtenidos para la curva de calibración y muestras, fueron de 1.29 y 10.67% respectivamente, estando acorde para ensayos cromatográficos donde el valor puede llegar hasta un 25% en dependencia de la concentración del analito. Considerando tres desviaciones estándar se propone un rango que puede variar entre 51-101 µg/g para la EGCG en muestras semisólidas de Rhizophora mangle L.
REFERENCIAS
1. Way T-D, Lin H-Y, Hua K-T, Lee J-C, Li W-H, Lee M-R, et al. Beneficial effects of different tea flowers against human breast cancer MCF-7 cells. Food Chem. 2009 Jun 15;114(4):1231-1236.
2. Tachibana H. Molecular basis for cancer chemoprevention by green tea polyphenol EGCG. Forum Nutr. 2009;61:156-169.
3. Gao Y, Dong Z. [Progress on study of pharmacological effects of procyanidins]. Zhongguo Zhong Yao Za Zhi. 2009 Mar;34(6):651-655.
4. Requisitos para las solicitudes de inscripción, renovación y modificación en el registro de medicamentos de origen natural de uso humano. Regulación 28/02 del CECMED, (2002).
5. Sánchez LM, Melchor G, Alvarez S, Bulnes C. Caracterización quimica y toxicologica de una formulación cicatrizante de Rhizophora mangle. Rev Salud Anim. 1998;20(2):69-72.
6. Escobar A, Pérez T, Riverón Y, Melchor G, Sánchez LM, Fernández O, et al. Estabilidad en vida de estante del Cikron-H. Rev Salud Anim. 2008;30(1):32-38.
7. Escobar A, Pérez T, Riverón Y, Sánchez LM, Fernández O, Marrero E. Estabilidad en condiciones drástica del CIKRON-H. Rev Salud Anim. 2008;30(1):25-31.
8. Beek TAv, Montoro P, Xie PS, van Beek TA. Chemical analysis and quality control of Ginkgo biloba leaves, extracts, and phytopharmaceuticals. J. Chromatogr. A. 2009;1216(11):2002-2032.
9. Püssa T, Raudsepp P, Kuzina K, Raal A. Polyphenolic composition of roots and petioles of Rheum rhaponticum L. Phytochem Anal. 2009;20(2):98-103.
10.Validación de métodos analíticos- regulacion 41-2007 del CECMED, (2007).
11.Sánchez J, Melchor G, Martinez G, Escobar A, Faure R. Antioxidant activity of Rhizophora mangle bark. Fitoterapia. 2006;77(2):141-143.
12.Marrero E, Sánchez J, de Armas E, Escobar A, Melchor G, Abad MJ, et al. COX-2 and sPLA2 inhibitory activity of aqueous extract and polyphenols of Rhizophora mangle (red mangrove). Fitoterapia. 2006;77(4):313-315.
13.Cuattrochi OA, Abelaira de Andrizz SI, Laba RF, editors. Introducción a la HPLC . Aplicación y Práctica: Impreso en la Argentina en Artes Grafica Farro SA, California 2750/52 (1289) Buenos Aires.; 1992.
14.Bombardelli E, Morazzoni P, Mustich G, inventors; Fracciones de polifenoles del té, uso de las mismas y formulaciones que las contienen. España patent ES 2 181 873 T3. 2003.
15.Sánchez LM, Mancebo B, Faure R, Travieso MdC. Validación de la técnica para la determinación de catequina en tabletas de Rhizophora mangle L. por CLAR. Rev. Cubana de Farmacia 2010;45(1):58-70.
16.Chen Q, Guo Z, Zhao J. Identification of green tea's (Camellia sinensis (L.)) quality level according to measurement of main catechins and caffeine contents by HPLC and support vector classification pattern recognition. J Pharmaceutical and Biomedical Analysis. 2008;48(5):1321-1325.
17.He Q, Yao K, Jia D, Fan H, Liao X, Shi B. Determination of total catechins in tea extracts by HPLC and spectrophotometry. Nat Prod Res. 2009;23(1):93-100.
18.Luo H, Cox SB, Gao W, Yu J, Tang L, Wang J-S. Metabolic profiling in validation of plasma biomarkers for green tea polyphenols. Metabolomics. 2006 Dec;2(4):235-241.
19.Ding M, Yang H, Xiao S. Rapid, direct determination of polyphenols in tea by reversed-phase column liquid chromatography. J Chromatogr A. 1999;849(2):637-640.
20.Abad-García B, Berrueta LA, López-Márquez DM, Crespo-Ferrer I, Gallo B, Vicente F. Optimization and validation of a methodology based on solvent extraction and liquid chromatography for the simultaneous determination of several polyphenolic families in fruit juices. J Chromatogr A. 2007;1154(1/2):87-96.
21.Horwitz W. Evaluation of analytical methods used for regulation of food and drugs. J AOAC. 1892;65:525-530.














