My SciELO
Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista de Salud Animal
Print version ISSN 0253-570X
Rev Salud Anim. vol.34 no.1 La Habana Jan.-Apr. 2012
Artículo original
VIABILIDAD DE OVOCITOS PORCINOS INMADUROS Y MADURADOS in vitro VITRIFICADOS CON ETILÉN GLICOL Y TREHALOSA
VIABILITY OF in vitro IMMATURE AND MATURED PIG OOCYTES VITRIFIED WITH ETHYLEN GLYCOL AND TREHALOSE
F. Fernández Reyes*, J.E. Hernández Pichardo*, Gabriela Castellanos García**
*Laboratorio de Manejo de la Reproducción Animal. Universidad Autónoma Metropolitana-Xochimilco (UAM-X). Calzada del Hueso 1100, Colonia Villaquietud, Delegación Coyoacán, CP. 04960, México, D.F. **Clínica Privada.
RESUMEN
Con el objetivo de evaluar la viabilidad de ovocitos porcinos inmaduros (VG) y madurados in vitro (MII) después de la vitrificación usando etilén glicol y trehalosa, se colectaron 503 ovarios de los cuales se obtuvieron 731 ovocitos por aspiración de folículos de 3 a 5 mm. Estos se dividieron en 3 grupos: Grupo 1) control (52 ovocitos), Grupo 2) vitrificación de ovocitos en estado de VG (326 ovocitos) y maduración después del calentamiento y Grupo 3) vitrificación de ovocitos madurados in vitro (353 ovocitos). En el grupo 1, después de ser cultivados in vitro por 44 horas se evaluó la maduración mediante la tinción con orceína al 1% en ácido acético al 45%. Los grupos 2 y 3 fueron vitrificados utilizando el protocolo de dos pasos (equilibrio y vitrificación), la viabilidad fue evaluada al momento del calentamiento (desvitrificación), mediante la tinción con azul de tiazolil (MTT). Los resultados obtenidos de maduración en el grupo 1, fue con presencia de VG 44%, en estado de MI (cromatina condensada o metafase I) 23% y MII 33%. La viabilidad en el grupo 2, en fresco fue 100%, al momento del calentamiento 76% y a 44 horas de cultivo in vitro después del calentamiento 13%. Los ovocitos del grupo 3, antes de la vitrificación presentaron una viabilidad de 94.8% y después del calentamiento 50%. Se concluye que aunque la viabilidad es mayor al momento del calentamiento en los ovocitos inmaduros que en los maduros, éstos últimos pueden presentar una mayor ventaja para el desarrollo posterior en la reproducción asistida, ya que en los inmaduros reduce mucho la viabilidad al cultivarlos por 44 horas para su maduración in vitro.
Palabras clave: porcino; ovocito; vitrificación; maduración in vitro; fertilización in vitro.
ABSTRACT
In order to assess the viability of immature oocytes (GV), matured in vitro (MII) after vitrification using glycol ethylene and trehalose, 503 ovaries were collected, from which 731 oocytes were obtained by aspiration of follicles from 3 to 5 mm. They were divided into 3 groups: Group 1) control (52 oocytes), Group 2) vitrification of oocytes under GV condition (326 oocytes) and maturing after heating and Group 3) vitrification of in vitro matured oocytes (353 oocytes). In group 1, after being cultured in vitro for 44 hours, maturation was assessed by staining with 1% orcein in 45% acetic acid. Groups 2 and 3 were vitrified using the two-step protocol (equilibrated and vitrification), viability was assessed at heating time (devitrification), by staining with thiazolyl blue (MTT). The results of maturation in group 1, was with the presence of GV 44%, in state of MI (condensed chromatin or metaphase I), 23% and 33% MII. Viability in group 2 was 100% fresh, at heating time 76% and at 44 h of culture in vitro after heating 13%. Group 3 oocytes before vitrification had a viability of 94.8% and 50% after heating. It is concluded that although viability is higher at heating time in immature oocytes than in those mature, the latter may have a major advantage for further development in assisted reproduction, since in those immature, viability is much more reduced when cultured 44 hours for in vitro maturation.
Key words: pig; oocyte; vitrification; in vitro maturation; in vitro fertilization.
INTRODUCCIÓN
La posibilidad de criopreservar material genético mediante la vitrificación de gametos, brinda una alternativa de perpetuar las especies (1). La ausencia de tecnologías eficaces para la criopreservación de ovocitos puede dar lugar a una pérdida de diversidad genética en el porcino, además de obstaculizar el uso de las tecnologías reproductivas (2). Una alternativa de criopreservación es la vitrificación, la cual se define como la transición de las soluciones acuosas de un estado líquido a un estado vítreo sólido sin la formación de cristales, aunque su estructura molecular sea la de un líquido extremadamente viscoso (estado vítreo) (3,4).
Los factores que mejoran el impacto de la vitrificación sobre los ovocitos o embriones, son los siguientes: El volumen de solución de vitrificación en el cual queden contenidos y la alta concentración de crioprotectores utilizados en la vitrificación. En cuanto al volumen se ha observado que al vitrificar ovocitos en estado de meiosis II (MII), en el contenedor Cryotop (<0.1 µl) presentaron después del calentamiento mejor recuperación y desarrollo que los vitrificados en la pajilla abierta estirada (OPS) (1-1.5 µl) (5), la disminución del volumen ha permitido obtener mejores resultados debido al paso más rápido por la zona de temperatura peligrosa (+15 a -5ºC), lo cual produce menores daños por enfriamiento (6). La alta concentración de crioprotectores utilizados en la vitrificación evita la formación de hielo y disminuye el daño causado por enfriamiento, puesto que disminuye la temperatura a velocidades muy rápidas (2,5000C/min) (3,4), aunque pueden incrementar las probabilidades de lesionar a las células debido al choque osmótico y a la toxicidad de los mismos (3). La técnica de vitrificación es un proceso rápido y fácil de realizar por lo que se convertirá en un método indispensable en criobiología (7).
Por las similitudes fisiológicas con los humanos, los cerdos pueden ser utilizados como modelos en investigaciones biomédicas y para crear animales genéticamente modificados como potenciales donadores de tejidos y órganos para genotrasplantes, estas biotecnologías requieren de la producción in vitro de ovocitos madurados y cigotos de buena calidad (8). In vivo la capacidad para la fertilización y el desarrollo se adquiere por los ovocitos después de un largo periodo de crecimiento y desarrollo, este proceso involucra tanto la síntesis de componentes citoplasmáticos como la reordenación y reducción de los cromosomas (9). La competencia meiótica, es decir, la capacidad de los ovocitos para reiniciar y completar la meiosis, se adquiere progresivamente durante el crecimiento del folículo y ovocito (3).
En condiciones de cultivo in vitro la maduración en algunos casos es deficiente por causas hasta ahora no identificadas (9), se considera que el tamaño del ovocito y la comunicación intercelular entre el ovocito y las células del cúmulo son importantes para su maduración (10), aunque durante muchos años se ha trabajado buscando reproducir artificialmente los eventos de la maduración, fertilización y el desarrollo embrionario temprano, los procedimientos aún no están completamente estandarizados(11), los estados de maduración meiótica de los ovocitos pueden influir en su capacidad para sobrevivir a la criopreservación, así se tiene que la vitrificación de ovocitos en estado de vesícula germinal (VG) podrían tener ventajas ya que los microtúbulos aún no están organizados en forma de huso y el material genético está dentro del núcleo protegido por la membrana nuclear, sin embargo los índices de supervivencia de ovocitos vitrificados en estado de VG, son todavía muy bajos en el bovino y porcino (3). En un estudio realizado por Wu et al. (12), usando como crioprotectores etilén glicol (EG) y sacarosa, con un protocolo de dos pasos y como contenedor la pajilla OPS, obtuvieron mayor viabilidad de ovocitos porcinos vitrificados en estado de VG que los vitrificados en estado de MII, los porcentajes fueron 56.8% y 41.9% respectivamente, se dice que los ovocitos porcinos en estado de MII son muy sensibles a la vitrificación con alteración localizada en los microtúbulos y organización mitocondrial (13), por otra parte Nagashima et al. (2) al utilizar EG 40% y 1 M de sacarosa en la vitrificación de ovocitos porcinos inmaduros obtuvieron una viabilidad de 56.3%, la cual evaluaron mediante el mantenimiento y apariencia intacta del citoplasma del ovocito, otros autores mencionan que el gran contenido de gotas de lípidos, característicos de los ovocitos de esta especie dificulta su vitrificación (14,15).
Los hallazgos mencionados indican que el proceso de vitrificación hace que disminuya la viabilidad de los ovocitos para su posterior desarrollo, por lo que es importante conocer la viabilidad al momento del calentamiento (desvitrificación) para poder establecer protocolos de investigación que mejoren los resultados del desarrollo posterior a la vitrificación en ovocitos porcinos. Zhou y Li (15), mencionan que la combinación de crioprotectores permeables y no permeables pueden incrementar el porcentaje de supervivencia de los ovocitos porcinos vitrificados. En ovocitos de ovino el uso de EG y trehalosa ha permitido obtener una maduración del 88% después de la vitrificación (16), de modo que la combinación de EG y trehalosa puede favorecer el proceso de vitrificación, pues el EG actúa como crioprotector de penetración rápida reduciendo el cambio de volumen y el tiempo de exposición para completar el equilibrio osmótico de los ovocitos, pero debe considerarse que en alta concentración o prolongada exposición produce un daño excesivo de la membrana y reduce potencialmente el desarrollo posterior (17). Por su parte la trehalosa tiene características más favorables que otros azúcares para la estabilización de las proteínas y de la doble capa de fosfolípidos de las membranas biológicas (18), puesto que tiene una acción protectora relacionada con el efecto osmótico y participa en interacciones específicas con los fosfolípidos de la membrana (19), estabiliza la bicapa de lípidos de la membrana y ejerce una función protectora contra el frío (20).
Debido a lo anterior el objetivo del presente trabajo fue evaluar la viabilidad al momento del calentamiento después de la vitrificación de ovocitos porcinos inmaduros (VG) y madurados in vitro (MII), usando como crioprotector permeable el etilén glicol y no permeable la trehalosa y como contenedor la pajilla estirada extrafina (SOPS).
MATERIALES Y MÉTODOS
Los ovarios de cerda provenientes del rastro se depositaron en un termo con 500 ml de solución de NaCl al 0.9 %, esta fue preservada con 0.5% de una solución de antibiótico antimicótico que contenía Penicilina, Estreptomicina y Anfotericina B. Los ovarios fueron transportados al laboratorio a una temperatura entre 25 y 30ºC en un tiempo no superior a dos horas, una vez en el laboratorio se lavaron 3 veces con la misma solución a temperatura ambiente.
Los complejos ovocitos células del cumulus (COCs) se aspiraron de folículos de 3 a 5 mm con una jeringa de 10 ml y aguja hipodérmica de 1 ½ calibre 1.20 mm x 38 mm, el contenido de las jeringas se vertió en tubos cónicos de 50 ml estériles para la extracción del sobrenadante, se dejó sedimentar media hora y posteriormente se hicieron lavados del sedimento con el mismo medio (TL-HEPES-PVA) a intervalos de 15 minutos, se obtuvo del fondo del tubo el paquete celular el cual se depositó en una caja Petri donde se procedió a buscar y seleccionar los ovocitos con citoplasma uniforme y rodeados de una masa compacta de células del cúmulo, de acuerdo a lo propuesto por (21,22).
En el diseño experimental se consideró clasificar a los COCs en tres grupos: Grupo 1) Control. Grupo 2) Vitrificación de ovocitos en estado de VG. Grupo 3) Vitrificación de ovocitos madurados in vitro; se realizaron siete ensayos por grupo.
Grupo 1) Control
Una vez obtenidos los COCs se lavaron tres veces con medio comercial de maduración TCM-199 con sales de Earle, L-Glutamina y bicarbonato de sodio libre de proteínas (IN VITRO, México), con el objeto de favorecer la maduración citoplasmática y la maduración nuclear el medio fue suplementado con D-glucosa, Piruvato de Sodio, PVA, Cisteína, EGF, FSH y LH, estas dos últimas hormonas fueron suplementadas usando 20 µl/ml de Merional (IBSA). Para su cultivo in vitro los COCs se colocaron en placas de 4 posillos (Nunc) con 500 µl de medio de maduración, cubierto con aceite mineral (Sigma), posteriormente se incubaron a 38.5ºC con 5 % de CO2 en aire y humedad a saturación por 44 horas, de acuerdo a Ducolomb et al., (22); Abeydeera et al., (23); Wang and Niwa, (24).
Después de la MIV las células del cúmulo fueron removidas con hialuronidasa al 0.1% en TCM-199, posteriormente se lavaron en medio TL-HEPES-PVA y después se depositaron los ovocitos con cantidad mínima de medio en un porta objetos (no más de 20 por porta objeto), para ser cubiertos con un cubre objeto con parafina sólida en los 4 extremos, una vez montados los ovocitos en el porta objeto se fijaron con ácido acético etanol (1:3) por 72 horas, transcurrido este tiempo los ovocitos fueron teñidos con orceína al 1% en ácido acético al 45% (21).
Los criterios de maduración fueron los siguientes:
- No madurados: Sin cromatina visible o con vesícula germinal (VG).
- En proceso de maduración: Los que presentaron cromatina condensada o metafase I (MI).
- Madurados: Los que presentaron metafase II (MII)y cuerpo polar.
Grupo 2) Vitrificación de ovocitos en estado de VG
Los ovocitos seleccionados se lavaron 3 veces en TCM-199 que contenía piruvato 0.255 mM, HEPES 25 mM, suero fetal bovino (SFB) 20% (v/v) y antibiótico 10 mL/L, posteriormente fueron transferidos al medio de equilibrio que contenía TCM-199, etilén glicol (EG) 4% y SFB 20%, en este medio permanecieron 15 minutos, transcurrido este tiempo fueron puestos en solución de vitrificación : TCM-199, EG 30%, SFB 20% y trehalosa 0.4 M por 20 s, posteriormente se colocaron en una pajilla extrafina (SOPS) (MINITUBE, México) para su vitrificación y se sumergieron directamente en nitrógeno líquido, procedimiento modificado de Al-aghbari et al. (16). El calentamiento (desvitrificación) fue una semana después a 37°C, para lo cual los ovocitos fueron colocados en una placa de 4 posillos (Nunc) con 500 ìl de medio TCM-199 con 10% de SFB y tres concentraciones decrecientes de trehalosa 0.3 M, 0.2 M, 0.1 M y 0.0 M, durante un periodo de 3 min en cada pozo, posteriormente fueron lavados 3 veces en TCM-199 suplementado con 10% SFB. El cultivo de ovocitos en estado de VG calentados fue similar al grupo control.
Evaluación de viabilidad
Para la evaluación de la viabilidad los ovocitos se colocaron en caja de Petri y posteriormente se les agregó azul tiazolil (MTT), transcurridas 2 hrs se procedió a observar la tinción de cada uno de los ovocitos, los viables presentaron una coloración azul y los no viables no presentaron coloración. Este procedimiento fue realizado en tres momentos: 1) En ovocitos frescos (recién colectados). 2) En ovocitos al momento del calentamiento (desvitrificación). 3) En los ovocitos calentados después de ser cultivados por 44 horas.
Grupo 3) Vitrificación de ovocitos madurados in vitro
El proceso de maduración in vitro fue similar al grupo control y la vitrificación fue igual al procedimiento usado en la vitrificación de ovocitos en estado de VG. La viabilidad fue evaluada en dos momentos: 1) En ovocitos frescos (recién colectados). 2) En ovocitos madurados vitrificados al momento del calentamiento (desvitrificación).
El análisis estadístico de los resultados fue realizado con la prueba de independencia de Chi-cuadrada (25,26).
RESULTADOS Y DISCUSIÓN
A partir de 503 ovarios colectados en rastro fueron obtenidos 731 ovocitos y estos fueron divididos en tres grupos, los resultados obtenidos se describen en las siguientes tablas:
El porcentaje obtenido después del cultivo por 44 horas no varió en los 3 grupos evaluados (Tabla 1).
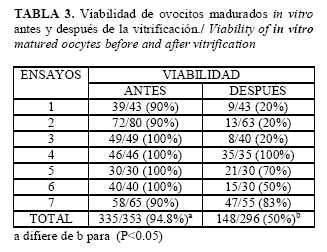
Como es de esperar se aprecia un mayor porcentaje de viabilidad en los ovocitos frescos recién colectados y en orden decreciente al momento de ser calentados (Tabla 2), así mismo la viabilidad disminuye significativamente después de la vitrificación (Tabla 3).
La suma total de ovocitos obtenidos en MI (12) y MII (17), dan como resultado que 29/52 (56%) presentaron rompimiento de vesícula germinal, siendo este porcentaje mayor al de ovocitos no madurados.
La viabilidad de los ovocitos disminuye con el proceso de vitrificación y se observa una disminución estadísticamente significativa (P<0.05) cuando son cultivados para su maduración después del calentamiento.
Al analizar los resultados obtenidos en nuestro ensayo encontramos diferencias atribuibles a factores de procedimiento. El % de maduración obtenido en el grupo control fue menor al 54.6%, reportado por Gonzales-Figueroa y Gonzales-Molfino (10), al utilizar un medio de cultivo diferente Medio San Marcos (SM) que contenía 22.3 mM piruvato de sodio, suplementado con Fluido Folicular porcino y gonadotropinas (eCG y hCG), posiblemente el aporte de los componentes que contiene el fluido folicular entre los que se encuentran proteínas, carbohidratos, enzimas y hormonas entre otros, en conjunto brinden mejores condiciones para su maduración. La maduración también fue menor al 60% mencionado por Casas et al. (21), quienes suplementaron FSH y LH en forma diferente, y los cultivaron hasta por 72 horas. Varios factores pueden contribuir en el porcentaje de maduración obtenido entre los que se tienen la temperatura del transporte de los ovarios del matadero al laboratorio (10), temperatura y tiempo de transporte (3), el tamaño del folículo que debe ser de 3-6 mm (8,14,27,28), cuando son menores puede afectar su maduración. Por otra parte (Shi et al. (7); Fujihira et al. (28); Li et al. (29), reportan que el periodo óptimo de cultivo in vitro es de 42 a 44 horas, suficientes para completar los procesos de maduración nuclear y citoplasmática. Asimismo las condiciones físicas específicas del ambiente en el que maduran los ovocitos van a influir en el resultado final, estas deben ser muy aproximadas a la temperatura corporal de la cerda que es de 38.5ºC (1,27), quedando dentro de los valores utilizados en este estudio. Mucci et al. (11) reportan que la utilización de SFB como suplemento proteico en los medios de cultivo pueden aumentar el porcentaje de maduración, sin embargo la posible presencia de elementos no identificados, determinan que algunos aspectos de su función aún no son completamente comprendidos. En los ovocitos inmaduros vitrificados y calentados no maduró ningún ovocito después de la vitrificación a 44 horas de cultivo in vitro, posiblemente por daño del citoesqueleto y los microfilamentos durante el proceso de vitrificación como lo mencionan Dobrinsky et al., (30).
Los resultados de viabilidad en el grupo control fueron similares al 100% reportado por Shi et al. (7) y superiores al 90.0% citado por Didion et al. (31). La viabilidad después del calentamiento para ovocitos en estado de VG fue superior al 57.0% reportado por Didion et al. (31), quienes los evaluaron por apariencia morfológica y citan 0% de viabilidad cuando los evaluaron mediante la tinción con azul tripan y diacetato de fluoresceína. En tanto que el porcentaje obtenido de viabilidad después del calentamiento y cultivados por 44 horas fue menor al 60.0% reportado por Didion et al., (31), quienes los cultivaron por 24 horas. Un menor porcentaje 56.8% de supervivencia fue reportado por Wu et al. (12), asimismo un porcentaje de 27.7% reportan Somfai et al. (32). Los resultados obtenidos de viabilidad durante el proceso de maduración indican que disminuye ligeramente 94.8%, comparado con la de los ovocitos frescos que presentaron el 100%. La viabilidad para ovocitos madurados in vitro vitrificados y calentados fue similar al 53.8% mencionado por Shi et al. (7). La diferencia en los porcentajes obtenidos de viabilidad con los autores antes mencionados, puede deberse a los componentes de los medios de cultivo ya que Shi et al. (7), utilizaron suplementos diferentes en el medio de cultivo (Gonadotropina coriónica equina, hCG de origen humano y Fluido folicular porcino). Un menor porcentaje 41.9% de supervivencia reporta Wu et al. (12), al utilizar un protocolo diferente en el proceso de vitrificación con EG y sacarosa. La supervivencia de los ovocitos vitrificados depende del daño que se ocasione durante el proceso, sobretodo por el choque osmótico en la deshidratación y rehidratación (13). Celestinos y Gatica (33), reportan que en el proceso de vitrificación es importante el volumen de la muestra, concentración de crioprotectores, método de adición de los mismos, temperatura y tiempo de equilibrio, y tasa de enfriamiento.
CONCLUSIÓN
El presente estudio demostró que el uso de EG y trehalosa como crioprotectores en el proceso de vitrificación de ovocitos porcinos permite obtener ovocitos viables al momento del calentamiento tanto en estado de VG como en MII al ser vitrificados en pajillas SOPS. La viabilidad al momento del calentamiento fue mayor en los ovocitos vitrificados en estado de vesícula germinal que en los vitrificados en estado de MII. Deberán realizarse estudios posteriores a fin de valorar si la viabilidad observada en lo ovocitos vitrificados en estado de MII es favorable para su posterior fertilización o desarrollo.
AGRADECIMIENTOS
Al Rastro Los Arcos de Los Reyes La Paz, estado de México, por la donación de los ovarios.
REFERENCIAS
1. Nagashima H, Hiruma K, Saito H, Tomii R, Ueno S, Nakayama N, et al. Production of Live Piglets Following Cryopreservation of Embryos Derived from In Vitro-Matured Oocytes. Biol Reprod 2007;76:900-905.
2. Nagashima H, Cameron RDA, Kuwayama M, Young M, Beebe L, Blackshaw AW, et al. Survival of Porcine Delipated Oocytes and Embryos after Cryopreservation by Freezing or Vitrification. J Reprod Develop. 1999;45(2):167-176.
3. Albarracín MJL. Vitrificación de ovocitos bovinos mediante la técnica open pulled Straw: estudio estructural de cromosomas, microtúbulos y microfilamentos y posterior desarrollo embrionario in vitro. Universidad Autónoma de Barcelona. Tesis Doctoral. 2005.
4. Cabrera P, Fernández A, Bastidas P, Perozo E, Molina M, Bethencourt S. Efecto de la vitrificación sobre la viabilidad morfológica de embriones murinos (Mus musculums). Zootecnia Trop. 2008;26(1):27-34.
5. Liu Y, Du Y, Lin L, Li J, Kragh PM, Kuwayama M, et al. Comparison of effiency of open pulled straw (OPS) and Cryotop vitrification for cryopreservation of in vitro matured pig oocytes. Cryo Letters. 2008;29(4):315-320.
6. Silva ME, Berland MA. Vitrificación de blastocitos bovinos producidos in vitro con el método Open Pulled Straw (OPS). Arch Med Vet. 2004;36(1):1-7.
7. Shi WQ, Zhu S, Zhang D, Wang W, Tang G, Hou P. Improved development by Taxol pretreatment after vitrification of in vitro matured porcine oocytes. Repropduction. 2006;131:795-804.
8. Gil MA, Cuello C, Parrilla I, Vazquez JM, Roca J, Martinez EA. Advances in swine in vitro embryo production technologies. Reprod Domest Anim. 2010;45(Suppl 2):40-48.
9. Hunter MG. Oocyte maturation and ovum quality in pigs. Rev Reprod. 2000;5:122-130.
10.Gonzales-Figueroa H, Gonzales-Molfino HM. Maturation of pig oocytes in vitro in a medium with pyruvate. Brazilian Journal of Medical and Biological Research. 2005;38:869-872.
11.Mucci N, Aller JF, Kaiser GG, Hozbor F, Alberio RH. Producción in vitro de embriones bovinos: suplementación de los medios de cultivo con suero. Arch Med Vet. 2006;38(2):97-104.
12.Wu C, Rui R, Dai J, Zhang C, Ju S, Xie B, et al. Effects of cryopreservation on the developmental competence, ultraestructure and cytoskeletal structure of porcine oocytes. Mol Reprod Develop. 2006;73:1454-1462.
13.Shi LY, Jin HF, Kim JG, Kumar BM, Balasubramanian S, Choe SY, et al. Ultra-structural changes and developmental potential of porcine oocytes following vitrification. Anim Reprod Sci. 2007;100:128-140.
14.Somfai T, Ozawa M, Noguchi J, Kaneko H, Nakai M, Maedomari N. et al. Live piglets derived from in vitro-produced zygotes vitrified at the pronuclear stage. Biol Reprod. 2009;80:42-49.
15.Zhou GB, Li N. Cryopreservation of porcine oocytes: recent advances. Mol Hum Reprod. 2009;15(5):279-285.
16.Al-agahbari AM, Menino JAR. Survival of oocytes recovered from vitrified sheep ovarian tissues. Anim Reprod Sci. 2002;71:101-110.
17.Hotamisligil S, Toner M, Powers D. Changes in membrane integrity, cytoskeletal structure, and developmental potential of murine oocytes after vitrification in ethylene glycol. Biology of Reproduction. 1996;55:161-168.
18.Corti RH. Criopreservación…¿y después? Soluciones acuosas sobreenfriadas y vitrificadas. Revista Ciencia Hoy. 2006;15:26-39.
19.Abe Y, Hara K, Matsumoto H, Kobayashi J, Sasada H, Ekwall H, et al. Feasibility of a nylon-mesh holder for vitrification of bovine germinal vesicle oocytes in subsequent production of viable blastocysts. Biol Reprod. 2005;72:1416-1420.
20.Conejo NJ. Estado funcional de la membrana, capacitación in vitro, reacción acrosomal y capacidad de fertilización in vitro de espermatozoides porcinos almacenados en un diluyente de larga duración. Tesis. Doctorado en Ciencias Biológicas. Universidad Autónoma Metropolitana Unidad Iztapalapa. México, D.F. 2003.
21.Casas E, Betancourt M, Bonilla E, Duculomb Y, Zayas H, Trejo R. Changes in cycling B localization during pig oocyte in vitro maturation. Zygote. 1999;7(2):21-26.
22.Ducolomb RYC, Romo GS, Balcázar SJA, Rodarte CLF, Casas HE, Fragoso GGC, et al. Primeros cerdos nacidos en México a partir de embriones producidos in vitro. Técnica Pecuaria México. 2005;43(3):425-432.
23.Abeydeera LR, Wang W, Pather RS, Day BN. Maturation in vitro of pig inezoocytes in protein-free culture media: Fertilization and subsequent embryo development in vitro. Biol Reprod. 1998;58:1316-1320.
24.Wang W, Niwa K. Synergetic effects of epidermal growth factor and gonadotropins on the cytoplamic maturation of pig oocytes in a serum-free medium. Zygote. 1995;3:345-350.
25.Kuehl RO. Diseño de Experimentos. Principios estadísticos para el diseño y análisis de Investigaciones. Ed. Thomson Learning. 2001.
26.Wayne WD. Biostadística: Base para el Análisis de las Ciencias de la Salud. 4ª. LIMUSA, México 2008; pp.588-599.
27.Esaki RH, Ueda M, Kurome K, Hirakawa R, Tomii H, Yoshioka H, et al. Cryopreservation of Porcine Embryos Derived from In Vitro-Matured Oocytes. Biol Reprod. 2004;71:432-437.
28.Fujihira T, Nagai H, Fukui Y. Relationship between equilibration times and the presence of cumulus cells, and effect of Taxol treatment for vitrification of in vitro matured porcine oocytes. Cryobiology. 2005;51:339-343.
29.Li R, Lai L, Wax D, Hao Y, Murphy CN, Rieke A, et al. Cloned Transgenic Swine Via In Vitro Production and Cryopreservation. Biol Reprod. 2006;75:226-230.
30.Dobrinsky JR, Pursel VG, Long CR, Johnson LA. Birth of piglets after transfer of embryos cryopreserved by cytoskeletal stabilization and vitrification. Biol Reprod. 2000;62:564-570.
31.Didion BA, Pomp D, Martin MJ, Homanics GE, Markert CL. Observations on the cooling and cryopreservation of pig oocytes at the germinal vesicle stage. J Animal Sci. 1990;68:2803-2810.
32.Somfai T, Noguchi J, Kaneko H, Nakai M, Ozawa M, Kashiwazaki N, et al. Production of good-quality porcine blastocysts by in vitro fertilization of follicular oocytes vitrified at the germinal vesicle stage. Theriogenology. 2010;73(2):47-56.
33.Celestinos M, Gatica R. Vitrificación como técnica de crioconservación de embriones bovinos. Arch Med Vet. 2002;34(2):1-9.
(Recibido 6-12-2010; Aceptado 5-11-2011)