My SciELO
Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista de Salud Animal
Print version ISSN 0253-570X
Rev Salud Anim. vol.35 no.2 La Habana May-Aug. 2013
ARTÍCULO ORIGINAL
Efecto de Lactobacillus sp. aislado de col fermentada, sobre el peso y los marcadores inmunológicos del camarón blanco Litopenaeus vannamei
Effect of Lactobacillus sp. isolated from fermented cabbage on the weight and immunological markers of white shrimp Litopenaeus vannamei
Ileana Sánchez OrtizI, Leonardo Martín MartínII, Yonarky García VarelaII, Zoila Abad MárquezI, Ramón Ffranco RodríguezI, Yamilka Ramírez NúñezI, Jesús Zamora SánchezI, Rosa Basulto MoralesI, Alain Moreira RubioI, Amílcar Arenal CruzII
ICentro de Ingeniería Genética y Biotecnología. P.O.Box 387. CP 70100. Camagüey. Cuba. Correo electrónico: ileana.sanchez@cigb.edu.cu.
IIUniversidad de Camagüey Ignacio Agramonte Loynaz. Circunvalación Norte. Camagüey. Cuba. Correo electrónico: amilcar.arenal@reduc.edu.cu.
RESUMEN
El empleo de probióticos para el control de enfermedades en la acuicultura intensiva es una alternativa al uso de antibióticos. En este trabajo se aisló la cepa bacteriana IC1 a partir de una fermentación acido láctica de col y se identificó por técnicas moleculares y convencionales como Lactobacillus sp. Se determinó la actividad antagónica in vitro de IC1 contra cepas patrones. Para la evaluación de la actividad probiótica un grupo de postlarvas de Litopenaeus vannamei se trató cada 24 horas con 1-2 x104 ufc/ml de IC1 y otro se mantuvo sin tratamiento. A los 25 días se cuantificaron el peso húmedo y el comportamiento de los parámetros inmunológicos (actividad de las enzimas superóxido dismutasa, fenoloxidasa y peroxidasa). El peso de los animales que se trataron con Lactobacillus sp. IC1 fue significativamente mayor en 1,3 veces respecto al control (p<0,05). Las actividades de las enzimas fenoloxidasa y superóxido dismutasa también se incrementaron, lo que indica la estimulación del sistema inmune de las postlarvas. La cepa tiene además actividad antagonista in vitro contra Vibrio harveyi R1, Pseudomonas aeruginosa ATCC 25 853 y Bacillus subtilis ATCC 6633. La bacteria ácido-láctica Lactobacillus sp. IC1 tiene potencialidades para el empleo como probiótico en camarón.
Palabras clave: probiótico, Litopenaeus vannamei, Vibrio harveyi, Lactobacillus sp., fermentaciones vegetales, bacterias ácido-lácticas.
ABSTRACT
The use of probiotics for controlling diseases in intensive aquaculture is an alternative to antibiotics. In this paper, the bacterial strain IC1 was isolated from an acid lactic fermentation of cabbage and it was identified by molecular and conventional techniques like Lactobacillus sp. The in vitro antagonistic activity against several pattern strains was determined. For probiotic activity evaluation, a group of Litopenaeus vannamei postlarvae was treated every 24 h with 1-2 x 104 cfu / ml of IC1 and the other remained untreated. At 25 days, the wet weight and the behaviour of the immunological parameters (superoxide dismutase, phenoloxidase and peroxidase enzyme activities) were measured. The weight of animals treated with Lactobacillus sp. IC1 was significantly higher in 1.3 times than the control (P <0.05). Superoxide dismutase and phenoloxidase activities also increased significantly, indicating the stimulation of the immune system. The strain also had in vitro antagonistic activity against Vibrio harveyi R1, Pseudomonas aeruginosa ATCC 25 853 and Bacillus subtilis ATCC 6633. The acid lactic bacteria Lactobacillus sp. IC1 has a great potential as probiotic for use in shrimp cultures.
Key words: probiotic, Litopenaeus vannamei, Vibrio harveyi, Lactobacillus sp., vegetable fermentation, acid- lactic bacteria.
INTRODUCCIÓN
El cultivo intensivo de camarones es una actividad con un alto potencial para satisfacer la creciente demanda de alimentos acuáticos(1); sin embargo, una de las principales dificultades que existe en el cultivo comercial de estos animales es la aparición de infecciones que se asocian a las deficiencias en los métodos de manejo, a la calidad de las aguas y al valor nutricional del alimento (2). Estas enfermedades infecciosas se controlaron con antibióticos por muchos años, pero el uso indiscriminado de estos compuestos provocó la aparición de cepas bacterianas multi-resistentes que pueden afectar la salud del consumidor, la disminución de la flora bacteriana que actúa como protección natural a los patógenos y la persistencia de estos agentes químicos en el ambiente (3).
La introducción del uso de bacterias benéficas para el desarrollo de vacunas, inmunoestimulantes y probióticos son algunas de las alternativas para resolver este problema(4). El empleo de probióticos en etapas de desarrollo larval y juvenil de los organismos acuáticos disminuye las tasas de mortalidad larvaria, aumenta las de crecimiento y mejora la capacidad inmunológica natural sin dejar residuos perjudiciales para la salud (2). Bacterias probióticas de los géneros Vibrio y Bacillus se han aislado con este fin del agua de cultivo de camarones y del intestino o hepatopáncreas de diferentes especies de penaeidos (5,6,7). Las especies de Lactobacillus sp. que se han probado son generalmente cepas provenientes de vertebrados (8), pero no existen informes de aislamientos de cepas probióticas a camarón a partir de fermentaciones ácido lácticas de vegetales.
Durante el proceso de fermentación espontáneo de vegetales en salmuera se desarrolla una amplia gama de microorganismos que forman parte de su propia microbiota y que presentan propiedades probióticas (9). En este artículo se presentan los resultados del aislamiento y selección mediante antagonismo a Vibrio harveyi R1 de un probiótico potencial para camarón a partir de fermentaciones ácido-lácticas de col y se muestra el efecto de esta cepa sobre el peso y los parámetros inmunológicos de los animales.
MATERIALES Y MÉTODOS
Material biológico
Las larvas de Litopenaeus vannamei se obtuvieron en estadio PL9 (9 días después de la metamorfosis a postlarva), procedentes del centro de Desove de camarón «Yaguanabo», ubicado en Cumanayagua, Cienfuegos, Cuba.
El aislamiento Vibrio harveyi R1 se obtuvo del Centro de Desove de Santa Cruz del Sur, Camagüey y se identificó mediante API 20 NE (Biomériux) y por técnicas bioquímicas convencionales según el Manual de Taxonomía Sistemática de Bergey (10).
Los aislamientos antagonistas a Vibrio harveyi R1 se obtuvieron de fermentaciones ácido-lácticas de col en salmuera (NaCl 6%, sacarosa 1%) y con 30 días desde el inicio del proceso.
Las cepas de referencia se suministraron por el cepario del Centro de Ingeniería Genética y Biotecnología de Camagüey.
Aislamiento y selección de microorganismos antagonistas a Vibrio harveyi R1
Un gramo de vegetal se suspendió en 9 mL de solución salina peptonada (Peptona 1g/L, NaCl 9 g/L). A partir de la suspensión se realizaron diluciones decimales seriadas que se sembraron por duplicado mediante diseminación con espátula de Drigalsky en placas de Petri (100 mm de diámetro) que contenían 20 ml de medio de cultivo Agar de Man, Rogosa y Sharpe (MRS) (11). Estos se incubaron a 30°C durante 48 h.
Para la selección, las colonias se inocularon por punción en 2 placas con medio MRS y se incubaron a 30°C durante 48 h. Una de las placas se trató durante 5 minutos con vapores de cloroformo y se adicionó sobre la superficie una mezcla de cultivo de la cepa patógena oportunista Vibrio harveyi R1 (108 ufc/mL) con agar Nutriente según Liao y colaboradores (12). Después de 48 horas a 30ºC se seleccionaron las colonias que mostraron halos de inhibición, se purificaron mediante agotamiento por estrías en medio agar MRS. Los microorganismos se conservaron por congelación a -70ºC con glicerol al 20% como crioprotector (13).
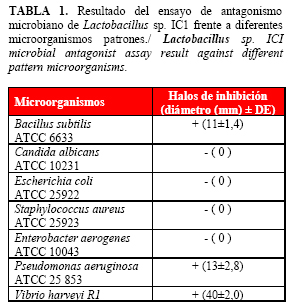
El ensayo de antagonismo microbiano se repitió según Liao (12). Se utilizaron además las cepas de referencia Bacillus subtilis ATCC 6633, Candida albicans ATCC 10231, Escherichia coli ATCC 25922, Staphylococcus aureus ATCC 25923, Enterobacter aerogenes ATCC 10043 y Pseudomonas aeruginosa ATCC 25 853. El ensayo se realizó por triplicado y se midieron los halos de inhibición en cada caso.
La identificación convencional se realizó según el Manual de Taxonomía Sistemática de Bergey (10). La ubicación taxonómica en el género se estableció a partir de los resultados de las tinciones de Gram y de esporas y de la determinación de la actividad de la enzima catalasa y de la relación de la cepa con el oxígeno (13). La producción de ácido a partir de diferentes azúcares y la utilización de nitratos por la cepa se detectó mediante la inoculación del juego de identificación API 20A (Biomériux).
Para la identificación molecular se realizó una Reacción en Cadena de la Polimerasa (PCR) en un volumen final de 100 µL. A cada reacción se adicionaron 10 ng/µL de ADN genómico (que se purificaron según Sambrook (14), 2,5 mM de MgCl2, 100 µM de cada dNTP en tampón de reacción (50 mM de KCl y 10 mM Tris-HCl pH 8,24), una unidad de ADN polimerasa de Thermus aquaticus (Promega) y 1 pmol/µL de los cebadores 27F (5'AGAGTTTGATC(AC)TGGCTCAG'3) y 1492R (5'TACGG(ACT)TACCTTGTTACGA CTT'3). El programa para la amplificación fue el siguiente: la desnaturalización fue de 95°C durante 1 minuto, la hibridación 55°C por 1 minuto y la elongación de 72°C durante 1,5 minutos y se realizaron durante 25 ciclos. La secuenciación se realizó a través del método de Sanger (Macrogen, Corea), con los mismos cebadores.
Las secuencias obtenidas a partir del producto de la PCR se compararon con las secuencias de ADN que codifican para la región 16S de ARN ribosomal disponibles en la base de datos pública NCBI GenBank (National Center for Biotechnology Information, EEUU.) mediante el algoritmo Blastn Clustal w (15).
Determinación del efecto de la cepa sobre el camarón Litopenaeus vannamei
Las larvas de camarones en estadio PL9 se sembraron en tanques plásticos con un volumen de 4L de agua a una densidad de 15 animales/l. La salinidad del agua fue de 32 g/l y la temperatura de 25 ±1ºC. Los animales se alimentaron dos veces al día con nauplios de artemia congelados (Aquatic Eco-Systems Inc.). Diariamente se intercambió el 25% del volumen de cada tanque para eliminar las heces y restos de alimentos. Se realizó un diseñó de clasificación simple. Los animales se seleccionaron al azar y se conformaron dos grupos experimentales con cuatro réplicas cada uno. El grupo 1 se trató cada 24 horas con 1-2 x104 ufc/ml de la cepa IC1 que se adicionó directamente al agua de cultivo. El grupo 2 se utilizó cómo control negativo y no se le aplicó ningún tratamiento. A los 25 días se pesaron los animales en una balanza analítica (Sartorius) después de colocarse durante 5 minutos sobre papel de filtro. También se determinó el comportamiento de los parámetros inmunológicos (actividad peroxidasa, fenoloxidasa (PO) y superóxido dismutasa (SOD)).
Ensayos bioquímicos
Preparación de las muestras
Cada una de las larvas se maceró en 300 µL de agua bidestilada con un homogenizador (Wiggenhauser, D-130, Malasia), se centrifugaron a 10000 rpm durante 10 minutos a 25oC y los sobrenadantes se almacenaron a -20oC hasta su utilización.
Contenido de proteínas solubles totales
La concentración de proteínas solubles se determinó por el método de Bradford (16). 10 µl de cada muestra, se distribuyeron en una placa de poliestireno de 96 pocillos de fondo plano (Costar ®, EE.UU), se añadieron 190 µL de reactivo de Bradford y se incubó 10 minutos a 25°C en la oscuridad. Se midió la absorbancia a 620 nm de longitud de onda en un Multiscan (Titertek MCC/340). El ensayo se realizó por triplicado y las concentraciones de proteínas de las muestras se calcularon a partir de una curva patrón con albúmina sérica bovina (ASB) (Sigma-Aldrich Chemie) en agua bidestilada.
Actividad específica de la enzima peroxidasa
A 20 µl de las muestras depositados en placas de 96 pocillos de fondo cóncavo (NUNC™ Brand Products, Dinamarca) se les añadió 50 µl de una solución de peróxido de Hidrógeno (H2O2) (0,15 % V/V) y o-fenilendiamina (OPD) (0,1 % p/v) en tampón sustrato pH 5 (Na2HPO4 0,05 M; ácido cítrico 0,02 M). Las muestras se incubaron 30 minutos a 25°C y se detuvo la reacción con 50 µl de ácido sulfúrico (2,5 M). Se midió la absorbancia a 492 nm (Titertek Multiskan MCC/340). La actividad se calculó a partir de una curva patrón con un anticuerpo monoclonal (contra hormona de crecimiento de tilapia) conjugado a peroxidasa de rábano (Heber Biotec, Cuba). Como control negativo se usó una solución de OPD (0,1 % p/v) y H2O2 (0,15 % v/v) en tampón fosfato pH 5. Una unidad de actividad específica se definió como la formación de 1 µmol de 2,3- diaminofenacina a partir de o-fenilendiamina por minuto de reacción por mg de proteínas solubles totales.
El cálculo se realizó a través de la siguiente ecuación:
Donde:
A: absorbancia
P: concentración de proteínas solubles
K: pendiente de la formación de 2,3- diaminofenacina
Vens: volumen de ensayo de reacción
Venz: volumen de enzima
t: tiempo de reacción
Actividad específica de la enzima fenoloxidasa
A 10 µL de cada una de las muestras depositadas en pocillos de placas de poliestireno se añadieron 10 µl de tripsina al 0,5 % p/v en tampón cacodilato de sodio (cacodilato de sodio (100 mM); MgCl2 (50 mM); CaCl2 (5 mM). Se incubaron 10 minutos a 25ºC en la oscuridad y se le adicionaron 80 µL de tampón cacodilato de sodio con L-dihidroxifenilalanina (L-DOPA) al 1.5% p/v. La medición de la absorbancia de las muestras antes y después de la incubación se realizó a 492 nm (Multiskan Titertek MCC/340). Como control negativo se usó la solución de tampón cacodilato de sodio. La actividad específica PO se definió como la variación de 0,001 unidades de absorbancia por minuto por µg de proteínas solubles totales (17).
Actividad específica de la enzima superóxido- dismutasa
Se realizó según el método propuesto por Beauchamp y Fridovich (22). A 10 µl de las muestras se depositaron en cubetas de poliestireno (Kem-O-Mat® 2, Reino Unido). Se adicionaron 490 µl de tampón fosfato (50 mM, pH 7,8) que contenía EDTA (0,1mM), metionina (13 µM) y riboflavina (20 µM) y 10 µl de nitroblue tetrazolio (NBT) (0,75 mM). Se midió la absorbancia inicial de las muestras a 560 nm en un espectrofotómetro (Ultrospec 2000 Pharmacia Biotech). Después de 15 minutos de incubación a 25°C bajo la acción de luz fluorescente se repitió la determinación. Una unidad de actividad específica SOD se definió como la variación de 0,001 unidades de absorbancia por minuto por µg de proteínas solubles en las postlarvas (18).
Análisis estadístico
Se realizó un análisis estadístico de los datos experimentales con empleo del programa GraphPad Prism versión 5.01, (19). La normalidad de los datos de peso de los animales experimentales, se comprobó a través de la prueba de Kolmogorov-Smirnov, luego se realizó una prueba F para determinar la homogeneidad entre las varianzas. Las diferencias entre los grupos se determinaron a través de pruebas T. El mismo procedimiento se utilizó para el análisis de las actividades peroxidasa, PO y SOD.
RESULTADOS
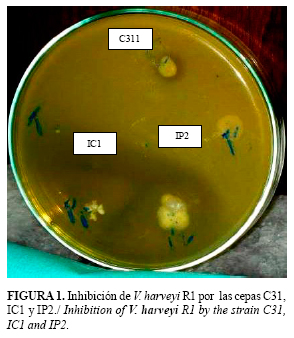
La metodología empleada para el aislamiento de microorganismos potencialmente probióticos a camarón a partir de fermentaciones de col permitió la selección de IC1, cepa que mostró el mayor halo de inhibición (40 mm) en ensayos contra el patógeno oportunista Vibrio harveyi (Figura 1).
La presencia de compuestos antimicrobianos es uno de los mecanismos de acción más generalizados entre las bacterias ácido lácticas con características probióticas (9). Lactobacillus sp. IC1 en ensayos in vitro mostró halos de inhibición de crecimiento de los microorganismos patrones Bacillus subtilis ATCC 6633 y Pseudomonas aeruginosa ATCC 25 853 (Tabla 1). Esto indica que la cepa produce compuestos antimicrobianos contra géneros bacterianos que se encuentran en la microbiota natural de los camarones y que en condiciones de estrés ambiental se suelen convertir en patógenos oportunistas.
IC1 es una bacteria Gram positiva en forma de bacilo, con reacción catalasa negativa, que no produce endosporas, por lo que se ubicó en el género Lactobacillus. Sus colonias son circulares de color blanco, opacas, superficie lisa y brillante y bordes enteros. La cepa es microaereofílica, reduce el nitrato a nitrógeno gaseoso y produce ácido a partir de un gran grupo de carbohidratos (Tabla 2).
La misma se identificó como Lactobacillus sp. a partir de la comparación de las secuencias de ADN que codifican para la región 16S del ARN ribosomal y de los resultados de las pruebas bioquímicas convencionales. La cepa IC1 mostró un 99, 9 % de homología con las secuencias de las especies Lactobacillus plantarum y Lactobacillus pentosus depositadas en las bases de datos de GeneBank. El análisis de ARN ribosomal no permitió diferenciar estas dos especies que están genotípicamente muy cercanas y tienen además alta similitud fenotípica. La diferenciación de estas dos especies podría ser posible a través del análisis de la secuencia de los genes rec (20).
La aplicación de probióticos en la acuicultura disminuye las tasas de mortalidad larvaria y aumenta las tasas de crecimiento (21). En el caso de Lactobacillus sp. IC1 la exposición de postlarvas de camarón a concentraciones de 1-2 x104 ufc/ml provocó un incremento significativo de 1,3 veces del peso de las postlarvas de Litopenaeus vannamei con respecto al grupo control (Figura 2).
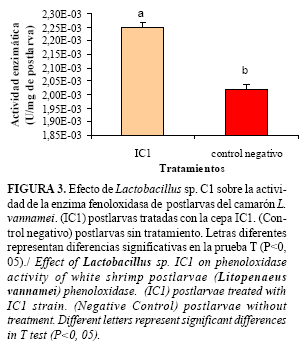
Otro mecanismo de acción encontrado entre las cepas probióticas es la modulación de la respuesta inmunológica no específica (22). Las actividades fenoloxidasa y superóxido dismutasa se incrementaron de forma significativa (p<0,05), aunque la actividad peroxidasa se redujo (Figuras 3, 4 y 5).
DISCUSIÓN
En este trabajo se demostró que es posible encontrar bacterias antagonistas in vitro a patógenos de camarón en fermentaciones ácido lácticas de vegetales. Este es un proceso microbiano complejo que conduce al predominio de las bacterias ácido lácticas (BAL) presentes en la microflora del vegetal que se emplea. Según Beauchamp et al. (18) en las primeras fases de este proceso intervienen bacterias y en menor medida levaduras. El aislamiento de Lactobacillus sp. IC1 corrobora el predominio de este género en las fermentaciones ácido lácticas de col. Las BAL son consideradas microorganismos generalmente reconocidos como seguros para el uso en alimentos, lo que reduce las pruebas de inocuidad que se emplean frecuentemente como probióticos (9). En humanos favorecen la salud mediante la reducción del colesterol, el mejoramiento de la absorción de nutrientes y la microflora intestinal, además promueven la digestión de la lactosa, suministran algunas vitaminas, previenen algunos tipos de cáncer, infecciones virales y alergia y tienen efecto inmunomodulatorio (23).
En el cultivo de camarones se informó el uso de las BAL para el control de enfermedades. Kongnum y Hongpattarakere (8), por ejemplo, controlaron una infección inducida con Vibrio harveyi en Litopenaeus vannamei con una cepa de Lactobacillus plantarum.
La eficacia de un probiótico seleccionado in vitro puede cambiar cuando se administra al hospedero debido a factores complejos como la ingestión selectiva y la muerte en el tracto gastrointestinal causada por la incapacidad del probiótico para mantener su fisiología bajo circunstancias de una mayor interacción microbiana (24). Sin embargo, el empleo del probiótico potencial Lactobacillus sp. IC1 mostró resultados satisfactorios in vivo y resultó en un incremento significativo del peso de los camarones.
Los microorganismos probióticos pueden mostrar diversos mecanismos de acción. La competencia por nutrientes, la modulación de la respuesta inmunológica no específica, la producción de compuestos antimicrobianos y la competencia por el sitio de fijación en el tracto gastrointestinal, son algunos de los que más se evidencian en experimentos in vitro e in vivo (25,26). Lactobacillus sp. IC1 por su parte produce un compuesto antimicrobiano de gran actividad contra V. harveyi R1, lo que le permite tener ventaja competitiva respecto a esta especie que se encuentra habitualmente en el tracto intestinal de los camarones. El ácido láctico, los ácidos orgánicos, el peróxido de hidrógeno y las antibiocinas son algunos de los compuestos que pueden ser liberados por las BAL (27). Estos compuestos inhiben el crecimiento de las bacterias patógenas e inducen mayor crecimiento y eficiencia en la alimentación (8,27,28,29). Se impone la necesidad de dilucidar por cuál de estos mecanismos Lactobacillus sp IC1 inhibe el crecimiento de V. harveyi in vitro.
El sistema complejo antioxidante de los organismos aeróbicos previene del efecto de las especies reactivas de oxígeno y también protege a las células del estrés oxidativo (30). Las defensas antioxidantes incluyen las enzimas ascorbato peroxidasa, glutatión reductasa, catalasa, peroxidasas y superóxido dismutasa (SOD), las cuales eliminan el anión superóxido (31). El balance oxidante/antioxidante es determinante en la función inmunológica celular. En este sentido Lactobacillus sp IC1 presenta otro atributo de gran interés, eleva los niveles de fenoloxidasa y superóxido dismutasa, por lo que pudiera considerarse inmunoestimulante. Estas enzimas están relacionadas con la resistencia de los animales a infecciones bacterianas y virales (32). En L. vannamei tratado con Lactobacillus plantarum aumentó significativamente la actividad fenoloxidasa (PO), el estallido respiratorio y la actividad superóxido dismutasa (SOD), así como la trascripción del mARN de peroxinectina (PE) y profenoloxidasa (proPO), lo que sugiere que esta cepa estimula el estado antioxidante del camarón a la misma vez que aumenta la respuesta inmune.
La menor actividad de la enzima peroxidasa pudiera deberse a que hay un incremento de la actividad de la enzima catalasa por la producción de H2O2 por Lactobacillus IC1 algo característico en este género. La enzima catalasa sólo difunde desde los peroxisomas cuando los niveles de este compuesto son elevados y en estas cirscuntancias los niveles de la enzima peroxidasa que actúa preferentemente sobre los peróxidos orgánicos o cuando los niveles de peróxidos inorgánicos son bajos, se reduce (33). Lo anterior sugiere la necesidad de determinar el comportamiento de la enzima catalasa en las postlarvas de camarón blanco cuando se adiciona esta cepa.
Los resultados indican que Lactobacillus sp. IC1 podría ser utilizado para prevenir y tratar enfermedades en los sistemas acuícolas intensivos de camarón, a la vez que estimule la ceba de los animales. Esta cepa podría permitir la implementación de nuevas estrategias en el desarrollo de productos probióticos a organismos acuáticos.
CONCLUSIONES
Las fermentaciones vegetales constituyen una fuente de gran interés para el aislamiento de bacterias probióticas a camarón. Lactobacillus sp. IC1 aislado de una fermentación vegetal del col y seleccionado mediante antagonismo in vitro al patógeno oportunista de camarón Vibrio harveyi R1 es un probiótico potencial para Litopenaeus vannamei. A concentraciones celulares de 104 ufc/ml, favorece el aumento de peso de los animales y estimula su sistema inmune.
Lactobacillus sp. IC1 podría ser utilizado para prevenir y tratar enfermedades en los sistemas acuícolas intensivos para camarón y para acelerar la ceba de los animales. Es necesario realizar estudios para el escalado del cultivo y para el diseño de una formulación adecuada que garantice su empleo con eficiencia. Esta cepa puede permitir la implementación de nuevas estrategias en el desarrollo de productos probióticos a organismos acuáticos.
REFERENCIAS
1. Fisheries F. Aquaculture Department: The State of World Fisheries and Aquaculture 2010. A report of the FOOD AND AGRICULTURE ORGANIZATION OF THE UNITED NATIONS Rome. 2010.
2. Nimrat S, Boonthai T, Vuthiphandchai V. Effects of probiotic forms, compositions of and mode of probiotic administration on rearing of Pacific white shrimp (Litopenaeus vannamei) larvae and postlarvae. Anim Feed Sci Technol. 2011;169(3-4):244-258.
3. Soto-Rodriguez SA, Gomez-Gil B, Lozano R, del Rio-Rodríguez R, Diéguez AL, Romalde JL. Virulence of Vibrio harveyi responsible for the «Bright-red» Syndrome in the Pacific white shrimp Litopenaeus vannamei. J Invertebr Pathol. 2012;109(3):307-317.
4. Hu Y-h, Deng T, Sun B-g, Sun L. Development and efficacy of an attenuated Vibrio harveyi vaccine candidate with cross protectivity against Vibrio alginolyticus. Fish Shellfish Immunol. 2012;32(6):1155-1161.
5. Luis-Villaseñor IE, Macías-Rodríguez ME, Gómez-Gil B, Ascencio-Valle F, Campa-Córdova ÁI. Beneficial effects of four Bacillus strains on the larval cultivation of Litopenaeus vannamei. Aquaculture. 2011;321(1-2):136-144.
6. Song ZF, An J, Fu GH, Yang XL. Isolation and characterization of an aerobic denitrifying Bacillus sp. YX-6 from shrimp culture ponds. Aquaculture. 2011;319(1-2):188-193.
7. Zokaeifar H, Balcázar JL, Saad CR, Kamarudin MS, Sijam K, Arshad A, et al. Effects of Bacillus subtilis on the growth performance, digestive enzymes, immune gene expression and disease resistance of white shrimp, Litopenaeus vannamei. Fish Shellfish Immunol. 2012;33(4):683-689.
8. Kongnum K, Hongpattarakere T. Effect of Lactobacillus plantarum isolated from digestive tract of wild shrimp on growth and survival of white shrimp (Litopenaeus vannamei) challenged with Vibrio harveyi. Fish Shellfish Immunol. 2012;32(1):170-177.
9. Di Cagno R, Coda R, De Angelis M, Gobbetti M. Exploitation of vegetables and fruits through lactic acid fermentation. Food Microbiol. 2013;33(1):1-10.
10.Kandler O, Weiss N. Regular, nonsporing gram-positive rods. Bergey's manual of systematic bacteriology. 1986;2(2):1208-1234.
11.De Man J, Rogosa M, Sharpe ME. A medium for the cultivation of lactobacilli. J Appl Microbiol. 1960;23(1):130-135.
12.Liao C-H. Antagonism of Pseudomonas putida strain PP22 to phytopathogenic bacteria and its potential use as a biocontrol agent. Plant Dis. 1989;73(3):223.
13.Seeley HW, Vandemark P. Microbes in Action: A Laboratory Manual of Microbiology: WH Freeman, 1962, Reprinted Bombay DB Taraporevala; 1970.
14.Sambrook J, Russell DW. Molecular cloning: a laboratory manual: CSHL press; 2001.
15.Thompson JD, Higgins DG, Gibson TJ. CLUSTAL W: improving the sensitivity of progressive multiple sequence alignment through sequence weighting, position-specific gap penalties and weight matrix choice. Nucleic Acids Res. 1994;22:4673-4680).
16.Bradford MA. Rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of proteindye binding. Anal Biochem. 1976;72(7):248-254.
17.Cerenius L, Henttonen P, Lindqvist OV, Söderhäll K. The crayfish pathogen Psorospermium haeckeli activates the prophenoloxidase activating system of freshwater crayfish in vitro. Aquaculture. 1991;99(3):225-233.
18.Beauchamp C, Fridovich I. Superoxide dismutase: improved assays and an assay applicable to acrylamide gels. Anal Biochem. 1971;44(1):276.
19.Prism G. version 5.01. GraphPad Software Inc: San Diego, CA, USA. 2007.
20.Parente E, Ciocia F, Ricciardi A, Zotta T, Felis GE, Torriani S. Diversity of stress tolerance in Lactobacillus plantarum, Lactobacillus pentosus and Lactobacillus paraplantarum: A multivariate screening study. Int J Food Microbiol. 2010;144(2):270-279.
21.Zhou X-X, Wang Y-B, Li W-F. Effect of probiotic on larvae shrimp (Penaeus vannamei) based on water quality, survival rate and digestive enzyme activities. Aquaculture. 2009;287(3-4):349-353.
22.Tseng D-Y, Ho P-L, Huang S-Y, Cheng S-C, Shiu Y-L, Chiu C-S, et al. Enhancement of immunity and disease resistance in the white shrimp, Litopenaeus vannamei, by the probiotic, Bacillus subtilis E20. Fish Shellfish Immunol. 2009;26(2):339-344.
23.Kawahara T, Otani H. Stimulatory effect of lactic acid bacteria from commercially available Nozawana-zuke pickle on cytokine expression by mouse spleen cells. Biosci Biotechnol Biochem. 2006;70(2):411-417.
24.Liu K-F, Chiu C-H, Shiu Y-L, Cheng W, Liu C-H. Effects of the probiotic, Bacillus subtilis E20, on the survival, development, stress tolerance, and immune status of white shrimp, Litopenaeus vannamei larvae. Fish Shellfish Immunol. 2010;28(5-6):837-844.
25.Villamil L. Probióticos como herramienta biotecnológica en el cultivo de camarón. Bol Invest Cost. 2009;38(2):165-167.
26.Kesarcodi-Watson A, Kaspar H, Lategan MJ, Gibson L. Probiotics in aquaculture: The need, principles and mechanisms of action and screening processes. Aquaculture. 2008;274(1):1-14.
27.Ma C-W, Cho Y-S, Oh K-H. Removal of pathogenic bacteria and nitrogens by Lactobacillus spp. JK-8 and JK-11. Aquaculture. 2009;287(3-4):266-270.
28.Salinas I, Myklebust R, Esteban MA, Olsen RE, Meseguer J, Ringø E. In vitro studies of Lactobacillus delbrueckii subsp. lactis in Atlantic salmon (Salmo salar L.) foregut: Tissue responses and evidence of protection against Aeromonas salmonicida subsp. salmonicida epithelial damage. Vet Microbiol. 2008;128(1-2):167-177.
29.Lee H-I, Kim MH, Kim KY, So J-S. Screening and selection of stress resistant Lactobacillus spp. isolated from the marine oyster (Crassostrea gigas). Anaerobe. 2010;16(5):522-526.
30.Downs CA, Fauth JE, Woodley CM. Assessing the health of grass shrimp (Palaeomonetes pugio) exposed to natural and anthropogenic stressors: a molecular biomarker system. Mar Biotechnol. 2001;3(4):380-397.
31.Campa-Córdova A, Hernández-Saavedra N, De Philippis R, Ascencio F. Generation of superoxide anion and SOD activity in haemocytes and muscle of American white shrimp (Litopenaeus vannamei) as a response to â-glucan and sulphated polysaccharide. Fish Shellfish Immunol. 2002;12(4):353-366.
32.Martín L, Castillo NM, Arenal A, Rodríguez G, Franco R, Santiesteban D, et al. Ontogenetic changes of innate immune parameters from eggs to early postlarvae of white shrimp Litopenaeus vannamei (Crustacea: Decapoda). Aquaculture. 2012;358-359(0):234-239.
33.Trasviña-Arenas CH, Garcia-Triana A, Peregrino-Uriarte AB, Yepiz-Plascencia G. White shrimp Litopenaeus vannamei catalase: Gene structure, expression and activity under hypoxia and reoxygenation. Comp Biochem Physiol B Biochem Mol Biol. 2013;164(1):44-52.
Recibido: 10-1-2012.
Aceptado: 7-6-2012.