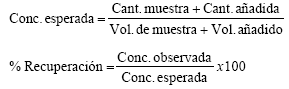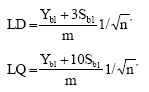Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de Salud Animal
versión impresa ISSN 0253-570X
Rev Salud Anim. vol.35 no.2 La Habana mayo.-ago. 2013
ARTÍCULO ORIGINAL
Niveles de ptaquilósido en muestras de leche bovina en granjas de San Miguel de Bolívar, provincia Bolívar, Ecuador
Ptaquiloside levels in bovine milk samples in farms of San Miguel de Bolivar, Bolivar province, Ecuador
Ángela CalderónI, Betty ManceboII, Luz María SánchezII, Ximena ChiribogaIII, Diego LuceroIII, Evangelina MarreroII
IUniversidad Estatal de Bolívar, Av. Che Guevara s-n y Gabriel Secaira Guaranda-Ecuador. Correo electrónico: acalderon@ueb.edu.ec.
IICentro Nacional de Sanidad Agropecuaria (CENSA), Apartado 10, San José de las Lajas, Mayabeque, Cuba.
IIIUniversidad Central del Ecuador, Ciudadela Universitaria. Av. América, Quito, Ecuador.
RESUMEN
En diferentes regiones ganaderas del mundo y en particular de América Latina se ha reportado la invasión de helechos tóxicos correspondientes al Género Pteridium que afectan la crianza animal vacuna y que supone un riesgo potencial al ser humano por la residualidad que manifiestan los componentes tóxicos de la planta en carne y leche. El objetivo del presente trabajo fue determinar los niveles de ptaquilósido (Pta) en muestras de leche fresca procedentes del Cantón de San Miguel de Bolívar, Provincia Bolívar, Ecuador, mediante cromatografía líquida de alta resolución. Las muestras de leche fueron colectadas de granjas invadidas por helechos Pteridium arachnoideum (Kaulf.) Maxon localizadas a diferentes niveles de altitud. Los resultados obtenidos mostraron la presencia de niveles residuales de ptaquilósido en el 82,76 % de las muestras analizadas, con una concentración máxima obtenida de 2219,67 µg/ml y una concentración promedio de 805,42 µg/ml; por lo que puede inferirse que altos niveles de infestación por el helecho P. arachnoideum, no sólo afecta la salud animal, sino que representa una amenaza para la Salud Pública de aquellos sectores rurales expuestos al consumo reiterado de la leche con residuos tóxicos (ptaquilósido).
Palabras clave: Pteridium arachnoideum, ptaquilósido, plantas tóxicas, inocuidad leche bovina, CLAR.
ABSTRACT
The invasion of toxic ferns for the Genus Pteridium adversely affecting bovine breeding has been reported in different agricultural regions of the world and particularly in Latin America. This genus is a potential risk to humans by the residuality showed by the toxic components of the plant in meat and milk. The aim of this study was to determine the ptaquiloside levels (Pta) in milk samples from San Miguel de Bolívar municipality, Bolívar Province, Ecuador, using high resolution liquid chromatography. Milk samples were collected from farms contaminated by the ferns Pteridium arachnoideum (Kaulf.) Maxon located in different altitudes. The results showed the presence of ptaquiloside residual levels in 82.76% of the samples analyzed, with a maximum concentration obtained from 2219.67 µg/ml and a mean concentration of 805.42 µg/ml. It was associated that high levels of infestation by the fern P. arachnoideum do not only affect animal health, but also represent a threat to public health of those rural sectors exposed to the repeated use of toxic waste in milk (ptaquiloside).
Key words: Pteridium arachnoideu, ptaquiloside, toxic plants, bovine milk safety, HPLC.
INTRODUCCIÓN
El helecho Pteridium arachnoideum (Kaulf.) Maxon, conocido como helecho macho, es una de las malezas más comunes en el mundo, que en condiciones favorables se caracteriza por formar poblaciones dominantes que excluyen otra vegetación (1,2,3,4). Varios estudios indican el impacto negativo que ha tenido la misma en diversas zonas ganaderas del mundo y en América, ya que se ha evidenciado un incremento en la invasión de potreros de producción láctea, lo cual ha favorecido el consumo de la planta por los animales, fundamentalmente en época de sequía (5,6,7).
Esta planta contiene varios componentes tóxicos que afectan el ganado de forma drástica, los cuales desencadenan una serie de afecciones graves que ocasionan la muerte del animal, generando pérdidas económicas (8,9,10). Adicionalmente, algunos de sus efectos pueden ser transmitidos al ser humano a través de la cadena alimentaria, debido al consumo de la leche de animales expuestos al helecho, pues se ha podido demostrar que la misma contiene la sustancia carcinogénica: ptaquilósido, en cantidad suficiente y puede ser el causante o coadyuvante de un alto índice de cáncer gástrico observado en regiones montañosas de países como Venezuela, Costa Rica y Bolivia, donde este helecho es prevaleciente (11,12,13).
La concentración del norsesquiterpeno ptaquilósido en la planta resulta elevada, según reportan otros autores (14, 15). Bajo condiciones de alcalinidad la pérdida de la glucosa da lugar a la formación de una dienona intermediaria, la cual posee un anillo ciclopropilo altamente reactivo capaz de reaccionar con macromoléculas celulares (16). Este compuesto carcinogénico se excreta por la leche según ha sido reportado, lo que su ingestión constituye un riesgo a la salud humana (17,18).
Estudios recientes han demostrado la ocurrencia de cuadros clínicos de Hematuria Enzoótica Bovina (HEB) en zonas ganaderas de San Miguel de Bolívar, Provincia Bolívar, Ecuador, lo cual está vinculado con la creciente colonización del helecho Pteridium arachnoideum (Kaulf.) Maxon en esta región, por lo que resulta de gran interés llevar a cabo investigaciones que permitan evaluar el riesgo potencial que supone para la salud humana el consumo de leche procedente de animales con HEB o expuestos al consumo de la planta (3, 19, 20). El objetivo del presente trabajo consistió en determinar niveles de ptaquilósido en muestras de leche procedentes del cantón San Miguel de Bolívar, Provincia Bolívar, Ecuador, mediante cromatografía líquida de alta resolución (CLAR).
MATERIALES Y MÉTODOS
La investigación se efectuó en el Cantón de San Miguel de Bolívar, ubicado en el centro de la Provincia de Bolívar, Ecuador, en un repliegue de la cordillera occidental de los Andes compartiendo territorios de la meseta interandina y una pequeña parte del subtrópico con una superficie de 570.10 km2, una altitud que va desde los 800 hasta los 2469 msnm y una temperatura que oscila entre los 220C en Balsapamba hasta los 80C en Piscurco, límites al sur y norte respectivamente.
Se estudiaron siete granjas de producción bovina, durante el período de junio a julio de 2011. Los animales eran mestizos, de doble propósito, para el consumo familiar y su comercialización. El manejo fue extensivo, a base de pastos naturales donde existía alta contaminación de helechos Pteridium arachnoideum (Kaulf.) Maxon.
Muestras de leche
Para colectar las muestras de leche (100 ml) se seleccionaron granjas ganaderas que presentaron invasión de P. arachoideum, con y sin la presencia de signos clínicos evidentes de HEB. Se muestreó el 10% del total de bovinos por cada granja (n=29). Se realizó la recolección de las muestras de forma individual, en frascos de vidrio color ámbar debidamente identificados, a través del ordeño manual en las primeras horas de la mañana. Estas muestras fueron conservadas en condiciones refrigeradas (sin pasteurizar) para posteriormente ser procesadas en el laboratorio. Las granjas muestreadas estaban ubicadas a una altitud de 2087 a 1257 msnm.
Procesamiento de las muestras de leche
Una alícuota de 25 ml de cada muestra de leche fresca, fue tratada con 40 ml de metanol con agitación durante 30 min. para la precipitación de las proteínas. A continuación la suspensión se filtró y se centrifugó a 3000 rpm durante 15 min. Consecutivamente, el sobrenadante se trató con 25 ml de acetonitrilo para lograr la precipitación de lípidos, se centrifugó desechando el pellet (lípidos y proteínas) y ulteriormente al sobrenadante se le añadió 1 g de cloruro de sodio. Se procedió a la extracción con diclorometano para eliminar las grasas. La fase acuosa fue tratada con hidróxido de sodio (0.003 N) para llevar a pH básico, para la conversión a pterosin B. Se agitó a 36°C durante 2 horas. Se realizó una segunda extracción con diclorometano (3 veces x 15 ml), para luego secar el extracto orgánico a presión reducida a 40°C. Posteriormente se redisolvió en 1 ml de metanol calidad CLAR y se colocó en viales muestreadores para su análisis por cromatografía líquida de alta resolución.
Obtención de la sustancia de referencia
La sustancia de referencia fue obtenida a partir de muestras de helechos Pteridium arachnoideum (Kaulf.) Maxon colectadas en la Provincia de Bolívar y llevadas al laboratorio de Fitoquímica de la Facultad de Ciencias Químicas de la Universidad Central del Ecuador en Quito, con un 90% de pureza.
Desarrollo del método por Cromatografía Líquida de Alta Resolución (CLAR) para determinar los niveles de ptaquilósido en muestras de leche
Se desarrolló un método analítico por CLAR siguiendo la metodología de Alonso-Amelot et al. (21) con algunas modificaciones. Se utilizó un cromatógrafo líquido de alta resolución, ULTIMATE 3000 (DIONEX), Columna Dionex RP 18, 12.5 x 0.4 cm d.i., 40 µ, Temperatura ambiente; modo isocrático con Metanol:Agua (65:35 v\v) como sistema de corrida, inyector de 20 µl; Velocidad de flujo= 1 mL/min, detección Ultravioleta variable a l= 260 nm, con un software CROMELEON. Todos los reactivos utilizados fueron de calidad CLAR.
Se procesaron dos curvas patrón de pterosin B; la primera osciló en un rango de valores de 1-0.1µg/ml y la segunda entre 0.1-0.01 µg/ml, para determinar la pendiente, el intercepto y el coeficiente de correlación entre el área y la concentración del analito, además de calcular la desviación estándar del blanco según Quatrocchi et al. (22).
Determinación del recobrado, límite de detección (LD) y cuantificación (LQ)
Al analito (leche obtenida en una zona no contaminada con helechos) se le añadió una cantidad conocida de pterosin B (2 mg). Se analizaron tres réplicas por cada muestra de leche. Se siguió el proceso de extracción y cuantificación de manera similar y se determinó el porcentaje de recuperación de este parámetro según la fórmula:
Se procesó una muestra de leche control negativo para ver la especificidad/selectividad del método.
Sensibilidad (Límite de detección y de cuantificación)
Se estableció la desviación estándar (S) para cada punto de la curva, se calculó la recta correspondiente a Concentración (A) vs S, es decir la ecuación S=m(A)+b, y se extrapoló la S a concentración igual a cero, obteniéndose el estimado Sbl correspondiente a la desviación estándar del blanco.
Se calculó el LD y el LQ para n' medidas individuales según la fórmula:
RESULTADOS
El método de CLAR propuesto presentó un límite de detección de 1.95 µg/ml y un límite de cuantificación de 2.47 µg/ml, lo que demuestra su sensibilidad en la determinación del ptaquilósido de Pteridium arachoideum en las muestras de leche analizadas. El recobrado del método tuvo un valor de 89%. El valor de concentración del ptaquilósido en la muestra fue corregido dividiendo por el factor de recobrado.
La Figura 1 representa los cromatogramas de la sustancia patrón (pterosina B) y de una muestra de leche, donde se aprecia la presencia del ptaquilósido en una elevada concentración y la especificidad del método con la presencia de un pico mayoritario correspondiente al compuesto analizado.
Los resultados evidenciaron la presencia del tóxico carcinogénico ptaquilósido en todas las granjas estudiadas. Las muestras de leche alcanzaron una concentración promedio general de 805,421 µg/ml del ptaquilósido, para un 82.76% de positividad en las mismas (Figura 2).
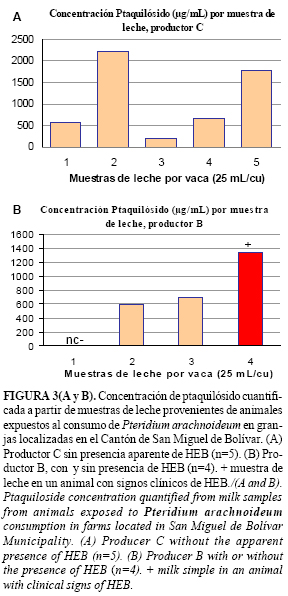
La Figura 3 (A y B) evidencia diferentes concentraciones de ptaquilósido en la leche, con independencia de la presentación clínica de hematuria; no obstante, en ambas granjas los animales estaban expuestos a la ingestión reiterada de P. arachnoideum. Algunas muestras provenientes de animales sin signos aparentes de HEB en el momento del muestreo mostraron una mayor concentración del tóxico de hasta 2219,67 µg/ml con respecto a aquellas provenientes de animales con signos clínicos manifiestos de HEB.
DISCUSIÓN
Los resultados indican la existencia de altos niveles residuales de ptaquilósido en muestras de leche provenientes de animales expuestos al consumo de Pteridium arachnoideum, que suponen un alto riesgo para la salud humana, constituyendo el primer reporte en el Ecuador de cuantificación del carcinógeno natural ptaquilósido en muestras de leche fresca, alimento de amplio consumo humano por las diversas poblaciones de grupos etarios en la región. Se reporta una alta densidad poblacional de helechos en esta región ganadera, lo que hace que los animales consuman grandes cantidades de esta planta tóxica Pteridium arachnoideum (19).
Otros autores refieren que el 9% del ptaquilósido contenido en estos helechos, los cuales son consumidos por los bovinos como alimento, se excreta a través de la leche (13,23). Crecientes reportes evidencian la correlación que existe entre la presencia de densas poblaciones de helechos del género Pteridium en zonas ganaderas y el aumento de la incidencia de cáncer gástrico en el hombre (17, 24, 25, 26, 27).
Varios estudios confirman la presencia de ptaquilósido (carcinógeno presente en el helecho) en leche proveniente de animales expuestos al consumo de esta planta (11,18,21,23,28,29). El Comité Británico de Toxicidad de Químicos en Alimentos, Productos de Consumo y el Ambiente (COT) por sus siglas en inglés, ha declarado al ptaquilósido como un agente carcinógeno potencial para los humanos a todos los niveles de ingestión (30). Desde su descubrimiento en 1983, varios estudios han documentado sus efectos genotóxicos como mutagénico y clastogénico que actúa como agente alquilante de la molécula de ADN (31,32,33,34). Otros autores han evidenciado los efectos citogenéticos como resultado de la inducción de aberraciones cromosómicas en animales afectados, luego del consumo reiterado de esta planta (16,35,36). Gil da Costa et al. (30) describen el efecto clastogénico, aneugénico e inductor de intercambio de cromátidas hermanas en linfocitos humanos a dosis de 5, 10 y 20 µg/ml. Todos estos antecedentes manifiestan el riesgo potencial que tiene el consumo de leche con residuos del tóxico en la Salud Pública del Cantón de San Miguel de Bolívar, que evidenció concentraciones promedio de ptaquilósido de 805,42 µg/ml de leche fresca, siendo la máxima encontrada de 2219,67 µg/ml, carcinogénico natural que produce cáncer gástrico, demostrado por varios autores (17,24,35,37).
Investigaciones desarrolladas han determinado los niveles de ptaquilósido en leche proveniente de bovinos alimentados con cantidades conocidas de helecho, que han revelado concentraciones de 2-10 mg/día en 24 litros/día (21,38). Alonso-Amelot (9) describe que cuando los animales ingieren cantidades sustanciales de ptaquilósido, 10 g por día o más, excretan hasta cerca del 10% por la leche en los siguientes días. Si un animal consume unos pocos kilos de helechos por cada uno en cinco días consecutivos, comenzará a excretar ptaquilósido desde el segundo día en adelante en cantidad creciente. Al suspender la ingestión del helecho tóxico, se continuará eliminando este compuesto en la leche por tres días más. Del mismo modo, si un animal que se alimenta de helechos por varios días, suspende temporalmente su dieta de Pteridium para comerlo nuevamente en forma irregular, generará pulsos de ptaquilósido en la leche que ampliará considerablemente el riesgo de que este carcinógeno sea ingerido por algún consumidor (9,11,23). Francesco et al. (18), describen un nuevo método para detectar trazas del ptaquilósido a partir de muestras de fluidos biológicos como la leche con una alta sensibilidad determinada en un rango de ppb, el cual fue capaz de detectar al tóxico no sólo a partir de las muestras provenientes del ganado intoxicado sino también a partir de aquellas derivadas de animales supuestamente sanos. Estos resultados confirman los encontrados en el presente trabajo, donde no sólo fueron evidenciadas altas concentraciones del ptaquilósido en muestras provenientes de animales que mostraban los signos clínicos de la enfermedad, sino también en aquellas que provenían de animales que no mostraban signos clínicos de hematuria y que sin embargo poseían una alta concentración del tóxico en la leche (18,39,40).
Estos resultados requieren la necesidad de continuar realizando investigaciones similares en otras regiones del Ecuador que están invadidas por el helecho Pteridium arachnoideum por las serias repercusiones que trae consigo a la salud animal y humana. A su vez, se pretende desarrollar estudios que evalúen la posible residualidad de este tóxico en muestras de tejido de animales, que por la cadena alimentaria también puedan deteriorar la salud del hombre.
REFERENCIAS
1. Webster BD, Steeves TA. Morphogenesis in Pteridium aquilinum (L.) Kuhn. General morphology and growth habit. Phytomorphology. 1958;8:30-41.
2. Watt AS. The ecological status of bracken. Bot J Linn Soc. 1976;73:217-239.
3. Hartig K, Beck E. The bracken fern (Pteridium arachnoideum (kaulf.) Maxon). Dilemma in the Andes of southern Ecuador. ECOTROPICA. 2003;9:3-13.
4. Stewart G, Cox E, Le Duc M, Pakeman R, Pullin A, Marrs R. Control of Pteridium aquilinum: meta-analysis of a multi-site study in the UK. Ann Bot. 2008;101(7):957-970.
5. Pakeman R, Marrs R, Jacob P. A model of bracken (Pteridium aquilinum) growth and the effects of control strategies and changing climate. J Appl Ecol. 1994;31:145-154.
6. Petrov P, Marrs RH. The reclamation of bracken dominated pastures in Bulgaria used asulam and fertilizers. Grass Forage Sci. 2001;56:131-137.
7. Roos K, Rollenbeck R, Peters T, Bendix J, Beck E. Growth of Tropical Bracken (Pteridium arachnoideum): Response to Weather. Variations and Burning. Invas Plant Sci Manage. 2010;2:402-411.
8. Evans WC, Smith RT, Taylor JA. The acute diseases caused by bracken in animals. In: Smith RT, Taylor JA (eds), Bracken Ecology, Land Use and Control Technology, Parthenon Publications: Carnforth, UK; 1986, pp 139-146.
9. Alonso-Amelot ME. Braken fern, animal and human health. Rev Fac Agron. 1999;16:528-541.
10.Carvalho T, Elias AP, Nunes T, Peleteiro MC, Dias S. Chemo-angiogenic profile of bovine urinary bladder tumors distinguishes urothelial carcinomas from hemangiosarcomas. Vet Immunol Immunopathol. 2008;121(3-4):344-358.
11.Alonso-Amelot ME, Castillo U, Smith BL, Lauren DR. Excretion, through milk, of ptaquiloside in bracken fed cows. A quantitative assessment. Lait. 1998;78:413-423.
12.Shahin M, Smith BL, Prakash AS. Bracken carcinogens in the human diet. Mutat Res. 1999;443(1-2):69-79.
13.Alonso-Amelot ME, Avendaño M. Human carcinogenesis and bracken fern: a review of the evidence. Curr Med Chem. 2002;9(6):675-686.
14.Vetter J. A biological hazard of our age: bracken fern Pteridium aquilinum (L.) Kuhn - a review. Acta Vet Hung. 2009;57(1):183-196.
15.Fletcher wT, Brock IJ, Reichmann KG, McKenzie RA, Blaney BJ. Norsesquiterpene glycosides in bracken ferns (Pteridium esculentum and Pteridium aquilinum subsp. wightianum) from eastern Australia: Reassessed poisoning risk to animals. J Agricult Food Chem. 2011;59(9):5133-5138.
16.Roperto S, Borzacchiello G, Brun R, Leonardi L, Maiolino P, Martano M. A review of bovine urothelial tumours and tumour-like lesions of the urinary bladder. J Comp Pathol. 2010;142:95-108.
17.Villalobos-Salazar J. Carcinogenity of Pteridium aquilinum and high incidence of gastric cancer in Costa Rica. Rev Costarric Cienc Med. 1985;6:131-139.
18.Francesco B, Giorgio B, Rosario N, Saverio RF, Francesco DG, Romano M, et al. A new, very sensitive method of assessment of ptaquiloside, the major bracken carcinogen in the milk of farm animals. Food Chem. 2011;124(2):660-665.
19.Calderón A, Marrero E, Murilllo V, Vega V. Reporte de casos de Hematuria Enzoótica Bovina por ingestión de Pteridium arachnoideum en la región ganadera de San Miguel de Bolívar, Ecuador. Rev Salud Anim. 2011;33(3):197-202.
20.Sharma R, Bhat TK, Sharma OP. The environmental and human effects of ptaquiloside-induced enzootic bovine hematuria: a tumorous disease of cattle. Rev Environ Contam Toxicol. 2013;224:53-95.
21.Alonso-Amelot ME, Castillo U, Jongh FD. Passage of the bracken fern carcinogen ptaquiloside into bovine milk. Lait. 1993;73:323-332.
22.Quattrocchi OA, Abelaira S, Laba RF. Introducción al HPLC Aplicación y Práctica Buenos Aires: Artes Gráficas. 1992; pp 302-328.
23.Alonso-Amelot ME, Castillo U, Smith BL, Lauren DR. Bracken ptaquiloside in milk. Nature. 1996;382(6592):587.
24.Galpin OP, Whitaker CJ, Whitaker RH, Kassab JY. Gastric cancer in Gwinned. Possible links with bracken. Br J Cancer. 1990;61:737-740.
25.Alonso-Amelot ME, Avendaño M. Possible association between gastric cancer and bracken fern in Venezuela: an epidemiologic study. Int J Cancer. 2001;91:252-259.
26.Rasmussen LH, Schmidt B, Sheffield E. Ptaquiloside in bracken spores from Britain. Chemosphere. 2013;90(10):2539-2541.
27.Gomes J, Magalhães A, Michel V, Amado IF, Aranha P, Ovesen RG, et al. Pteridium aquilinum and its ptaquiloside toxin induce DNA damage response in gastric epithelial cells, a link with gastric carcinogenesis. Toxicological sciences: an official journal of the Society of Toxicology. 2012;126(1):60-71.
28.Pissarelli Caceres-Pena YC, Naya M, Calcagno M, Alonso-Amelot ME. Influence of Bracken Fern (Pteridium caudatum L. Maxon) Pre-treatment on Extraction Yield of Illudane Glycosides and Pterosins. Phytochem Anal. 2012.
29.Lucena RB, Rissi DR, Kommers GD, Pierezan F, Oliveira-Filho JC, Macedo JT, et al. A retrospective study of 586 tumours in Brazilian cattle. J Comp Pathol. 2011;145(1):20-24.
30.COT - Committee on the Toxicity of Chemicals in Food, Consumer Products and the Environment, COT Statement on the Risk to Consumers of Eating Foods Derived from Animals that Have Eaten Bracken, Food Standards Agency, London, 2008. pp. 20-21.
31.Mori H, Sugie S, Hirono I, Yamada K, Niwa H, Ojika M. Genotoxicity of ptaquiloside, a bracken carcinogen, in the hepatocyte primary culture/DNA-repair test. Mutat Res. 1985;143(1-2):75-78.
32.Matoba M, Saito E, Saito K, Koyama K, Natori S, Matsushima T, et al. Assay of ptaquiloside, the carcinogenic principle of bracken, Pteridium aquilinum, by mutagenicity testing in Salmonella typhimurium. Mutagenesis. 1987;2(6):419-423.
33.Shahin M, Moore MR, Worrall S, Smith BL, Seawright AA, Prakash AS. H-ras activation is an early event in the ptaquiloside-induced carcinogenesis: comparison of acute and chronic toxicity in rats. Biochem Biophys Res Commun. 1998;250(2):491-497.
34.Gil da Costa RM, Coelho P, Sousa R, Bastos MM, Porto B, Teixeira I, et al. Multiple genotoxic activities of ptaquiloside in human lymphocytes: aneugenesis, clastogenesis and induction of sister chromatid exchange. Mutat Res. 2012;747(1):77-81.
35.Lioi MB, Barbieri R, Borzacchiello G, Dezzi S, Roperto S, Santoro A. Chromosome aberrations in cattle with chronic enzootic haematuria. J Comp Pathol. 2004;131:233-236.
36.Peretti V, Ciotola F, Albarella S, Russo V, Meo GPD, Iannuzzi L. Chromosome fragility in cattle with chronic enzootic haematuria. Mutagenesis. 2007;22:317-320.
37.Vetter J. A biological hazard of our age: bracken fern Pteridium aquilinum (L.) Kuhn - a review. Acta Vet Hung. 2009;57(1):183-196.
38.Jensen PH, Jacobsen OS, Hansen HC, Juhler RK. Quantification of ptaquiloside and pterosin B in soil and groundwater using liquid chromatography-tandem mass spectrometry (LC-MS/MS). J Agric Food Chem. 2008;56:9848-9985.
39.Gil da Costa RM, Bastos MM, Oliveira PA, Lopes C. Bracken-associated human and animal health hazards: Chemical, biological and pathological evidence. J Hazard Mater. 2012;1(12):203-204.
40.Marrero FE, Calderón TA. Plantas tóxicas e inocuidad alimentaria: Hematuria Enzoótica Bovina por Pteridium spp. un problema relevante de salud. Rev Salud Anim. 2012;34(3):137-143.
Recibido: 8-6-2012.
Aceptado: 21-12-2012.